转铁蛋白在制备免疫抑制剂类药物中的应用的制作方法
本发明涉及生物医学技术领域,尤其涉及转铁蛋白在制备免疫抑制剂类药物中的应用。
背景技术:
toll样受体(toll-likereceptors,tlrs)能够识别各种不同的疾病相关分子模式(pamp),是机体抵抗感染的一道重要屏障。微生物感染并刺激tlrs家族引起促炎反应继而介导的宿主免疫防御,但是过度的炎症产生对机体是非常有害的,后果也是非常严重。tlr4是识别细菌的重要的tlrs家族成员,主要识别革兰氏阴性菌的脂多糖(lps)从而激活nf-κb信号通路进而激活宿主免疫反应。为了防止产生过度炎症,避免炎症对机体的损害,tlr4信号通路也受着严格的负调控。例如,rp105/md-1可以通过抑制lps与tlr4/md-2复合物的相互作用从而负调控tlr4信号通路。胞内的sigirr,st2l,myd88s,irak-m以及socs-1等通过靶向nf-κb信号通路胞内的重要因子而负调控tlr4信号通路。目前,现有技术中还没有将转铁蛋白用于tlr4信号通路激活的记载和报道。
技术实现要素:
本发明的目的在于提供转铁蛋白在制备免疫抑制剂类药物中的应用,转铁蛋白能够抑制lps诱导的tlr4信号通路激活。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了转铁蛋白在制备免疫抑制剂中的应用。
优选的,所述免疫抑制剂通过抑制tlr4信号通路激活实现免疫抑制。
优选的,所述tlr4信号通路激活包括细菌产物诱导的tlr4信号通路激活。
本发明提供了转铁蛋白在制备抑制炎症反应的药物中的应用。
优选的,所述炎症反应包括细菌产物诱导的炎症反应。
优选的,所述细菌产物包括脂多糖。
优选的,所述转铁蛋白包括血浆转铁蛋白。
本发明的有益效果:本发明提供了转铁蛋白在制备免疫抑制剂中的应用。转铁蛋白能够靶向tlr4的共受体单核细胞表面抗原cd14从而抑制脂多糖(lps)与cd14的识别并抑制lps诱导的tlr4信号通路激活,抑制lps诱导的细胞炎症因子产生,抑制lps诱导的血浆炎症因子tnf-α、il-6、il-1β和ifn-β的产生,减轻lps诱导的肝组织损伤与细胞凋亡。转铁蛋白在抑制细菌产物诱导的炎症中具有非常明显的效果。转铁蛋白能够抑制细菌产物诱导的炎症反应并具有制备免疫抑制剂类药物的潜力。
附图说明
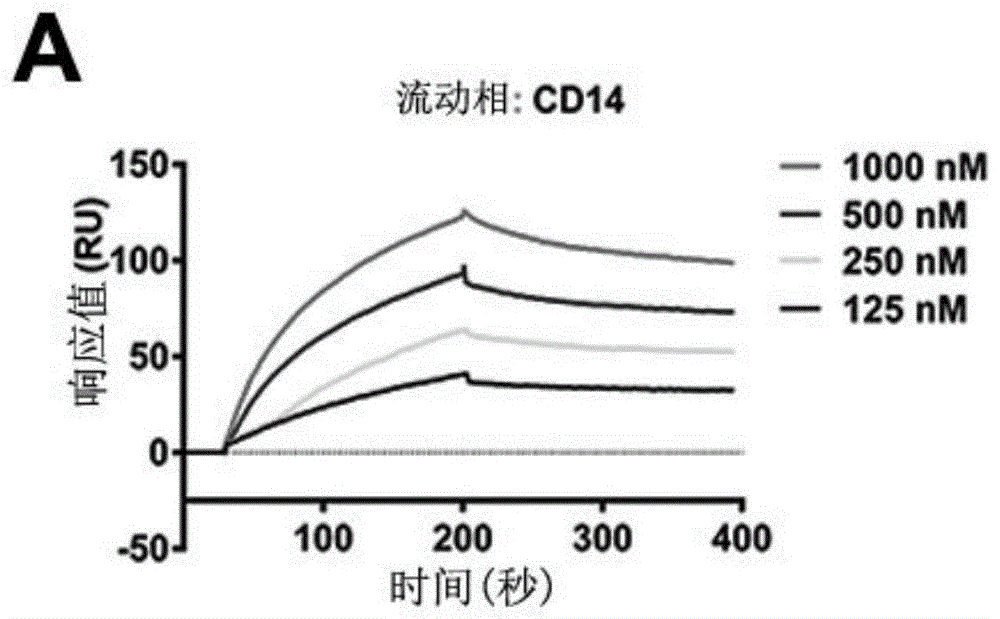
图1-a表示表面等离子共振spr检测转铁蛋白与cd14的结合;其中,转铁蛋白作为固定相偶联到cm5芯片上,cd14作为流动相;图1-b表示分子对接(docking)分析转铁蛋白与cd14的结合特性;
图2-a表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子tnf-α产生情况;
图2-b表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子il-6产生情况;
图2-c表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子ifn-β产生情况;
图2-d表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子tnf-α产生情况;
图2-e表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子il-6产生情况;
图2-f表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子ifn-β产生情况;
图2-g表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子tnf-α产生情况;
图2-h表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子il-6产生情况;
图2-i表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子ifn-β产生情况;
图2-j表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子tnf-α产生情况;
图2-k表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子il-6产生情况;
图2-l表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子ifn-β产生情况;
图2-m表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子tgf-β产生情况;
图2-n表示转铁蛋白抑制剂lps诱导的静脉内皮细胞分泌炎症因子tnf-α产生情况;
图2-o表示转铁蛋白抑制剂lps诱导的静脉内皮细胞分泌炎症因子il-6产生情况;
图3-a表示转铁蛋白干预对tnf-α、β的影响;
图3-b表示转铁蛋白干预对il-6的影响;
图3-c表示转铁蛋白干预对il-1β的影响;
图3-d表示转铁蛋白干预对ifn-β的影响;
图4-a表示通过he染色验证转铁蛋白对lps诱导的肝组织损伤的影响;
图4-b表示通过tunel染色验证转铁蛋白对lps诱导的肝组织细胞凋亡的影响。
具体实施方式
本发明提供了转铁蛋白在制备免疫抑制剂中的应用;所述免疫抑制剂优选的通过抑制tlr4信号通路激活实现免疫抑制;所述tlr4信号通路激活优选的包括细菌产物诱导的tlr4信号通路激活。
本发明提供了转铁蛋白在制备抑制炎症反应的药物中的应用;所述炎症反应优选的包括细菌产物诱导的炎症反应。
本发明中,所述细菌产物优选的包括革兰氏阴性菌的产物,更优选的包括脂多糖;所述转铁蛋白优选的包括血浆转铁蛋白,更优选的包括人血浆转铁蛋白。
本发明中,所述人血浆转铁蛋白来源于常规市售。
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
转铁蛋白免疫靶点验证:采用biacore2000(ge,usa)分析转铁蛋白与cd14的结合。
具体步骤如下:
1、用n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐活化液活化cm5芯片(br100012,ge,usa),后将用醋酸钠溶液(10mm,ph=5)稀释的终浓度为20μg/ml的转铁蛋白溶液流经已经活化好的cm5芯片表面以共价偶联转铁蛋白(500反应值),流速为5μl/min。
2、用步骤1)同样的方法和流速使75μl的封闭液乙醇胺流经芯片表面以封闭多余的位点。
3、将不同浓度(125,250,500和1000nm)的用tris缓冲液(20mm,ph7.4)稀释的流动相cd14溶液流经芯片表面以检测转铁蛋白与cd14的结合曲线。
4、运用zdock分子对接分析转铁蛋白(pdbid:3v83)与cd14(pdbid:4glp)的结合特性与精细的氨基酸残基相互作用。结果为:转铁蛋白与cd14具有明显的相互作用(结果参见图1-a和图1-b,其中图1-a表示表面等离子共振spr检测转铁蛋白与cd14的结合;其中,转铁蛋白作为固定相偶联到cm5芯片上,cd14作为流动相;图1-b表示分子对接(docking)分析转铁蛋白与cd14的结合特性;tf:转铁蛋白)。
实施例2
检测细胞水平转铁蛋白对炎症因子的抑制作用:转铁蛋白对lps诱导的细胞炎症因子检测。
具体操作如下:
将外周血单核细胞、中性粒细胞、小鼠骨髓来源的树突细胞、单核巨噬细胞和静脉内皮细胞铺板96孔板。后加入不同浓度(0.05,0.5,and5μm)的脱铁转铁蛋白(apo-transferrin)和全铁转铁蛋白(holo-transferrin)与上述细胞孵育10min,最后加入脂多糖(lps,2μg/ml)诱导细胞炎症8h。最后采用购买的elisa试剂盒检测细胞上清tnf-α、il-6、ifn-β和tgf-β的含量。结果为:转铁蛋白能够明显的抑制lps诱导的细胞炎症因子产生(图2-a表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子tnf-α产生情况,图2-b表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子il-6产生情况,图2-c表示转铁蛋白抑制lps诱导的人外周血单核细胞分泌炎症因子ifn-β产生情况;图2-d表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子tnf-α产生情况,图2-e表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子il-6产生情况,图2-f表示转铁蛋白抑制lps诱导的人中性粒细胞分泌炎症因子ifn-β产生情况;图2-g表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子tnf-α产生情况,图2-h表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子il-6产生情况,图2-i表示转铁蛋白抑制lps诱导的小鼠骨髓来源的树突细胞分泌炎症因子ifn-β产生情况;图2-j表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子tnf-α产生情况,图2-k表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子il-6产生情况,图2-l表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子ifn-β产生情况,图2-m表示转铁蛋白抑制剂lps诱导的单核巨噬细胞分泌炎症因子tgf-β产生情况;图2-n表示转铁蛋白抑制剂lps诱导的静脉内皮细胞分泌炎症因子tnf-α产生情况,图2-o表示转铁蛋白抑制剂lps诱导的静脉内皮细胞分泌炎症因子il-6产生情况;上述各图表示对5次独立重复实验的统计结果。*p<0.5,**p<0.01;apo-tf:脱铁转铁蛋白;holo-tf:全铁转铁蛋白)。
实施例3
检测动物水平转铁蛋白对炎症的抑制作用:转铁蛋白过表达(plp-tf)、敲降(rnr-tf)和转铁蛋白尾静脉注射对脂多糖lps诱导的小鼠血浆炎症因子,肝组织损伤的影响。
首先构建小鼠转铁蛋白过表达(plp-tf)与敲降(rnr-tf)慢病毒和逆病毒载体并感染小鼠模型,具体操作为:合成小鼠转铁蛋白编码区基因(genbank:bc092046.1)并克隆到plvx-puro(clontech,usa)慢病毒过表达载体。设计并合成转铁蛋白敲降的干扰rna(shrna,核苷酸序列如seqidno.1所示,具体为:5’-aagaatctgaagcaggaagacttcaagagagtcttcctgcttcagattcttctttttt-3’(forwardoligo),)序列并克隆到rnai-readypsiren-retroq(clontech,usa)逆病毒敲降载体。将转铁蛋白过表达质粒连同病毒包装质粒pspax2(addgeneinc.,usa)和pmd2g(ddgeneinc.,usa)通过lipofectamine2000转染到hek293t细胞中并连续培养细胞48h。同样,将转铁蛋白敲降质粒也通过lipofectamine2000转染到ecopacktm2–293细胞中并连续培养细胞48h。48h后,收取细胞培养上清液并于4℃,25000转超速离心3h以获取病毒颗粒。通过尾静脉注射收集的转铁蛋白过表达慢病毒和敲降逆病毒(滴度:107tu)使小鼠(c57bl/6jmice,25~30g)转铁蛋白水平升高和降低,同时也采用尾静脉注射的方式注射不同浓度的转铁蛋白(0.64、3.2和16mg/kg)对小鼠进行干预。
通过构建的转铁蛋白慢病毒过表达和敲降载体使小鼠(c57bl/6jmice,25~30g)转铁蛋白水平升高和降低,同时也采用尾静脉注射的方式注射不同浓度的转铁蛋白(0.64、3.2和16mg/kg)对小鼠进行干预。后通过给小鼠尾静脉注射lps(750μg/kg)以诱导炎症反应,诱导时间为2h。最后检测小鼠血浆炎症因子tnf-α、il-6、il-1β和ifn-β的含量。结果为:转铁蛋白过表达和尾静脉注射可以抑制lps诱导的血浆炎症因子tnf-α、il-6、il-1β和ifn-β的产生,而转铁蛋白的敲降可以明显的加重炎症反应(结果参见图3-a~图3-d,其中图3-a表示转铁蛋白干预对tnf-α、β的影响;图3-b表示转铁蛋白干预对il-6的影响;图3-c表示转铁蛋白干预对il-1β的影响;图3-d表示转铁蛋白干预对ifn-β的影响;上述各图表示对10只小鼠的统计结果;*p<0.5,**p<0.01)。
实施例4
检测动物水平转铁蛋白对炎症的抑制作用:转铁蛋白过表达(plp-tf)、敲降(rnr-tf)和转铁蛋白尾静脉注射对脂多糖lps诱导的小鼠血浆炎症因子,肝组织损伤的影响。
通过给小鼠尾静脉注射lps(750μg/kg)以诱导炎症反应,诱导时间为2h。最后通过he染色和tunel染色分别评估转铁蛋白对lps诱导的肝组织损伤和细胞凋亡的影响。结果为:转铁蛋白过表达(plp-tf)和尾静脉注射可以减轻lps诱导的肝组织损伤与细胞凋亡,而转铁蛋白的敲降(rnr-tf)则明显的加重肝组织损伤与细胞凋亡(结果参见图4-a和图4-b,其中图4-a表示通过he染色验证转铁蛋白对lps诱导的肝组织损伤的影响;图4-b表示通过tunel染色验证转铁蛋白对lps诱导的肝组织细胞凋亡的影响;上述各图表示对10只小鼠的统计结果。*p<0.5,**p<0.01)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国科学院昆明动物研究所
<120>转铁蛋白在制备免疫抑制剂类药物中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>1
aagaatctgaagcaggaagacttcaagagagtcttcctgcttcagattcttctttttt58
- 还没有人留言评论。精彩留言会获得点赞!