一种药物和基因双重运载系统、其制备方法及应用与流程
本发明属于生物医学工程技术领域,尤其涉及一种药物和基因双重运载系统、其制备方法及应用。
背景技术:
肿瘤的发生是多因素、多阶段、多基因相互作用的复杂过程。治疗手段主要有手术治疗、放射治疗、化学治疗和生物治疗。然而,这些治疗手段往往会损伤人体正常细胞,产生严重的毒副反应。综合治疗的肿瘤仍可增殖复发,因此彻底治疗肿瘤是目前的难点。
因肿瘤的发生与癌基因的突变相关,近年来,基因治疗逐渐成为药学、医学和生物化学领域中的研究重点。“基因治疗”是将基因物质引入病人的细胞或组织从而达到治疗疾病的目的。据统计,全球进行的疾病基因治疗临床试验中,有64%是肿瘤基因治疗临床试验。基因疗法可以为那些不能手术切除的、转移肿瘤或难治性实体瘤提供一种替代疗法。肿瘤的基因治疗研究中广泛应用到的核酸有质粒dna、合成的核酸如反义寡核苷酸、小干扰rna(sirna)和其他双链rna等。各种类型的核酸在分子基因水平可以起到不同的效应,质粒dna主要用于细胞核内的输送,用以取代或替代靶向细胞某种特异的基因功能,发挥的是“获得基因功能”的作用;相反,细胞质输送的反义寡核苷酸或sirna以序列特异性的方式通过抑制内源性基因的表达发挥治疗作用,是一种“失去基因功能”的作用,sirna是一类长约21~23个核苷酸的特殊双链rna分子,其序列与所作用的靶mrna序列具有同源性,在mrna水平上诱发序列特异性的转录后基因表达沉默,能够有效抑制转录后基因表达,因其特异性、高效性以及作为基因治疗药物的巨大潜力而备受青睐。
因此,sirna成为目前治疗的可选择方案。但单种药物并不能满足治疗的需要,因此多重药物载体的设计成为目前的热门课题。目前科研上,基因载体以病毒和脂质体为主。病毒的转染效率高,但存在致癌性和安全性问题。脂质体为阳离子载体,具有一定的毒性,且无法携带其他的药物。
技术实现要素:
本发明的目的在于提供一种药物和基因双重运载系统、其制备方法及应用,本发明中的药物和基因双重运载系统能够同时运载药物和任意序列的sirna,并且稳定性好、无毒性。
本发明提供一种药物和基因双重运载系统,包括载体与生物素化的sirna,所述载体与生物素化的sirna之间通过亲和素接枝连接;
所述载体为核壳结构,内核为聚三亚甲基碳酸酯,外壳为氧化葡聚糖,所述聚三亚甲基碳酸酯内核内负载有疏水性药物;
所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1。
优选的,所述载体的粒径为50~400nm。
优选的,所述载体和亲和素的质量比为(0.1~5)∶1。
本发明提供一种药物和基因双重运载系统的制备方法,包括以下步骤:
a)将葡聚糖与高碘酸钠混合,进行氧化反应,然后加入多元醇终止反应,透析得到氧化葡聚糖;
b)将氧化葡聚糖水溶液、聚三亚甲基碳酸酯溶液和疏水性药物在共溶剂中混合,超声破碎形成初乳,然后加入2~8g/l的聚乙烯醇水溶液,超声破碎形成复乳,最后再加入0.1~1g/l的聚乙烯醇水溶液,经离心、洗涤和重悬后,得到载体;
所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1;
c)将亲和素溶液和载体溶液混合,搅拌反应1~5小时后加入硼氢化钠,进行还原反应,得到表面接枝有亲和素的载体;
d)将生物素化的sirna与所述步骤c)得到的表面接枝有亲和素的载体混合,反应后得到药物和基因双重运载系统。
优选的,所述葡聚糖与高碘酸钠的摩尔比为1∶(1~10);
所述多元醇为乙二醇和/或丙三醇;所述高碘酸钠的质量与所述多元醇的体积之比为(1~5)∶1;所述透析的时间为2~5天。
优选的,所述步骤b)中葡聚糖水溶液的质量浓度为10~500mg/ml;
所述聚三亚甲基碳酸酯溶液为聚三亚甲基碳酸酯溶液的二氯甲烷溶液,所述聚三亚甲基碳酸酯溶液的质量浓度为1~5mg/ml。
优选的,所述初乳与2~8g/l的聚乙烯醇水溶液的体积比为1∶(1~8)。
优选的,所述亲和素溶液为亲和素的碳酸氢钠溶液,所述亲和素溶液的质量浓度为1~10mg/ml;
所述载体溶液中的溶剂为摩尔比为1∶(1~3)的na2hpo4和nacl,所述载体溶液的质量浓度为1~10mg/ml。
优选的,所述步骤d)中反应的温度为0~6℃;所述步骤d)中反应的时间为1~5小时。
本发明提供一种药物和基因双重运载系统在制备治疗肿瘤药物中的应用。
本发明提供一种药物和基因双重运载系统,包括载体与生物素化的sirna,所述载体与生物素化的sirna之间通过亲和素接枝连接;所述载体为核壳结构,内核为聚三亚甲基碳酸酯,外壳为氧化葡聚糖,所述聚三亚甲基碳酸酯内核内负载有疏水性药物;所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1。本发明使用葡聚糖和聚三亚甲基碳酸酯(ptmc)制备核壳状的纳米载体,并与亲和素-生物素反应体系结合,克服目前sirna阳离子脂质体毒性大、无法同时运载其他药物的缺陷,为肿瘤等多基因、多因素疾病的诊疗提供新的思路。同时,本发明制备得到的载体纳米颗粒呈双亲性,使用亲和素与载体纳米颗粒接枝后,生物素修饰的sirna稳定性更佳。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
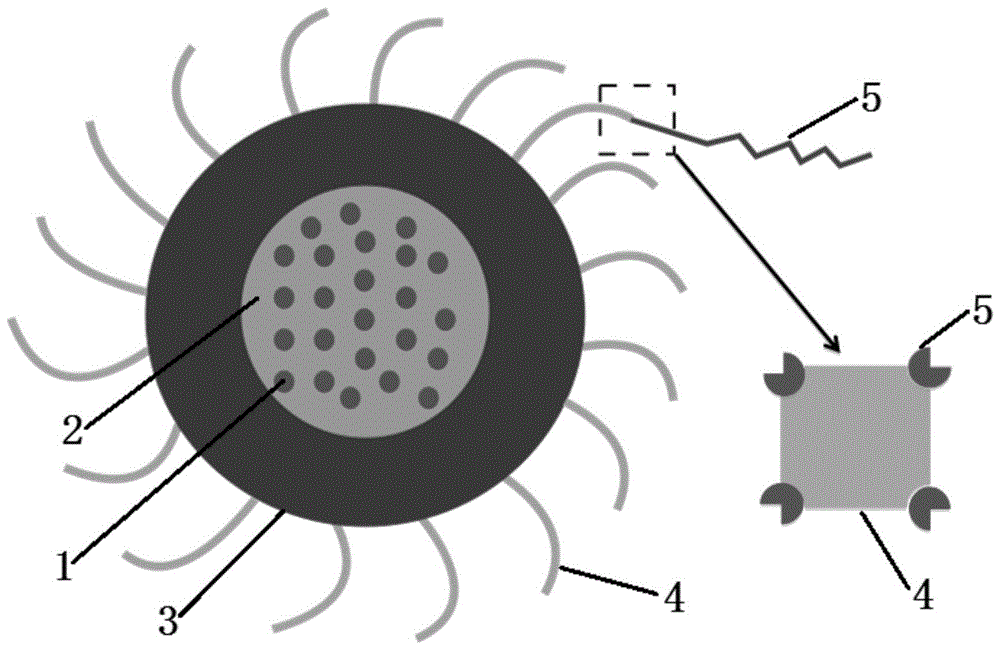
图1为本发明中药物和基因双重运载系统的结构示意图;
其中,1为疏水性药物,2为ptmc,3为氧化葡聚糖,4为亲和素,5为生物素修饰的sirna;
图2为本发明实施例中ptmc/葡聚糖纳米载体颗粒的粒径表征;
图3为本发明实施例中ptmc/葡聚糖纳米载体颗粒的zeta电位;
图4为本发明实施例中ptmc/葡聚糖纳米载体颗粒扫描电镜图;
图5为本发明实施例中bca法测定纳米颗粒表面接枝亲和素的量;
图6为本发明实施例中a~d组在琼脂糖凝胶电泳sirna迁移实验中的泳动距离缩动。
具体实施方式
本发明提供一种药物和基因双重运载系统,包括载体与生物素化的sirna,所述载体与生物素化的sirna之间通过亲和素接枝连接;
所述载体为核壳结构,内核为聚三亚甲基碳酸酯,外壳为氧化葡聚糖,所述聚三亚甲基碳酸酯内核内负载有疏水性药物;
所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1。
在本发明中,所述载体为核壳结构,内核为聚三亚甲基碳酸酯(ptmc),且所述ptmc内核内部负载有疏水性药物,外壳为氧化葡聚糖。本发明所制备的载体为双亲性的载体,即亲水又亲油。ptmc是一种无序或具有少许结晶的脂肪族聚碳酸酯,具备较高的力学性能,优良的生物相容性和生物降解性能。做药物载体具有突释期短、药物释放速度稳定、药物释放时间长的优点。而葡聚糖是一种多糖,天然、无毒、良好的生物降解性及生物兼容性等,将ptmc/葡聚糖做成双亲性的纳米颗粒有利于延长药物在体内的循环时间。
在本发明中,所述氧化葡聚糖与ptmc的质量比优选为(1~6)∶1,更优选为(2~5)∶1,最优选为(3~4)∶1,具体的,在本发明的实施例中,可以是5∶1。
在本发明中,所述疏水性药物的种类和用量没有特殊的限制,根据实际需求选择所需种类和用量的疏水性药物即可。
在本发明中,所述载体的微观形态为纳米尺寸的圆球,粒径优选为51~400nm,更优选为200~400nm,具体的,在本发明的实施例中,可以是331.8nm。
在本发明中,所述载体的表面接枝有亲和素,亲和素的另一端与生物素化的sirna接枝连接,每个亲和素分子可与四个生物素化的sirna接枝结合。两者间的非共价键相互作用特异性强、亲和力大,二者亲和常数为1015mol/l,结合极为稳定。亲和素-生物素系统被广泛用在表面改性、生化技术、免疫检测。同时亲和素对肿瘤细胞有靶向作用,易与肿瘤细胞表面的凝集素结合。而sirna正义链的5’和3’端都可以被生物素修饰,使sirna的稳定性增加而rna干扰效率没有明显改变。因此亲和素-生物素-sirna系统是一个较为稳定的体系。
在本发明中,所述亲和素为抗生物素蛋白,本发明中所使用的亲和素生工生物货号:orderno.a610068cas:[1405-69-2]。所述载体与亲和素的质量比优选为(0.1~5)∶1,更优选为(0.5~4)∶1,最优选为(2~3)∶1,具体的,在本发明的实施例中,可以是1∶0.5、1∶1或2∶1。
本发明对所述sirna的种类没有特殊的限制,本发明中的运载系统能够运载任意序列的sirna。
本发明还提供了一种药物和基因双重运载系统的制备方法,包括以下步骤:
a)将葡聚糖与高碘酸钠混合,进行氧化反应,然后加入多元醇终止反应,透析得到氧化葡聚糖;
b)将氧化葡聚糖水溶液、聚三亚甲基碳酸酯溶液和疏水性药物在共溶剂中混合,超声破碎形成初乳,然后加入2~8g/l的聚乙烯醇水溶液,超声破碎形成复乳,最后再加入0.1~1g/l的pva水溶液,经离心、洗涤和重悬后,得到载体;
所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1;
c)将亲和素溶液和载体溶液混合,搅拌反应1~5小时后加入硼氢化钠,进行还原反应,得到表面接枝有亲和素的载体;
d)将生物素化的sirna与所述步骤c)得到的表面接枝有亲和素的载体混合,反应后得到药物和基因双重运载系统。
本发明将葡聚糖与高碘酸钠混合,避光搅拌进行氧化反应,加入多元醇终止反应,然后进行透析,烘干后得到带醛基的氧化葡聚糖。
在本发明中,所述葡聚糖优选为分子量为70ka的葡聚糖,所述葡聚糖与高碘酸钠的摩尔比优选为1∶(1~20),更优选为1∶(2~10),最优选为1∶(3~8),具体的,在本发明的实施例中,可以是1∶5;所述多元醇优选为乙二醇和/或丙三醇,所述高碘酸钠的质量与所述多元醇的体积之比优选为(1~5)∶1,更优选为(2~4)∶1。
在本发明中,所述氧化反应全程需避光,温度优选为20~35℃,更优选为25~30℃;所述氧化反应的时间优选为0.5~3小时,更优选为1~2小时;所述透析必须避光,时间优选为2~5天,更优选为3~4天;所述烘干的温度优选为30~100℃,更优选为40~80℃,最优选为50~60℃;所述烘干的时间优选为12~36小时,更优选为20~24小时。
得到氧化葡聚糖后,本发明将氧化葡聚糖水溶液、ptmc的二氯甲烷溶液和疏水性药物在共溶剂中混合,超声破碎后形成初乳,然后加入2~8g/l的聚乙烯醇水溶液,超声破碎形成复乳,最后再加入0.1~1g/l的聚乙烯醇水溶液,经离心、洗涤和重悬后,得到载体;
在本发明中,所述氧化葡聚糖的浓度优选为1~10mg/ml,更优选为2~8mg/ml,最优选为3~6mg/ml,具体的,在本发明的实施例中,可以是5mg/ml;所述ptmc的二氯甲烷溶液的浓度优选为1~5mg/ml,更优选为2~4mg/ml,最优选为3mg/ml;所述氧化葡聚糖水溶液与ptmc的二氯甲烷溶液的体积比优选为(1~5)∶1,更优选为(2~4)∶1,最优选为3∶1。
在本发明中,所述共溶剂优选为丙酮,所述共溶剂的体积、氧化葡聚糖的体积与ptmc溶液的体积比优选为1∶(1~3)∶(4~10),更优选为1∶2∶(5~6)。
在本发明中,所述初乳为油包水,内水相为ptmc和疏水性药物,外油相为氧化葡聚糖。
本发明在初乳中先加入2~8g/l的聚乙烯醇水溶液,以便更好的形成复乳,所述聚乙烯醇(pva)水溶液的浓度优选为2~7g/l,更优选为3~6g/l,最优选为4~5g/l;所述初乳与2~8g/l的聚乙烯醇水溶液的体积比优选为1∶(1~5),更优选为1∶(2~4),最优选为1∶3。
超声破碎形成复乳后,本发明在复乳中加入0.1~1g/l的聚乙烯醇水溶液,使溶液中的颗粒分散开。所述聚乙烯醇的浓度优选为0.3~0.8g/l,更优选为0.5~0.6g/l;所述复乳与0.1~1g/l的聚乙烯醇水溶液的体积比优选为1∶(10~15),更优选为1∶(11~14),最优选为1∶(12~13)。
加入0.1~1g/l的聚乙烯醇水溶液后,缓慢搅拌直至有机溶剂完全挥化,并通过进一步的离心、洗涤和重悬,得到分散在水中的ptmc/葡聚糖纳米载体颗粒。
本发明优选先配制亲和素的碳酸氢钠溶液和载体溶液,然后再将上述两种溶液混合,搅拌反应1~5小时后加入硼氢化钠,进行还原反应,得到表面接枝有亲和素的载体。
在本发明中,所述亲和素的碳酸钠溶液的质量浓度优选为1~10mg/ml,更优选为3~8mg/ml,最优选为5~6mg/ml;所述载体溶液中的溶剂优选为na2hpo4和nacl,所述na2hpo4和nacl的摩尔比优选为1∶(1~3),更优选为1∶(1.5~2);所述载体溶液中载体的质量浓度优选为1~10mg/ml,更优选为3~8mg/ml,最优选为5~6mg/ml。两溶液混合之后,本发明将得到的混合溶液在室温下搅拌反应1~5小时,更优选为2~3小时。
在本发明中,所述硼氢化钠的摩尔浓度优选为3~10mol/l,更优选为5~6mol/l;所述硼氢化钠的体积与上述混合溶液的体积之比优选为1ml∶(1~10)μl,更优选为1ml∶(3~8)μl,最优选为1ml∶(5~6)μl。加入硼氢化钠之后,反应20~50min,优选反应30~40min,离心去除上清,冷冻干燥后保存,得到表面接枝有亲和素的载体。
然后将生物素修饰的sirna与上述表面接枝有亲和素的载体混悬液混合,进行反应,得到药物和基因双重运载系统。
在本发明中,所述生物素修饰的sirna与表面接枝有亲和素的载体的体积比优选为1∶(1~10),更优选为1∶(3~8),最优选为1∶(5~6)。
在本发明中,所述反应的温度优选为0~6℃,更优选为1~5℃,最优选为2~4℃;所述反应的时间优选为1~3小时,更优选为1.5~2小时。本发明优选在涡旋振荡的条件下进行上述反应。
基于上述所述的药物和基因双重运载系统及其制备方法,本发明提供一种上文所述的药物和基因双重运载系统在制备治疗肿瘤药物中的应用。
本发明提供一种药物和基因双重运载系统,包括载体与生物素化的sirna,所述载体与生物素化的sirna之间通过亲和素接枝连接;所述载体为核壳结构,内核为聚三亚甲基碳酸酯,外壳为氧化葡聚糖,所述聚三亚甲基碳酸酯内核内负载有疏水性药物;所述氧化葡聚糖和聚三亚甲基碳酸酯的质量比为(1~6)∶1。本发明使用葡聚糖和聚三亚甲基碳酸酯(ptmc)制备核壳状的纳米载体,并与亲和素-生物素反应体系结合,克服目前sirna阳离子脂质体毒性大、无法同时运载其他药物的缺陷,为肿瘤等多基因、多因素疾病的诊疗提供新的思路。同时,本发明制备得到的载体纳米颗粒呈双亲性,使用亲和素与载体纳米颗粒接枝后,生物素修饰的sirna稳定性更佳。
为了进一步说明本发明,以下结合实施例对本发明提供的一种药物和基因双重运载系统、其制备方法及应用进行详细描述,但不能将其理解为对本发明保护范围的限定。
实施例
(1)材料:ptmc、二氯甲烷、葡聚糖、高碘酸钠、乙二醇、盐酸羟胺、聚乙烯醇、丙酮、亲和素、硼氢化钠、乙醇胺、5′端生物素修饰的sirna。
(2)设备:集热式恒温加热磁力搅拌器、超声波细胞破碎仪、电子分析天平、傅里叶红外光谱仪、纳米粒径及zeta电位仪、透射电子显微镜、冷冻干燥机。
(3)合成方法:
ptmc/葡聚糖纳米载体颗粒的制备
将葡聚糖与高碘酸钠按摩尔比1∶5混合,避光搅拌1小时后,用乙二醇终止反应,透析3天后,烘干,得到带醛基的氧化葡聚糖,用盐酸羟胺(0.25m)滴定测定醛基数量,红外光谱分析氧化葡聚糖的结构。5mg/ml氧化葡聚糖水溶液、3mg/ml的ptmc-二氯甲烷溶液、疏水性药物一起混合于共溶剂1ml丙酮溶液,超声破碎形成初乳(w1/o1)。再按1∶3体积比加入5g/l的pva水溶液,超声破碎形成复乳(w1/o1/w2),最后倒入一定体积0.5g/lpva水溶液,缓慢搅拌直至有机溶剂完全挥化。通过进一步的离心、洗涤、重悬,得到分散在水中的ptmc/葡聚糖纳米颗粒。将纳米颗粒进行粒径分析。
结果如图2~4所示,图2为本发明实施例中ptmc/葡聚糖纳米载体颗粒的粒径表征;图3为本发明实施例中ptmc/葡聚糖纳米载体颗粒的zeta电位;图4为本发明实施例中ptmc/葡聚糖纳米载体颗粒扫描电镜图。由图2~4可以看出,本实施例制备得到的ptmc/葡聚糖纳米载体颗粒粒径约为331.8nm,zeta电位为-8.86mv,为壳核双层结构。
ptmc/葡聚糖纳米颗粒与亲和素接枝的制备过程
配制5mg/ml亲和素-碳酸氢钠溶液,5mg/mlptmc/葡聚糖纳米颗粒溶液(溶剂为0.1mna2hpo40.15mnacl混合液),两种溶液混合,室温下搅拌反应3小时,每ml混合液加入5μ15m硼氢化钠,反应30分钟后,离心去上清,冷冻干燥保存。bca法测定纳米颗粒表面接枝亲和素的量。
琼脂糖凝胶电泳实验检验纳米颗粒结合sirna的能力
分别取2μl生物物-sirna至不含rnase的4个ep管中,然后分别加入,a组:10uldepc水、b组:10ulnp/a(纳米颗粒/亲和素质量比)2∶1混悬液、c组:10μlnp/a1∶1混悬液、d组:10μlnp/a1∶2混悬液,总反应体系为12ul。在4℃冰箱内涡旋震荡1.5小时后,加入5×loadingbuffer混匀,60v电压电泳30分种,凝胶成像仪观察结果。
结果如图5所示,图5为本发明实施例中a~d组在琼脂糖凝胶电泳sirna迁移实验中的泳动距离缩动。由图5可以看出,b组中的sirna随纳米颗粒固定于上样孔内。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!