一种用于抑制脂肪酸合成酶的药物及其制备方法
1.本发明属于医药生物技术领域,具体涉及一种用于抑制脂肪酸合成酶的药物及其制备方法。
背景技术:
2.众所周知,脂肪酸的生物合成是机体的重要代谢途径,其在能量运输和储存、细胞生物膜结构、提供激素合成的中间物和参与信号转导及蛋白质酰化等多个方面发挥着重要的作用。人体内的脂肪酸来源主要有两部分构成,一部分是直接通过膳食摄入的外源性脂肪酸,而另一部分就是人体自身合成的内源性脂肪酸。
3.脂肪酸合成酶(fatty acid synthase,fasn)是生物体内脂肪酸从头合成的唯一关键酶类,以多酶复合体的形式存在,并通过其七个活性位点的作用,催化乙酰辅酶a和丙二酸单酰辅酶a(即丙二酰辅酶a)生成以棕榈酸为主的长链脂肪酸的所有反应步骤。fasn普遍表达于各种组织细胞中,尤其在哺乳动物肝、肾、脑、肺、乳腺以及脂肪组织中表达量丰富。其表达量和活性极易受机体营养、激素和发育状况的影响。当动物受不同营养素或激素刺激时,肝脏和脂肪组织中的fasn的表达量或活性会发生巨大的变化。
4.已有多项报道表明,fasn与肥胖、糖尿病、动脉粥样硬化等多种代谢综合征密切相关,开发fasn抑制剂有望为肥胖症等代谢综合征的治疗开辟新途径。fasn特异性的小分子抑制剂可通过抑制fasn而减少脂肪酸的合成;并提高肝脏、脂肪等外周组织中的肉毒碱软脂酰转移酶-1的活性以增强脂肪酸的氧化和能量的消耗,进而达到减肥的目的。另外,fasn 抑制剂还可以改善非胰岛素依赖型糖尿病,降低高血压、冠状动脉栓塞及其他肥胖并发症的症状,降低发病率。
5.脂肪酸生成增加是多种癌细胞的代谢特征之一。脂肪酸生成的增加可满足癌细胞对细胞成分,脂质信号分子和蛋白质翻译后修饰的过度需求。因此,在包括前列腺癌,卵巢癌,乳腺癌,结直肠癌和肺癌等的多种恶性肿瘤中,已经报道了脂肪酸合酶(fasn)的过表达。此外,fasn表达的高水平与更多的肿瘤侵袭性和不良的预后结果有关。通过药物分子抑制 fasn活性或通过小干扰rna(sirna)将其沉默,可破坏脂质筏的形成,进而限制致癌信号传导途径,耗尽维持细胞膜所需的脂质,诱导丙二酰辅酶a和神经酰胺的毒性蓄积,并因此诱导癌细胞凋亡。
6.总之,fasn在肝脏及脂肪细胞、各种肿瘤细胞中都有较高的表达,已成为研究此类疾病的药物新靶标。而现有的脂肪酸合成酶抑制剂都存在靶点不明确,起效浓度高,溶解度差以及副作用严重等问题。因此,新型fasn抑制剂的研究,对于抑制内源性脂肪酸的过度生物合成,进而有效控制肿瘤、肥胖及各种相关代谢综合症等的发生、发展有着重要的意义。
技术实现要素:
7.为了解决上述问题,本发明提供了通式(i)所示的化合物或其药学上可接受的盐在制备用于抑制脂肪酸合成酶药物中的应用,
[0008][0009]
其中,x1、x2、x3分别独立地选自n、o、ch中任意一种;为双键或者单键;r1选自氢、烷基;r2选自氢、卤素、羟基、烷基、烷氧基中任意一种;
[0010]
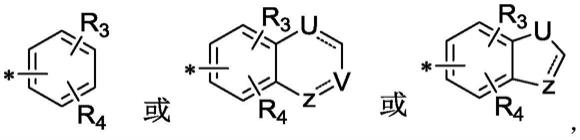
环a为环a为为双键或者单键;u、 v、z分别独立的选自ch、n、nh;r3、r4分别独立地选自氢、卤素、芳氧基和烷氧基中任意一种;
[0011]
q为至少一个杂原子或不包含杂原子的c
1~5
直链或支链烃基,所述杂原子分别独立地选自氮、氧和硫;
[0012]
n为0-4;y选自氮、氧或硫。
[0013]
在本发明的一种实施方式中,所述环a为取代基取代或未取代的苯基、萘基、[1,8]萘啶基、苯并噁唑基、苯并噻唑基、苯并咪唑基、苯并三唑基、吲哚基、苯并-1,3-二氧杂环戊烯基、苯并二氧杂环己烷基、苯并噻二唑基、吲唑基、苯并呋喃基、喹啉基、异喹啉基、噁唑并[5,4-b]吡啶基或噁唑并[5,4-c]吡啶基;其中取代基为卤素、芳氧基和烷氧基中任意一种。
[0014]
在本发明的一种实施方式中,所述q为端基为-o-、-n(r)-、-s-、-so-、-so
2-、-nrc(o)-、
ꢀ-
c(o)nr-、-n(r)so
2-、-so2n(r)-、-oc(o)-或-c(o)o-的c
1~5
直链或支链烃基。
[0015]
在本发明的一种实施方式中,所述通式(i)所示化合物药学上可接受的盐包括:乳酸盐、盐酸盐、磷酸盐、醋酸盐、苹果酸盐、枸椽酸盐或天冬氨酸盐。
[0016]
在本发明的一种实施方式中,所述通式(i)化合物包含下述结构所示的化合物:
[0017]
[0018]
本发明提供的通式(i)所示的化合物或其药学上可接受的盐,可作为脂肪酸合成酶抑制 zz剂,用于抑制脂肪酸合成酶的活性,在调节脂肪酸组成中的发挥作用。
[0019]
本发明的第二个目的是提供一种药物组合物,所述组合物包含上述通式(i)所示的化合物、或其药学上可接受的盐、溶剂化物、酯、前药、互变异构体、立体异构体中的任意一种或者多种混合。
[0020]
所述组合物还含有其他医学上可接受的辅料,包括黏合剂、填充剂、崩解剂、润滑剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂等。
[0021]
本发明的第三个目的是提供一种用于治疗脂肪酸代谢疾病的药物,所述药物中包含上述通式(i)所示的化合物、或其药学上可接受的盐、溶剂化物、酯、前药、互变异构体、立体异构体中的任意一种或者多种混合。
[0022]
所述脂肪酸代谢疾病选自肥胖症、心脑血管疾病、高脂血症、原发性肥胖、肺动脉高血压、hodgkin疾病、肠易激综合征、脑血管意外、动脉粥样硬化和糖尿病、血管球性肾炎、病毒感染。
[0023]
本发明的第四个目的是提供一种用于治疗癌症的药物,所述药物中包含上述通式(i)所示的化合物、或其药学上可接受的盐、溶剂化物、酯、前药、互变异构体、立体异构体中的任意一种或者多种混合。
[0024]
所述癌症选自卵巢癌、乳腺癌、子宫癌、结肠癌、子宫颈癌、肺癌、前列腺癌、睾丸癌、胸腺癌、皮肤癌、膀胱癌、胰腺癌、白血病、淋巴瘤、非小细胞肺癌、小细胞肺癌、多发性骨瘤癌、鳞状上皮细胞癌、肾癌、尿道癌、支气管癌、食管癌、骨癌、咽喉癌、膀胱癌、甲状腺癌、肝癌、头颈癌、眼癌、皮肤癌、口腔癌、胃癌、结肠癌、直肠癌、脑癌和中枢神经系统癌症。
[0025]
本发明的第五个目的是提供一种用于治疗免疫性疾病的药物,所述药物中包含上述通式 (i)所示的化合物、或其药学上可接受的盐、溶剂化物、酯、前药、互变异构体、立体异构体中的任意一种或者多种混合。
[0026]
所述免疫性疾病选自多发性硬化、中枢神经系统损伤、炎性肠病、类风湿性关节炎、骨关节炎、银屑病、系统性红斑狼疮、移植物抗宿主疾病、哮喘和慢性阻塞性肺疾病。
[0027]
所述药物的剂型包括传统剂型,例如汤剂、丸剂、散剂、膏剂、丹剂、酒剂、糖浆剂、浸膏剂、锭剂、棒剂、栓剂、曲剂、炙剂等;还包括现代剂型,例如片剂、冲剂、袋泡剂、口服液剂、胶囊剂、滴丸剂、合剂、酊剂、气雾剂、膜剂、针剂、注射剂等。
[0028]
所述药物还含有其他医学上可接受的辅料,包括黏合剂、填充剂、崩解剂、润滑剂、抗氧剂、矫味剂、芳香剂、助溶剂、乳化剂、增溶剂、渗透压调节剂、着色剂等。
[0029]
本发明提供的技术方案具有如下优点:
[0030]
(1)本发明通式i所示结构的化合物或其药学上可接受的盐可用于制备脂肪酸合成酶抑制剂,能够抑制fasn的酶活性,是一种新型的fasn抑制剂。fasn作为哺乳动物体内脂肪酸从头合成的关键酶,参与了肿瘤的发生和发展。有望通过fasn抑制剂的作用有效降低肿瘤细胞内源性脂肪酸的过量合成,进而影响其细胞能量代谢、细胞周期调节和上皮间质转化。因此,本发明脂肪酸合成酶抑制剂对fasn的酶活性抑制效果明显,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,发挥对肿瘤的治疗效果,具有重要的临床应用前景。
[0031]
(2)本发明脂肪酸合成酶抑制剂能够调节脂肪酸组成和比例,可应用于治疗脂肪酸代谢类疾病或者免疫系统疾病。
[0032]
(3)本发明脂肪酸合成酶抑制剂制备的药物组合物,对脂肪酸酶的抑制效果明显,能够使肿瘤细胞发生细胞周期停滞、并明显缩小活体小鼠内体的移植瘤,抑制脂滴的形成。因此,上述的药物组合物是一种重要的肿瘤治疗前景药物,为癌症或脂肪酸代谢疾病提供了一种新的治疗途径。
附图说明
[0033]
图1为式ⅰ所示化合物对多种肿瘤细胞增殖的影响;
[0034]
图2为式ⅰ所示化合物能诱导前列腺癌细胞pc3凋亡;
[0035]
图3为式ⅰ所示化合物对前列腺癌细胞pc3脂肪酸组成的影响;
[0036]
图4为式ⅰ所示化合物对前脂肪细胞op9脂滴合成的影响;
[0037]
图5为式ⅰ所示化合物对小鼠前列腺癌细胞pc3移植瘤的影响。
具体实施方式
[0038]
本申请提及的卤素为氟、氯、溴、碘;烷基为c1-8直链或者支链烷基;烷氧基为c1-8 直链或者支链烷氧基;芳氧基为中芳基为未取代的苯基或者含有下述取代基的苯基:卤素、 (c
3-c
10
)-环烷基、(c
1-c
10
)-烷基、(c
2-c6)-链烯基、(c
2-c6)-炔基、o-(c
1-c6)-烷基、 o-co-(c
1-c6)-烷基。
[0039]
化合物1-3、对比化合物c-1的来源:可于chemdiv购买得到(http://www.chemdiv.com/),其中化合物i-1的产品编号为y200-4916;化合物i-2的产品编号为y207-4406;化合物i-3 的产品编号为y200-5086。
[0040]
其中,化合物1-3的结构如下所示:
[0041][0042]
实施例1
[0043]
检测下述式i-1所示的化合物对结肠癌细胞hct116中fasn活性的影响:
[0044]
fasn酶活检测:
[0045]
(1)收集对数期细胞,调整细胞悬液浓度,以直径6cm规格的培养皿每2x106个细胞/皿为宜。
[0046]
(2)在5%co2,37℃下孵育,待细胞贴壁完全后弃去原培养基,每皿细胞中分别加
入6ml含20μm化合物i-1的1%fbs培养基,以加入6ml含20μm浅蓝菌素的1%fbs 培养基作为阳性对照。
[0047]
(3)孵育4h后弃上清,胰酶消化2min,以2~4倍胰酶体积的完全培养基终止消化,1000rpm离心5min,弃上清,5ml dpbs重悬细胞,取500μl至1.5ml ep管中待蛋白定量,其余离心弃尽上清。
[0048]
(4)以1ml 10mm kh2po4/koh ph6.5的缓冲液(含4mm dtt,0.3mg/ml bsa, 2.5mm edta)重悬细胞,加入nadph、乙酰辅酶a和丙二酰辅酶a使其终浓度分别为0.14mm、0.18mm和0.09mm,在340nm处测其吸光度值,测定时间为1min。
[0049]
fasn酶活的定义:活性单位定义:37℃中每毫克蛋白每分钟氧化1μmol nadph为 1u;
[0050]
fasn(u/mg蛋白)=[(δa
测定管-δa
空白管
)]
÷
ε
÷
d
×
v
总
×
106]
÷
(cpr
×
v
样
)
÷
t=1.16
×
(δa
测定管
ꢀ-
δa
空白管
)
÷
cpr;
[0051]
抑制剂对fasn酶活的影响(抑制率)定义为:fasn(%)=[1-(fasn
抑制剂
÷
fasn 对照
)]
×
100%;
[0052]
其中ε:nadph摩尔消光系数,6.22
×
103l/mol/cm;d:比色皿光径,1cm;v
总
:反应体系总体积,1000μl=0.001l;cpr:上清液蛋白浓度,mg/ml;v样:加入反应体系中上清液体积,100μl=0.1ml;t:反应时间,1min;fasn
抑制剂
:经各抑制剂处理的细胞fasn 酶活;fasn
对照
:未经抑制剂处理的细胞fasn酶活。
[0053]
ic50值测定:
[0054]
ic50(half maximal inhibitory concentration)是指被测量的拮抗剂的半抑制浓度。它能指示一定浓度的某一药物或者物质(抑制剂)诱导肿瘤细胞凋亡50%,该浓度称为50%抑制浓度,即凋亡细胞与全部细胞数之比等于50%时所对应的浓度。ic50值可以用来衡量药物诱导凋亡的能力,即诱导能力越强,该数值越低,也可以反向说明某种细胞对药物的耐受程度。
[0055]
(1)收集对数期细胞,调整细胞悬液浓度,以96孔板每孔100μl为宜,种板使待测细胞密度调整至1000~10000个/孔,边缘孔以无菌pbs填充。
[0056]
(2)5%的co2,37℃孵育细胞,待细胞贴壁完全后弃去原培养基,每孔加入200μl 含0.01μm、0.1μm,1μm,5μm和10μm化合物i-1或浅蓝菌素(cerulenin)的1wt%fbs 培养基,复孔数为6。加入等体积dmso作为阴性对照。
[0057]
(3)孵育72h后,拍照记录细胞状态,并弃去原培养液,每孔加入100μl含0.5mg/ml mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名:噻唑蓝)的无血清培养基.
[0058]
(4)孵育2~4h后,弃去原培养液,每孔加入150μl二甲亚砜(dmso),300rpm 振荡10min,使紫色结晶物充分溶解。
[0059]
(5)在酶联免疫检测仪在od
570nm
处测量各孔的吸光值,并以od
630nm
处吸光值为参考,进行双波长测定,存活率结果经如下公式计算得到:
[0060]
细胞存活率=(od
570-od
630
)/(od
570阴性对照-od
630阴性对照
);
[0061]
其中,od
570
:各处理组od
570
值;od
630
:各处理组od
630
值;od
570
对照:阴性对照组的od
570
值;od
630
对照:阴性对照组的od
630
值。
[0062]
(6)按浓度梯度将存活率结果用graphpad6.0软件处理,分析模式为log
(inhibitor)vs. nonlinear regression(curve fit),计算所得ic50值表述为x
±
sd。
[0063]
实施例2
[0064]
检测式i-1所示的化合物对肿瘤细胞(pc3、ht-29、hela、hepg2)增殖的影响:
[0065]
(1)收集对数期细胞,调整细胞悬液浓度,以96孔板每孔100μl为宜,种板使待测细胞密度调整至1000~10000个/孔,边缘孔以无菌pbs填充。
[0066]
(2)5%的co2,37℃孵育细胞,待细胞贴壁完全后弃去原培养基,每孔加入200μl 含10μm化合物i-1的1wt%fbs培养基,复孔数为6。分别加入相同浓度的脂肪酸合成酶抑制剂c75、浅蓝菌素(cerulenin)和gsk2194069(以下表示为gsk)作为阳性对照,加入等体积dmso作为阴性对照。
[0067]
(3)孵育72h后,拍照记录细胞状态,并弃去原培养液,每孔加入100μl含0.5mg/ml mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,商品名:噻唑蓝)的无血清培养基.
[0068]
(4)孵育2~4h后,弃去原培养液,每孔加入150μl二甲亚砜(dmso),300rpm 振荡10min,使紫色结晶物充分溶解。
[0069]
(5)在酶联免疫检测仪在od
570nm
处测量各孔的吸光值,并以od
630nm
处吸光值为参考,进行双波长测定,结果经如下公式计算得到:
[0070]
细胞存活率=(od
570-od
630
)/(od
570阴性对照-od
630阴性对照
);
[0071]
其中,od
570
:各处理组od
570
值;od
630
:各处理组od
630
值;od
570
对照:阴性对照组的od
570
值;od
630
对照:阴性对照组的od
630
值。
[0072]
图1显示脂肪酸合成酶抑制剂c75、浅蓝菌素和gsk,以及化合物i-1对22rv1、 pc3、ht-29、hela、hepg2、caco-2和hct116共7种不同肿瘤细胞的增殖的影响。由图1可知虽然c75、浅蓝菌素和gsk作为脂肪酸合成酶抑制剂,具有抑制肿瘤细胞增殖的效果,但在不同种类的肿瘤细胞中效果相差较大,对部分肿瘤细胞的增殖无明显影响,稳定性差。与上述三种抑制剂相比,化合物i-1对肿瘤增殖的抑制效果明显提升,且对多种不同种类的肿瘤细胞中均能形成有效抑制。
[0073]
实施例3
[0074]
检测式i-1所示的化合物对前列腺癌细胞pc3凋亡的影响:
[0075]
(1)取处于对数生长期的癌细胞,接种于6cm培养皿中,每皿接种量为2x106个细胞, 5%co2,37℃孵育。
[0076]
(2)待细胞贴壁完全后,加入6ml含10μm的式ⅰ所示的结构化合物的2%fbs培养基。
[0077]
(3)分别孵育24h和48h后,弃上清,不含edta的胰酶消化2min,以2~4倍胰酶体积的完全培养基终止消化,1000rpm离心5min,弃上清,1ml预冷的dpbs洗两次,弃尽上清。
[0078]
(4)300μl的1
×
binding buffer重悬细胞。
[0079]
(5)加入5μl的annexin
ⅴ-
fitc混匀后,避光室温孵育15min。
[0080]
(6)加入5μl的pi染液混匀,避光室温孵育5min;
[0081]
(7)补加200μl的1
×
binding buffer后流式细胞仪上级检测。
[0082]
图2为式ⅰ所示化合物对前列腺癌细胞pc3凋亡的影响。图2显示,和未经抑制剂处理的对照组前列腺癌细胞pc3相比,分别经过10μm浅蓝菌素和化合物i-1处理24h和72h 后的前列腺癌细胞pc3初期凋亡和晚期凋亡的细胞比例明显增加,尤其是经化合物i-1 处理的实验组,24h时细胞凋亡的总比例(初期凋亡+晚期凋亡)为29.9%,72h时为38.5%,不仅
高于对照组(0.498%和8.20%),也明显高于作为阳性参照的浅蓝菌素处理组(23.87%和34.5%)。因此式ⅰ所示的结构化合物可诱导pc3细胞凋亡,提示式ⅰ所示的结构的化合物能够抑制肿瘤的发生、发展,作为一种新型的治疗药物应用于肿瘤的临床治疗。
[0083]
实施例4
[0084]
检测式i-1所示结构的化合物对肿瘤细胞(前列腺癌细胞pc3)合成的脂肪酸含量和组成的影响:
[0085]
(1)取处于对数生长期的癌细胞,于6cm细胞培养皿种板,种板密度为2x106个细胞,5%co2,37℃孵育。
[0086]
(2)待细胞贴壁后,每皿加入6ml含20μm式ⅰ所示化合物的1%fbs培养基,以培养基为阴性对照,以浅蓝菌素为阳性对照。
[0087]
(3)孵育24h后,弃培养基,胰酶消化2min,以2~4倍胰酶体积完全培养基终止消化,1000rpm离心5min,弃上清。
[0088]
(4)10ml dpbs重悬,取1ml细胞悬液至1.5ml ep管中用于蛋白定量,其余9ml 再次离心弃上清,加入适量体积内标,冻干。
[0089]
(5)加入1ml 0.5m naoh-甲醇溶液,充氮,涡旋振荡30s,100℃固浴5min,冷却至室温。
[0090]
(6)加入1ml 40%三氟化硼-甲醇溶液,充氮,涡旋振荡30s,100℃固浴5min,冷却至室温。
[0091]
(7)加入4ml正己烷,2ml饱和氯化钠溶液,涡旋振荡,2000rpm离心10min,取上清,氮吹至完全,500μl正己烷重悬,转移至进样瓶中,气质联用上机检测。
[0092]
图3为式ⅰ所示化合物对前列腺癌细胞pc3脂肪酸含量和组成的影响,脂肪酸种类包括肉豆蔻酸(14:0)、棕榈酸(16:0)、棕榈油酸(16:1)、硬脂酸(18:0)、油酸(18:1)和亚油酸(18:2)。由图3可知,经式ⅰ所示化合物处理的pc3细胞脂肪酸总量和16:0的含量都明显低于对照组,说明式ⅰ所示化合物能够抑制pc3的脂肪酸合成,改变肿瘤细胞内脂肪酸分布,从而减少了细胞增殖所需的结构脂质和能量,是抑制肿瘤增殖、诱导肿瘤细胞凋亡的重要原因,因此,式ⅰ所示化合物在肿瘤治疗方面具有重要的临床应用前景。
[0093]
实施例5
[0094]
检测式i-1所示结构的化合物对前脂肪细胞op9的影响:
[0095]
(1)取处于对数生长期的癌细胞,于6cm细胞培养皿种板,种板密度为2x106个细胞,5%co2,37℃孵育。
[0096]
(2)待细胞贴壁后,每皿加入6ml含0.5μm罗格列酮的培养基以诱导op9细胞分化,以未加罗格列酮的组为完全对照,抑制剂组所加培养基不仅含0.5μm罗格列酮,还含有20μm浅蓝菌素或式ⅰ所示化合物。
[0097]
(3)孵育5d后,弃培养基,每孔1ml dpbs洗一遍,每孔加入1ml 4%多聚甲醛溶液,室温避光孵育半小时;
[0098]
(4)弃上清,每孔1ml dpbs洗一遍,加入500μl的油红o工作液;60℃避光水浴1h;
[0099]
(5)弃上清,每孔1ml dpbs洗三遍;拍照记录实验结果;
[0100]
(6)弃上清,每孔加入500μl异丙醇,37℃震荡孵育10min,510nm处测定od值。
[0101]
图4为式ⅰ所示化合物对前脂肪细胞op9脂滴合成的影响。与对照组相比,经式ⅰ所
示结构的化合物处理的op9细胞od
510
值明显下降,且降幅显著大于浅蓝菌素处理组,说明式ⅰ所示结构能够抑制op9细胞脂滴合成。
[0102]
实施例6
[0103]
检测式ⅰ所示结构的化合物对小鼠移植瘤生长的影响:
[0104]
(1)培养癌细胞至密度80%(对数生长期),按照细胞传代实验进行,pbs洗涤,消化,离心去上清,之后用无血清的培养基重悬洗涤细胞两遍;用无血清培养基调整细胞悬液浓度为2
×
107个/ml;等体积加入已经过夜四度融化的基质胶,振荡混合均匀待用 (含基质胶的步骤全部在冰上操作);
[0105]
(2)每只裸鼠在背部皮下接种100μl细胞与基质胶混合液,接种后每天定时观察肿瘤的生长情况,确定移植瘤模型是否成功,待肿瘤体积约在200mm3,开始药物处理;
[0106]
(3)实验选取移植瘤模型成功裸鼠(成瘤率100%),裸鼠适应饲养7d,进行皮下癌细胞移植实验,待瘤体肉眼可见后,每隔2d进行一次腹腔注射,注射剂量为5mg/kg 的化合物i-1,以注射溶剂组为对照,每组5只。给药4周后,取瘤体称重。
[0107]
图5为式ⅰ所示化合物对小鼠前列腺癌细胞pc3移植瘤的影响。如图所示,经式
ⅰ-
1所示化合物处理四周的小鼠肿瘤质量明显低于对照组,表明式ⅰ所示化合物可以在体内抑制肿瘤细胞增殖,其作为一种新型的抗肿瘤药物具有重要的应用前景。
[0108]
实施例7
[0109]
检测化合物i-1~化合物i-5及对比化合物c-1对hct116中fasn活性的抑制效果,以及对肿瘤细胞pc3增殖的影响。
[0110]
以实验例1中所示的fasn酶活的测定方法检测不同物质对fasn酶活性的影响,以实验例2中所示的方法检测不同物质对肿瘤细胞增殖增殖的影响,并以浅蓝菌素为对照计算不同物质对fasn酶活性抑制率(%)和对肿瘤增殖的抑制率(ic
50
nm)。检测结果如下述表1所示:
[0111]
表1不同物质对fasn酶活性和肿瘤增殖的抑制效果
[0112] fasn酶活性抑制率(%)pc3(ic
50
nm)浅蓝菌素20.5219
±
2.5化合物i-155.2610
±
1.2化合物i-234.3716
±
1.9化合物i-341.7713
±
1.1
[0113]
由上述表1可知,本发明提供的化合物i-1至化合物i-5均具能有效抑制脂肪酸合成酶活性,其中以化合物i-1对脂肪酸合成酶(fasn)的抑制率最高,为55.26%,明显高于阳性对照浅蓝菌素的抑制率20.52%;且根据ic50结果可知,化合物i-1有效浓度也明显低于浅蓝菌素,10
±
1.2nm时可致前列腺癌细胞pc3达到50%的死亡率。此外,申请人还发现,如果a环上有羟基取代的话,其抑制率只有18.22%,ic50结果也较高,较浅蓝菌素并未有显著提升,甚至有所不足。
[0114]
脂肪酸合成酶(fasn)参与肿瘤脂肪酸代谢和细胞周期过程,在肿瘤的生长、侵袭和迁移中发挥重要作用,本申请提供的具有通式i所示结构的化合物,能够作为fasn 抑制剂,影响肿瘤细胞中的脂肪酸合成、分布,使细胞周期停滞在间期,组织肿瘤细胞的有丝分裂,实现对肿瘤增殖的抑制。因此,通式i所示结构的化合物作为一种新型的脂肪酸合成酶
抑制剂,在肿瘤的临床治疗、以及肥胖症等代谢性疾病的治疗中具有重要的应用前景。
[0115]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1