小分子化合物YJ-5-41在制备抗胃癌药物中的应用
本发明涉及医药技术领域,具体涉及前列腺素e2受体亚型ep4(ep4受体)拮抗剂yj-5-41用于治疗胃癌中的应用。
背景技术:
胃癌起源于胃壁最表层的黏膜上皮细胞,是常见的消化系统恶性肿瘤,中国胃癌患者约占全球人数的1/3。胃癌治疗目前仍以根治性手术切除为主,辅以化疗和放疗。由于胃癌起病隐蔽、早期诊断率低,大约40%的患者确诊时已处于晚期,故手术切除率低、长期生存率低已成为胃癌的特点。对于不可手术切除的晚期胃癌患者,治疗以全身化疗为主,化疗相比较其他支持治疗来说,可以明显改善生存时间,但是在一线临床试验中,即使使用最优的化疗方案,中位生存时间也仅有9-11个月,高达80%的接受潜在治疗的胃癌患者随后发生局部复发或远处转移。
近年来,随着对胃癌分子生物学特点的不断认识,新的胃癌治疗方案不断出现,单克隆抗体治疗和免疫治疗给胃癌患者带来希望。曲妥珠单抗是针对her-2阳性胃癌治疗的靶向药物。随机对照临床试验结果显示曲妥珠单抗治疗组患者的总生存率明显优于对照组。一项回顾性研究,既往未接受过曲妥珠单抗治疗的5-氟尿嘧啶治疗失败的患者二线应用曲妥珠单抗仍然有效,然而,在胃癌患者中,仅有10-15%的患者表达her-2,由于绝大部分患者不表达her-2,这些患者对曲妥珠单抗的治疗无应答。免疫检查点抑制剂疗法为一种负反馈疗法,主要是利用单克隆抗体进行治疗,单克隆抗体特异性地与相关位点结合,激活t淋巴细胞,进而达到杀伤肿瘤细胞的目的。在胃癌患者中,pd-l1和pd-l2在部分患者中高表达。在一项由493名胃癌患者参与的ⅲ期临床试验中,纳武单抗和安慰剂组的中位生存期分别为5.32和4.14个月,1年生存率分别为26.6%和10.9%,有效率分别为11.2%和0%,纳武单抗的持续起效时间为9.53个月。同样,在一项ii期研究中,帕博利珠单抗也显示出免疫治疗用于晚期胃癌/胃食管结合部癌后线治疗的疗效。但不同于纳武单抗,该研究中,肿瘤及免疫细胞pd-l1表达(联合阳性评分≥1)阳性患者较阴性患者缓解率更高,而帕博利珠单抗被美国食品药品管理局(fda)获批的适应证也强调联合阳性评分条件。美国fda批准派帕博利珠单抗用于治疗肿瘤表达pd-l1(联合阳性评分≥10)的既往接受过两种或两种以上治疗后疾病发生进展的复发性局部晚期或转移性胃或胃食管交界性腺癌。但是,帕博利珠单抗在胃癌的一线和二线临床试验中均以失败告终。此外,多项研究显示,免疫检查点程序性死亡受体1(programmeddeathprotein1,pd-1)抑制剂在胃癌中的响应率仅为10%~26%。因此,免疫检查点抑制剂在胃癌患者的早期治疗或者pd-l1和pd-l2不表达的患者中疗效有限。
目前晚期胃癌的治疗仍然是临床肿瘤学界研究的难点,因此急需开发新型高效低毒的胃癌靶向药物。研究表明幽门螺杆菌感染与胃癌的发生密切相关,70%以上的胃癌组织中存在环氧合酶-2(cox-2)的表达,环氧合酶-2基因的表达是对幽门螺旋杆菌感染的直接反应,环氧合酶-2的表达促进前列腺素e2(pge2)的生成,前列腺素e2结合到细胞上的前列腺素e2受体亚型ep4(ep4受体),激活下游信号通路,通过多种途径调节免疫反应,这提示cox2/pge2/ep4信号通路在胃癌的发生过程中具有重要作用。此外,在高表达cox-2和前列腺素e合酶-1(mpges-1)的转基因小鼠中,幽门螺杆菌感染增强ep4受体在胃癌组织中的表达并促进巨噬细胞的浸润,cox-2抑制剂明显抑制肿瘤的形成。然而,长期使用cox-2抑制剂易引起肾脏和胃肠道毒性,增加心血管风险。这些因素限制它作为抗癌药物的使用。
技术实现要素:
为克服现有技术的上述缺陷,本发明提出以ep4受体为靶点,开发的新型高效低毒的ep4受体拮抗剂用于胃癌的治疗。本发明提出了一种新型的ep4受体拮抗剂式(i)yj-5-41在胃癌中的抗肿瘤功能和机制,为胃癌的治疗提供新的思路和策略,具有基础研究和临床应用的双重意义。
本发明提出化合物yj-5-41或药学上可接受的盐或与药学上可接受的载体联用在制备抗胃癌/治疗胃癌的药物中的应用,其结构如式(i)所示:
式(i)所示化合物yj-5-41,其中文名:4-((2-(4-氟苄基)-4,7-二氢-5h-噻吩并[2,3-c]吡喃-3-甲酰胺基)甲基)苯甲酸,分子式为c23h20fno4s,分子量为425.47。
本发明应用中,式(i)yj-5-41在体外和体内具有如下作用:在体外,式(i)yj-5-41能够促进树突状细胞(dc)的形成,抑制粒细胞样-骨髓来源免疫抑制性细胞的形成,抑制骨髓来源免疫抑制性细胞,抑制骨髓来源免疫抑制性细胞表达免疫抑制因子精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)。在体内,式(i)yj-5-41能够抑制胃癌的皮下生长,明显促进肿瘤内部t细胞的浸润,显著增强杀伤性t细胞的功能,明显提高骨髓细胞向抗原递呈细胞分化的比例,促进巨噬细胞向m1型巨噬细胞极化,此外,还可以明显降低粒细胞样-骨髓来源免疫抑制性细胞的比例。
本发明应用中,式(i)yj-5-41体外对肿瘤细胞本身不具有毒性作用,不同于传统化疗药物直接杀死细胞,所述式(i)yj-5-4化合物是靶向药物,且本发明实施例中体内抑制肿瘤生长的结果正是通过免疫调节实现的。
本发明应用中,所述胃癌细胞株指的是人胃癌细胞株bgc-823、mgc-803、hgc-27、mkn45、ags和sgc-7901,小鼠前胃癌细胞株mfc。
本发明应用中,式(i)yj-5-41体外促进树突状细胞(dc)的形成。其中,所述树突状细胞(dc)指的是骨髓细胞分化成的树突状细胞,在小鼠中为骨髓细胞分化成的树突状细胞(dc)。
本发明应用中,式(i)yj-5-41体外抑制前列腺素e2(pge2)诱导的粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)形成。其中,所述粒细胞样-骨髓来源免疫抑制性细胞指的是骨髓细胞分化成的粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc);在小鼠中为骨髓细胞分化成的粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc,cd11b+ly6g+ly6clow)。
本发明应用中,式(i)yj-5-41体外抑制肿瘤上清诱导的骨髓来源免疫抑制性细胞和粒细胞样-骨髓来源免疫抑制性细胞形成。所述骨髓来源免疫抑制性细胞和粒细胞样-骨髓来源免疫抑制性细胞指的是骨髓细胞分化成的骨髓来源免疫抑制性细胞(mdsc)和粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)。在小鼠中,所述肿瘤上清指的是前胃癌细胞mfc,所述骨髓来源免疫抑制性细胞和粒细胞样-骨髓来源免疫抑制性细胞指的是小鼠骨髓细胞分化成的骨髓来源免疫抑制性细胞(mdsc)和粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)。
本发明应用中,式(i)yj-5-41体外抑制细胞因子(粒细胞-巨噬细胞集落刺激因子和白细胞介素6)诱导的骨髓来源免疫抑制性细胞(mdsc)表达免疫抑制因子精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)。其中,所述骨髓来源免疫抑制性细胞指的是骨髓细胞分化成的骨髓来源免疫抑制性细胞(mdsc),所述免疫抑制因子指的是骨髓来源免疫抑制性细胞(mdsc)分泌的精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)。在小鼠中,所述骨髓来源免疫抑制性细胞指的是骨髓细胞分化成的骨髓来源免疫抑制性细胞(mdsc),所述免疫抑制因子指的是骨髓来源免疫抑制性细胞(mdsc)分泌的精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)。
本发明应用中,式(i)yj-5-41在615小鼠皮下荷瘤动物模型中抑制胃癌的生长。
本发明应用中,式(i)yj-5-41体内显著促进肿瘤内部t细胞的浸润和显著增强杀伤性t细胞的功能。其中,所述促进t细胞的浸润指的是促进肿瘤内部cd8+t细胞和t细胞招募的趋化因子cxcl10和cxcl11的分泌/合成,增强杀伤性t细胞的功能指的是促进cd8+t细胞分泌肿瘤杀伤作用的γ-干扰素、肿瘤坏死因子和颗粒酶b。
本发明应用中,式(i)yj-5-41体内增加肿瘤内部抗原递呈细胞的比例。其中,所述抗原递呈细胞指的是肿瘤内部树突状细胞(dc)和m1型巨噬细胞。
本发明应用中,式(i)yj-5-41体内降低肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(mdsc)的比例。其中,所述粒细胞样-骨髓来源免疫抑制性细胞(mdsc)指的是肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)。
本发明应用中,式(i)yj-5-41与药物载体联合使用,促进吸收。
本发明通过以ep4受体为靶标,得到优势化合物yj-5-41,在体外评价药物对免疫细胞以及免疫抑制分子的影响,该药物可以促进树突状细胞(dc)的形成,抑制粒细胞样-骨髓来源免疫抑制性细胞的形成,抑制骨髓来源免疫抑制性细胞表达免疫抑制因子精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)。在体内,该药物抑制胃癌的皮下生长,主要通过促进肿瘤内部t细胞的浸润,t细胞招募的趋化因子cxcl10和cxcl11的分泌以及发挥肿瘤杀伤作用的细胞因子γ-干扰素、肿瘤坏死因子和颗粒酶b显著增加,树突状细胞的比例明显增多,促进巨噬细胞向m1型巨噬细胞极化,此外,明显降低粒细胞样-骨髓来源免疫抑制性细胞的比例。yj-5-41具有改善胃癌肿瘤内部免疫抑制性微环境的重要作用,克服了临床上胃癌治疗的难题,具有治疗胃癌的应用前景。
附图说明
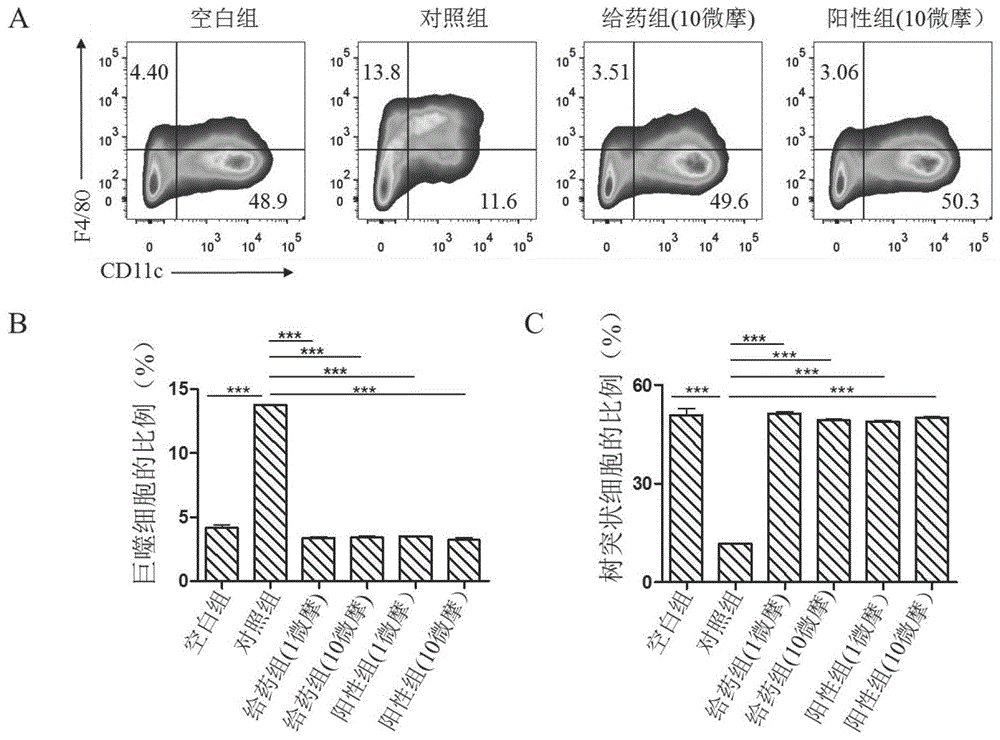
图1yj-5-41明显促进小鼠骨髓细胞向树突状细胞(dc)分化。其中,a为各实验分组对小鼠骨髓细胞向树突状细胞和巨噬细胞分化的影响的流式图;b为各实验分组对小鼠骨髓细胞分化为巨噬细胞的影响的统计图;c为各实验分组对小鼠骨髓细胞分化为树突状细胞的影响的统计图。
图2yj-5-41抑制前列腺素e2(pge2)诱导的粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)形成。其中,a为各实验分组对小鼠骨髓细胞向粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)分化的影响的流式图;b为各实验分组对小鼠骨髓细胞分化为粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的影响的统计图。
图3yj-5-41抑制肿瘤上清诱导的骨髓来源免疫抑制性细胞(mdsc)形成。其中,a为各实验分组对小鼠骨髓细胞向骨髓来源免疫抑制性细胞(mdsc)分化的影响的流式图;b为各实验分组对小鼠骨髓细胞向粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)分化的影响的流式图;c为各实验分组对小鼠骨髓细胞分化为骨髓来源免疫抑制性细胞(mdsc)的影响的统计图;d为各实验分组对小鼠骨髓细胞分化为粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的影响的统计图。
图4为各实验分组对细胞因子(粒细胞-巨噬细胞集落刺激因子和白细胞介素6)诱导的骨髓来源免疫抑制性细胞(mdsc)表达免疫抑制因子精氨酸酶1(arg1)、诱导型一氧化氮合酶(inos)和环氧合酶-2的影响。
图5yj-5-41明显抑制胃癌的皮下生长。其中,a为各实验分组对mfc异种移植肿瘤生长模型中剥离肿瘤的影响的白光照片(横坐标代表给药第24天,各组剥离肿瘤的宽度);b为各实验分组对mfc异种移植肿瘤生长模型中肿瘤增长的影响效果的统计结果(横坐标代表给药天数);c为各实验分组对mfc异种移植肿瘤生长模型中剥离的肿瘤重量的影响的统计结果;d为在灌胃给药方式下,各实验分组对615小鼠体重的影响(横坐标代表给药天数)。
图6yj-5-41促进肿瘤内部cd8+t细胞浸润、增强杀伤性t细胞的功能。其中,a为肿瘤生长模型中,各实验分组对肿瘤内部cd8+t细胞浸润的影响的流式图;b为肿瘤生长模型中,各实验分组对cd8+t细胞浸润的影响的统计图;c为肿瘤生长模型中,各实验分组对cxcl10和cxcl11基因表达的影响的结果;d为肿瘤生长模型中,各实验分组对γ-干扰素、肿瘤坏死因子和颗粒酶b基因表达的影响的结果。
图7yj-5-41治疗增加肿瘤内部抗原递呈细胞的比例。其中,a为肿瘤生长模型中,各实验分组对肿瘤内部树突状细胞(cd11c+mhc-ii+)数量的影响的流式图(左)和统计图(右);b为肿瘤生长模型中,各实验分组对肿瘤内部m1型巨噬细胞(f4/80+mhc-ii+)数量的影响的流式图(左)和统计图(右);c为肿瘤生长模型中,各实验分组对肿瘤内部m2型巨噬细胞(f4/80+cd206+)数量的影响的统计图;d为肿瘤生长模型中,各实验分组对肿瘤内部m1型巨噬细胞/m2型巨噬细胞比例的影响的统计图。
图8yj-5-41减少肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的浸润。其中,a为肿瘤生长模型中,各实验分组对肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)浸润的影响的流式图;b为肿瘤生长模型中,各实验分组对肿瘤内部单核细胞样-骨髓来源免疫抑制性细胞(mo-mdsc)影响的统计图;c为肿瘤生长模型中,各实验分组对肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)浸润的影响的统计图。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1:式(i)yj-5-41的细胞毒性评价。
1、细胞的培养
人胃癌细胞株bgc-823、mgc-803、hgc-27、mkn45、ags和sgc-7901,小鼠前胃癌细胞株mfc,人胃粘膜上皮细胞ges-1均培养于含10%胎牛血清的1640培养基中,青霉素-链霉素的浓度为1%。细胞培养在37℃恒温培养箱(湿度为95%,二氧化碳浓度为5%)中。
2、mts法测定细胞增殖
取对数生长期的细胞,接种至96孔板,细胞密度为2.5~10×103个,每孔100微升培养基。12小时后,加入不同浓度yj-5-41(给药组)或e7046(阳性组),对照组加入等量的1640完全培养基,每组设3个复孔。继续培养72小时后,每孔加入20微升mts,将96孔板置于酶标仪中,在490纳米波长下测定od值。统计分析药物对于细胞增殖水平的影响。
实验结果:
如表1所示,yj-5-41在人胃癌细胞株、小鼠前胃癌细胞株mfc和人胃粘膜上皮细胞ges-1上的ic50>100微摩。此实验结果证明式(i)yj-5-41对正常细胞(人胃粘膜上皮细胞ges-1)、肿瘤细胞本身不具有毒性作用。
表1
实施例2:式(i)yj-5-41明显促进小鼠骨髓细胞向树突状细胞(dc)分化。
1、树突状细胞形成实验
骨髓细胞制备:
麻醉处死8~10周龄615小鼠,经75%乙醇消毒后,取出小鼠股骨和胫骨,剪掉骨头两端,吹打出骨髓细胞,1500转/分钟,离心5分钟,弃上清,裂解红细胞,1500转/分钟,离心5分钟,弃上清,重悬细胞并计数,调整细胞密度为3.0×106个/毫升,铺6孔板。
实验分组:
空白组只添加细胞因子:粒细胞-巨噬细胞集落刺激因子(gm-csf,10纳克/毫升)及白细胞介素4(il-4,5纳克/毫升);
对照组加入上述细胞因子和前列腺素e2(10纳摩);
给药组加入上述细胞因子、前列腺素e2(10纳摩)和不同浓度的yj-5-41(1微摩或10微摩);
阳性组加入上述细胞因子、前列腺素e2(10纳摩)和不同浓度的阳性药物e7046(1微摩或10微摩)。
每3天进行一次半量换液。培养至第8天,收集悬浮和贴壁细胞,流式上机检测巨噬细胞(f4/80+cd11c-)(图1a每个小图分为四个象限,左上群的细胞为巨噬细胞)和树突状细胞(f4/80-cd11c+)(图1a每个小图分为四个象限,右下群的细胞为树突状细胞)的形成。
实验结果:
如图1所示,小鼠骨髓细胞分化过程中,与空白组相比,前列腺素e2(对照组)明显抑制树突状细胞(f4/80-cd11c+)的生成;而式(i)yj-5-41处理后(给药组),树突状细胞(dc)(f4/80-cd11c+)的比例明显增加,可以恢复到空白组的水平(图1a和1c)。与空白组相比,前列腺素e2(对照组)明显促进巨噬细胞(f4/80+cd11c-)的生成,而式(i)yj-5-41处理后(给药组),巨噬细胞(f4/80+cd11c-)的形成明显受到抑制,与空白组水平一致(图1a和1b)。此实验结果证明式(i)yj-5-41明显促进小鼠骨髓细胞向树突状细胞(dc)分化。
实施例3:式(i)yj-5-41抑制前列腺素e2(pge2)诱导的粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)形成。
技术方法:
1、粒细胞样-骨髓来源免疫抑制性细胞形成实验
骨髓细胞制备:
麻醉处死8~10周龄615小鼠,经75%乙醇消毒后,取出小鼠股骨和胫骨,剪掉骨头两端,吹打出骨髓细胞,1500转/分钟,离心5分钟,弃上清,裂解红细胞,1500转/分钟,离心5分钟,弃上清,重悬细胞并计数,调整细胞密度为1.5×106个/毫升,铺12孔板。
实验分组:
空白组只添加细胞因子:粒细胞-巨噬细胞集落刺激因子(gm-csf,40纳克/毫升)及白细胞介素6(il-6,40纳克/毫升);
对照组加入细胞因子和前列腺素e2(10纳摩);
给药组加入细胞因子、前列腺素e2(10纳摩)和不同浓度的yj-5-41(1微摩或10微摩);
阳性组加入细胞因子、前列腺素e2(10纳摩)和不同浓度的阳性药物e7046(1微摩或10微摩)。
每3天,进行一次换液。培养至第6天,收集悬浮细胞和半贴壁的细胞,流式上机检测粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc,cd11b+ly6g+ly6clow)的形成。gr-mdsc(cd11b+ly6g+ly6clow)的标志需要三个指标:cd11b,ly6g,ly6c,图2a流式图中显示的是在cd11b的基础上展示的是ly6g和ly6c。
2、实验结果:
如图2所示,小鼠骨髓细胞分化过程中,与空白组相比,前列腺素e2(对照组)明显促进粒细胞样-骨髓来源免疫抑制性细胞的形成,而式(i)yj-5-41处理后(给药组),粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的比例明显降低,可以降低到本底水平(图2a和2b)。此实验结果证明式(i)yj-5-41明显抑制粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的形成。
实施例4:式(i)yj-5-41抑制肿瘤上清诱导的骨髓来源免疫抑制性细胞(mdsc)形成。
1、骨髓来源免疫抑制性细胞形成实验
骨髓细胞制备:
麻醉处死8~10周龄615小鼠,经75%乙醇消毒后,取出小鼠股骨和胫骨,剪掉骨头两端,吹打出骨髓细胞,1500转/分钟,离心5分钟,弃上清,裂解红细胞,1500转/分钟,离心5分钟,弃上清,重悬细胞并计数,然后进行共培养实验。
共培养实验分组:
①空白组:加入完全培养基培养骨髓细胞;②对照组:加入体外培养48小时的小鼠前胃癌细胞株mfc上清培养骨髓细胞;③给药组:加入体外培养48小时的小鼠前胃癌细胞株mfc上清和不同浓度的yj-5-41(1微摩或10微摩)培养骨髓细胞;④阳性组:加入体外培养48小时的小鼠前胃癌细胞株mfc上清和不同浓度的阳性药物e7046(1微摩或10微摩)培养骨髓细胞。
共培养48小时后,收集悬浮和半贴壁的细胞,流式上机检测骨髓来源免疫抑制性细胞(mdsc,cd11b+gr1+)和粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc,cd11b+ly6g+ly6clow)的形成。gr-mdsc(cd11b+ly6g+ly6clow)的标志需要三个指标:cd11b,ly6g,ly6c,图3a流式图中显示的是在cd11b的基础上展示的是ly6g和ly6c。
2、实验结果:
如图3所示,与空白组相比,对照组采用小鼠前胃癌细胞mfc的上清培养骨髓细胞,骨髓来源免疫抑制性细胞的生成明显增加;而与对照组相比,式(i)yj-5-41处理后,骨髓来源免疫抑制性细胞的产生明显受到抑制(图3a和3c)。此外,与空白组相比,对照组采用小鼠前胃癌细胞mfc的上清培养骨髓细胞,粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的生成也明显增加,而与对照组相比,式(i)yj-5-41处理(共培养)48小时后,粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的比例明显降低(图3b和3d)。此实验结果证明式(i)yj-5-41明显抑制骨髓来源免疫抑制性细胞和粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的形成。
实施例5:式(i)yj-5-41抑制骨髓来源免疫抑制性细胞(mdsc)表达免疫抑制因子精氨酸酶1(arg1)、诱导型一氧化氮合酶(inos)和环氧合酶-2。
1、骨髓来源免疫抑制性细胞免疫抑制因子表达实验
(1)骨髓来源免疫抑制性细胞形成实验
麻醉处死8~10周龄c57bl/6小鼠,经75%乙醇消毒后,取出小鼠股骨和胫骨,剪掉骨头两端,吹打出骨髓细胞,1500转/分钟,离心5分钟,弃上清,裂解红细胞,1500转/分钟,离心5分钟,弃上清,重悬细胞并计数,调整细胞密度,铺6孔板,细胞培养于含有gm-csf(40纳克/毫升)和il-6(40纳克/毫升)的1640完全培养基中,4天后,收集细胞。
(2)免疫抑制因子的表达
收集细胞,离心后,弃上清,重悬细胞并计数,调整细胞密度,铺12孔板,细胞培养于含有不同药物的1640培养基中。
实验分组:
①空白组:只加入完全培养基培养细胞;②对照组:加入上述完全培养基和前列腺素e2(10微摩)培养细胞;③给药组(1微摩):加入上述完全培养基、前列腺素e2(10微摩)和yj-5-41(1微摩)培养细胞;④给药组(10微摩):加入上述完全培养基、前列腺素e2(10微摩)和yj-5-41(10微摩)培养细胞;⑤阳性组(1微摩):加入上述完全培养基、前列腺素e2(10微摩)和阳性药物e7046(1微摩)培养细胞;⑥阳性组(10微摩):加入上述完全培养基、前列腺素e2(10微摩)和阳性药物e7046(10微摩)培养细胞。
培养48小时后,收集rna样本。提取rna,反转录成cdna,荧光定量pcr检测免疫抑制因子精氨酸酶1(arg1)、环氧合酶-2和诱导型一氧化氮合酶(inos)的表达。
2、实验结果:
如图4所示,精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)是骨髓来源免疫抑制性细胞发挥免疫抑制功能的两条主要途径,精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)消耗l-精氨酸使t细胞周期阻滞,降低t细胞受体(tcr)ζ链表达,导致t细胞无能,t细胞不能正常发挥抗肿瘤活性。
与空白组相比,对照组在前列腺素e2的刺激下,骨髓来源免疫抑制性细胞产生免疫抑制因子精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)的能力显著增加,此外,环氧合酶-2的表达也明显增加,有利于诱导前列腺素e2的产生,进一步增强精氨酸酶1(arg1)和诱导型一氧化氮合酶(inos)的表达。而式(i)yj-5-41处理后,给药组明显抑制精氨酸酶1(arg1)、诱导型一氧化氮合酶(inos)和环氧合酶-2的表达明显受到抑制(图4)。此实验结果证明式(i)yj-5-41明显抑制骨髓来源免疫抑制性细胞(mdsc)表达免疫抑制因子精氨酸酶1(arg1)、诱导型一氧化氮合酶(inos)和环氧合酶-2。
实施例6:式(i)yj-5-41明显抑制胃癌的皮下生长。
技术方法:
1、615小鼠皮下荷瘤动物实验
胰酶消化对数生长期的小鼠前胃癌细胞mfc,离心后,弃去上清,pbs洗涤两遍。用pbs重悬细胞计数,调整细胞密度。麻醉小鼠,剔除小鼠背部毛发,将2×106个前胃癌细胞mfc,皮下注射到6~8周龄615小鼠右侧背部。按照公式:体积=长×宽2×0.52计算肿瘤体积。待肿瘤长到100立方毫米左右时,随机分组:①对照组:溶剂组(羧甲基纤维素钠);②yj-5-41低剂量组(75毫克/千克),③yj-5-41高剂量组(150毫克/千克)。每周2次测量并记录肿瘤长与宽的变化,同时记录小鼠体重。给药频率为每天1次,给药方式为灌胃,待实验结束后,麻醉处死小鼠,剥离皮下肿瘤,称重并拍照记录肿瘤大小。
实验结果:
如图5所示,剥离肿瘤图片表明,与对照组相比,式(i)yj-5-41浓度梯度依赖性抑制肿瘤的生长,高剂量组明显抑制肿瘤的生长(图5a),实时的肿瘤体积监测(图5b)及给药后第24天剥离肿瘤质量测量结果(图5c)也得出了同样的结论。同时,在给药期间对各组小鼠体重的监测发现,各给药剂量下的小鼠体重平稳增长,与对照组相比,没有明显差别,这表明式(i)yj-5-41没有明显的毒副作用(图5d)。此实验结果证明式(i)yj-5-41明显抑制胃癌的皮下生长。
实施例7:式(i)yj-5-41促进肿瘤内部t细胞浸润、增强杀伤性t细胞的功能。
1、615小鼠皮下荷瘤动物实验
同实施例6第1节“615小鼠皮下荷瘤动物实验”。
2、肿瘤细胞的分离
分离615小鼠皮下荷瘤小鼠模型的肿瘤,去掉皮肤,用剪刀将肿瘤剪碎,加入适量的消化液(10u/毫升胶原酶i,400u/毫升胶原酶iv和30u/毫升dna酶),37℃培养箱中,消化至浑浊状态,吹打消化后的肿瘤,过70微米滤网,1500转/分钟,离心5分钟,弃上清,裂解红细胞,过40微米滤网,1500转/分钟,离心5分钟,弃上清,重悬细胞并计数。
3、肿瘤细胞的流式分析实验
调整细胞数目,细胞密度为1~10×106细胞/毫升,加入1微升区分死细胞和活细胞的染料,室温避光孵育10-15分钟,加入1毫升缓冲液,1500转,离心5分钟,洗涤两次,弃上清,100微升缓冲液重悬细胞,加入2微升fc受体阻断剂,4℃孵育冰上孵育10分钟,加入50微升稀释抗体,4℃避光孵育30分钟,孵育结束后,加入1毫升缓冲液,1500转,离心5分钟,弃去上清,300-400微升缓冲液重悬,转移到流式管中,上机检测对照组、低剂量组(75毫克/千克)和高剂量组(150毫克/千克)免疫细胞亚群的变化。
3、定量即时聚合酶链锁反应
收集肿瘤样本,匀浆后,提取rna,然后反转录成cdna,荧光定量pcr检测对照组、低剂量组(75毫克/千克)和高剂量组(150毫克/千克)中cxcl10、cxcl11、γ-干扰素、肿瘤坏死因子和颗粒酶b的表达。
实验结果:
如图6所示,流式分析结果表明,与对照组相比,式(i)yj-5-41治疗后,高剂量组(150毫克/千克)中肿瘤内部杀伤性t细胞(cd8+t)的比例明显增加,促进肿瘤内部cd8+t细胞浸润(图6a和6b)。与此同时,采用定量即时聚合酶链锁反应检测肿瘤内部t细胞招募的趋化因子和杀伤性t细胞相关效应细胞因子的表达,t细胞招募的趋化因子cxcl10和cxcl11(图6c)以及发挥肿瘤杀伤作用的细胞因子γ-干扰素、肿瘤坏死因子和颗粒酶b显著增加(图6d)。此实验结果证明式(i)yj-5-41治疗后,高剂量组(150毫克/千克)促进肿瘤内部t细胞浸润和增强杀伤性t细胞的功能。
实施例8:式(i)yj-5-41增加肿瘤内部抗原递呈细胞的比例。
1、615小鼠皮下荷瘤动物实验
同实施例6第1节“615小鼠皮下荷瘤动物实验”。
2、肿瘤组织中抗原递呈细胞的流式分析实验
肿瘤细胞的分离和流式分析实验参照实施例7第2、3节。流式上机检测肿瘤组织中抗原递呈细胞的比例。
实验结果:
如图7所示,流式分析结果表明,与对照组相比,式(i)yj-5-41处理后,高剂量组(150毫克/千克)中肿瘤内部树突状细胞(cd11c+mhc-ii+)的比例明显增加(图7a);m1型巨噬细胞(f4/80+mhc-ii+)显著增多(图7b);而m2型巨噬细胞(f4/80+cd206+)不变(图7c);m1型巨噬细胞/m2型巨噬细胞的比例上调(图7d)。因此,式(i)yj-5-41处理后,高剂量组(150毫克/千克)促进肿瘤内部抗原递呈细胞的增加,促进巨噬细胞向m1型巨噬细胞极化。此实验结果证明式(i)yj-5-41治疗增加肿瘤内部抗原递呈细胞的比例。
实施例9:式(i)yj-5-41减少肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的浸润。
1、615小鼠皮下荷瘤动物实验
同实施例6第1节“615小鼠皮下荷瘤动物实验”。
2、肿瘤组织中骨髓来源免疫抑制性细胞(mdsc)的流式分析实验
肿瘤细胞的分离和流式分析实验参照实施例7第2、3节。流式上机检测肿瘤组织中骨髓来源免疫抑制性细胞(mdsc)的比例。
实验结果:
如图8所示,对照组肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的比例高达40%。与对照组相比,式(i)yj-5-41处理后,高剂量组(150毫克/千克)明显抑制肿瘤内部粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的浸润(图8a和8c),粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的比例降低10%,而单核细胞样-骨髓来源免疫抑制性细胞(mo-mdsc,cd11b+ly6c+ly6g-)细胞的比例不变(图8b),这与体外骨髓细胞分化实验结果相符合,yj-5-41主要抑制粒细胞样-骨髓来源免疫抑制性细胞(gr-mdsc)的形成。这些结果表明,式(i)yj-5-41具有改善胃癌肿瘤内部免疫抑制性微环境的重要作用。此实验结果证明式(i)yj-5-41治疗减少肿瘤内部骨髓来源免疫抑制性细胞(mdsc)的浸润。
上述实施例仅为了说明本发明的技术构思及特点,其目的在于让本领域技术人员能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡是根据本发明内容的实质所作出的等效变化或修饰,都应涵盖在本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!