基于沸石咪唑框架结构的药物载体及其制备方法与应用
1.本技术涉及一种基于沸石咪唑框架结构的药物载体及其制备方法与应用,属于沸石咪唑框架类结构材料的制备领域。
背景技术:
2.沸石咪唑框架结构材料是一类特殊的金属有机框架材料,其配体与金属离子的配位键角与传统硅酸盐沸石材料的si-o-si键角相近。近年来,沸石咪唑框架结构材料在肿瘤递药领域广受关注。沸石咪唑框架结构材料具备大比表面积,多孔结构和高孔隙率,是一种良好的药物递送载体,药物负载率高。沸石咪唑框架结构材料在生物体内具有微酸响应性,能控制药物释放,且生物相容性好,毒性小。
3.分子靶向治疗是在细胞分子水平上,针对已经明确的致癌位点来设计相应的治疗药物载体,药物载体进入体内会特异地选择致癌位点来结合发生作用,使肿瘤细胞特异性死亡,较少影响正常组织。研究发现肿瘤细胞的主要分子靶点有cxcr、fgfr、vegfr、pdgfr、raf、flt和kit等,且它们在各种癌症细胞中的表达水平不均一。
4.目前,药物载体中,靶向性抑制剂通常通过包埋的方式包裹在沸石咪唑框架材料内,通过epr效应进入肿瘤组织,在肿瘤组织的微酸环境中释放出抑制剂,实现被动靶向性。在血液循环中,抑制剂的泄露会对正常细胞和组织造成损伤。
技术实现要素:
5.针对以上问题,本技术一方面提供了一种基于沸石咪唑框架结构的药物载体,该药物载体中咪唑类靶向性抑制剂依靠配位键固定在沸石咪唑框架上,能主动靶向肿瘤细胞且具有抑制作用,在体内循环时,能有效减少抑制剂的泄露,降低对正常细胞的毒性。同时,该药物载体具备高孔隙率,可以进一步包裹阿霉素等各种小分子抗癌药物,具有一定的临床应用潜能。
6.所述药物载体包括沸石咪唑框架结构材料和咪唑类抑制剂;
7.所述咪唑类抑制剂位于所述沸石咪唑框架材料表面,且与所述沸石咪唑框架材料通过配位键连接。
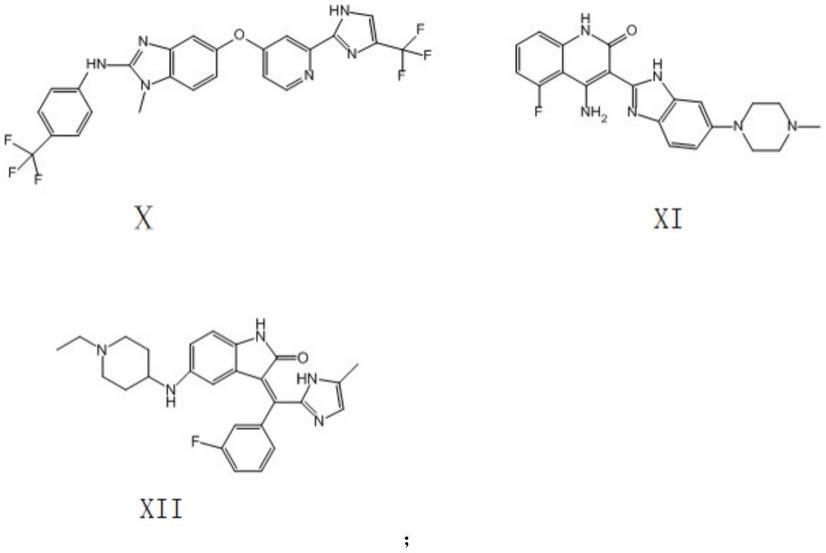
8.可选地,所述咪唑类抑制剂选自式i~xii、式i~xii的衍生物中的至少一种:
9.[0010][0011]
其中,式i~xii依次为amd070、amd-070-1、amd-070-2、krh-3955、krh-3955-1、krh-3955-2、krh-3955-3、krh-3955-4、krh-3955-5、chir-265、tki258、tyrosine kinase-in-1。
[0012]
优选地,所述咪唑类抑制剂选自式iv~ix中的至少一种,即krh-3955、krh-3955-1、krh-3955-2、krh-3955-3、krh-3955-4、krh-3955-5中的至少一种。
[0013]
可选地,所述咪唑类抑制剂的摩尔数为所述沸石咪唑框架材料的1~40%,其中,所述咪唑类抑制剂的摩尔数以所述咪唑类抑制剂的摩尔数计,所述沸石咪唑框架材料的摩尔数以所述沸石咪唑框架材料所含咪唑基团的摩尔数计;
[0014]
优选地,所述咪唑类抑制剂的摩尔数为所述沸石咪唑框架材料的1~5%。
[0015]
可选地,所述沸石咪唑框架材料中的金属选自锌、钴、铟中的至少一种;
[0016]
所述沸石咪唑框架结构材料中的配体为咪唑类有机配体,所述咪唑类有机配体选自咪唑(im)、2-甲基咪唑(mim)、2-乙基咪唑(eim)、2-硝基咪唑(nim)、4-氯咪唑(cim)、4-溴咪唑(brim)、4-硝基咪唑(nim)、4,5-二氯咪唑(dcim)、苯并咪唑(bim)、3-氮杂苯并咪唑(abim)、5-氯苯并咪唑(cbim)、5,6-二甲基苯并咪唑(dmbim)、5-溴苯并咪唑(brbim)、5-硝基苯并咪唑(nbim)、5-氮杂苯并咪唑(abim)、4-氰基咪唑(cnim)、2-醛基咪唑(ica)、嘌呤(pur)中的至少一种;
[0017]
可选地,所述沸石咪唑框架结构材料的拓扑结构选自zif-1、zif-2、zif-3、zif-4、zif-5、zif-6、zif-7、zif-8、zif-9、zif-10、zif-11、zif-12、zif-13、zif-14、zif-20、zif-21、zif-22、zif-23、zif-60、zif-61、zif-62、zif-64、zif-65、zif-67、zif-68、zif-69、zif-70、zif-71、zif-72、zif-73、zif-74、zif-75、zif-76、zif-77、zif-78、zif-79、zif-80、zif-81、zif-82、zif-90、zif95、zif-100、zif-268中的至少一种;
[0018]
优选地,所述沸石咪唑框架结构材料的拓扑结构选自zif-7或zif-90;
[0019]
可选地,所述沸石咪唑框架结构材料的粒径为50~300nm。
[0020]
本技术的第二方面,提供了上述任一项所述的基于沸石咪唑框架结构的药物载体的制备方法,通过对沸石咪唑框架结构的有机骨架咪唑基团和咪唑类抑制剂的咪唑基团进行后交换,得到表面具有咪唑类抑制剂的药物载体。所述方法反应条件温和,步骤简单,易于操作。所述方法制备的药物载体稳定性好,对正常细胞毒性小,同时对cxcr、fgfr、vegfr、pdgfr、raf、flt和kit等受体高表达的癌症细胞具有靶向和抑制功能。
[0021]
所述基于沸石咪唑框架结构的药物载体的制备方法至少包括以下步骤:
[0022]
(1)获得沸石咪唑框架结构材料;
[0023]
(2)对含有所述沸石咪唑框架结构材料、咪唑类抑制剂的混合液进行咪唑基团后交换反应,得到所述的基于沸石咪唑框架结构的药物载体。
[0024]
本技术中,所述咪唑基团后交换反应是咪唑类抑制剂上的咪唑基团与沸石咪唑框架结构上的咪唑基团进行交换反应。
[0025]
可选地,步骤(1)所述的沸石咪唑框架结构材料的获得方法,包括:
[0026]
对含有金属源、咪唑类有机配体、溶剂i的混合物在0~500℃下进行反应,得到所述沸石咪唑框架结构材料。
[0027]
可选地,所述金属源中的金属选自锌、钴、铟中的至少一种;
[0028]
所述金属源选自金属的硝酸盐、氯化盐、醋酸盐、硝酸盐水合物、醋酸盐水合物中的至少一种;
[0029]
所述咪唑类有机配体选自咪唑、2-甲基咪唑、2-乙基咪唑、2-硝基咪唑、4-氯咪唑、4-溴咪唑、4-硝基咪唑、4,5-二氯咪唑、苯并咪唑、3-氮杂苯并咪唑、5-氯苯并咪唑、5,6-二甲基苯并咪唑、5-溴苯并咪唑、5-硝基苯并咪唑、5-氮杂苯并咪唑、4-氰基咪唑、2-醛基咪唑、嘌呤中的至少一种;
[0030]
所述溶剂i选自水、甲醇、乙醇、丙醇、乙二醇、丙三醇、n,n-二甲基甲酰胺,乙腈、四氢呋喃、吡啶中的至少一种。
[0031]
步骤(1)中的反应选自水热合成法、溶剂热法、机械研磨法、搅拌反应或气相沉积法中的至少一种。
[0032]
可选地,所述沸石咪唑框架结构材料选择zif-1、zif-2、zif-3、zif-4、zif-5、zif-6、zif-7、zif-8、zif-9、zif-10、zif-11、zif-12、zif-13、zif-14、zif-20、zif-21、zif-22、zif-23、zif-60、zif-61、zif-62、zif-64、zif-65、zif-67、zif-68、zif-69、zif-70、zif-71、zif-72、zif-73、zif-74、zif-75、zif-76、zif-77、zif-78、zif-79、zif-80、zif-81、zif-82、zif-90、zif95、zif-100或zif-268。
[0033]
可选地,所述沸石咪唑框架结构材料的粒径为50~300nm。
[0034]
可选地,步骤(2)所述的咪唑基团后交换反应的反应条件具体包括:
[0035]
在搅拌条件下进行反应;
[0036]
反应温度为25~40℃;
[0037]
反应时间为4~48h;
[0038]
可选地,所述沸石咪唑框架结构材料和咪唑类抑制剂的摩尔比为20~50:1,其中,所述咪唑类抑制剂的摩尔数以所述咪唑类抑制剂的摩尔数计,所述沸石咪唑框架材料的摩尔数以所述沸石咪唑框架材料所含咪唑基团的摩尔数计;
[0039]
可选地,所述混合液中还含有溶剂ii,所述溶剂ii选自水、甲醇、乙醇、丙醇、乙二醇、丙三醇、n,n-二甲基甲酰胺,乙腈、四氢呋喃、吡啶中的至少一种
[0040]
可选地,所述咪唑类抑制剂选自amd070、amd-070-1、amd-070-2、krh-3955、krh-3955-1、krh-3955-2、krh-3955-3、krh-3955-4、krh-3955-5、chir-265、tki258、tyrosine kinase-in-1及以上抑制剂衍生物中的至少一种。
[0041]
可选地,步骤(2)所述的咪唑基团后交换反应之后,还包括:
[0042]
离心,得到离心产物;
[0043]
将所述离心产物分散在溶剂iii中,每4~12h更换一次所述溶剂iii,更换次数为3~10次,离心,干燥,得到所述沸石咪唑框架结构材料;
[0044]
该方法可确保沸石咪唑框架结构材料孔隙中未参与反应的咪唑类抑制剂被去除,
使咪唑类抑制剂仅位于材料表面。
[0045]
可选地,将离心产物分散在水中,每4~12小时更换一下溶液,72小时后离心,干燥,得到产物。
[0046]
其中,所述溶剂iii选自水、甲醇、乙醇、丙醇、乙二醇、丙三醇、n,n-二甲基甲酰胺、乙腈、四氢呋喃、吡啶中的至少一种。
[0047]
在一具体实施例中,所述沸石咪唑框架结构材料与咪唑类抑制剂的后交换至少包括以下步骤:
[0048]
(1)将沸石咪唑框架结构材料与咪唑类抑制剂加入到溶剂中搅拌均匀,25~40℃,反应4~48小时,离心后得到粗产物。
[0049]
(2)将粗产物分散在水中,每4~12小时更换一下溶液,72小时后离心,在冷冻干燥机中干燥得到产物。
[0050]
可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的后交换反应温度上限选自30℃、35℃或40℃;下限选自25℃、30℃或35℃。
[0051]
可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的后交换反应时间上限选自12小时、24小时或48小时,下限选自4小时、12小时或24小时。
[0052]
可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的摩尔比为50~20:1。
[0053]
其中,所述咪唑类抑制剂的摩尔数以所述咪唑类抑制剂的摩尔数计,所述沸石咪唑框架材料的摩尔数以所述沸石咪唑框架材料所含咪唑基团的摩尔数计。可选地,所述沸石咪唑框架结构材料与含有咪唑基团的抑制剂的摩尔比上限选自20:1、25:1、30:1、35:1、40:1或45:1,下限选自25:1、35:1、40:1、45:1或50:1。
[0054]
可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的摩尔比为35:1。
[0055]
其中,所述咪唑类抑制剂的摩尔数以所述咪唑类抑制剂的摩尔数计,所述沸石咪唑框架材料的摩尔数以所述沸石咪唑框架材料所含咪唑基团的摩尔数计。可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的摩尔比为35:1,反应温度25~40℃,反应时间4~48小时。
[0056]
其中,所述咪唑类抑制剂的摩尔数以所述咪唑类抑制剂的摩尔数计,所述沸石咪唑框架材料的摩尔数以所述沸石咪唑框架材料所含咪唑基团的摩尔数计。可选地,所述沸石咪唑框架结构材料与咪唑类抑制剂的摩尔比为30:1,反应温度30℃,反应时间36小时。
[0057]
本技术的第三个方面,提供了上述任一项所述的基于沸石咪唑框架结构的药物载体、上述任一项所述的制备方法制得的基于沸石咪唑框架结构的药物载体中的至少一种在靶向和/或抑制癌症细胞中的应用。
[0058]
本技术中,所述癌症细胞包括cxcr(趋化因子受体)、fgfr(成纤维生长因子受体)、vegfr(血管内皮细胞生长因子受体)、pdgfr(血小板衍生生长因子受体)、raf(酪氨酸激酶受体raf)、flt(酪氨酸激酶受体flt)、kit(酪氨酸激酶受体kit)中的至少一种受体高表达的癌症细胞。其中,受体表达超过30%即为高表达。
[0059]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。
[0060]
本发明的有益效果包括但不限于:
[0061]
本技术提供了一种生物相容性好,对正常细胞毒性小的基于沸石咪唑框架结构的
多靶点抑制剂药物载体的制备方法,其可用于靶向和/或抑制cxcr、fgfr、vegfr、pdgfr、raf、flt和kit中的至少一种受体高表达的癌细胞。在体内循环中,该药物载体化学稳定性好,只有到肿瘤微酸环境中,才会解体,释放出抑制剂。本发明中,搭载的抑制剂依靠配位键固定在沸石咪唑框架上,能主动靶向肿瘤细胞且具有抑制作用。在体内循环时,能有效减少抑制剂的泄露,降低对正常细胞的毒性。同时,该多靶点抑制型载体具备高孔隙率,可以包裹各种小分子抗癌药物,具有一定的临床应用潜能。
[0062]
本技术提供了一种沸石咪唑框架结构材料,其制备工艺条件温和,步骤简单,易于操作。
附图说明:
[0063]
图1为实施例1中化合物的制备原理示意图;
[0064]
图2为实施例1中制备的化合物的tem图;
[0065]
图3为实施例1中制备的化合物的xrd图;
[0066]
图4为实施例1中制备的化合物的高效液相色谱图;
[0067]
图5为实施例1中制备的化合物的细胞摄取情况;
[0068]
图6为实施例1中制备的化合物的细胞抑制情况;
[0069]
图7为实施例1中制备的化合物的药物释放曲线。
具体实施方式
[0070]
下面给出实施例以对本发明作进一步说明,但本技术并不局限于这些实施例。有必要在此指出的是以下实施例不能理解为对本发明保护范围的限制,如果该领域的技术熟练人员根据上述本发明内容对本发明做出一些非本质的改进和调整,例如对沸石咪唑框架结构材料尺寸的修改,仍属于本发明保护范围。
[0071]
本技术实施例中涉及到的原料等化学试剂,未做特殊说明的均为市售产品;
[0072]
其中,amd070、amd-070-1、amd-070-2购买自medchemexpress公司;
[0073]
krh-3955、krh-3955-1、krh-3955-2、krh-3955-3、krh-3955-4、krh-3955-5购买自medchemexpress公司;
[0074]
chir-265购买自medchemexpress公司;
[0075]
tki258购买自medchemexpress公司;
[0076]
tyrosine kinase-in-1购买自medchemexpress公司。
[0077]
本技术中,咪唑基团交换率=药物载体上咪唑类抑制剂的峰面积/原始沸石咪唑框架上咪唑基团的峰面积。
[0078]
实施例1化合物c1(amd070-zif-7)的合成
[0079]
按照如下步骤合成c1
[0080]
将质量比1:2.5:150的六水合硝酸锌、苯并咪唑和n,n-二甲基甲酰胺混合,于室温下搅拌24小时,离心收集沉淀,洗涤,烘干得到白色粉末zif-7。
[0081]
取摩尔比35:1的zif-7和cxcr4抑制剂amd070于装有50ml水的单口烧瓶中,超声分散均匀后,25℃,搅拌48小时。反应结束后,以每分钟5000转的转速离心30分钟收集沉淀,用水洗涤5次,冷冻干燥得到产物amd070-zif-7。
[0082]
利用高效液相色谱分析,得知amd070与zif-7骨架上的咪唑基团交换率为2.48%。
[0083]
实施例2化合物c2(krh-3955-zif-60)的合成
[0084]
按照如下步骤合成c2
[0085]
将质量比1:2.5:3:150的六水合硝酸锌、咪唑、2-甲基咪唑和甲醇混合,于室温下搅拌24小时,离心收集沉淀,洗涤,烘干得到白色粉末zif-60。
[0086]
取摩尔比35:1的zif-60和cxcr4抑制剂krh-3955于装有50ml水的单口烧瓶中,超声分散均匀后,30℃,搅拌36小时。反应结束后,以每分钟6000转的转速离心20分钟收集沉淀,用水洗涤6次,冷冻干燥得到产物krh-3955-zif-60。
[0087]
利用高效液相色谱分析,得知krh-3955与zif-60骨架上的咪唑基团交换率为4.31%。
[0088]
实施例3化合物c3(krh-3955-1-zif-90)的合成
[0089]
按照如下步骤合成c3
[0090]
将质量比1:2.5:150的六水合硝酸锌、2-甲醛咪唑和甲醇混合于室温下搅拌24小时,离心收集沉淀,洗涤,烘干得到白色粉末zif-90。
[0091]
取摩尔比35:1的zif-90和cxcr4抑制剂krh-3955-1于装有50ml水的单口烧瓶中,超声分散均匀后,35℃,搅拌24小时。反应结束后,以每分钟7000转的转速离心15分钟收集沉淀,用水洗涤7次,冷冻干燥得到产物krh-3955-1-zif-90。
[0092]
利用高效液相色谱分析,得知krh-3955-1与zif-90骨架上的咪唑基团交换率为4.78%。
[0093]
实施例4化合物c4~c516的合成
[0094]
本实施例中化合物c4~c516,仅含有一种有机配体的沸石咪唑框架的后交换操作与实施例1基本相同,含有两种有机配体沸石咪唑框架的后交换操作与实施例2基本相同;不同之处参见表1。
[0095]
利用高效液相色谱分析咪唑类抑制剂与沸石咪唑框架上的咪唑基团的交换率,c1~c516的交换率在1~5%,c2、c3、c132~c215交换率较高,均在4%以上,更有利于肿瘤细胞的靶向和抑制,具有一定的临床应用潜能。
[0096]
表1化合物c4~c516的合成参数表
[0097]
[0098]
[0099]
[0100]
[0101]
[0102]
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116][0117]
表1中,第二列a-zif-n中a表示咪唑类抑制剂,zif-n表示沸石咪唑框架结构材料,如tyrosine kinase-in-1-zif-268中tyrosine kinase-in-1表示咪唑类抑制剂,zif-268表示沸石咪唑框架结构材料。
[0118]
对比例1
[0119]
将质量比1:0.2:150的六水合硝酸锌、cxcr4抑制剂amd070和n,n-二甲基甲酰胺混合,于室温下搅拌5分钟,利用硝酸锌的锌离子与amd070形成配位键。
[0120]
加入苯并咪唑,质量为六水合硝酸锌的2.5倍,于室温下继续搅拌30分钟。反应结束后,以每分钟5000转的转速离心30分钟收集沉淀,用水洗涤5次,冷冻干燥得到zif-7包裹的amd070,即对比例zif-7@amd070。
[0121]
对比例2
[0122]
与实施例1制备方法相同,唯一不同的是cxcr4抑制剂amd070换成cxcr4抑制剂krh-3955,zif-7换成zif-60,得到zif-60@krh-3955。
[0123]
实施例5形貌和结构表征
[0124]
对实施例中制备的化合物c1~c516进行形貌和结构表征。
[0125]
表征方法:
[0126]
透射电子显微扫描仪器:feitecnai f20;
[0127]
x射线衍射法仪器:布鲁克d8advance;
[0128]
高效液相色谱:安捷伦1260。
[0129]
实施例1提供的amd070-zif-7为典型代表,图2给出了amd070-zif-7的tem图,图3给出了amd070-zif-7的xrd图,图4给出了amd070-zif-7的hplc图。
[0130]
从图2中可以看出:药物载体化合物c1的尺寸在70~100nm;后交换后,并未表现出明显的缺陷和空洞。
[0131]
其他化合物c2~c516的测试结果与化合物c1的测试结果类似,尺寸在50~300nm之间。
[0132]
从图3中可以看出,化合物c1的xrd图谱与zif-7的标准xrd图谱相比,含有zif-7的特征峰2θ=7.14
°
、7.68
°
、12.07
°
、13.33
°
、15.41
°
、16.27
°
、19.61
°
、21.55
°
,实施例1中所述方法制备得到zif-7沸石咪唑框架结构材料。
[0133]
其他化合物c2~c516的测试结果与化合物c1的测试结果类似。
[0134]
图4中,图4a为标准样品咪唑类抑制剂amd-070的高效液相色谱图,图4b为实施例1
步骤1中制备沸石咪唑框架有机材料所用的苯并咪唑的高效液相色谱图,图4c为化合物c1酸解后样品的高效液相色谱图;可以确定化合物c1经过盐酸酸解后结构崩塌,释放出的物质含有咪唑类抑制剂amd-070和苯并咪唑,通过比较图4c中咪唑类抑制剂amd-070和苯并咪唑的峰面积,可以确定amd-070对zif-7的交换率为2.48%。
[0135]
其他化合物c2~c516的测试结果在1~5%,c2、c3、c132~c215交换率较高,均在4%以上。
[0136]
实施例6
[0137]
将化合物c1(amd070-zif-7)和对比例1提供的zif-7@amd070各自分散在pbs中,用细胞完全培养液稀释至10nm,与癌细胞37℃孵育24小时。细胞消解后通过电感耦合等离子体光谱仪测定金属离子浓度。
[0138]
如图5所示,和zif-7@amd070相比,amd070-zif-7的细胞摄取率提高了10%,化合物c1提高了对食管癌细胞的靶向效果。
[0139]
化合物c1~c516对各类癌细胞的靶向作用结果详见表2。
[0140]
其他化合物c2~c516的细胞摄取率较对应对比例提高了2~30%,其中,化合物c2细胞摄取率为32%,与对比例2提供的zif-60@krh-3955相比细胞摄取率提高了21%,c3、c132~c215在食管癌和乳腺癌中的摄取率均在30%以上,与各自对应的对比例相比均提高了20%以上,提高了对食管癌和乳腺癌细胞的靶向效果。其中,各实施例对应的对比例制备方法均与实施例1相同,唯一不同的是咪唑类抑制剂替换成对应实施例所用抑制剂,沸石咪唑框架有机材料替换成对应实施例所用材料。
[0141]
表2化合物c1~c516对各类癌细胞的靶向作用结果
[0142][0143]
注:注:+++表示癌细胞摄取率为30~40%;++表示癌细胞摄取率为25%~30%;+表示癌细胞摄取率为20~25%。
[0144]
实施例7
[0145]
将化合物1(amd070-zif-7)和对比例zif-7@amd070各自分散在pbs中,用细胞完全培养液稀释至10nm,与癌细胞37℃孵育24小时。用cck-8染色法通过酶标仪测定癌细胞活性。
[0146]
如图6所示,和对比例zif-7@amd070相比,amd070-zif-7的细胞抑制率较对比例提高了20%,化合物c1提高了对食管癌细胞的抑制效果。
[0147]
化合物c1~c516对各类癌细胞的抑制作用结果详见表3;
[0148]
其他化合物c2~c516的抑制抑制率较各自对应的对比例提高了5~30%,c2、c3、
c132~c215的细胞抑制率较各自对应的对比例提高较多,均在20%以上。其中,c2、c3、c132~c215在食管癌、乳腺癌、肺癌和肝癌中的抑制率较各自对应的对比例提高25%以上,提高了对食管癌、乳腺癌、肺癌和肝癌细胞的抑制效果。
[0149]
表3化合物c1~c516对各类癌细胞的抑制作用结果
[0150][0151][0152]
注:+++表示癌细胞抑制率大于50%;++表示癌细胞抑制率为10%~50%;+表示癌细胞抑制率为0~10%。
[0153]
实施例8
[0154]
将化合物1(amd070-zif-7)和对比例zif-7@amd070在ph 7.4的pbs环境下测定释放曲线。通过高效液相色谱分析上清中的抑制剂amd070的含量,制作药物释放曲线。
[0155]
从图7中可以看出,amd070-zif-7在ph 7.4的环境下,36小时后释放率为22%。对比例zif-7@amd070在ph 7.4的环境下,36小时后释放率为54%。amd070-zif-7比对比例zif-7@amd070稳定,对正常组织的损害小。
[0156]
其他化合物c2~c516的抑制剂释放率在25%以内。其对应对比例的释放率在40~60%。c1~c516的抑制剂泄漏率比其对应对比例低,c1~c516的生物安全性更高。
[0157]
以上所述,仅是本技术的一些实施例,并非对本技术做任何形式的限制,虽然本技术以较佳实施例揭示如上,然而并非用以限制本技术,任何熟悉本专业的技术人员,在不脱离本技术技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1