GSDMD蛋白及其靶点在制备治疗炎症性肠病药物的应用的制作方法
本发明涉及gsdmd蛋白及其靶点在制备治疗炎症性肠病药物的应用。
背景技术:
炎症性肠病(inflammatoryboweldisease,ibd)主要包括溃疡性肠炎(ulcerativecolitis,uc)和克隆氏病(crohn’sdisease,cd)两种。uc的特征是炎症弥漫,主要涉及结肠、直肠的粘膜表层和粘膜下层,反复发作;cd的则可能累及从口腔到肛周部位的整个消化道或任意部分消化道,二者虽在病因及临床表现有所不同,但两者都是由环境和基因共同作用并由免疫系统介导的疾病,肠道黏膜免疫异常是其主要病理诱因。ibd患者会出现腹痛,呕吐,腹泻,直肠出血等临床症状,给病人工作生活带来了极大的痛苦,该病目前缺乏有效根治手段,易复发,此外长期的ibd还会诱发大肠癌(colorectalcancer,crc)的发生。流行病学调查研究显示过去三十多年来ibd变得越来越普遍。据统计数据显示,uc病例数在近几十年呈倍数增长,此外,cd发病率也逐年增加。因此深入了解肠道炎症疾病的发病机理,寻找有效诊治该疾病方法,对缓解这一重大疾病问题具有重要意义。
近年来研究表明,炎症性肠病(ibd)、肠易激惹综合症(ibs)等肠道免疫相关疾病与炎症小体的功能异常有密切关系。早期研究发现ibd病人血清中il-1β和il-18炎症因子表达增多,提示炎症小体可能促进ibd的形成,但基于基因敲除小鼠的肠炎模型研究却发现il-18或其受体il-18r却加剧dss(葡聚糖硫酸钠盐)诱导的肠炎症状。随后的研究又进一步发现基因敲除nlrp6、asc和caspase-1炎症小体分子也能加剧dss诱导的肠炎症状。因此针对炎症小体及其下游分子进行干预可有效的治疗炎症性肠病的发生,但是目前还没有有效的针对炎症小体的抗肠炎药物的问世。
gasdermind(细胞焦亡蛋白,gsdmd)为近两年新发现的炎症小体下游关键效应分子,属于gasdermin蛋白家族成员,该家族还包括gsdma,gsdmb,gsdmc,dfna5,dfnb59等分子,这个家族的蛋白之间具有大约45%的同源性,都包含gasdermin-n和gasdermin-c两个结构域。有研究报道gsdmd孔隙形成还能促进白细胞介素il-1β和il-18释放,gsdmd过度激活与脓毒症发生密切相关。另外,多项研究表明gsdmd在中风和神经炎症的发生也发挥重要作用。也有研究揭示gsdmd蛋白的n端寡聚片段可以插入富含心磷脂的细菌膜中,发挥杀菌作用。目前的研究主要集中在gsdmd结构及基础研究,针对gsdmd在抗肠炎中的研究以及针对该蛋白及其靶点的抗炎药物尚属空白领域。针对gsdmd的抗肠炎作用机制研究尚不明确。
技术实现要素:
发明目的:本发明gsdmd在调控肠炎发生的用途,本发明还提供gsdmd蛋白及其靶点cgas作为制备治疗炎症性肠病治疗的药物应用。
技术方案:本发明第一方面提供了gsdmd蛋白在筛选或制备治疗肠道疾病的药物或试剂盒中的应用。
本发明第二方面提供了gsdmd蛋白在筛选或制备治疗炎症性肠道疾病的药物或试剂盒中的应用。
在一个优选实施例中,所述炎症性肠道疾病为溃疡性肠炎。
本发明第三方面提供了gsdmd靶点cgas蛋白在筛选治疗炎症性肠病药物或试剂盒中的用途。
本发明第四方面提供了cgas抑制剂ru.521用作治疗炎症性肠病的药物的用途。
在一个优选的实施例中,所述抑制剂ru.521通过cgas蛋白发挥治疗作用。
本发明第五方面提供了一种cgas-sting信号通路抑制剂,其特征在于,所述抑制剂为gsdmd蛋白。
本发明第六方面提供了gsdmd蛋白在制备cgas-sting信号通路抑制剂中的用途。
在一个优选的实施例中,所述cgas-sting信号通路是由gsdmd介导。
有益效果:(1)本发明通过gsdmd在肠炎发生中的的用途,抗炎靶点的确定,可以为多种cgas相关的炎症性疾病提供治疗思路和理论依据,更可以为筛选和制备治疗炎症性疾病的药物提供分子靶点和制备思路;(2)本发明发现了gsdmd可以通过调控cgas的激活发挥抑制肠炎的作用。
附图说明
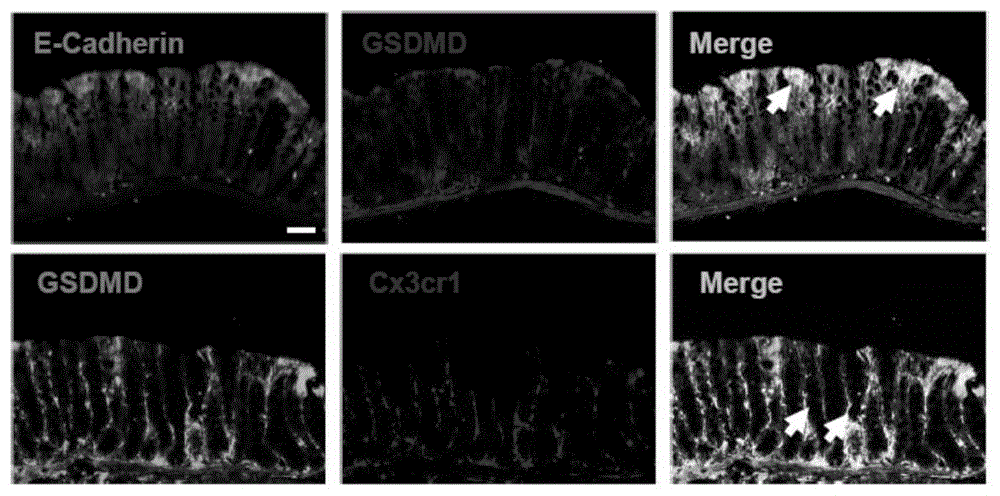
图1为免疫荧光标记的gsdmd在肠上皮和固有层表达结果,结果表明,gsdmd,e-cadherin和cx3cr1均有共定位。
图2为dss肠炎小鼠肠道组织gsdmd蛋白激活情况western检测结果;
图3为dss肠炎模型研究中,显示gsdmd在肠炎发生过程中的保护作用,其中,a为小鼠的体重曲线,从图中可以看出,与野生鼠对比,gsdmd敲除鼠体重随着时间推移体重逐渐降低,b为小鼠的结肠组织长度,从图中可以看出,与野生鼠对比,gsdmd敲除鼠的结肠长度显著变短;
图4为在dss诱导小鼠肠炎模型中,wt鼠与gsdmd敲除鼠的特征分子表达差异,结果表明,与wt鼠相比,gsdmd敲除鼠肠道巨噬细胞分泌il6,tnf和ccl2的量明显增加,然而分泌il-1β和il-18却明显降低;
图5为gsdmd蛋白的肠炎保护作用可能的作用机制,结果表明,与对照组小鼠(gsdmdfl/fl)相比,特异性髓系细胞gsdmd敲除鼠(gsdmdfl/fllysmcre)体重下降明显增加,结肠长度显著缩短,gsdmd蛋白的肠炎保护作用可能是通过对髓系细胞的免疫调节作用来发挥的;
图6为rna测序分析gsdmd作用的相关信号通路,结果表明gsdmd可以抑制dna感受信号通路的激活;
图7为gsdmd通过cgas发挥抑制炎症作用的测定结果;
图8为ru.521对gsdmd缺失诱导的肠炎发生的抑制结果;
图9为ru.521对dss诱导的cgas信号通路的激活的抑制结果。
具体实施方式
一、试验材料和样品
bmdm(骨髓来源的巨噬细胞):制备方法见文献(shenetal.,2019,thejournalofexperimentalmedicine);
dss(硫酸葡聚糖):tdblabs,db001;
抗gsdmd抗体:abcam,ab219800;
抗caspase-11抗体:novus,nb120-10454;
抗e-cadherin抗体:bd,612131;
抗-β-actin抗体:sigma,a1978;
抗磷酸化sting抗体:affinity,af7416;
抗sting抗体:cst,13647s;
抗磷酸化irf3抗体:cst,4302s;
抗irf3抗体:cst,4947s;
il-6elisa试剂盒:r&dsystems,dy406;
tnfelisa试剂盒:r&dsystems,dy410;
il-1βelisa试剂盒:r&dsystemsdy401;
il-18elisa试剂盒:r&dsystems,d047-3;
ccl2elisa试剂盒:r&dsystems,dy478;
ccl5elisa试剂盒:r&dsystems,dy466;
ru.521(cgas抑制剂):aobious,inc;
gsdmd敲除鼠可以直接购买,本实施例中所用的gsdmd敲除鼠为北京生命科学研究所邵峰院士赠送;
特异性髓系细胞gsdmd敲除鼠(gsdmdfl/fllysmcre)广州赛业生物有限公司购买。
二、试验结果
实施例1:gsdmd在肠上皮和固有层均有表达
1.1实验方法
处死小鼠,收集结肠组织样品,用无菌pbs将小鼠结肠的粪便冲洗干净,并截取一段,卷成瑞士卷,4%多聚甲醛固定,包埋,切片。
1.2实验结果
免疫荧光标记gsdmd(红色和绿色)在小鼠肠道的定位表达,e-cadherin(绿色)和cx3cr1(红色)分别代表肠上皮和固有层免疫细胞。结果见图1,显示gsdmd、e-cadherin和cx3cr1均有共定位。
实施例2:dss肠炎小鼠肠道组织gsdmd蛋白发生激活表达
2.1实验方法
第零天:将dss溶于无菌水,配成2.5%dss溶液,然后让野生鼠(wt)和gsdmd敲除鼠持续饮用6天。
第六天:将2.5%dss溶液换成正常的饮用水。
第九天:处死小鼠,收集结肠组织样品,用无菌pbs将小鼠结肠的粪便冲洗干净,并截取一段称重记录。加入蛋白裂解液,收集蛋白。
2.2实验结果
对2.1部分的蛋白裂解液用抗鼠gsdmd抗体,抗鼠β-actin抗体,western检测gsdmd的激活情况,western结果显示,在dss诱导的结肠炎小鼠中,gsdmd的表达和激活情况显著增加,见图2(泳道1,2为对照组,泳道3-7为dss诱导组)。
实施例3:dss肠炎模型研究显示gsdmd在肠炎发生过程中有保护作用
3.1实验方法
第零天:将dss溶于无菌水,配成2.5%dss溶液,然后让野生鼠(wt)和gsdmd敲除鼠持续饮用6天。
第六天:将2.5%dss溶液换成正常的饮用水。
第九天:处死小鼠,收集结肠组织样品,用无菌pbs将小鼠结肠的粪便冲洗干净,量取结肠长度并拍照。
3.2实验结果,小鼠造模期间,每天对小鼠称重,做体重时间曲线,见图3中a部分(黑线为wt小鼠,红线为gsdmd敲除鼠),小鼠结肠组织长度见图3中b部分(图左为wt鼠,图右为gsdmd敲除鼠)。结果表明,dss造模后,gsdmd缺失小鼠,的体重下降比例显著高于wt小鼠,并且gsdmd缺失小鼠的结肠长度更短,说明肠炎炎症性更强。
实施例4:在dss诱导小鼠肠炎模型中,gsdmd敲除促进il6,tnf和ccl2的分泌,il-1β和il-18却明显降低。
4.1实验方法
第零天:将dss溶于无菌水,配成2.5%dss溶液,然后让野生鼠(wt)和gsdmd敲除鼠持续饮用6天。
第六天:将2.5%dss溶液换成正常的饮用水。
第九天:处死小鼠,收集结肠组织样品,用无菌pbs将小鼠结肠的粪便冲洗干净,并截取一段称重记录。放37℃细胞培养箱用含有抗生素的dmem培养基培养12小时。
第十天:结肠组织培养12小时后,收集组织块上清,2500rpm4℃离心。
4.2实验结果
收集4.1处理后的细胞上清,elisa法检测细胞上清中细胞分泌的il6,tnf,ccl2,il-1β和il-18的蛋白表达见图4,图4中,a为il6的蛋白表达结果,b为tnf的蛋白表达结果,c为ccl2的蛋白表达结果,d为il-1β的蛋白表达结果,e为il-18的蛋白表达结果,图中第一列为wt鼠组,第二列为第gsdmd敲除鼠组。从结果可以看出,与wt鼠相比,gsdmd敲除鼠肠道巨噬细胞分泌il6,tnf和ccl2的量明显增加,然而分泌il-1β和il-18却明显降低。
实施例5:gsdmd蛋白的肠炎保护作用可能是通过对髓系细胞的免疫调节作用来发挥的。
5.1实验方法
第零天:将对照鼠(gsdmdfl/fl)和特异性髓系细胞gsdmd敲除鼠gsdmdfl/fllysmcre)进行称重,对小鼠的粪便情况、皮毛外观和身体姿势进行双盲评分。将dss溶于无菌水,配成2.5%dss溶液,然后让小鼠持续饮用6天。
第六天:将2.5%dss溶液换成正常的饮用水。
第九天:处死小鼠收集样品。取下结肠(包括盲肠段)拍照,记录长度;拍照完成后,去除盲肠段,纵向切开结肠,称重记录;接着收取结肠中下端不同部分进行蛋白、rna以及病理组化分析。
第零天到第九天:称量并记录对照鼠(gsdmdfl/fl)和特异性髓系细胞gsdmd敲除鼠(gsdmdfl/fllysmcre)的体重,对小鼠的粪便情况、皮毛外观和身体姿势进行双盲评分。
5.2实验结果
试验结果见图5,图中,a为敲除鼠与对照组的体重的比较结果,b为敲除鼠与对照组直肠的长度的比较结果,从图中可以看出,与对照组小鼠(gsdmdfl/fl)相比,特异性髓系细胞gsdmd敲除鼠(gsdmdfl/fllysmcre)体重下降明显增加,结肠长度显著缩短。
实施例6:rna测序分析gsdmd作用的相关信号通路
6.1实验方法
第零天:将dss溶于无菌水,配成2.5%dss溶液,然后让对照鼠(野生型wt)和gsdmd敲除鼠(gsdmd-/-)持续饮用5天。
第五天:处死小鼠,收集小鼠结肠,用pbs将小鼠结肠的粪便冲洗干净,将结肠剪成1-2cm的小段。加入5ml肠组织上皮去除溶液(stemcell),放入摇床,150rpm,37℃孵育20分钟。用pbs将肠组织洗三遍,然后将肠组织剪碎,加入5ml消化液(含1.5mg/ml的胶原酶iv和20u/ml的dna酶i),放入摇床,150rpm,37℃孵育20分钟。将消化后的肠组织剧烈震荡,然后用74μm的细胞筛过滤消化液,再将肠组织收集起来,加入5ml消化液进行第二次消化。然后,将两次消化液的细胞进行1500rpm,4℃离心收集。将细胞用percoll进行梯度离心,收集处于40%percoll和80%percoll分界面的固有层免疫细胞,然后用pbs洗一次细胞。单细胞悬液用fvd
第五天:处死小鼠收集小鼠结肠,用pbs将小鼠结肠的粪便冲洗干净,收集1-2cm结肠加入细胞裂解液,然后进行匀浆,收集细胞裂解液进行westernblotting分析。
6.2实验结果
见图6,其中,a为巨噬细胞rna全基因组测序的结果,第一列是野生型wt组,第二列是野生型wt组重复组,第三列是野生型wt组的重复组,第四列是gsdmd敲除鼠组,第五列是gsdmd敲除鼠组的重复组,第六列是gsdmd敲除鼠组的重复组。与对照组相比,gsdmd敲除鼠组的炎症因子和dna感受信号通路相关基因的表达明显增加。收集细胞裂解液用抗鼠p-sting,sting,p-tbk1,tbk1,p-irf3,irf3,gsdmd,p38,actin抗体进行westernblotting分析。结果见图6中的b图(泳道1为野生型wt组,泳道2为野生型wt组,泳道3为野生型wt组,泳道4为gsdmd敲除鼠组,泳道5为gsdmd敲除鼠组,泳道6为gsdmd敲除鼠组。从图6中的b图可以看出,与对照组相野生型小鼠相比,gsdmd敲除鼠组的p-sting,p-tbk1,p-irf3的活化明显增加,即在肠炎发生的过程中,gsdmd可以抑制dna感受信号通路的激活。
实施例7:gsdmd通过cgas发挥抑制炎症作用
7.1实验方法
第一天:收集野生鼠(wt)和gsdmd敲除鼠的结肠,用pbs将小鼠结肠的粪便冲洗干净,将结肠剪成1-2cm的小段。加入5ml肠组织上皮去除溶液(stemcell),放入摇床,150rpm,37℃孵育20分钟。用pbs将肠组织洗三遍,然后将肠组织剪碎,加入5ml消化液(含1.5mg/ml的胶原酶iv和20u/ml的dna酶i),放入摇床,150rpm,37℃孵育20分钟。将消化后的肠组织剧烈震荡,然后用74μm的细胞筛过滤消化液,再将肠组织收集起来,加入5ml消化液进行第二次消化。然后,将两次消化液的细胞进行1500rpm,4℃离心收集。将细胞用percoll进行梯度离心,收集处于40%percoll和80%percoll分界面的固有层免疫细胞,然后用pbs洗一次细胞。单细胞悬液用fvd
第二天:先吸去上清,每孔加入300μldmem培养基。两种肠道巨噬细胞各分成三组,共六组,每组设置三组重复。
第一组:wt鼠肠道巨噬细胞,阴性对照组。
第二组:wt鼠肠道巨噬细胞,每孔用lipo2000转染0.5μg的沙门氏菌基因组dna,孵育八个小时。
第三组:wt鼠肠道巨噬细胞,先加入终浓度为20μg/ml的cgas抑制剂(ru.521),孵育三个小时。再用lipo2000转染0.5μg的沙门氏菌基因组dna,孵育八个小时。
第四组:gsdmd敲除鼠肠道巨噬细胞,阴性对照组。
第五组:gsdmd敲除鼠肠道巨噬细胞,每孔用lipo2000转染0.5μg的沙门氏菌基因组dna,孵育八个小时。
第六组:gsdmd敲除鼠肠道巨噬细胞,先加入终浓度为20μg/ml的cgas抑制剂(ru.521),孵育三个小时。再用lipo2000转染0.5μg的沙门氏菌基因组dna,孵育八个小时。
7.2实验结果
收集7.1处理后的细胞上清,elisa法检测细胞上清中细胞分泌的il6,tnf(本实施例中为tnfα)和ccl5的蛋白表达见图7中b图,第一列为7.1部分处理的第一组(wt鼠阴性对照),第二列为7.1部分处理的第四组(wt鼠阴性对照),第三列为7.1部分处理的第二组,第四列为7.1部分处理的第四组,第五列为7.1部分描述的第三组,第六列为7.1部分处理的第六组。然后细胞里加入trizol,trizol法提取细胞中总的rna,通过实时定量pcr(qpcr)法检测细胞中tnf和ccl5的蛋白表达见图7中的图a,分组方式与上述描述相同,具体为:第一列为7.1部分处理的第一组(wt鼠阴性对照),第二列为7.1部分处理的第四组(wt鼠阴性对照),第三列为7.1部分处理的第二组,第四列为7.1部分处理的第四组,第五列为7.1部分处理的第三组,第六列为7.1部分处理的第六组。与转染沙门氏菌基因组dna之后,与野生型肠道巨噬细胞,gsdmd敲除鼠肠道巨噬细胞表达和分泌il6,tnf和ccl5的量明显增加。同时,加入cgas抑制剂(ru.521)后明显抑制了野生型和gsdmd敲除鼠肠道巨噬细胞中il6,tnf和ccl5的表达,并且ru.521的加入使gsdmd敲除鼠肠道巨噬细胞中il6,tnf和ccl5的表达与野生型相一致的水平。
实施例8:ru.521可以明显抑制gsdmd缺失诱导的肠炎发生
8.1.实验方法:
第一组:给予野生鼠2.5%dss溶液,然后让小鼠持续饮用6天,第六天换成正常饮用水。
第二组:给予gsdmd敲除鼠2.5%dss溶液,然后让小鼠持续饮用6天,第六天换成正常饮用水。
第三组:在给予野生鼠2.5%dss溶液的前一天,给小鼠10mg/kg的ru.521腹腔注射。然后在处死小鼠之前每天给予小鼠10mg/kg的ru.521腹腔注射。
第四组:在给予gsdmd敲除鼠2.5%dss溶液的前一天,给小鼠10mg/kg的ru.521腹腔注射。然后在处死小鼠之前每天给予小鼠10mg/kg的ru.521腹腔注射。
第零天:给予2.5%dss的当天是第零天,对四组小鼠进行称重,对小鼠的粪便情况、皮毛外观和身体姿势进行双盲评分。将dss溶于无菌水,配成2.5%dss溶液,然后让小鼠持续饮用6天。
第六天:将2.5%dss溶液换成正常的饮用水。
第九天:处死小鼠收集样品。取下结肠(包括盲肠段)拍照,记录长度;拍照完成后,去除盲肠段,纵向切开结肠,称重记录;接着收取结肠中下端不同部分进行蛋白、rna以及病理组化分析。
第零天到第九天:称量并记录对照鼠(gsdmdfl/fl)和特异性髓系细胞gsdmd敲除鼠(gsdmdfl/fllysmcre)的体重,对小鼠的粪便情况、皮毛外观和身体姿势进行双盲评分,并且给予第三组和第四组小鼠每天腹腔注射10mg/kg的ru.521。
8.2.实验结果:
结果见图8,腹腔注射cgas抑制剂(ru.521)明显减轻了小鼠肠炎的严重程度,并且ru.521的加入使gsdmd敲除鼠体重下降程度和结肠的长度与野生鼠一致。
实施例9:ru.521显著抑制dss诱导的cgas信号通路的激活
9.1实验方法:
第一组:给予野生鼠2.5%dss溶液,然后让小鼠持续饮用5天。
第二组:给予gsdmd敲除鼠2.5%dss溶液,然后让小鼠持续饮用5天。
第三组:在给予野生鼠2.5%dss溶液的前一天,给小鼠10mg/kg的ru.521腹腔注射。然后在处死小鼠之前每天给予小鼠10mg/kg的ru.521腹腔注射。
第四组:在给予gsdmd敲除鼠2.5%dss溶液的前一天,给小鼠10mg/kg的ru.521腹腔注射。然后在处死小鼠之前每天给予小鼠10mg/kg的ru.521腹腔注射。
第零天:给予2.5%dss的当天是第零天,对四组小鼠进行称重,对小鼠的粪便情况、皮毛外观和身体姿势进行双盲评分。将dss溶于无菌水,配成2.5%dss溶液,然后让小鼠持续饮用5天。
第五天:处死小鼠收集小鼠结肠,用pbs将小鼠结肠的粪便冲洗干净,收集100mg左右的结肠,加入500ul的pbs进行匀浆,收集上清进行elisa检测cgamp的含量。收集1-2cm结肠加入细胞蛋白裂解液,然后进行匀浆,收集细胞裂解液进行westernblotting分析。
9.2实验结果
收集9.1处理后的组织匀浆上清,elisa法检测结肠组织中的cgamp表达,见图9中的图a,第一列为9.1部分处理的第一组,第二列为9.1部分处理的第二组,第三列为9.1部分处理的第三组,第四列为9.1部分处理的第四组。从图9的a部分结果可以看出,与野生型小鼠组相比,gsdmd敲除小鼠肠炎发生过程中产生更多的cgamp。收集9.1处理后的组织蛋白裂解液,用抗鼠p-sting,sting,p-tbk1,tbk1,p-irf3,irf3,gsdmd,p38,actin抗体进行westernblotting分析。结果见图9中的b部分结果(泳道1为9.1部分处理的第一组,泳道2为9.1部分处理的第一组,泳道3为9.1部分处理的第三组,泳道4为9.1部分处理的第三组,泳道5为9.1部分处理的第二组,泳道6为9.1部分处理的第二组,泳道7为9.1部分处理的第四组,泳道8为9.1部分处理的第四组。从图9的b部分可以看出,加入cgas抑制剂(ru.521)后明显抑制了野生型和gsdmd敲除鼠肠道中p-sting,p-tbk1,p-irf3的活化,并且ru.521的加入使gsdmd敲除鼠肠道中p-sting,p-tbk1,p-irf3的活化与野生型相一致的水平。
我们通过明确gsdmd在肠炎发生中的抑炎作用,研究其在调控肠炎发生过程中的作用靶点,可以为多种gsdmd相关炎症性疾病提供治疗思路和理论依据,为筛选和制备治疗炎症性肠病的药物提供新靶点和新思路。
- 还没有人留言评论。精彩留言会获得点赞!