一种脂肪细胞靶向的DNA纳米药物及其制备方法与应用与流程
本发明属于生物纳米药物技术领域,具体涉及一种脂肪细胞靶向的dna纳米药物及其制备方法与应用。
背景技术:
肥胖已被世界卫生组织认定为世界上最严重的公共卫生疾病。它不仅影响人民生活质量,更是诱导各类重大疾病产生的重要因素。目前,对于肥胖的临床治疗策略及临床前研究主要通过控制人体能量摄取、吸收以及机体的新陈代谢等途径进行的。但是,这些策略的治疗效果欠佳,且存在明显的个体差异性。同时,绝大多数抗肥胖药物常常引起严重的副作用,从而导致治疗的失败,甚至威胁到患者的生命安全。因此,发展安全、有效的、通用的肥胖及其并发症的治疗策略对于提高患者生活质量,降低重大疾病产生风险具有非常重要的意义。
技术实现要素:
本发明的目的是提供一种安全稳定、尺寸可调,且具有抗氧化和抗炎作用脂肪细胞靶向的dna纳米药物及其制备方法与应用。
本发明这种脂肪细胞靶向的dna纳米药物,由脂肪细胞靶向的dna框架结构tdm和单宁酸通过氢键结合而成;脂肪细胞靶向的dna框架结构tdm和单宁酸的质量比为1:25~30。
所述的脂肪细胞靶向的dna框架结构tdm平均尺寸为1~2μm。
所述的脂肪细胞靶向的dna框架结构tdm,包含如序列1所示的dna序列,该序列通过特定结构的堆积形成dna框架结构tdm。
本发明这种脂肪细胞靶向的dna框架结构tdm的制备方法,包括以下步骤:
1)连接:包含有脂肪细胞核酸适配体靶向序列的磷酸化dna模板(如序列2所示)和引物(如序列3所示)混合于dna连接酶缓冲液中,进行退火处理,退火之后的产物与ecolidna连接酶进行连接反应,形成环化的dna模板;
2)聚合:将步骤1)中环化的dna模板与phi29dna聚合酶、dntp和bsa在聚合酶缓冲液中进行聚合反应,反应结束后,反应混合物在设定温度加热终止聚合反应,反应产物洗涤后,得到脂肪细胞靶向的dna框架结构tdm。
所述步骤1)中,磷酸化dna模板浓度为8~12μm,引物的浓度为8~12μm,dna连接酶缓冲液由5mmtris-hcl、1mmmgcl2、0.1mmatp和1mm二硫苏糖醇组成,ecolidna连接酶的浓度为50~70u/μl,四者的体积比为(2~4):(5~7):(30~60):(7~9);退火具体工艺参数为:95℃下保持5min,然后在2h之内缓慢降温至室温,连接反应温度为16℃,反应时间为3h。
所述步骤2)中,环化的dna模板的浓度为0.5~0.7μm,phi29dna聚合酶的浓度为8~12u/μl,bsa的浓度为(0.04~0.06)%,聚合酶缓冲液由50mmtris-hcl、10mm(nh4)2so4、10mmmgcl2和4mm二硫苏糖醇组成,四者混合的体积比为(45~55):(15~25):(0.5~1.5):(95~105);聚合反应温度为28~32℃,聚合反应时间为18~30h,设定温度为70~80℃,加热时间为8~12min。
本发明这种脂肪细胞靶向的dna纳米药物的制备方法,包括以下步骤:
向tdm溶液中加入单宁酸ta设定温度下进行摇床上结合反应,反应完毕后,离心,即可得到脂肪细胞靶向的dna纳米药物tadn。
所述的tdm溶液的浓度为0.2~0.4μm,单宁酸ta的浓度为5~15mm,两者的混合体积比为(0.5~1.5):(0.5~1.5)。
所述的脂肪细胞靶向的抗氧化dna纳米药物在作为减肥药物中的应用。
本发明的原理:本发明构建一种脂肪细胞靶向的dna纳米药物tadn,在本发明中首先利用dna分子的可编程性,巧妙地把脂肪细胞靶向的核酸适配体序列设计在dna磷酸化模板中,再以滚环复制技术和dna自组装能力相结合的方式合成了传统脂肪细胞靶向的dna框架结构tdm,然后tdm的框架结构可以通过氢键,高效地结合天然抗氧化分子ta形成tadn。dna框架上大量的ta结合位点,使其具有高的ta负载能力。同时,ta对dna框架的打包压缩能力,使其能精确地控制tdm的尺寸和表面化学性质。通过tdm和ta相互作用形成的脂肪细胞靶向、多功能tadn既具有可调的尺寸、高的ta负载能力、广泛的抗氧化和抗炎能力,又具有特异性的结合脂肪细胞的能力。一旦,tadn特异性的进入脂肪细胞,就可以清除细胞内的过多的活性氧和活性氮(rons),降低细胞内rons的含量,阻断细胞内的炎症通路,阻断脂肪细胞和巨噬细胞之间的信号交流,大大地减缓脂肪细胞内脂滴的累积,从而达到tadn特异性抗肥胖的效果。
本发明的有益效果:
1)本发明的dna纳米药物中包含有dna框架结构tdm和单宁酸,单宁酸负载dna框架结构tdm上;dna框架结构tdm包括有脂肪细胞靶向的核酸适配体序列,对脂肪细胞有很好的靶向性,可以特异性的进入脂肪细胞,而单宁酸具有很好的抗氧化和抗炎能力,因而两者结合后,可以特异性的进入脂肪细胞,因而可以对肥胖组织处氧化还原态失衡和慢性炎症环境进行重新修复,阻断肥胖细胞和免疫细胞之间的炎症信号通路,从而达到治疗肥胖、抑制其他并发症产生的目的。
2)本发明的dna纳米药物的载体为dna框架结构tdm其主体为核苷酸,不存在毒性,而且本发明的dna纳米药物是利用肥胖及其相关并发症中氧化应激和慢性过度炎症这一共有的微环境而进行设计的,因而其副作用小,且治疗效果好,安全性高。
3)本发明的dna纳米药物中,dna框架tdm上有大量的单宁酸的结合位点,使其具有高的负载能力,单宁酸对dna框架的打包压缩能力,使其能精确地控制tdm的尺寸和表面化学性质。
附图说明
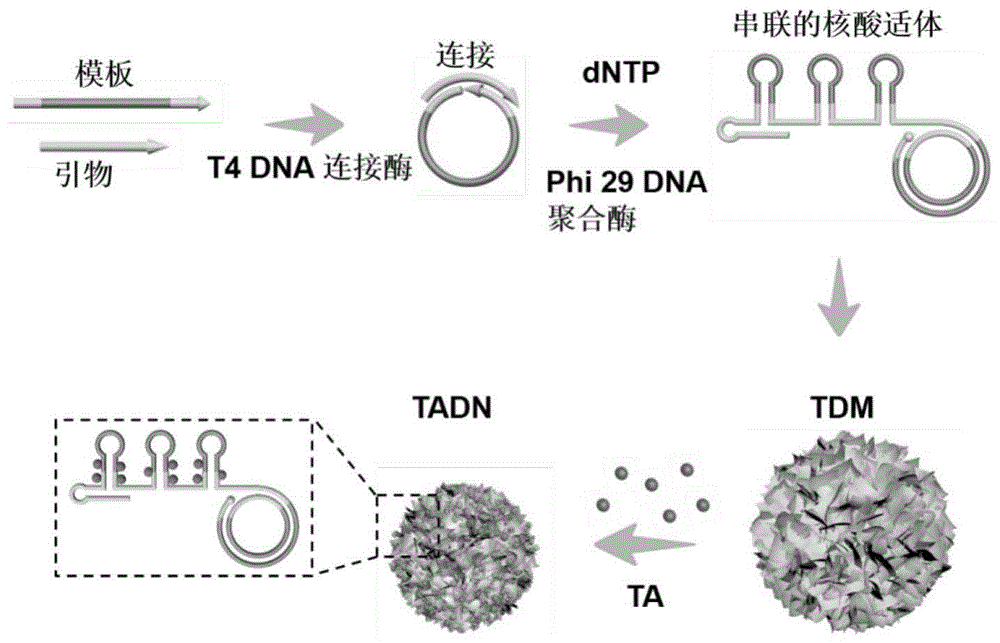
图1本发明的dna纳米药物的制备流程图。
图2实施例1制备的tdm和tadn的微观结构和表面电位。tdm(a)和tadn(b)的sem成像。(c)zeta表面电位分析。
图3实施例1中(a)tadn在不同时间内的dls分析。(b)ta从tadn中的释放动力学研究。(c)bsa在不同浓度的ta和tadn存下的荧光光谱分析。
图4tadn对多种rons的清除结果图;tadn清除(a)o2·–(b)·no和(c)·oh的epr光谱分析;tadn清除(d)h2o2(e)1o2和(f)onoo-的荧光光谱分析。
图5o2·-的消除能力的研究结果图;(a)tadn、tdm和ta对o2·-的清除的epr光谱分析。(b)ta和(c)tadn对o2·-的清除的稳定性的epr光谱分析。(d)tadn与o2·-反应后的sem成像。
图6细胞肥胖模型的结果图;(a)从3t3-l1细胞中萃取的油红o紫外可见光谱。(b)h2dcf-da对3t3-l1细胞染色的荧光共聚焦成像。
图7tadn的脂肪细胞靶向的抗氧化和抗炎研究结果图;(a)cy5-tadn特异性结合3t3-l1成熟脂肪细胞的荧光共聚焦成像。(b)经过tadn或ntadn治疗的前脂肪细胞和成熟的脂肪细胞内的油红o染色成像和h2dcf-da荧光共聚焦成像。
图8细胞毒性实验结果图;tdm、tadn或ta对3t3-l1细胞的毒性分析。
图9tadn抑制炎症细胞内自由基的产生;tadn和lps处理的raw264.7细胞内h2dcf-da荧光共聚焦成像。
图10小鼠肥胖模型的构建的结果图。hfd(a)和nd(b)喂养的小鼠主要器官的h&e染色成像。
图11tadn在活体内的生物分布。(a)正常小鼠和hfd小鼠经过尾静脉注射cy7-tadn或cy7-natdn后的不同时间点的活体荧光成像。(b)主要器官(心、肝、脾、肺和肾)的荧光成像。(c)图中荧光成像的相对定量。
图12tadn的抗肥胖效果结果图;经过tadn、ntadn或ta治疗后nd或hfd小鼠的(a)肝重和(b)体重变化监测。
图13活体抗肥胖研究结果图;经过tadn、ntadn或ta治疗后nd或hfd小鼠的肝组织的免疫组化染色。
图14tadn系统性毒性研究结果图;经过tadn和ntadn处理的健康的c57bl/6小鼠的主要器官的h&e染色成像。
具体实施方式
实施例1
本发明的dna纳米药物的制备过程图,如图1所示,具体如下:
1、连接:包含有脂肪细胞核酸适配体(ma-91)靶向序列的磷酸化dna模板(10μm,0.6μl)(序列2所示)和引物(10μm,1.2μl)(序列3所示)混合于10μldna连接酶缓冲液(5mmtris-hcl、1mmmgcl2、0.1mmatp和1mm二硫苏糖醇)中,进行退火(95℃下保持5min,然后在2h之内缓慢降温至室温)。退火之后的产物与ecolidna连接酶(60u/μl,1.6μl)在16℃下放置3h连接成环化的dna模板。
2、聚合:环化的dna模板(0.6μm,5μl)与phi29dna聚合酶(10u/μl,2μl)、dntp(10mm/μl,2μl)和bsa(0.05%,0.1μl)在10μl聚合酶缓冲液(50mmtris-hcl、10mm(nh4)2so4、10mmmgcl2和4mm二硫苏糖醇)中,于30℃下聚合24h后,反应混合物在75℃下加热10分钟以终止聚合反应,这样就生成了脂肪细胞靶向的dna框架结构tdm。生成的tdm用双蒸水洗两次并储存在-20℃冰箱中备用。
所生成的tdm按照图1中的框架结果,包含有序列1所示dna序列,其具体的堆积结构和微观结构,见流程图图1或图2a。
3、ta负载:20μl0.3μmtdm溶液同单宁酸ta(10mm,20μl)于4℃摇床上混合24h,这样就合成了脂肪细胞靶向的tadn,再离心并收集上清液,用紫外可见分光光度仪(uv-2450,shimadzu)测上清中ta在275nm波长处的紫外吸收值,以此定量tadn对ta的负载效率。
在本实施例中tdm与ta的质量比为1:28。
表1序列信息表
备注:黑色加粗的部分与引物dna互补,斜体部分与核酸适配体或随机对照链互补。
在本实施例中的构建tadn,首先合成了dna框架结构tdm,如表1和图1所示,我们先把脂肪细胞特异性结合的核酸适配体序列巧妙的设计到rcr的dna模板中,成功合成了具有致密层状结构的dna框架结构tdm,其具体的微观结构如图2a所示,本实施例的tdm是一种不仅具有单分散的、尺寸可调的、即使在严酷的生理环境下也能耐酶切、耐高温、抗解离的框架dna结构。通过进一步与单宁酸进行结合,生成的dna纳米药物tadn,其微观结构如图2b所示;从图2a和2b可知,ta能把tdm从~1μm层状微米结构压缩到~100nm球状纳米结构tadn,且ta如此显著的压缩能力可能归因于tadn中负载了大量的ta。对tdm和tadn进行zeta-电位分析,其结果如图3c:与tdm的表面电位相比,tadn其表面电位变的更负,这也证明了tadn对含有大量多酚基团的ta的高效负载。通过紫外定量结果表明tdm对ta的负载能力高达96%。
将本实施例制备的tadn在生理条件下进行释放,其结果如图3所示。从图3a与3b中,可以得知,tadn在生理条件下能保持稳定性,没有发生明显的聚集和ta的释放。从图3c可知,相对于空白的ta容易吸附蛋白,这将导致ta的生物活性的大大降低,tadn中负载的ta却可以在dna框架的保护下,能有效的阻止ta对蛋白的吸附,这样的结果,可以为tadn能顺利的用于活体应用打下了坚实的基础。
对比例1
按照实施例1的方法(所有步骤和参数都相同),只是将脂肪细胞核酸适配体(ma-91)靶向序列的磷酸化dna模板(序列3)换成任意一段随机的序列,即在构建序列时输入n,即可获得一段未知的随机序列,ntdm序列如序列0所示,n代表随机的未知序列,最终获得了一种ntadn纳米药物。
实施例2tadn的生物性能研究
1、tadn对活性氧和活性氮(rons)的清除
随着机体对营养物质的过量吸收,过多的rons不断在体内产生和积累,就会导致机体的氧化应激,进而引发相关的代谢性炎症、胰岛素抵抗和其他并发症。因此,rons的清除或许是肥胖干预治疗中一种创新、通用且安全有效的治疗策略,这就要求消除各种rons的抗氧化药物具备广泛的抗氧化活性。然而,传统抗氧化剂狭窄的抗氧化活性范围这一缺点大大限制了其生物应用,严重影响其对疾病的治疗效果。因此,一种理想的抗氧化剂,就需要具备安全、靶向性、抗氧化能力强、生物相容性好且对rons有广泛的清除能力等特点。而tadn的作为一种抗氧化药物,其抗氧化能力是我们要考察的首要的且最重要的研究项目。
①tadn对超氧自由基(o2·-)和羟基自由基(·oh)清除能力的研究:电子顺磁共振(epr)技术用来表征该药物对o2·-和·oh清除能力,同时depmpo被用作epr的电子捕获剂。其中,o2·-是从溶解在dmso/冠醚中的ko2(0.2m)产生,·oh是通过h2o2和cuso4发生芬顿反应产生。
②tadn对·no清除能力的研究:用epr技术来表征tadn对·no清除能力,carboxy-ptio(sigmaaldrich)被用作epr的电子捕获剂,而noc7作为产生·no的来源。简而言之,carboxy-ptio溶解在磷酸缓冲液(250mm,ph7.4)中,noc7溶解在1mm的naoh溶液中。然后0.5%甲基纤维素与5μmnoc7室温下混合反应30分钟后,再加入5μmcarboxy-ptio和tadn,去测电子顺磁共振信号。
③tadn对onoo–的清除:onoo-的制备:待4g亚硝酸钠完全溶解在12ml水中后,加入7.5ml30%的h2o2。所得混合液用2ml96%的浓硫酸酸化,然后再快速加入250mlnaoh(12.5g)溶液中和。过多的h2o2通过与过量的mno2反应15分钟移除。用紫外可见分光光度计测302nm波长处的紫外吸收值来定量产生的onoo-的浓度,定量前通过简单离心除去未反应的mno2。为了研究tadn对onoo-的清除能力,我们采用onoo-荧光探针表征tadn对onoo-的清除。首先不同浓度的tadn与13.5μmonoo-混合,然后加入5μmonoo-荧光探针反应1h,最后记录下540nm波长激发下荧光探针的荧光光谱。
④tadn对单线态氧1o2和过氧化氢h2o2清除能力的研究:1o2通过chlorine6(ce6)产生,并用单线态氧探针(sosg)作为1o2指示剂。为了研究tadn对1o2清除能力,1μmce6和不同浓度的tadn与2μmsosg混合于磷酸缓冲液中。所得混合溶液用波长为404nm的激光持续照射5分钟,然后记录494nm波长激发下的sosg的荧光光谱。每个样品对1o2的定量检测是将sosg的荧光增强和背景或对照样品做对比所得。
tadn对h2o2的清除能力研究。为了研究tadn对h2o2的清除能力,采用检测h2o2的h2o2荧光探针。简单来说,20μmh2o2荧光探针与不同浓度的tadn和150μmh2o2混合反应2h后,记录420nm波长激发下h2o2荧光探针的荧光光谱。
结果分析
对o2·-清除能力的结果如图4a所示,depmpo本身没有epr信号,一旦与o2·-反应就会生成具有稳定epr信号的depmpo-ooh。当加入tadn时,dmpmpo-ooh的信号开始降低,而且随着tadn浓度的不断增大到900nm,dmpmpo-ooh的epr信号逐渐降低直到接近dmpmpo的背景信号,这表明了tadn对o2·-极好的清除效果。同时,我们还对比了tdm和ta对o2·-的清除效果。图5a表明基于dna自身的抗氧化能力,tdm对o2·-有微弱的清除能力。虽然ta具有与tadn相当的清除能力,但稳定性很差,其抗氧化能力在24h内几乎全部消失(图5b),这也解释了为什么多酚类化合物对疾病的治疗效果不佳。令人欣慰的是,经过tadn抗氧化处理的样品没有出现明显的dempmpo-ooh信号的增强,表明tadn能长时间保持ta的活性(图5c)。图5d中,即使在o2·-存在下tadn依然能保持完整的球状结构,表明tadn中ta活性的保持可能归因于dna框架的稳定性和保护作用。
对·no清除能力的结果如图4b所示,氮氧自由基(·no),作为一种在不同的细胞中都高表达的活性氮,参与许多生理和病理生理学进程。特别是在肥胖疾病中,不断产生和积累的·no会导致机体的氧化损伤、代谢性炎症、脂肪变性、胰岛素抵制和其他的并发症,并且进一步促进体重的增长。因此,我们接下来研究tadn对·no的清除效果,carboxy-ptio和noc7分别作为·no的捕获剂和供体。检测原理是carboxy-ptio可以被noc7释放的·no氧化成carboxy-pti,相应的epr信号也会从carboxy-ptio的5条线变成carboxy-pti的7条线。且随着·no被慢慢清除,carboxy-pti的7条线信号会逐渐减弱直到恢复carboxy-ptio的5条线信号。因此,图5b中,随着tadn浓度的增加,epr信号逐渐减弱最后恢复成5条线,表明tadn对·no的有效清除。
除了超氧自由基和氮氧自由基这两种自由基引起的直接的氧化损伤,这两种一级rons也可以彼此之间相互反应或与其他的生物分子作用产生许多类型的二级rons,这样会在一定程度上加重原本就有的氧化压力。但是没有任何一种天然酶是特异性的针对二级rons,而且目前已经报道的抗氧化剂很少能对一级和二级rons都有高效的清除效率。因此,为了进一步挖掘tadn的抗氧化潜力,我们同样探究了tadn对肥胖相关的二级rons的清除,包括·oh、h2o2、1o2和onoo-。类似于tadn对o2·-和·no的清除,tadn可以以剂量依赖的方式的下调这些rons的含量(图4c-4f)。
以上这些结果都表明tadn具有广泛的rons清除能力,有望能有效的治疗肥胖和肥胖相关的并发症。
2、细胞实验
①细胞毒性实验
104个/孔3t3-l1前脂肪细胞种在96孔板中,贴壁培养24h后,加入样品ta、tdm或者tadn孵育24h。然后移去旧的培养液,pbs洗两遍之后,每孔加入100μl培养液和10μlcck-8培养箱中培养0.5h-1h,并用synergy2多功能酶标仪(bio-tek,winooski,vt)记录450nm波长处的紫外吸收值。
②细胞肥胖模型
为了建立细胞的肥胖模型,3t3-l1前脂肪细胞用含有10%fbs和1%双抗的dmem完全培养液在37℃、5%co2的氛围中培养。为了诱导3t3-l1前脂肪细胞分化成成熟的脂肪细胞,待细胞长到80%,移去旧的dmem培养液,加入分化培养液(dmem含有10%fbs、1μmol/l地塞米松、0.5mmol/l3-异丁基-1-甲基黄嘌呤和1.67mol/l胰岛素)诱导两天。然后换成脂肪细胞保持培养液(dmem含有10%fbs和10μg/ml胰岛素)继续培养,每两天换一次液。诱导过程中,细胞的分化情况和细胞内活性氧含量的变化分别用油红o和h2dcf-da来表征。
③细胞靶向实验
为了研究tadn对脂肪细胞的特异性结合能力,3t3-l1前脂肪细胞和成熟的脂肪细胞与cy5-tadn或者cy5-ntadn在结合缓冲液(1ml4.5g/l葡萄糖、5mmmgcl2、0.1mg/ml鲑鱼精dna(sigmaaldrich,st.louis,mo)和10%fbs)中37℃下孵育7分钟。然后用清洗缓冲液(1ml4.5g/l葡萄糖和5mmmgcl2于d-pbs中)洗三遍后,细胞中重新加入1ml清洗缓冲液,并用fv1000-x81共聚焦显微镜(olympus,japan)对细胞进行荧光共聚焦成像。
④tadn的细胞抗肥胖实验
3t3-l1前脂肪细胞用上述提到的方法诱导分化成成熟的脂肪细胞。在诱导分化的过程中,我们在细胞加入样品tadn、ntadn或者ta进行抗氧化处理,每三天处理一次直到第9天。治疗后的细胞用4%的多聚甲醛固定10-20分钟后,用0.6%(w/v)油红o溶液对细胞进行染色。最后,染色完的细胞用双蒸水洗3遍后,洗去多余的油红o,再用荧光倒置显微镜对细胞中油红o染色情况进行分析。
⑤tadn的细胞抗氧化效果
3t3-l1细胞和raw264.7细胞分别用上述提到的诱导方法和脂多糖lps诱导,在诱导的过程中细胞用tadn或ntadn进行抗氧化处理。然后用5μmh2dcf-da和hoechst33342对细胞进行染色,以此通过细胞内活性氧含量的变化来评价tadn在细胞内的抗氧化效果。
结果分析:
①tadn抑制脂肪细胞的分化
为了研究tadn的抗氧化和抗炎能力,我们先用诱导培养液去诱导细胞,构建3t3-l1细胞的脂肪细胞研究模型。油红o染色表明诱导的细胞内明显的脂滴的积累,且随着诱导时间的延长,油红o颜色逐渐加深,表明细胞慢慢分化成成熟的脂肪细胞(图6a)。更能引起注意的是,脂肪细胞分化表现了明显的时间依赖的细胞内自由基含量的增加(图6b)。由于细胞在诱导9天时已经有明显的分化效果,后面我们都采用诱导9天的脂肪细胞进行相关的实验。
为了研究tadn的抗肥胖效果,首先,我们通过rcr技术把cy5-dutp融合到tadn或ntadn中形成cy5-tadn或cy5-ntadn,研究tadn对脂肪细胞的靶向能力。如图7a所示,相比经过cy5-ntadn处理的成熟的脂肪细胞,经过cy5-tadn处理的成熟的脂肪细胞内有明显增强的红色荧光,表明tadn优异的靶向和内在化能力,这为tadn的靶向抗肥胖研究提供强大的支持依据。然后,细胞毒性实验研究表明,浓度大于25μm的ta,能显著的影响细胞的活性,tdm和tadn即使在浓度大于100μm时,也不会对细胞的增殖分化造成明显的影响(图8),证明tadn的安全无毒,这是tadn能用于细胞干预实验的前提。最后,在tadn具有良好的靶向能力和安全性的基础上,我们研究了tadn的抗肥胖效果。为了评价tadn对3t3-l1细胞的抗肥胖干预能力,我们在细胞诱导的过程中加入tadn或者ntadn对细胞进行干预治疗,每三天一次,总共3次,之后细胞内ros和脂滴的积累的变化分别用h2dcf-da荧光成像和油红o染色表征。明显地,与成熟的脂肪细胞相比,经tadn或ntadn处理的细胞内有明显降低的油红o累积和减弱的h2dcf-da荧光强度,且与ntadn相比,tadn处理的细胞内更少的油红o累积和更弱的h2dcf-da荧光强度证明了其较高的抗氧化和抗肥胖能力(图7b)。这些结果表明tadn在细胞抗肥胖治疗方面的应用潜力。
②tadn抑制免疫细胞的激活
脂肪细胞分化过程中,细胞内氧化还原和炎症微环境的改变会快速激活和招募周围的免疫细胞和炎症细胞,使其产生更多的活性氧、活性氮和炎症因子,这将导致一系列的级联信号的改变,包括系统性炎症反应、胰岛素抵抗等等。由于在肥胖过程中,巨噬细胞是单核细胞和浸润性炎症细胞的主要群体,故采用脂多糖(lps)刺激raw264.7细胞产生炎性细胞模型,来评价tadn对细胞的抗氧化效果。如图9所示,raw264.7细胞在lps刺激下胞内产生了显著增强的荧光,表明细胞内过多的自由基的产生,相比之下,经过tadn和lps共同处理的raw264.7细胞胞内的荧光强度显著降低,表明细胞内的自由基被有效的清除,也强调了tadn作为一种有效的抗氧化剂在对抗免疫细胞激活方面的潜力(图9)。
实施例3动物实验研究
活体实验
①活体实验和肥胖模型的建立
c57bl/6j雄鼠购自湖南斯莱克景达实验动物有限公司。动物实验经湖南大学实验动物管理中心批准同意。为了建立肥胖模型,6周龄的小鼠喂以高脂饲料(hfd,60%卡路里,pensourcedietd12492,researchdiet)。小鼠体重每周称量一次,直至喂养到约30g。
②tadn的生物分布
待小鼠用高脂饲料喂养到~30g,正常c57bl/6小鼠或者肥胖小鼠通过尾静脉注射以cy7-tadn或者cy7-ntadn。然后,用ivisluminaii活体成像系统(caliperlifescience,usa)对不同的时间点的小鼠进行成像。24h后,处死小鼠,收集主要器官(心、肝、脾、肺和肾),并对主要器官进行成像。
③tadn的活体抗肥胖治疗效果
为了进行tadn的活体抗肥胖研究,6周龄的c57bl/6j雄性小鼠用高脂饲料喂养。待其体重达到30g左右,随机分成4组,每组8只,具体分组如下:(i)hfd小鼠+pbs、(ii)hfd小鼠+tadn、(iii)hfd小鼠+ntadn和(iv)hfd小鼠+ta。另设一组正常饲料喂养的小鼠作为对照组。治疗组小鼠每周用药两次,直到第9周,体重每周称量一次。并在第10周,处死小鼠,取出肝组织进行称重,并送去做免疫组化染色,以备后续的病理性分析。
④系统性毒性研究。
通过尾静脉给正常的c57bl/6小鼠分别注射以pbs、tadn或ntadn,24h后,取出相应的器官(心、肝、脾、肺和肾),用福尔马林浸泡后进行苏木精—伊红(h&e)染色,以用做后续的病理性分析。
结果分析:
①tadn在活体内的生物分布
既然tadn有广泛的体外抗氧化和抗肥胖效果,我们接下来就以高脂饲料喂养的小鼠作为肥胖小鼠模型,进一步进行tadn的活体抗肥胖的研究。如图10所示,经过数周的喂养之后,高脂饲料喂养的小鼠的肝组织内会发现了明显的脂肪变性和脂滴的积累,表明小鼠的肥胖模型构建成功。首先,为了研究tadn的活体抗肥胖研究,我们对tadn在肥胖小鼠中的活体分布进行监测。如图11所示,cy7-tadn和cy7-ntadn两种荧光纳米药物都是以时间依赖的形式在小鼠肝脏内积累,但是靶向tadn在hfd小鼠肝脏内的累积明显高于非靶向的ntadn,且tadn在hfd小鼠脂肪变性的肝内的累积明显要优于nd小鼠正常的肝脏。由于肝脏是营养摄入和能量代谢的主要器官,在持续的hfd刺激下容易发生炎症,并迅速发展为脂肪变性的肝。因此,与全身给药的其他脏器相比,脂肪细胞靶向的tadn在肝脏中有明显的积累并不奇怪。
②tadn的活体抗肥胖效果
在tadn活体肝脏靶向的基础上,我们继续利用hfd诱导的肥胖小鼠模型,研究tadn全身给药是否能有效预防肝脂肪变性的发生和控制体重的增加。简而言之,将hfd喂养的肥胖c57bl/6小鼠随机分为4个实验组。另设一组健康c57bl/6小鼠作为参照,喂以正常饲料nd。然后,给肥胖小鼠静脉注射样品tadn、ntadn或ta,每周两次,注射剂量为5mgta/kg,对照组给予pbs处理。所有这些小鼠每周测量一次体重。10周后,对小鼠进行去皮、称重,并收集肝脏进行组织病理学分析。结果显示,与其他组相比,接受tadn治疗的小鼠,肝脏的重量和体重都得到了有效的控制(图12)。免疫组化分析(ihc)进一步调查肝脏组织内各种炎症细胞因子或其他监管因子(诱导一氧化氮合酶(inos)、环氧合酶-2(cox-2)、过氧物酶体(ppar)γ和肿瘤坏死因子α(tnf-α))的表达(图13)。与体外实验结果一致,tadn能有效抑制这些炎症因子的表达,是所有抑制这些炎症因子表达的药物中最有效的药物之一,可显著减轻炎症和肝损伤。
③tadn的系统的毒性研究
fda认证的抗肥胖药物所面临的另一个关键的挑战是药物的安全性问题。为了对其潜在的不良反应进行评估,我们按治疗剂量给健康c57bl/6小鼠注射以pbs、ntadn或tadn,24h后采集主要器官进行组织学检查。如图14所示,h&e染色结果显示经过处理的小鼠,其主要器官内未见明显的组织损伤。这些结果表明tadn纳米药物具有良好的生物相容性,不会对小鼠造成明显的伤害。
序列表
<110>湖南大学
<120>一种脂肪细胞靶向的dna纳米药物及其制备方法与应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>99
<212>dna
<213>人工序列(人工序列)
<400>1
atcgacctctgggttatgcctgcagtgtgtgtgatgcctgttatttggcctgccggtggg60
cccagcacgcttccgcgcgtaccaacaattgttggtacg99
<210>2
<211>36
<212>dna
<213>人工序列(人工序列)
<400>2
cataacccagaggtcgatcgtaccaacaattgttgg36
<210>3
<211>40
<212>dna
<213>人工序列(人工序列)
<400>3
caccggcaggccaaataacaggcatcacacacactgcagg40
- 还没有人留言评论。精彩留言会获得点赞!
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法