一种聚合物仿生涂层及其制备方法与流程
本发明涉及医疗技术领域,尤其涉及一种聚合物仿生涂层及其制备方法。
背景技术:
心血管类疾病已经成为人类死亡的第一病因。心血管类植介入医疗器械,如心脏支架,人工血管,心脏瓣膜等,是心血管治疗的重要手段之一。这类医疗器械与血液接触容易在医疗器械表面形成血栓,造成医疗器械失效。通过表面改性,一般可以抑制血液与医疗器械起始接触引发的血栓,但由于植介入器械长期在血液环境中,血液微环境的变化会引发后期和晚期血栓,同样威胁病人健康。血栓的生成与血液中的炎症反应紧密相关。
植介入材料植入人体过程通常引发两类炎症:1)由手术损伤所造成的急性炎症,加剧组织损伤程度,加重病人痛苦,同时会引起血管内血栓的产生;2)由人体自身免疫系统产生的,对植入物的免疫排斥反应所引起的慢性炎症。这类炎症会导致植入物在人体内失效,对于血液接触类而言甚至会造成血管平滑肌细胞(smc)过度增殖,引起深静脉血栓等一系列血液疾病。
目前,植介入医疗器械的常用改性方法包括表面涂覆含药物涂层,如药物洗脱心脏支架(des)。相比于金属裸支架,药物洗脱支架,会显著降低再狭窄的概率。然而,后续研究发现,在植入此类des后心肌梗塞的速率和心血管死亡率反而增加。这主要因为:首先,药物涂层设计单一,没有根据血液微环境的变化设计涂层,最终无法调整血液微环境的平衡;其次,药物释放,通常使涂层表面结构发生降解,使器械的血液相容性变差,容易引发血小板聚集和急性血栓;最后,涂层设计忽略了炎症对器械的影响,炎症是形成植入后期和晚期血栓的主要原因。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种聚合物仿生涂层及其制备方法,本发明提供的聚合物仿生涂层具有较优的抗炎、抗凝血效果,提高了植介入医疗器械安全性以及服役时间。
本发明提供了一种聚合物仿生涂层,包括:
衬底;
附着在所述衬底上的内层,所述内层包括生物相容性聚合物和抗炎药物;
附着在所述内层上的外层,所述外层包括炎症响应性聚合物。
优选的,所述炎症响应性聚合物包括苯硼酸酯类聚合物、芳基草酸酯类聚合物和烷基硫醚类聚合物中的一种或几种;
所述炎症响应性聚合物的聚合度为2~2000;
所述生物相容性聚合物包括聚乙二醇类聚合物、聚己内酯聚合物、聚氨酯类聚合物和肝素类聚合物中的一种或几种。
优选的,所述炎症响应性聚合物包括包括4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇、聚(1,4-对苯二甲酸丁二醇酯-四亚甲基草酸酯)共聚物和聚乙二醇二丙烯酸酯-乙二硫醇共聚物中的一种或几种;
所述生物相容性聚合物包括肝素钠、聚乙二醇和聚乙烯基吡咯烷酮中的一种或几种;
所述生物相容性聚合物的重均分子量为50000~130000da。
优选的,所述抗炎药物包括乙酰水杨酸盐类抗炎药、非乙酰基水杨酸盐类抗炎药和非水杨酸类抗炎药中的一种或几种。
优选的,所述抗炎药物包括阿司匹林、对乙酰氨基酚、吲哚美辛、萘普生、萘普酮、双氯芬酸、布洛芬、尼美舒利、罗非昔布或塞来昔布。
优选的,所述衬底包括:由铁、镁、镍、钨、钛、锆、铌、钽、锌或硅组成的金属衬底;或由锂、钠、钾、钙、锰、铁和钨中的一种或几种组成的金属衬底;或由二氧化锆和/或羟基磷酸钙组成的陶瓷衬底;或由聚氨酯类聚合物、聚砜类聚合物、聚酯类和聚醚类聚合物中的一种或几种组成的聚合物衬底。
优选的,所述内层中,抗炎药物的质量分数为1%~20%。
优选的,所述内层的厚度与外层的厚度比为0.5~3:0.5~2。
本发明还提供了一种聚合物仿生涂层的制备方法,包括以下步骤:
a)采用静电纺丝技术或静电喷涂技术,将内层混合液均匀附着在衬底表面,真空干燥后得到内层;所述内层混合液包括生物相容性聚合物、抗炎药物和第一溶剂;
b)采用静电纺丝技术或静电喷涂技术,将外层混合液均匀附着在所述内层表面,真空干燥后,得到聚合物仿生涂层;所述外层混合液包括炎症响应性聚合物和第二溶剂。
优选的,步骤a)中,所述第一溶剂选自四氢呋喃、乙酸、n,n-二甲基甲酰胺、水和乙醇中的一种或几种;
所述内层混合液中,生物相容性聚合物和抗炎药物的质量浓度为10%~30%;
步骤b)中,所述第二溶剂选自二氯甲烷、丙酮、四氢呋喃、乙酸、n,n-二甲基甲酰胺、乙酸乙酯、乙醇和氯仿中的一种或几种;
所述外层混合液中,炎症响应性聚合物的质量浓度为3%~15%。
本发明提供了一种聚合物仿生涂层,包括:衬底;附着在所述衬底上的内层,所述内层包括生物相容性聚合物和抗炎药物;附着在所述内层上的外层,所述外层包括炎症响应性聚合物。将由本发明的聚合物仿生涂层修饰的植介入医疗器械植介入血管的过程中,血管损伤和修复生成大量反应活性氧簇(ros),引起急性炎症,涂层表现自适应行为,外层炎症响应性聚合物吸附过量的ros,发生降解,消除急性炎症。外层降解后,露出高血液相容性的内层。内层中含有抗炎症药物在血液环境中缓慢释放,实现抗慢性炎症的作用,提高植介入医疗器械安全性以及服役时间。本发明体现了自适应性和智能响应性,降低了植介入医疗器械(例如血管内置假体、管腔内置假体、支架、冠状动脉支架或外周支架等)引发的病理反应,延长了器械使用寿命。
实验表明,本发明提供的聚合物仿生涂层具有抗血小板粘附的能力,具有较高的bci指数,具有优异的抗凝血能力,可以有效抑制炎症和血栓的发生。
附图说明
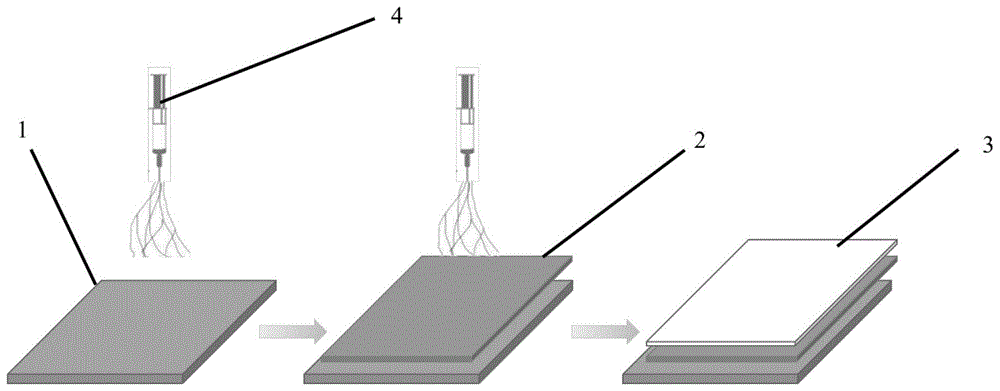
图1为本发明的一个实施例提供的聚合物仿生涂层的制备过程图;
图2为本发明实施例1的聚合物仿生涂层的血小板吸附电镜图;
图3为聚己内酯涂层的血小板吸附电镜图;
图4为本发明实施例1的聚合物仿生涂层与铝箔的bci值;
图5为本发明实施例1的聚合物仿生涂层和裸衬底的炎症因子tnf-α含量。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种聚合物仿生涂层,包括:
衬底;
附着在所述衬底上的内层,所述内层包括生物相容性聚合物和抗炎药物;
附着在所述内层上的外层,所述外层包括炎症响应性聚合物。
本发明提供的聚合物仿生涂层包括衬底。在本发明的某些实施例中,所述衬底包括:由铁、镁、镍、钨、钛、锆、铌、钽、锌或硅组成的金属衬底;或由锂、钠、钾、钙、锰、铁和钨中的一种或几种组成的金属衬底;或由二氧化锆、生物玻璃、氧化铝和羟基磷酸钙中的一种或几种组成的陶瓷衬底;或由聚氨酯类聚合物、聚砜类聚合物、聚酯类和聚醚类聚合物中的一种或几种组成的聚合物衬底。所述衬底优选为由铁、镁、镍、钨、钛、锆、铌、钽、锌或硅组成的金属衬底。在本发明的某些实施例中,所述金属衬底为钛合金。在某些实施例中,所述陶瓷衬底为生物玻璃陶瓷(cao-na2o-sio2-p2o5)片、氧化铝生物陶瓷(vk-l05c)片或羟基磷酸钙固体。在本发明的某些实施例中,所述聚合物衬底为聚氨酯basf膜、聚砜p1700膜。
所述聚合物仿生涂层还包括附着在所述衬底上的内层。所述内层包括生物相容性聚合物和抗炎药物。
在本发明的某些实施例中,所述生物相容性聚合物包括聚乙二醇类聚合物、聚己内酯聚合物、聚氨酯类聚合物和肝素类聚合物中的一种或几种。在本发明的某些实施例中,所述生物相容性聚合物包括肝素钠、聚乙二醇和聚乙烯基吡咯烷酮中的一种或几种;所述生物相容性聚合物的重均分子量为40000~130000da,优选为50000~130000da。在本发明的某些实施例中,所述生物相容性聚合物的重均分子量为40000da、50000da、60000da、70000da、80000da、86000da、100000da或130000da。
在本发明的某些实施例中,所述抗炎药物包括乙酰水杨酸盐类抗炎药、非乙酰基水杨酸盐类抗炎药和非水杨酸类抗炎药中的一种或几种。在本发明的某些实施例中,所述抗炎药物包括阿司匹林、对乙酰氨基酚、吲哚美辛、萘普生、萘普酮、双氯芬酸、布洛芬、尼美舒利、罗非昔布或塞来昔布;优选为阿司匹林、吲哚美辛或萘普生。
在本发明的某些实施例中,所述内层中,抗炎药物的质量分数为1%~30%;优选为1%~20%;更优选为5%~15%。在某些实施例中,所述内层中抗炎药物的质量分数为15%、5%、6%、9%或17%。
所述聚合物仿生涂层还包括附着在所述内层上的外层。所述外层包括炎症响应性聚合物。在本发明的某些实施例中,所述炎症响应性聚合物包括苯硼酸酯类聚合物、芳基草酸酯类聚合物和烷基硫醚类聚合物中的一种或几种;所述炎症响应性聚合物的聚合度为2~2000。在某些实施例中,所述炎症响应性聚合物的聚合度为2~1000、10~100、2000、1000、2、100、10或20。在某些实施例中,所述苯硼酸酯类聚合物为4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇,所述芳基草酸酯类聚合物为聚(1,4-对苯二甲酸丁二醇酯-四亚甲基草酸酯)共聚物,所述烷基硫醚类聚合物为聚乙二醇二丙烯酸酯-乙二硫醇共聚物中的一种或几种。
在本发明的某些实施例中,所述内层的厚度与外层的厚度比为0.5~4:0.5~5。在某些实施例中,所述内层的厚度与外层的厚度比为1:1、1.5:1、2:1、3:1、2:0.7、2:1、1:2、3:2或4:5。在某些实施例中,所述外层的厚度为1500μm、1000μm、750μm、1400μm、600μm、500μm、200μm、70μm或80μm。
本发明提供的聚合物仿生涂层中,外层为自适应层,目的在于植入物植入人体后,外层作为活性成分快速降解,自适应环境变化,其中的炎症响应性聚合物释放到体液中,能够高效清除由于手术损伤所引起的过量活性氧簇(ros),治疗急性炎症,降低手术后初期病人痛苦。外层降解后,内层暴露,所述内层为生物相容性聚合物,不会造成细胞损伤。但是,为了避免免疫排斥作用所引起的慢性炎症,内层材料包含有抗炎药物,优选为阿司匹林、吲哚美辛、萘普生。所述抗炎药物从涂层内层缓慢释放,实现抗炎效果。
本发明还提供了一种聚合物仿生涂层的制备方法,包括以下步骤:
a)采用静电纺丝技术或静电喷涂技术,将内层混合液均匀附着在衬底表面,真空干燥后得到内层;所述内层混合液包括生物相容性聚合物、抗炎药物和第一溶剂;
b)采用静电纺丝技术或静电喷涂技术,将外层混合液均匀附着在所述内层表面,真空干燥后,得到聚合物仿生涂层;所述外层混合液包括炎症响应性聚合物和第二溶剂。
本发明提供的聚合物仿生涂层的制备方法中,采用的原料和组分同上,在此不再赘述。
图1为本发明的一个实施例提供的聚合物仿生涂层的制备过程图。其中,1为衬底,2为内层,3为外层,4为静电纺丝装置或静电喷涂装置。
本发明先采用静电纺丝技术或静电喷涂技术,将内层混合液均匀附着在衬底表面,真空干燥后得到内层。所述内层混合液包括生物相容性聚合物、抗炎药物和第一溶剂。
在本发明的某些实施例中,所述第一溶剂选自四氢呋喃、乙酸、n,n-二甲基甲酰胺、水和乙醇中的一种或几种。
在本发明的某些实施例中,所述内层混合液中,生物相容性聚合物和抗炎药物的质量浓度为10%~30%;优选为15%~30%;更优选为20%~25%。在某些实施例中,所述内层混合液中,生物相容性聚合物和抗炎药物的质量浓度为12%、31%、21%或16%。
本发明对所述内层混合液的制备方法并无特殊的限制,采用本领域技术人员熟知的溶液的制备方法即可。在本发明的某些实施例中,所述内层混合液按照以下方法进行制备:
将生物相容性聚合物、抗炎药物和第一溶剂混合,得到内层混合液。
在本发明的某些实施例中,所述生物相容性聚合物、抗炎药物和第一溶剂混合的时间为2~24h。
本发明中,内层的纺丝电压或喷涂电压优选为10~30kv,更优选为15~25kv,在本发明的实施例中可以是18kv、19kv、20kv、21kv、22kv。在本发明中,内层的纺丝速率或喷涂注射速率优选为0.5~2ml/h,具体的,在本发明的实施例中可以是0.5ml/h、0.7ml/h、0.8ml/h、0.9ml/h、1.0ml/h或1.5ml/h。在本发明中,内层的纺丝或喷涂的接收器的接收距离优选为10~20cm,具体的,在本发明的实施例中可以是10cm、12cm、15cm、18cm或20cm。在本发明中,内层的纺丝或喷涂的接收器的接收的时间优选为10min~3h,具体的,可以为2h、0.5h、1h或10min。本发明中,内层在静电纺丝或静电喷涂的过程中,所用喷射针针头优选为15~20g,具体的,在本发明的实施例中可以是15g、16g、17g、19g或20g。
在本发明的某些实施例中,所述真空干燥的温度为25~80℃。在某些实施例中,所述真空干燥的温度为37℃。在本发明的某些实施例中,所述真空干燥的时间不小于24h。在某些实施例中,所述真空干燥的时间为24~72h或37h。
本发明中,采用静电纺丝技术真空干燥后得到的内层为纤维层。在本发明的某些实施例中,所述纤维层中纤维的直径为0.1~10μm。本发明中,采用静电喷涂技术真空干燥后得到的内层为聚合物粒子层。在本发明的某些实施例中,所述聚合物粒子层中聚合物粒子的直径为0.1~10μm。
得到内层后,采用静电纺丝技术或静电喷涂技术,将外层混合液均匀附着在所述内层表面,真空干燥后,得到聚合物仿生涂层;所述外层混合液包括炎症响应性聚合物和第二溶剂。
在本发明的某些实施例中,所述第二溶剂选自二氯甲烷、丙酮、四氢呋喃、乙酸、n,n-二甲基甲酰胺、乙酸乙酯、乙醇和氯仿中的一种或几种。
在本发明的某些实施例中,所述外层混合液中,炎症响应性聚合物的质量浓度为3%~15%;优选为6%~10%。在某些实施例中,所述外层混合液中,炎症响应性聚合物的质量浓度为3%。
本发明对所述外层混合液的制备方法并无特殊的限制,采用本领域技术人员熟知的溶液的制备方法即可。在本发明的某些实施例中,所述外层混合液按照以下方法进行制备:
将炎症响应性聚合物和第二溶剂混合,得到外层混合液。
在本发明的某些实施例中,炎症响应性聚合物和第二溶剂混合的时间为0.5~3h。
本发明中,外层的纺丝电压或喷涂电压优选为5~15kv,更优选为8~12kv,在本发明的实例中可以是7kv、8kv、9kv、10kv、11kv、12kv。在本发明中,外层的纺丝速率或喷涂注射速率优选为1~3ml/h,具体的,在本发明的实施例中可以是1ml/h、1.5ml/h、2ml/h、2.5ml/h、2.8ml/h或3ml/h。在本发明中,外层的纺丝或喷涂的接收器的接收距离优选为15~30cm,具体的,在本发明的实施例中可以是15cm、20cm、25cm、28cm或30cm。在本发明中,外层的纺丝或喷涂的接收器的接收的时间优选为0.01~2h,具体的,可以为1.5h、1h、40min、10min或1min。本发明中,外层在静电纺丝或静电喷涂的过程中,所用喷射针针头优选为15~20g,具体的,在本发明的实施例中可以是15g、16g、17g、19g或20g。
在本发明的某些实施例中,所述真空干燥的温度为25~80℃。在某些实施例中,所述真空干燥的温度为37℃。在本发明的某些实施例中,所述真空干燥的时间不小于24h。在某些实施例中,所述真空干燥的时间为24~72h、37h或48h。
本发明中,所述第一溶剂和第二溶剂多为有机溶剂,为了消除有机溶剂的毒性,采用上述真空干燥除去有机溶剂。在本发明的某些实施例中,所述真空干燥在真空干燥箱中进行。
本发明中,所述静电纺丝技术和静电喷涂技术原理基本一样,都是在静电力的作用下,溶液被吸引并附着在指定的接受器上。在此过程中,溶液的溶剂挥发或部分挥发,溶质析出并均匀分布在接收器表面。整个过程的影响因素包括直流电压、液注射速率、接收器距离和喷射针针头直径。
本发明对上文采用的原料的来源并无特殊的限制,可以为一般市售。
为了进一步说明本发明,下面结合实施例对本发明提供的一种聚合物仿生涂层及其制备方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
以下实施例所用的原料均为一般市售。
实施例1:金属衬底
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。将0.3g吲哚美辛和1.7g肝素钠(50000da)溶于15g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为12%。随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收2h,37℃下干燥48h,内层厚度为1500μm。随后配制外层溶液。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为2000)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着内层涂层的衬底接收1.5h,外层厚度1500μm,使内层的厚度与外层的厚度比为1:1。将涂层涂覆的金属钛合金置于真空烘箱中,37℃下干燥48h,得到聚合物仿生涂层。
实施例2
血小板粘附实验:
新鲜血液从健康成年新西兰兔(2.5±0.5kg,吉林大学动物实验中心提供)耳动脉抽取,血液收集于装有2ml质量分数为3.5%的柠檬酸钠的采血管中以防凝固。在两种不同转速下离心血液以便获得两种不同类型的血浆。通过在1000rpm下离心获得第一种类型(富血小板血浆(prp)),通过在1500rpm下离心获得第二种类型(贫血小板血浆(ppp))。为了有足够量进行试验,将血浆稀释于pbs(磷酸盐缓冲盐溶液)。运用扫描电镜直观观察血小板吸附情况。
将实施例1中所述制备的聚合物仿生涂层(2×2cm2)和聚己内酯纺丝得到的涂层(2×2cm2)分别在37℃和连续震荡下(thz-312台式恒温振荡器),浸入prp中24h。完成后用pbs缓冲液冲洗,在电镜下观察血小板吸附情况。
图2为本发明实施例1的聚合物仿生涂层的血小板吸附电镜图。图3为聚己内酯涂层的血小板吸附电镜图。图2显示,本发明实施例1的聚合物仿生涂层表面没有血小板粘附,说明本发明制备的仿生涂层不产生血小板激活和粘附,具有优异的血液相容性。相比而言,聚己内酯涂层表面粘附了大量的血小板,容易引发血栓(参见图3)。
实施例3
抗凝实验:
将血液收集于装有2ml质量分数为3.5%的柠檬酸钠的采血管中以防凝固,将所述血液200μl分别滴加在实施例1的聚合物仿生涂层和铝箔表面,然后分别滴加20μl的氯化钙溶液(0.2m的浓度),37℃下孵育5min。完成后,将25ml的去离子水加入以破坏未凝的红细胞,运用酶标仪检测涂层抗凝血能力。以bci代表抗凝能力大小,bci数值越大,抗凝效果越好。所述bci的计算公式如式(1)所示:
在公式(1)中,odsample为酶标仪所测样品在541nm处吸光度;odblank为将新鲜的200μl血液用25ml去离子水溶血后样品在541nm处的吸光度。
图4为本发明实施例1的聚合物仿生涂层与铝箔的bci值。图4显示,聚合物仿生涂层的bci值为98%,相比而言,光滑铝箔表面的bci值为60%,说明聚合物仿生涂层具有优异的抗血栓能力。
实施例4
抗炎实验:
将实施例1的聚合物仿生涂层浸泡在用lps诱发炎症的吞噬细胞(raw264.7,上海邦景实业有限公司)中,在37℃、5%的co2中培养24h。完成后,在培养基中使用根据提供的说明设置的常规elisa测量tnf-α的含量。同时,本实施例还采用裸衬底进行了上述实验。图5为本发明实施例1的聚合物仿生涂层和裸衬底的炎症因子tnf-α含量。图5显示,裸衬底引发了大量炎症因子tnf-α生成,生成量超过1800pg/ml,而聚合物仿生涂层仅诱导tnf-α生成量为1300pg/ml,有效的抑制了炎症发生。
实施例5:陶瓷衬底
以生物玻璃陶瓷(cao-na2o-sio2-p2o5)为衬底,将生物玻璃陶瓷片固体固定到纺丝或喷涂接收器上,进行表面涂覆。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例6:陶瓷衬底
以氧化铝生物陶瓷(vk-l05c)为衬底,将氧化铝生物陶瓷片固定到纺丝或喷涂接收器上,进行表面涂覆。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例7:聚合物衬底
以聚氨酯basf为衬底,将聚氨酯basf膜固定到纺丝或喷涂接收器上,进行表面涂覆。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例8:聚合物衬底
以聚砜p1700为衬底,将聚砜p1700膜固定到纺丝或喷涂接收器上,进行表面涂覆。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例9:内层的厚度与外层的厚度比
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。外层纺丝和喷涂时间变为1h,使外层厚度降低至750μm,内层的厚度与外层的厚度比为2:1。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例10:衬底与内层的厚度之和与外层的厚度比
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。将外层纺丝和喷涂时间变为40min,使外层厚度降低至500μm,内层的厚度与外层的厚度比为3:1。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例11:金属衬底-炎症响应性聚合物的种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变外层炎症响应性聚合物为聚(1,4-对苯二甲酸丁二醇酯-四亚甲基草酸酯)共聚物,聚合度为1000。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例12:金属衬底-炎症响应性聚合物的分子量
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变外层炎症响应性聚合物为4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇,聚合度为2。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例13:金属衬底-炎症响应性聚合物的分子量
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变外层炎症响应性聚合物为4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇,聚合度为100。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例14:金属衬底-炎症响应性聚合物的分子量
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变外层炎症响应性聚合物为4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇,聚合度为10。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例15:金属衬底-内层生物相容性聚合物种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层生物相容性聚合物为聚乙二醇,重均分子量为50000da。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例16:金属衬底-内层生物相容性聚合物种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层生物相容性聚合物为聚乙烯基吡咯烷酮,重均分子量为50000da。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例17:金属衬底-内层生物相容性聚合物分子量
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层生物相容性聚合物肝素钠的重均分子量为40000da。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为95%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1000pg/ml,有效抑制了炎症和血栓的发生。
实施例18:金属衬底-内层生物相容性聚合物分子量
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层生物相容性聚合物肝素钠的重均分子量为130000da。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例19:金属衬底-内层抗炎药物的质量分数
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层抗炎药物的质量分数:0.1g吲哚美辛和1.9g肝素钠(50000da)溶于15g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为12%。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例20:金属衬底-内层抗炎药物的种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层抗炎药物为阿司匹林。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1000pg/ml,有效抑制了炎症和血栓的发生。
实施例21:金属衬底-内层抗炎药物的种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层抗炎药物为萘普生。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例22:金属衬底-内层抗炎药物的种类
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。改变内层抗炎药物为罗非昔布。其他步骤按照实施例1进行。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例23
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。将0.3g吲哚美辛和1.7g聚乙二醇(50000da)溶于4.4g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和聚乙二醇的质量浓度为31%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收0.5h,37℃下干燥48h,内层厚度为210μm。
将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为2000)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收10min,外层厚度70μm,使内层的厚度与外层的厚度比为3:1。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为97%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例24
以金属钛合金(ta1eli,通项金属材料有限公司)为衬底,将金属钛合金固定到纺丝或喷涂接收器上,进行表面涂覆。将0.05g吲哚美辛和1.0g聚己内酯(70000da)溶于4g乙酸中,吲哚美辛和聚乙二醇的质量浓度为21%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收0.5h,37℃下干燥48h,内层厚度为200μm,内层中抗炎药物的质量分数为5%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收10min,外层厚度70μm,使内层的厚度与外层的厚度比为2:0.7。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例25
以聚氨酯(basf)为衬底,将聚氨酯basf膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.05g吲哚美辛和0.75g肝素钠(50000da)溶于4.25g水中,吲哚美辛和肝素钠的质量浓度为16%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收0.5h,37℃下干燥48h,内层的厚度为400μm,内层中抗炎药物的质量分数为6%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为20)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收10min,外层厚度200μm,使内层的厚度之和与外层的厚度比为2:1。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例26(改变抗凝高分子分子量)
以聚氨酯(basf)为衬底,将聚氨酯basf膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.1g吲哚美辛和0.5g肝素钠(100000da)溶于4.4g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为12%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收1h,37℃下干燥48h,内层的厚度为700μm,内层中抗炎药物的质量分数为17%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1.5h,外层厚度1400μm,使内层的厚度与外层的厚度比为1:2。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1000pg/ml,有效抑制了炎症和血栓的发生。
实施例27
以聚氨酯(basf)为衬底,将聚氨酯basf膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.05g吲哚美辛和1.0g聚己内酯(70000da)溶于4.0g乙酸中,吲哚美辛和肝素钠的质量浓度为21%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收10min,37℃下干燥48h,内层的厚度为120μm,内层中抗炎药物的质量分数为5%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为2000)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收10min,外层厚度80μm,使内层的厚度与外层的厚度比为3:2。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为98%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1000pg/ml,有效抑制了炎症和血栓的发生。
实施例28
以聚砜(p1700)为衬底,将聚砜p1700膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.05g吲哚美辛和0.75g肝素钠(100000da)溶于4.25g水中,吲哚美辛和肝素钠的质量浓度为16%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收0.5h,37℃下干燥48h,内层的厚度为500μm,内层中抗炎药物的质量分数为6%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1h,外层厚度1000μm,使内层的厚度与外层的厚度比为1:2。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1000pg/ml,有效抑制了炎症和血栓的发生。
实施例29
以聚砜(p1700)为衬底,将聚砜p1700膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.1g吲哚美辛和0.5g肝素钠(100000da)溶于4.4g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为12%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收1h,37℃下干燥48h,内层的厚度为750μm,内层中抗炎药物的质量分数为17%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1h,外层厚度1000μm,使内层的厚度与外层的厚度比为3:4。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为94%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例30
以聚砜(p1700)为衬底,将聚砜p1700膜固定到纺丝或喷涂接收器上,进行表面涂覆。将0.1g吲哚美辛和1g聚己内酯(80000da)溶于4g乙酸与水(2:1质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为21%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收1h,37℃下干燥48h,内层的厚度为800μm,内层中抗炎药物的质量分数为9%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1h,外层厚度1000μm,使内层的厚度与外层的厚度比为4:5。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为95%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例31
以羟基磷酸钙为衬底,将羟基磷酸钙固体固定到纺丝或喷涂接收器上,进行表面涂覆。将0.1g吲哚美辛和1g聚己内酯(80000da)溶于4g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为21%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收1h,37℃下干燥48h,内层的厚度为800μm,内层中抗炎药物的质量分数为9%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1h,外层厚度1000μm,使内层的厚度与外层的厚度比为4:5。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为93%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1200pg/ml,有效抑制了炎症和血栓的发生。
实施例32
以羟基磷酸钙为衬底,将羟基磷酸钙固体固定到纺丝或喷涂接收器上,进行表面涂覆。将0.1g吲哚美辛和0.5g肝素钠(100000da)溶于4.4g乙酸与水(2:1,质量比)混合溶剂中,吲哚美辛和肝素钠的质量浓度为12%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收1h,37℃下干燥48h,内层的厚度为750μm,内层中抗炎药物的质量分数为17%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收1h,外层厚度1000μm,使内层的厚度与外层的厚度比为3:4。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
实施例33
以羟基磷酸钙为衬底,将羟基磷酸钙固体固定到纺丝或喷涂接收器上,进行表面涂覆。将0.05g吲哚美辛和0.75g肝素钠(50000da)溶于4.25g水中,吲哚美辛和肝素钠的质量浓度为16%。
随后将混合液转到注射针头,在22kv的电势差下以1ml/h的注射速度纺丝或喷涂。在15cm处接收30min,37℃下干燥48h,内层的厚度为300μm,内层中抗炎药物的质量分数为6%。将5g溶有0.15g4-甲基-1-(对苯硼酸频哪醇酯)甲氧基-2,6-二甲醇(聚合度为100)的二氯甲烷溶液(质量浓度为3%)在10kv的电势差下以1ml/h的速率注射,在15cm处用已附着有内层涂层的衬底接收45min,外层厚度600μm,使内层的厚度与外层的厚度比为1:2。将得到的涂层在真空烘箱37℃下干燥48h,得到聚合物仿生涂层。
血小板粘附实验表明:聚合物仿生涂层具有抗血小板粘附的能力;抗凝实验表明:聚合物仿生涂层的bci指数为96%,具有优异的抗凝血能力;抗炎实验表明,聚合物仿生涂层的炎症因子tnf-α含量为1100pg/ml,有效抑制了炎症和血栓的发生。
上述实验表明,本发明提供的聚合物仿生涂层具有抗血小板粘附的能力,具有较高的bci指数,具有优异的抗凝血能力,可以有效抑制炎症和血栓的发生。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!