P4HB抑制剂在治疗或预防肿瘤恶病质中的用途
no.1序列为:5
’-
cagaggccaucgaugacauaccauu-3’;seq id no.2序列为:5
’-
gcuucaagggcaagauccuguucau-3’。
11.优选地,所述小分子化合物为ccf642,化学式为c
15
h
10
n2o4s3,结构如下式(i)所述:
[0012][0013]
本发明提供一种治疗或预防哺乳动物肿瘤恶病质的方法,包括向遭受所述癌症恶病质症状的机体给药治疗的p4hb抑制剂。通过免疫组化芯片分析p4hb 与临床指标的相关性,发现蛋白p4hb在人食管鳞癌患者组织中高表达,并且与肿瘤的分化程度显著相关,具有重要的临床意义;通过p4hb核酸抑制剂 sirna,使得p4hb蛋白表达下调,从而抑制肌肉细胞凋亡和促进肌肉细胞生长,由此说明p4hb是诱导肿瘤恶病质过程中潜在的关键靶点;通过p4hb的小分子化合物抑制剂抑制肌肉细胞凋亡和裸鼠骨骼肌降解,从而治疗或预防肿瘤恶病质。
[0014]
本发明的有益效果在于:
[0015]
本发明提供一种p4hb抑制剂作为用于制备治疗或预防肿瘤恶病质的药物中的用途,通过p4hb抑制剂使得p4hb基因表达下调,从而治疗或预防肿瘤恶病质。
附图说明
[0016]
图1a为p4hb在77对食管鳞状细胞癌组织和配对的癌旁组织的表达切片照片。
[0017]
图1b为p4hb在77对食管鳞状细胞癌组织和配对的癌旁组织的表达卡方统计结果图。
[0018]
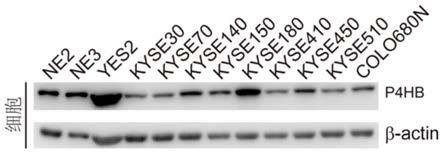
图2为p4hb在10株食管鳞状细胞癌细胞系和2株永生化正常食管上皮细胞的表达的western blot结果图。
[0019]
图3为p4hb在食管鳞状细胞癌细胞系及能够诱导恶病质的其他消化道肿瘤分泌的外泌体中的表达的western blot结果图。
[0020]
图4a为p4hb在kyse150 control细胞和kyse150 flag-p4hb细胞中的表达结果图。
[0021]
图4b为p4hb在kyse150 control细胞和kyse150 flag-p4hb细胞外泌体中的表达结果图。
[0022]
图5a为加入kyse150 control exo外泌体处理的c2c12细胞的流式细胞结果图。
[0023]
图5b为加入kyse150 flag-p4hb exo处理的c2c12细胞的流式细胞结果图。
[0024]
图5c为图5a和图4b的t-test统计结果图。
[0025]
图6a为p4hb在kyse150 lv-flag-p4hb细胞和kyse150 lv-control细胞外泌体中的表达结果图。
[0026]
图6b为kyse150 lv-flag-p4hb外泌体和kyse150 lv-control外泌体对 c2c12成肌细胞生长的结果比较图。
structural variations in esophageal squamous cell carcinoma.am j hum genet 98,256-274(2016).)。
[0049]
运用生物信息学对我国食管鳞状细胞癌的基因组研究结果进行了统计分析 (song y.等人(2014).”identification of genomic alterations in oesophageal squamous cell cancer.”nature 509,91-95.和cheng,c.等人(2016).
”ꢀ
whole-genome sequencing reveals diverse models of structural variations in esophageal squamous cell carcinoma.”am j hum genet 98,256-274.),出人意料地发现,p4hb在食管鳞状细胞癌中高表达,具有9.09%的扩增率。通过免疫组织化学分析发现,p4hb在77对食管鳞状细胞癌患者组织中的表达水平显著高于其配对的癌旁组织。随后我们的功能实验证明,高表达p4hb的外泌体处理肌肉细胞可以促进肌肉细胞凋亡和抑制肌肉细胞生长,抑制基因p4hb表达的外泌体处理肌肉细胞能显著抑制肌肉细胞凋亡和促进肌肉细胞生长。因此,基因p4hb有望成为食管鳞状细胞癌恶病质的治疗靶点。
[0050]
为此,本发明提供p4hb抑制剂作为用于制备治疗或预防肿瘤恶病质的药物中的用途。
[0051]
特别地,根据本发明所述的p4hb抑制剂是特异地结合并抑制p4hb蛋白质的抗体。
[0052]
术语“抗体”用于文中,指所有类型的特异地结合p4hb多肽,并抑制p4hb 活性的抗体。优选地,本发明的该抑制性抗体特异地结合位于配体结合结构域的p4hb多肽中的表位。优选地,本发明的抗体是单克隆抗体、多克隆抗体、单链抗体、嵌合抗体或任何该抗体的片段或衍生物。包含在术语抗体中的这样的片段或衍生物用于文中,包括双特异抗体、合成的抗体、fab、f(ab)2、fv或 scfv片段、或这些抗体中任何一个的化学修饰的衍生物。在本发明抗体的上下文中使用的特异的结合,指抗体不与其他多肽交叉反应。可使用公知技术检测特异的结合。
[0053]
更特别地,根据本发明所述的p4hb抑制剂是核酸抑制剂。
[0054]
优选地,所述的核酸抑制剂特异地结合编码p4hb,并抑制p4hb的转录或翻译的多核苷酸。
[0055]“核酸抑制剂”用于文中,指如适体的核酸分子,其通过以类似于对上述抗体所描述的方式结合多肽来抑制p4hb多肽活性,或者指与编码p4hb多肽的多核苷酸互补而结合所述多核苷酸的核酸分子,其抑制多核苷酸的转录或翻译。例如,抑制性核酸可通过干扰p4hb基因的正确转录作为三螺旋形成寡核苷酸发挥作用。而且,抑制性核酸可以是核酶,其特异地结合并降解p4hb转录物。可替换地,其可以是能够结合、降解转录物或至少抑制其有效翻译的反义(核酸)、sirna或microrna。后一类型的抑制性核酸的特征在于其通常包含于 p4hb转录物中的序列互补的核酸序列。该互补序列应该足够长,且应当包含足够数目的匹配核苷酸,从而允许与细胞中转录物的特异杂交。
[0056]
进一步地,根据本发明所述的核酸抑制剂选自核酶、反义分子、寡核苷酸抑制剂、适体、microrna或sirna。
[0057]
根据本发明的“核酶”是包含与p4hb转录物互补的序列的rna分子。核酶技术是本领域公知的,本领域技术人员能够设计和应用合适的核酶,而无需周折;参见,例如,khan 2006,clin.chim.acta 367(1-2):20-7;kalota 2004,cancer biology&therapy 3(1):4-12。
[0058]“反义分子”用于文中,指与p4hb转录物互补的治疗性反义rna或能够结合p4hb转录物的吗啉代寡核苷酸。包括吗啉代寡核苷酸应用的反义技术是本领域公知的,参见,例如kalota 2004,cancer biology&therapy 3(1):4-12;morcos 2007,biochem.biophys.res.commun 358(2):521-7。
[0059]
抑制性寡核苷酸用于文中,优选地,指能够结合靶标基因组dna特定的区域,从而实现基因沉默(所谓的三螺旋形成寡核苷酸)的小双链dna分子,或者指作为诱饵发挥作用,而阻隔靶标基因转录特异地需要的转录因子的寡核苷酸。这些技术已经成功地用于体内,而且在某种程度上在治疗中已经获得结果;也参见kalota 2004,cancer biology&therapy 3(1):4-12。
[0060]
术语“适体”用于文中,指特异地结合p4hb多肽的核酸适体。通过使用,例如通过指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,selex),可生成适体的库(pool)。能将选择步骤用于那些特异地结合p4hb多肽的适体。在特异地结合的适体中,阻断配体结合那些适体,或阻断相互作用结构域的那些适体,因而能被鉴定为本发明意义上适合的适体。用于生成适体的技术是本领域公知的,参见,例如tuerk 1990, science 249(4968):505-510;ellington 1990,nature 346(6287):818-822。
[0061]
在本发明意义上的“microrna”指单链rna分子,其与p4hb转录物中包含的核酸序列至少部分互补。microrna通常具有大约19至26个核苷酸长度。 microrna作为前体合成,即所谓的pri-microrna,所述pri-microrna具有发夹结构和形成发夹茎的两个互补的自互补区域。
[0062]
术语“小干扰rna(sirna)”指为双链rna剂的核酸分子,其与p4hb转录物的一部分互补,并能够碱基配对。sirna通过特异地指导宿主细胞中的酶而发挥作用,从而切割靶标rna。凭借sirna序列的特异性,以及其与rna靶标的同源性,sirna能够引起靶标rna链的切割,从而失活靶标rna分子。优选地,足以调节rnai的sirna包含如下核酸序列,其含有靶标基因反向重复片段和目标基因编码区域(或部分)。sirna的互补区域允许sirna足以与靶标rna杂交,从而调节rnai。在哺乳动物中,sirna是大约19-25个核苷酸的长度。
[0063]
优选地,根据本发明所述的食管鳞状细胞癌指哺乳动物中的食管鳞状细胞癌。
[0064]
更优选地,根据本发明其中所述的哺乳动物是人。
[0065]
另一方面,本发明涉及一种治疗或预防哺乳动物食管鳞状细胞癌恶病质肌肉萎缩的方法,包括向遭受所述癌症症状的患者给药治疗有效量的p4hb抑制剂。
[0066]
本发明涉及的检测方法包括免疫组织化学、western blot免疫印迹杂交、流式细胞仪检测、生长曲线及裸鼠皮下成瘤实验等。鉴于发明人已经找到和验证了基因p4hb在食管鳞状细胞癌中恶病质肌萎缩发生和发展中的作用,在今后科学研究及临床应用中,免疫组织化学、蛋白提取及western blot免疫印迹杂交三种技术运用的较为普通,这三种方法对于本领域的技术人员为常规操作。因此,该成果在科研和临床中容易被运用。
[0067]
本发明的具体实施方案中,利用了免疫组织化学方法检测p4hb在食管鳞状细胞癌患者组织中的表达情况。
[0068]
功能实验验证:提取食管鳞状细胞癌细胞系及永生化正常食管上皮细胞的全细胞蛋白,进行western blot免疫印迹杂交,比较食管鳞状细胞癌细胞系及永生化正常食管上
皮细胞中p4hb蛋白表达情况,根据western blot结果挑选合适细胞系分别高表达、抑制p4hb基因表达,通过细胞凋亡、生长曲线、裸鼠皮下成瘤实验研究p4hb基因在食管鳞状细胞癌恶病质肌萎缩发生发展中的作用。
[0069]
在下述实施例中,若非特意表明,所用的试剂均为分析纯,所用试剂均可从商业渠道获得。除非另外指明,本发明实施例中涉及的western blot等操作均按照“分子克隆实验指南(第三版)”(科学出版社,2002[美]j.萨姆布鲁克d.w 拉塞尔著,黄培堂等译)及厂商说明书进行,细胞培养、细胞传代、细胞复苏及冻存、细胞转染及免疫荧光测定等操作均按照“动物细胞培养
--
基本技术指南 (第四版)”(科学出版社,2000,[英]弗雷谢尼(r.i.)著,章静波等译)及厂商说明书进行操作。
[0070]
细胞、质粒、慢病毒、化合物:
[0071]
1.人源食管鳞癌细胞系yes2,kyse30,kyse70,kyse140,kyse150, kyse180,kyse410,kyse450,kyse510和colo680n细胞均为商业化细胞系,由日本京都大学的yutaka shimada教授馈赠,也可以到商业网站进行购买。
[0072]
2.ne2和ne3细胞系细胞均为商业化细胞系,由汕头大学李恩民教授提供,也可以到商业网站进行购买。
[0073]
3.c2c12细胞为小鼠成肌细胞,购买自中国医学科学院基础医学研究所细胞中心(国家实验细胞资源共享平台)。
[0074]
4:llc细胞(lewis肺癌细胞(lewis lung carcinoma))购买自中国科学院典型培养物保藏委员会细胞库。
[0075]
5.ags细胞为人源胃腺癌细胞,由河北医科大学第四医院科研中心馈赠,也可以到商业网站进行购买。
[0076]
6.aspc1细胞为人源胰腺癌细胞,由北京协和医院馈赠,也可以到商业网站进行购买。
[0077]
7.bxpc3细胞为人源胰腺癌细胞,由北京协和医院馈赠,也可以到商业网站进行购买。
[0078]
8.penter质粒购买自山东维真生物科技有限公司。
[0079]
9.penter-p4hb质粒购买自山东维真生物科技有限公司,产品编号:ch830493;为以penter为载体的p4hb基因真核表达质粒。
[0080]
10.稳转高表达p4hb慢病毒由发明人提供penter-p4hb质粒,由北京利科丽生物科技有限公司包装。
[0081]
11.稳转高表达p4hb对照组慢病毒由发明人提供penter质粒,由北京利科丽生物科技有限公司包装。
[0082]
12.sirna序列sirna-1和sirna-2根据p4hb的基因(编号:nm_000918) 由invitrogen公司设计序列并合成。
[0083]
13.稳转敲降p4hb慢病毒根据sirna-2序列由北京利科丽生物科技有限公司合成序列并包装。
[0084]
14.spf级balb/c裸鼠(nude mice),4周龄、雄性,购买自北京维通利华实验动物技术有限公司。
[0085]
15.小分子抑制剂ccf642购买自selleck公司。
[0086]
试剂:
[0087]
1.山羊二步法检测试剂盒(山羊增强聚合物法检测系统)购买自北京中杉金桥生物技术有限公司,货号pv-9003。
[0088]
2.人食管鳞癌组织芯片购买自上海芯超生物科技有限公司,该芯片上带有77对食管鳞状细胞癌组织和配对的癌组织(管鳞癌组织2cm处的组织,癌旁组织),通过蜡块包埋切片得到组织切片。
[0089]
3.抗原修复液购买自北京中杉金桥生物有限公司,货号:zli-9071。
[0090]
4.p4hb抗体(一抗)购买自proteintech公司,货号:11245-1-ap。
[0091]
5.β-actin抗体(一抗)购买自sigma-aldrich公司,货号:a5316。
[0092]
6.alix抗体购买自proteintech公司,货号:12422-1-ap。
[0093]
7.flot-1抗体购买自proteintech公司,货号:15571-1-ap。
[0094]
8.murf1抗体购买自proteintech公司,货号:55456-1-ap。
[0095]
9.western blot实验所用二抗购买自promega corporation公司,anti-mouse igg(h+l),hrp conjugate,货号:w4021;anti-rabbit igg(h+l),hrp conjugate,货号:w401b。
[0096]
10.bca蛋白浓度测定试剂盒购买自北京普利莱基因技术有限公司,货号 p1511
[0097]
11.完全培养基购买自北京细工生物科技有限公司,为10%fbs rpmi-1640 培养基,其中含10%胎牛血清(fbs),100u/ml penicillin(青霉素),100u/ml streptomycin(链霉素),5958mg/ml hepes,l-glutamine(谷氨酰胺),nahco3, phenol red(酚红)。
[0098]
12.无血清培养基,即完全培养基中不加血清;购买自北京细工生物科技有限公司,为rpmi-1640培养基,其中含100u/ml penicillin(青霉素),100u/ml streptomycin(链霉素),5958mg/ml hepes,l-glutamine(谷氨酰胺),nahco3, phenol red(酚红)。
[0099]
13.无外泌体血清培养基:胎牛血清(fbs)购买自北京细工生物科技有限公司。无外泌体血清处理方法:利用optima l-100xp ultracentrifuge离心机,将胎牛血清4℃10,0000g离心2小时,用0.22μm无菌滤器过滤上清,即得到无外泌体血清;加入至无血清培养基中即得到无外泌体血清。
[0100]
14.exoquick-tc试剂盒购买自system biosciences公司,货号: exotc50a-1。
[0101]
15.转染试剂neofect购买自北京码因科技有限公司。
[0102]
16.super ecl超敏发光液(中)购买自北京普利莱基因技术有限公司,货号p1030。
[0103]
17.转染试剂lipofectamine 2000reagent(lipo2000)购买自invitrogen公司。
[0104]
18.细胞凋亡试剂盒annexin v-fitc apoptosis detection kit购买自欣博盛生物科技有限公司。
[0105]
19.polybrene购买自上海吉凯基因化学技术有限公司,货号revg0001。
[0106]
20.顺铂注射液购买自hospira australia pty ltd。
[0107]
21.白蛋白购买自merk公司。
[0108]
22.stealth rnai
tm sirna negative controls购买自invitrogen公司。
[0109]
设备:
[0110][0111]
实施例1:检测蛋白p4hb在77对食管鳞状细胞癌组织和配对的癌旁组织的表达情况
[0112]
1.免疫组织化学实验方法检测p4hb在人食管鳞癌组织芯片中的表达
[0113]
免疫组织化学实验所用试剂盒为山羊二步法检测试剂盒(山羊增强聚合物法检测系统),其中的内源性过氧化物酶阻断剂用羊血清代替以达到更好的封闭效果,其余试剂均为试剂盒所带试剂,操作按试剂盒说明书进行。
[0114]
(1)将人食管鳞癌组织芯片65℃烤片过夜;
[0115]
(2)脱蜡:二甲苯15min,换新鲜的二甲苯15min;
[0116]
(3)水化:无水乙醇10min;换新鲜的无水乙醇10min;90%5min;80%5min;
[0117]
(4)70%5min;60%5min;50%5min;
[0118]
(5)pbs洗3min 3遍;
[0119]
(6)3%过氧化氢室温孵育20min;
[0120]
(7)pbs洗3min 3遍;
[0121]
(8)抗原修复液放进抗原修复盒中,微波炉空煮:中高火8min,待液体煮沸冒泡后,将人食管鳞癌组织芯片放入盛有抗原修复液的盒中,中低火煮 15min;放室温自然冷却;
[0122]
(9)pbs洗3min 3遍;
[0123]
(10)羊血清室温15min;
[0124]
(11)p4hb抗体(稀释比例1:20000)4℃过夜;
[0125]
(12)pbs洗3min 3遍;
[0126]
(13)将山羊二步法检测试剂盒中试剂i(增敏剂)室温20min,pbs洗3min 3遍;试剂盒中试剂ii(二抗)室温20min,pbs洗3min 3遍;
[0127]
(14)dab显色,水终止;
[0128]
(15)苏木素染5-10min,水洗;
[0129]
(16)盐酸乙醇分化5s,水洗;
[0130]
(17)氨水返蓝,10s水洗;
[0131]
(18)50%5min;60%5min;70%5min;80%5min;90%5min;无水乙醇脱水,二甲苯封片。
[0132]
2.数据收集及处理
[0133]
通过免疫组化实验检测了p4hb在77对人食管鳞癌组织样本及其配对的癌旁组织样本中的表达水平,根据染色强度和阳性率进行判读打分,分为p4hb 高表达组、p4hb中等表达组、p4hb低表达组,如图1a所示。然后,分别统计食管鳞癌组织样本和癌旁组织样本在三组中的分布数量并进行卡方检验,结果如图1b。
[0134]
从图1a和图1b可以看出,p4hb在食管鳞癌组织中的表达水平显著高于配对的癌旁
组织,统计学上具有显著差异(p<0.05),说明p4hb在人食管鳞癌组织中高表达。
[0135]
实施例2:p4hb在食管鳞状细胞癌细胞系和永生化正常食管上皮细胞的表达情况
[0136]
利用western blot免疫印迹杂交方法检测p4hb在10株食管鳞状细胞癌细胞系(yes2,kyse30,kyse70,kyse140,kyse150,kyse180,kyse410, kyse450,kyse510和colo680n)和2株永生化正常食管上皮细胞(ne2 和ne3)的表达情况。
[0137]
1.对12株细胞的各自总蛋白的提取
[0138]
(1)分别取上述细胞的生长状态良好的细胞,弃去培养基,用冰预冷的 1
×
pbs清洗两遍。
[0139]
(2)刮取细胞,3000rpm,4℃,离心5min,收集细胞沉淀。
[0140]
(3)在细胞沉淀中加入适量蛋白裂解液,冰上作用40min,每10min涡旋震荡一次。
[0141]
(4)12,000rpm,4℃,离心20min。
[0142]
(5)上清即为细胞总蛋白,放置于冰上待用或-80℃冰箱中保存备用,即为12株细胞各自的总蛋白。
[0143]
(6)蛋白质浓度的测定
[0144]
使用bca蛋白浓度测定试剂盒测定蛋白质浓度,按照bca蛋白浓度测定试剂盒说明书进行操作。
[0145]
(1)配制bca工作液:根据标准品和样品数量,按50体积试剂a,1体积试剂b配制适量bca工作液,充分混匀。
[0146]
(2)将蛋白标准品按0,3.125,6.25,12.5,25μl加到96孔板的蛋白标准品孔中,加去离子水补足到25μl;取2μl待测样品加入96孔板,加去离子水补足到25μl。
[0147]
(3)向待测样品孔和蛋白标准品孔中加入200μl bca工作液(即样品与工作液的体积比为1:20)混匀。
[0148]
(4)37℃温浴30min。
[0149]
(5)酶标仪570nm波长下测定吸光度。
[0150]
(6)制作标准曲线,从标准曲线中求出样品蛋白浓度。
[0151]
(7)加入与步骤(5)所得上清等体积的蛋白上样缓冲液(2
×
loading buffer,可根据“分子克隆实验指南(第三版)”配制),金属浴100℃或沸水浴煮样5min,使蛋白完全变性,冷却至室温后上样western blot电泳或者保存至-80℃冰箱中待用。
[0152]
3.western blot
[0153]
十二烷基硫酸钠-聚丙烯酰胺(sds-page)蛋白电泳
[0154]
(1)制胶:按蛋白分子量要求制备相应浓度的sds-page分离胶和5%的积层胶,待积层胶层凝固后,小心地拔出梳子,反复冲洗上样孔,将凝胶玻璃板固定于电泳装置上,加入1
×
tris-甘氨酸电泳缓冲液,加样孔用电泳缓冲液冲洗后上样。
[0155]
(2)上样:根据所测蛋白浓度,取步骤2(7)中所得每个细胞系的蛋白样品50μg上样。
[0156]
(3)电泳条件:80v,直至染料到达最下沿。
[0157]
恒流湿转
[0158]
(1)提前配制好转膜缓冲液并预冷。
[0159]
(2)裁下合适大小pvdf膜,在甲醇中激活,40s-1min。
[0160]
(3)取出page胶,去除积层胶,将分离胶放入转膜液中,按照“白板-海绵-滤纸-膜-胶-滤纸-海绵-黑板”注意不能有气泡,海绵板装好后,连接装置。黑对黑,红对白。
[0161]
(4)电泳条件:恒流0.35a,90min。
[0162]
蛋白免疫印迹
[0163]
(1)将pvdf膜放入封闭液(1
×
pbs+5%脱脂奶粉)中,室温封闭1h。
[0164]
(2)用封闭液按一定比例稀释一抗(检测p4hb表达水平使用一抗为p4hb 抗体;检测β-actin的表达水平使用一抗为β-actin抗体),装入杂交袋中,37℃孵育2h或4℃过夜。
[0165]
(3)用pbst室温漂洗3次,每次5-10min。
[0166]
(4)用封闭液按一定比例稀释二抗(一抗使用p4hb抗体(兔源)时,使用二抗为anti-rabbit igg(h+l),hrp conjugate;一抗使用β-actin抗体(鼠源) 时,使用二抗为anti-mouse igg(h+l),hrp conjugate),装入杂交袋中,室温孵育1h。
[0167]
(5)将super ecl超敏发光液(中)的a液和b液等量混合,滴在膜上,使之完全覆盖pvdf膜。室温作用1min。曝光。
[0168]
如图2所示,以β-actin的表达量(即条带颜色深浅)为标准,p4hb在yes2 细胞系的表达量(条带颜色最深)明显高于ne2和ne3及其他食管鳞癌细胞系,说明与2株永生化正常食管上皮细胞系ne2和ne3相比,p4hb在食管鳞癌细胞系yes2中表达上调。
[0169]
实施例3:p4hb在食管鳞状细胞癌细胞系及能够诱导恶病质的其他消化道肿瘤分泌的外泌体中的表达情况
[0170]
外泌体(exosome)是由细胞主动分泌的直径约为30-100nm的双层囊泡小体,外泌体中含有大量功能性蛋白质、mrna、mirna、lncrna、脂质等多种具有生物活性的物质,这些活性物质被运输到达受体细胞,通过与受体细胞的质膜融合,被受体细胞摄取,并与其进行信息交流,从而调控受体细胞的生理功能。
[0171]
本实施例中利用了western blot免疫印迹杂交方法检测p4hb在食管鳞状细胞癌细胞系及能够诱导恶病质的其他消化道肿瘤分泌的外泌体中的表达情况。
[0172]
提取外泌体
[0173]
(1)取完全培养基培养的生长状态良好的yes2、kyse30、kyse70、 kyse140、kyse150、colo680n、ags、aspc1、bxpc3和llc细胞,当生长至80%-90%时,1
×
pbs洗一遍,更换无血清的培养基,孵箱培养24-48h后收取细胞上清;
[0174]
(2)300g,离心10min,去除死细胞和细胞碎片,用0.22μm滤器过滤上清,通过超滤管将上清浓缩至1ml,转移至eppendorf管中;
[0175]
(3)根据exoquick-tc试剂盒说明书操作,按5:1的体积比加入试剂盒提取液,颠倒混匀后,4℃过夜;
[0176]
(4)1500g,离心30min;弃去上清,1500g,离心5min,;
[0177]
(5)沉淀即为提取到的外泌体。加入1
×
pbs或无外泌体血清培养基重悬,于-80℃冰箱待用。
[0178]
(6)提取外泌体蛋白(方法同实施例2.1提取细胞总蛋白)并进行western blot。
[0179]
外泌体为一种双层囊泡结构,而外泌体蛋白是外泌体结构中所包含的蛋白,提取外泌体蛋白用于检测外泌体中某种蛋白的表达水平。
[0180]
如图3所示,其中alix表示alix蛋白,该蛋白不但参与受体内吞以及细胞粘附和趋
化等细胞行为,还参与囊泡的形成和细胞内多囊泡的转运;flot-1表示flot-1蛋白,flot-1蛋白作为膜联蛋白,被广泛用作脂筏蛋白的分子标志物,参与细胞粘附和跨膜运输等信号通路。蛋白alix和flot-1为外泌体的特异性蛋白,用作外泌体的标志物,即以alix和flot-1的表达量(即条带颜色深浅)为标准。
[0181]
从图3可以看出,p4hb在食管鳞癌细胞系yes2及能够诱导恶病质的消化道肿瘤细胞系胃腺癌ags、胰腺癌bxpc3、肺腺癌llc均表达上调。
[0182]
从实施例3可以看出,p4hb在食管鳞癌细胞系yes2细胞及其分泌的外泌体中表达量高,而在kyse150细胞及其分泌的外泌体中表达量低。因此在后续实施例中选择kyse150细胞作为内源性相对低表达p4hb的食管鳞癌细胞系,在kyse150细胞中转染质粒以达到高表达p4hb的目的,而yes2作为内源性相对高表达p4hb的细胞系,则在yes2细胞中转染p4hb sirna以达到敲降 p4hb的目的。
[0183]
实施例4:上调p4hb表达的外泌体对肌肉细胞凋亡的影响
[0184]
将penter质粒(空对照)和penter-p4hb质粒采用脂质体转染方法分别采用脂质体转染方法分别将penter质粒和penter-p4hb质粒转染到 kyse150细胞中,得到转染penter质粒的对照组kyse150 control细胞和转染penter-p4hb质粒的kyse150 flag-p4hb细胞。脂质体转染使用转染试剂 neofect,操作方法,使用量按照转染试剂neofect的说明书进行。
[0185]
分别提取kyse150 control细胞和kyse150 flag-p4hb细胞的总蛋白和外泌体蛋白,进行western blot,结果如图4a所示,从图4a可以看出,在kyse150 flag-p4hb细胞中p4hb的表达量显著升高。然后采用实施例3的方法提取外泌体,然后提取外泌体蛋白,进行western blot,检测外泌体中相应蛋白p4hb, alix,flot-1结果如图4b所示,从图4b可以看出,在kyse150 flag-p4hb 细胞分泌的外泌体中p4hb的表达量显著升高。
[0186]
然后,计数2
×
106个c2c12成肌细胞于100mm培养皿中,12-15h后,1
×
pbs 洗一次,更换预先处理好的无外泌体血清培养基,将提取到的转染p4hb质粒组和空载质粒组的60μg外泌体分别加入到上述含有c2c12成肌细胞的100mm 培养皿中,24h后,胰蛋白酶消化,将经转染p4hb质粒组和空载质粒组的外泌体对应处理的c2c12细胞种于六孔板中,加入无外泌体血清培养基,放入孵箱中孵育12-15h后,加入35μm顺铂,孵箱孵育18-24h后,利用annexin v-fitc apoptosis detection kit进行流式细胞凋亡的检测。
[0187]
(1)将六孔板对应孔中的细胞上清收集到相应管中,1
×
pbs洗一次,胰蛋白酶消化,4℃,1000r,离心5min,弃上清,用1ml预冷的1
×
pbs洗细胞1 次,1000r离心5min;
[0188]
(2)加入195μl 1
×
binding buffer和5μl annexin v-fitc,轻轻混匀后,冰上孵育15-20min,再加入300μl 1
×
binding buffer;
[0189]
(3)加入5μl pi,轻轻混匀,流式细胞仪进行检测,加入kyse150 control exo外泌体的c2c12细胞的流式细胞结果如图5a所示,加入kyse150 flag-p4hb exo的c2c12细胞的流式细胞结果如图5b所示。
[0190]
将上述流式细胞结果所测出的凋亡率进行t-test进行统计,显示p<0.05为有统计学差异,结果如图5c所示。
[0191]
上述结果表明,上调p4hb表达的外泌体显著促进了顺铂诱导的肌肉细胞凋亡。
[0192]
实施例5:上调p4hb表达的外泌体对肌肉细胞生长的影响
[0193]
将penter-p4hb质粒和penter质粒分别用慢病毒包装得到稳转高表达 p4hb慢病毒lv-flag-p4hb和稳转高表达p4hb对照组慢病毒lv-control,然后分别感染kyse150细胞,具体步骤如下:
[0194]
1.孵箱中取出生长状态良好的kyse150细胞,正常胰酶消化,细胞计数,将细胞接种于12孔板中;
[0195]
2.待细胞密度达到50-60%左右时,弃去细胞上清,1
×
pbs洗1次,每孔加 900μl含终浓度为8μg/ml polybrene的完全培养基;
[0196]
3.使用含有8μg/ml polybrene的完全培养基10倍梯度稀释病毒(以滴度为 108tu/ml的病毒为例),具体操作步骤为:取一个12孔板,每孔含有900μl 培养基,第一孔加入100μl病毒原液,混匀后吸取100μl病毒混合液加至第二个孔(混匀时尽量不要产生气泡)。这样就得到了三个梯度的病毒:原液、10倍稀释、100倍稀释;
[0197]
4.各吸取100μl病毒稀释液到待感染细胞的12孔板的三个孔中,计算可知,三个孔的moi分别为100、10、1;
[0198]
5.将细胞放置于37℃孵箱培养过夜,感染16-24h后用新鲜的完全培养基换液;
[0199]
6.待细胞密度达到90%左右时,胰酶消化,将细胞接种到60mm培养皿中培养;
[0200]
7.待细胞密度达到90%左右时,胰酶消化,将细胞接种到100mm培养皿中培养;同时接种一个100mm培养皿正常未做处理的细胞,使得和接种的感染病毒组细胞数相同,以此作为阴性对照;
[0201]
8.待100mm培养皿中的细胞密度达到70%,均加入含有2μg/ml嘌呤霉素的培养基,筛选细胞;
[0202]
9.加入嘌呤霉素培养基24h后,阴性对照组细胞基本全部死亡,感染病毒组的细胞生长状态良好,收细胞,提rna和蛋白,做real-time pcr和western blot验证感染效率;
[0203]
10.通过上一步验证,细胞已成功感染病毒,感染效率较好;给细胞更换为含有0.5μg/ml嘌呤霉素的培养基,继续培养。
[0204]
采用上述慢病毒感染的方法,将稳转高表达p4hb慢病毒(lv-flag-p4hb 慢病毒)和稳转高表达p4hb对照组慢病毒(lv-control慢病毒)分别感染 kyse150细胞,构建稳定高表达p4hb的kyse150 lv-flag-p4hb细胞系以及对照kyse150 lv-control细胞系,收集细胞上清,提取外泌体,如图6a所示, kyse150 lv-flag-p4hb细胞系分泌的外泌体中p4hb表达量显著升高。
[0205]
然后,在c2c12成肌细胞中检测上调p4hb表达对细胞生长的影响。计数 1
×
106个c2c12成肌细胞于60mm培养皿中,12-15h后,1
×
pbs洗一次,更换预先处理好的无外泌体血清培养基,将提取到的稳定过表达p4hb组和对照组的30μg外泌体加入到60mm培养皿中,24h后,胰蛋白酶消化。细胞计数,分别计数800个细胞接种于96e-plate上,并将接种细胞的e-plate放入rtca-mp 仪器中进行培养,仪器将自动每15分钟计细胞数一次,最终获得细胞的生长曲线。该实验表明,如图6b所示,上调p4hb表达的外泌体显著抑制肌肉细胞的生长。
[0206]
实施例6:下调p4hb表达的外泌体对肌肉细胞凋亡的影响
[0207]
采用sirna瞬时转染方法将与p4hb的dna序列匹配的sirna序列 (sirna-1序列或sirna-2序列)转染到yes2细胞中,转染使用转染试剂 lipofectamine 2000reagent(lipo2000),按照该试剂说明书进行操作。
[0208]
所用的sirna序列根据p4hb基因mrna序列(genbank编号:nm_000918) 设计合成。该sirna序列为sirna-1序列和sirna-2序列,sirna-1序列为seq id no.1所示:5
’-
cagaggccaucgaugacauaccauu-3’;sirna-2序列为 seq id no.2所示:5
’-
gcuucaagggcaagauccuguucau-3’。
[0209]
具体地,在yes2细胞系中分别转染阴性对照sinc组(stealth rnai
tm sirna negative controls,invitrogen)、p4hb sirna序列sirna-1或sirna-2 后,利用western blot实验对转染p4hb sirna及sinc结果进行验证,如图7a 所示,转染了p4hb sirna-1(si-1组)或sirna-2(si-2组)后使得yes2细胞中p4hb的表达量显著降低;收集细胞上清,提取外泌体,如图7b,转染p4hb sirna组(转染p4hb si-1、si-2组)分泌的外泌体中p4hb表达量显著降低。
[0210]
然后,计数2
×
106个c2c12成肌细胞于100mm培养皿中,12-15h后,1
×
pbs 洗一次,更换预先处理好的无外泌体血清培养基,将提取到的转染p4hb si-1 和p4hb si-2和对照p4hb sinc组的60μg外泌体加入到含有c2c12成肌细胞的100mm培养皿中,24h后,胰蛋白酶消化细胞,将上述经对照p4hb sinc、 p4hb si-1和p4hb si-2的外泌体处理的c2c12细胞种于六孔板中,加入无外泌体血清培养基,放入孵箱中孵育12-15h后,加入35μm顺铂,孵箱孵育18-24h 后进行流式细胞凋亡的检测,结果如图8a至图8c所示。
[0211]
结果运用t-test进行统计,结果如图8d所示,可以看出p<0.05,具有统计学差异,表明下调p4hb的外泌体显著抑制了顺铂诱导的肌肉细胞凋亡。
[0212]
从上述实验可以看出,sirna序列可将p4hb的dna序列沉默而抑制p4hb 表达;下调p4hb表达的外泌体显著抑制了顺铂诱导的肌肉细胞凋亡。
[0213]
实施例7:下调p4hb表达的外泌体对肌肉细胞生长的影响
[0214]
稳转敲降p4hb慢病毒为将sirna-2序列(5
’-
gcuucaagggcaagauccuguucau-3’)交由北京利科丽生物科技有限公司合成序列并包装,制备成慢病毒溶液,用于慢病毒感染细胞操作,同时该公司提供shnc慢病毒作为阴性对照。
[0215]
在本实施例中,采用实施例5所示的慢病毒感染方法,将稳转敲降p4hb 慢病毒转染到yes2细胞系中,构建yes2 shp4hb细胞系,同时构建对照细胞系yes2 shnc细胞系。然后分别收集细胞上清,提取外泌体yes2-exo,如图 7a所示,可以看出yes2 shp4hb细胞分泌的外泌体中p4hb表达量显著降低。
[0216]
在c2c12成肌细胞中检测下调p4hb表达对细胞生长的影响。计数1
×
106个c2c12成肌细胞于60mm培养皿中,12-15h后,1
×
pbs洗一次,更换预先处理好的无外泌体血清培养基,将提取到的yes2 shp4hb细胞系和对照yes2 shnc细胞系分泌的30μg外泌体分别加入到已接种c2c12成肌细胞的60mm培养皿中,24h后,胰蛋白酶消化c2c12成肌细胞。细胞计数,分别计数800个 c2c12成肌细胞接种于96e-plate上,并将接种细胞的e-plate放入rtca-mp 仪器中进行培养,仪器将自动每15分钟计细胞数一次,最终获得细胞的生长曲线,如图7b所示,其中yes2 shnc exo表示由对照yes2 shnc细胞系分泌提取的外泌体处理的c2c12成肌细胞的生长曲线,yes2 shp4hb exo表示由yes2 shp4hb细胞系分泌提取的外泌体处理的c2c12成肌细胞的生长曲线。该实验表明,yes2 shp4hb细胞下调p4hb表达的外泌体显著促进肌肉细胞的生长,从而说明sirna的存在抑制p4hb基因的表达。
[0217]
实施例8:上调p4hb表达对裸鼠预后的影响
[0218]
裸鼠皮下成瘤实验:
[0219]
4周龄、雄性、spf级balb/c裸鼠(nude mice),分为2组,每组5只,一组接种kyse150 lv-control细胞,一组接种kyse150 lv-flag-p4hb细胞。饲养环境为spf级动物实验室,常规饲养。
[0220]
成瘤步骤如下:
[0221]
(1)正常培养实施例5慢病毒转染的稳转过表达p4hb的kyse150 lv-flag-p4hb细胞及对照细胞kyse150 lv-control至70%-80%密度,胰酶消化细胞;
[0222]
(2)将细胞悬液转移至无菌的离心管中,800rpm离心5min,1
×
pbs洗2 次,用适量pbs重悬细胞,细胞计数;
[0223]
(3)裸鼠右侧后背消毒后,皮下注射,kyse150 lv-flag-p4hb细胞组接种kyse150 lv-flag-p4hb细胞悬液,kyse150 lv-control组接种kyse150 lv-control细胞悬液,每只接种2
×
106个细胞。
[0224]
(4)接种细胞后,每周两次观察测量,记录裸鼠体重及肿瘤长短径(肿瘤体积计算公式如下:v=肿瘤长径
×
肿瘤短径
×
肿瘤短径/2),并随时记录裸鼠死亡时天数;
[0225]
(5)8周后给予安乐死处理,取皮下肿瘤、裸鼠腓肠肌,拍照,记录裸鼠去瘤重、腓肠肌重量、肿瘤体积。腓肠肌组织及肿瘤组织分别放于质量百分比为4%的中性多聚甲醛溶液固定过夜。
[0226]
利用graphpad prism 5软件中的kaplan-meier分析方法发现与kyse150 lv-control组相比,kyse150 lv-flag-p4hb组缩短了裸鼠的生存天数,如图 10所示,该结果具有统计学上显著差异,p<0.05,说明高表达p4hb后会缩短裸鼠的生存期。
[0227]
实施例9:上调p4hb表达对裸鼠去瘤重的影响
[0228]
利用graphpad prism 5软件统计,发现与kyse150 lv-control组相比, kyse150 lv-flag-p4hb组裸鼠的去瘤重降低,如图11所示,该结果具有统计学上显著差异(p<0.05),说明高表达p4hb,造成裸鼠体内肌肉蛋白降解,导致肌肉组织重量减轻,裸鼠剥离或者说去除肿瘤后的体重降低,符合恶病质的典型临床表现,说明高表达p4hb可以促进裸鼠产生恶病质表型。
[0229]
实施例10:上调p4hb表达对裸鼠腓肠肌重量的影响
[0230]
利用graphpad prism 5软件统计,发现与kyse150 lv-control组相比, kyse150 lv-flag-p4hb组裸鼠的腓肠肌重量降低,如图12所示,具有统计学上显著差异,p<0.05。说明高表达p4hb后裸鼠的腓肠肌重量降低。高表达p4hb 造成裸鼠体内肌肉蛋白降解,导致肌肉组织重量减轻,即腓肠肌重量降低,符合恶病质的典型临床表现,说明高表达p4hb可以促进裸鼠产生恶病质表型。
[0231]
实施例11:上调p4hb表达对裸鼠腓肠肌形态学的影响
[0232]
将固定在中性多聚甲醛溶液中的腓肠肌进行蜡块包埋,切片,并进行苏木精-伊红染色。根据染色结果,观察到kyse150 lv-flag-p4hb组裸鼠肌纤维出现了明显的萎缩现象。利用imagej软件对肌纤维横截面积进行定量,与 kyse150 lv-control组相比(图13a),kyse150 lv-flag-p4hb组(图13b) 的裸鼠肌纤维横截面积显著降低,具有统计学上显著差异,p<0.05,如图13c 所示。说明高表达p4hb造成裸鼠体内肌肉蛋白降解,最终导致肌纤维横截面积显著降低,符合恶病质的典型临床表现,说明高表达p4hb可以促进裸鼠产生恶病
质表型。
[0233]
实施例12:上调p4hb表达对裸鼠肌萎缩相关蛋白表达的影响
[0234]
murf1是肌萎缩过程中的关键标志蛋白。将留取的腓肠肌组织进行全组织蛋白的提取,并进行western blot免疫印迹杂交实验。以β-tubulin为标准,测得p4hb在kyse150 lv-flag-p4hb组表达显著上调,murf1在kyse150 lv-flag-p4hb组显著高表达,如图14所示,说明,高表达p4hb后裸鼠腓肠肌组织蛋白murf1表达增加,而murf1表达的增加造成了裸鼠的肌肉萎缩。
[0235]
综合实施例8-12的裸鼠皮下成瘤实验可以看出,表明高表达p4hb后裸鼠骨骼肌降解增加,肌萎缩现象明显,从而导致裸鼠恶病质出现。
[0236]
实施例13:p4hb小分子抑制剂ccf642对肌肉细胞凋亡的影响
[0237]
小分子抑制剂ccf642在novel protein disulfide isomerase inhibitor with anticancer activity in multiple myeloma.doi:10.1158/0008-5472.can-15-3099. 中报道,ccf642的靶点为蛋白质二硫键异构酶(protein disulfide isomerases) 家族,ccf642通过与蛋白p4hb结构的活性位点cghck motif共价结合从而抑制pdi的功能。而p4hb别名protein disulfide isomerase-associated 1 (pdia1),属于蛋白质二硫键异构酶(protein disulfide isomerases)家族的成员。因此ccf642可能可以对p4hb的功能起到抑制作用。
[0238]
小分子抑制剂ccf642相关化学性质如表1所示。
[0239]
表1小分子抑制剂ccf642相关化学性质
[0240][0241][0242]
结构式为:
[0243][0244]
计数2
×
105c2c12成肌细胞于六孔板中,待12-15h后细胞长至60%左右, 1
×
pbs洗一次,更换新的完全培养基,分别加入0,0.5μm,1μm,3μm,5μm 的p4hb的小分子抑制剂
ccf642与35μm顺铂处理18-24h后准备进行流式细胞凋亡的检测,如图15a至图15f所示。
[0245]
结果运用t-test进行统计。p<0.05为有统计学差异,如图15g所示。
[0246]
上述结果表明,p4hb小分子抑制剂ccf642显著抑制了顺铂诱导的肌肉细胞凋亡。
[0247]
实施例14:p4hb小分子抑制剂ccf642对裸鼠去瘤重的影响
[0248]
裸鼠皮下成瘤实验
[0249]
4周龄、雄性、spf级balb/c裸鼠(nude mice),30只。饲养环境为spf 级动物实验室,常规饲养。
[0250]
成瘤步骤如下:
[0251]
(1)正常培养食管鳞癌细胞系yes2,至70%-80%密度,胰酶消化细胞;
[0252]
(2)将细胞悬液转移至无菌的离心管中,800rpm离心5min,1
×
pbs洗2 次,用适量pbs重悬细胞,细胞计数;
[0253]
(3)裸鼠右侧后背消毒后,皮下注射yes2细胞悬液,每只3
×
106个细胞,共20只。
[0254]
(4)接种细胞后,每周两次观察测量,记录裸鼠体重及肿瘤长短径;
[0255]
(5)当肿瘤长至50mm3时,裸鼠被随机分成2组,每组10只。每周3次进行腹腔注射p4hb小分子抑制剂ccf642(10mg/kg)和顺铂(5mg/kg),对照组给予白蛋白(albumin)(10mg/kg)和顺铂(5mg/kg)注射。给药4周。
[0256]
给药4周后,给予安乐死处理,取皮下肿瘤、裸鼠腓肠肌,拍照,记录裸鼠去瘤重、腓肠肌重量、肿瘤体积。腓肠肌组织及肿瘤组织放于质量百分比浓度为4%的中性多聚甲醛溶液中固定过夜。
[0257]
利用graphpad prism 5软件统计,发现与顺铂+白蛋白(cisplatin+albumin) 组相比,顺铂+白蛋白-ccf642(cisplatin+albumin-ccf642)组裸鼠去瘤重降低缓慢,结果如图16所示,具有统计学上显著差异(p<0.05)。说明加入ccf642 处理后,抑制了裸鼠肌肉蛋白降解,缓解了肌肉组织重量减轻,抑制了裸鼠骨骼肌降解,抑制裸鼠去瘤重降低,裸鼠的恶病质表型得到了显著的改善。
[0258]
实施例15:p4hb小分子抑制剂ccf642对裸鼠腓肠肌形态的影响
[0259]
将固定在中性多聚甲醛溶液中的腓肠肌进行蜡块包埋,切片,并进行苏木精-伊红染色,如图17a和17b所示,根据染色结果,观察到顺铂+白蛋白-ccf642 组抑制了裸鼠肌纤维萎缩现象。利用imagej软件对肌纤维横截面积进行定量,顺铂+白蛋白-ccf642组的裸鼠肌纤维横截面积显著高于顺铂+白蛋白组,具有统计学上显著差异(p<0.05),如图17c所示。说明加入ccf642处理后,抑制了裸鼠肌肉蛋白降解,缓解了肌肉组织重量减轻,抑制裸鼠肌纤维横截面积降低,抑制了裸鼠骨骼肌降解,裸鼠的恶病质表型得到了显著的改善。
[0260]
实施例16:p4hb小分子抑制剂ccf642对裸鼠肌萎缩相关蛋白表达的影响
[0261]
将留取的腓肠肌组织进行全组织蛋白的提取,利用western blot实验,测得 murf1在顺铂+白蛋白-ccf642组表达显著低于顺铂+白蛋白组,如图16所示。说明ccf642处理,能够抑制murf1表达,即抑制了裸鼠骨骼肌降解,说明裸鼠的恶病质表型得到了显著的改善。
[0262]
综合上述实施例13-15的p4hb小分子抑制剂ccf642处理可以看出, ccf642能够在细胞水平上抑制裸鼠成肌细胞凋亡,体内水平上说明ccf642能抑制裸鼠骨骼肌降解,即能抑制裸鼠恶病质现象。
[0263]
从上述实施例中可以看出,本发明提供p4hb抑制剂作为用于制备治疗或预防肿瘤恶病质的药物中的用途。p4hb在人食管鳞癌组织中高表达;在能够诱导食管鳞癌恶病质表型的细胞系及其他能够诱导恶病质的细胞系胃腺癌、胰腺癌以及lewis肺腺癌分泌的外泌体中高表达;p4hb促进肌肉细胞凋亡和抑制肌肉细胞生长,即p4hb促进食管鳞癌恶病质骨骼肌降解表型;利用p4hb的核酸抑制剂p4hb sirna能够抑制肌肉细胞凋亡,促进肌肉细胞生长,即p4hb 的核酸抑制剂p4hb sirna抑制食管鳞癌恶病质骨骼肌降解表型;p4hb能缩短裸鼠生存时间,促进裸鼠骨骼肌降解即促进恶病质现象;p4hb小分子抑制剂 ccf642加药处理能够抑制肌肉细胞凋亡和抑制裸鼠骨骼肌降解即抑制恶病质现象。因此p4hb的小分子抑制剂ccf642有望作为未来治疗食管鳞癌恶病质骨骼肌降解的候选药物,p4hb是一个诱导肿瘤恶病质潜在的关键靶点。
[0264]
综上所述,本发明提供p4hb抑制剂作为用于制备治疗或预防肿瘤恶病质的药物中的用途。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1