枸杞糖肽用于制备缓解焦虑情绪的药物的用途的制作方法
1.本发明涉及枸杞糖肽功效研究领域,尤其涉及一种枸杞糖肽用于制备缓解焦虑情绪的药物的用途。
背景技术:
2.压力应激下的焦虑情绪是当代社会人们普遍存在的问题,且年龄跨度大,如果不在早期干预,那么长久的焦虑情绪可导致人体免疫力下降从而引发一系列疾病,甚至引起更严重的情绪性疾病,如抑郁症等。
3.现有的研究大多关注于缓解抑郁症,但是对早期压力应激下的焦虑反应关注较少。而人体服用抗焦虑、抗抑郁的药物通常具有比较强的副作用,如肠胃反应等,且大部分抗抑郁药物影响大脑中的血清素的正常调节,长期服用会影响与之有关的多种生理功能。
4.本研究提供一种温和、有效的对压力应激下的焦虑反应早期干预方式,可避免直接使用抗焦虑、抗抑郁相关的精神类药物,较少对个体的伤害。
技术实现要素:
5.有鉴于现有技术的上述缺陷,本发明提供枸杞糖肽在制备缓解焦虑情绪的药物中的应用。
6.枸杞糖肽在制备通过改善压力应激导致的mpfc神经元树突异常缓解焦虑情绪的药物中的应用。
7.枸杞糖肽在制备通过缓解局部炎症改善焦虑情绪的药物中的应用。
8.枸杞糖肽在制备通过调节相关基因的表达水平改善焦虑情绪的药物中的应用,其中所述相关基因包括但不限于nectin3,其dna序列为seq id no.1、cx3cr1,其dna序列为seqid no.2、per2,其dna序列为seq id no.3、bhlhe41,其dna序列为seq id no.4、acer2,其dna序列为seq id no.5、ii1r1,其dna序列为seq id no.6。
9.枸杞糖肽在制备通过缓解压力应激导致的小胶质细胞激活缓解焦虑情绪的药物中的应用。
10.枸杞糖肽在制备通过缓解压力应激导致的小胶质细胞形态改变缓解焦虑情绪的药物中的应用。
11.枸杞糖肽在制备通过调节糖皮质激素水平缓解焦虑情绪的药物中的应用。
12.枸杞糖肽在制备通过激活糖皮质激素受体相关通路调节所述糖皮质激素水平来缓解焦虑情绪的药物中的应用。
13.如上任一所述的应用,其中,枸杞糖肽的含量为3
–
15mg。
14.如上所述的应用,其中,枸杞糖肽的作用浓度为3-15mg/kg。
15.本发明与现有技术相比,本发明提供了温和、有效的对压力应激下的焦虑反应进行早期干预方式,填补了枸杞糖肽在用于制备缓解焦虑情绪的药物的用途方面的空白,充实了枸杞糖肽改善情感障碍的研究,
16.以下将结合附图对本发明的构思和产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
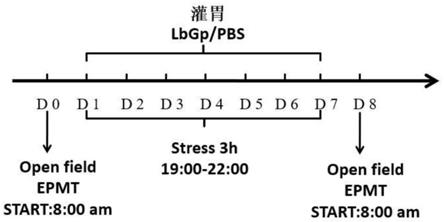
17.图1为根据本发明一个实施例的小鼠压力应激模型,其中d0-d8表示实验周期的第0天
ꢀ-
第8天,open field表示在实验的第0天和第8天对参加实验的小鼠进行旷场实验,epmt 表示在实验的第0天和第8天对参加实验的小鼠进行高架十字迷宫实验,start:8:00am表示旷场实验和高架十字迷宫实验的开始时间为上午8时,stress 3h 19:00-22:00表示在实验的第1天-第7天的每天19:00-22:00对参与实验的非对照组小鼠进行束缚3小时,灌胃lbgp/pbs 表示在实验的第1天-第7天的每天使用lbgp或pbs对参与实验的小鼠灌胃处理;
18.图2a为根据本发明一个实施例的各组实验小鼠在旷场实验中心区域停留时间比较,其中横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予5mg/kg lbgp的给药lbgp 1组小鼠、以及有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示各组实验小鼠在中心区域的停留时间;
19.图2b为根据本发明一个实施例的各组实验小鼠在高架十字迷宫实验中的开放臂上停留时间比较,其中横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予5mg/kg lbgp的给药lbgp 1组小鼠、以及有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示各组实验小鼠在开放臂上的停留时间;
20.图3为根据本发明一个实施例的各组实验小鼠的内侧前额叶皮质(mpfc)脑区椎体神经元形态图,其中图3a-c为根据本发明一个实施例的各组实验小鼠mpfc脑区锥体神经元形态的高尔基染色原始图片,图3d-f为根据本发明一个实施例的重构小鼠mpfc脑区代表性锥体神经元树突网络图;其中,图3a和图3d为未束缚并给予pbs的对照1组小鼠神经元形态图,图3b和图3e为有束缚并给予pbs的模型1组小鼠神经元形态图,图3c和图3f为有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠神经元形态图;
21.图4a为根据本发明一个实施例的各实验组小鼠的内侧前额叶皮质(mpfc)脑区锥体神经元树突分支长度统计;其中,横坐标表示半径,纵坐标表示树突长度,圆形(
○
) 表示没有束缚的对照1组小鼠,方形(
□
)表示有束缚并给予pbs的模型1组小鼠,三角形(
△
)表示有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠;
22.图4b为根据本发明一个实施例的各实验组小鼠mpfc脑区锥体神经元树突分支密度统计;其中,横坐标表示半径,纵坐标表示树突分支点数量,圆形(
○
)表示没有束缚的对照1组小鼠,方形(
□
)表示有束缚并给予pbs的模型1组小鼠,三角形(
△
)表示有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠;
23.图5a-c为根据本发明一个实施例的各组小鼠mpfc锥体神经元顶端树突在40倍油镜白光拍摄下的高尔基染色原始图;其中,图5a属于没有束缚且不给予pbs的对照1 组小鼠,图5b属于有束缚并给予pbs的模型1组小鼠,图5c属于有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠;
24.图5d为根据本发明一个实施例的各实验组小鼠mpfc脑区锥体神经元顶端树突棘密度统计图;其中,横坐标分别表示没有束缚且不给予pbs的对照1组小鼠、有束缚并给予
pbs的模型1组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠;纵坐标表示树突棘密度;
25.图6a为根据本发明一个实施例的枸杞糖肽抗焦虑因子筛选结果柱状图;其中,横坐标分别表示有束缚并给予lbgp的给药lbgp 1组小鼠与只束缚不给予lbgp的模型1组小鼠相比,基因转录显著上调或者下降的数目,例如上调数目为54个,下降数目为23个、有束缚并给予lbgp的给药lbgp 1组小鼠与未束缚且不给予lbgp的对照1组小鼠相比,基因转录显著上调或者下降的数目,例如上调数目为24个,下降数目为30个、以及只束缚不给予lbgp 的模型1组小鼠与未束缚且不给予lbgp的对照1组小鼠相比,基因转录显著上调或者下降的数目,例如上调数目为56个,下降数目为28个;纵坐标表示基因转录显著上调或者下降的数目;其中,红色(每对比较组的左侧柱形图)表示基因转录显著上调、绿色(每对比较组的右侧柱形图)表示基因转录显著下调;
26.图6b为根据本发明一个实施例的枸杞糖肽抗焦虑因子筛选结果文氏图;其中,红色圈 (左上区域)表示有束缚并给予lbgp的给药lbgp 1组小鼠与未束缚且不给予lbgp的对照1组小鼠相比,基因转录具有显著差异的基因数目、黄色圈(右上区域)表示有束缚并给予lbgp的给药lbgp 1组小鼠与只束缚不给予lbgp的模型1组小鼠相比,基因转录具有显著差异的基因数目、绿色圈(下方区域)表示只束缚不给予lbgp的模型1组小鼠与未束缚且不给予lbgp的对照1组小鼠相比,基因转录具有显著差异的基因数目;
27.图7a-f为根据本发明一个实施例的枸杞糖肽抗焦虑的关键性差异基因的表达水平柱状图;其中,横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1 组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示相关基因的表达水平;
28.图8a为根据本发明一个实施例的prl脑区和mo脑区在pfc脑区的分区示意图;
29.图8b为根据本发明一个实施例的各组小鼠prl脑区小胶质细胞免疫荧光染色结果图;其中横向分别表示ibal阳性细胞、dapi染色的所有细胞、以及两类细胞染色荧光叠加;纵向分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予lbgp的给药lbgp 1组小鼠;
30.图8c为根据本发明一个实施例的各组小鼠prl脑区小胶质细胞形态示意图(40倍油镜拍摄);其中横向分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、以及有束缚并给予lbgp的给药lbgp 1组小鼠;纵向分别表示ibal阳性细胞、以及ibal阳性细胞与dapi染色细胞荧光叠加;
31.图8d为根据本发明一个实施例的prl脑区小胶质细胞ibal阳性细胞数目;其中,横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示prl脑区小胶质阳性细胞ibal 的数量;
32.图8e为根据本发明一个实施例的各组小鼠mo脑区小胶质细胞免疫荧光染色结果图;其中横向分别表示ibal阳性细胞、dapi染色的所有细胞、以及两类细胞染色荧光叠加;纵向分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予lbgp的给药lbgp 1组小鼠;
33.图8f为根据本发明一个实施例的各组小鼠mo脑区小胶质细胞形态示意图(40倍油
镜拍摄);其中横向分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、以及有束缚并给予lbgp的给药lbgp 1组小鼠;纵向分别表示ibal阳性细胞、以及ibal阳性细胞与dapi染色细胞荧光叠加;
34.图8g为根据本发明一个实施例的mo脑区小胶质细胞ibal阳性细胞数目;其中,横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示prl脑区小胶质阳性细胞ibal 的数量;
35.图9a为根据本发明一个实施例的各实验组小鼠血清中糖皮质激素(cort)含量统计图;其中横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型 1组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示血清cort含量;
36.图9b为根据本发明一个实施例的各组小鼠mpfc中糖皮质激素(cort)表达水平统计图;其中横坐标分别表示无束缚并给予pbs的对照1组小鼠、有束缚并给予pbs的模型1组小鼠、有束缚并给予10mg/kg lbgp的给药lbgp 1组小鼠,纵坐标表示mpfc中cort 含量;
37.图10a为根据本发明一个实施例的各实验组小鼠在旷场实验中心区停留时间比较;其中横坐标分别表示无束缚并给予pbs和dmso的对照2组小鼠、有束缚并给予pbs和dmso 的模型2组小鼠、有束缚并给予10mg/kg lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予10mg/kg lbgp和ru486的给药ru486组小鼠,纵坐标表示各组实验小鼠在中心区域的停留时间;
38.图10b为根据本发明一个实施例的各实验组小鼠在高架十字实验开放臂探索时间比较;其中横坐标分别表示无束缚并给予pbs和dmso的对照2组小鼠、有束缚并给予pbs和 dmso的模型2组小鼠、有束缚并给予10mg/kg lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予10mg/kg lbgp和ru486的给药ru486组小鼠,纵坐标表示各组实验小鼠在开放臂上的停留时间;
39.图11a为根据本发明一个实施例的小鼠prl脑区小胶质细胞免疫荧光染色结果图;其中,横向分别表示ibal阳性细胞、以及ibal阳性细胞与dapi染色细胞荧光叠加,纵向分别表示有束缚并给予lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予lbgp和 ru486给药ru486组小鼠;
40.图11b为根据本发明一个实施例的prl脑区小胶质细胞ibal阳性细胞数目;其中,横坐标分别表示无束缚并给予pbs和dmso的对照2组小鼠、有束缚并给予pbs和dmso 的模型2组小鼠、有束缚并给予10mg/kg lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予10mg/kg lbgp和ru486的给药ru486组小鼠,纵坐标表示prl脑区小胶质阳性细胞 ibal的数量;
41.图11c为根据本发明一个实施例的小鼠mo脑区小胶质细胞免疫荧光染色结果图;其中,横向分别表示ibal阳性细胞、以及ibal阳性细胞与dapi染色细胞荧光叠加,纵向分别表示有束缚并给予lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予lbgp和 ru486给药ru486组小鼠;
42.图11d为根据本发明一个实施例的小鼠mo脑区小胶质细胞ibal阳性细胞数目;其中,横坐标分别表示无束缚并给予pbs和dmso的对照2组小鼠、有束缚并给予pbs和 dmso的模型2组小鼠、有束缚并给予10mg/kg lbgp和dmso的给药lbgp 2组小鼠、以及有束缚并给予
10mg/kg lbgp和ru486的给药ru486组小鼠,纵坐标表示prl脑区小胶质阳性细胞ibal的数量。
具体实施方式
43.以下介绍本发明的优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
44.在本发明中使用了很多术语,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、行为学、分子生物学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。为了更清楚一致地理解本发明,下面提供相关术语的定义和解释。
45.如本文所使用的术语“枸杞糖肽”、“lbgp”是指从枸杞多糖(lycium barbarumpolysaccharide,lbp)中进一步分离纯化得到具有较强免疫活性和抗衰老作用的糖缀合物,简称枸杞糖肽(lycium barbarum glycopeptides,lbgp)。其糖含量为70%,糖组成为 ara:gal:glc=2.5:1.0:1.0(摩尔比),并含有其他18种天然氨基酸。关于枸杞糖肽的制备、分离、提纯方法,可参见以下专利和专利申请内容:cn109608557a、cn110066313a、 cn110183511a、cn110840964a以及us20200030403a1。枸杞糖肽已知的主要功效有提高免疫力、抗肿瘤、保护心肌、治疗非脂肪性脂肪肝病等作用。本技术进一步发现枸杞糖肽可进一步缓解压力应激引起的焦虑情绪,可修正引压力应激引起的神经炎症。
46.如本文所使用的术语“下丘脑-垂体-肾上腺(hpa)轴”即the hypothalamic
–
pituitary
–
adrenal axis,hpa或者htpa axis,也被叫做边缘系统-下丘脑-垂体-肾上腺轴(lhpa轴),是一个直接作用和反馈互动的复杂集合,包括下丘脑(脑内的一个中空漏斗状区域),脑垂体 (下丘脑下部的一个豌豆状结构),以及肾上腺(肾脏上部的一个小圆椎状器官)。这三者之间的互动构成了hpa轴。hpa轴是神经内分泌系统的重要部分,参与控制应激的反应,并调节许多身体活动,如消化,免疫系统,心情和情绪,性行为,以及能量贮存和消耗。从最原始的有机体到人类,许多物种,都有hpa轴。它是一个协调腺体,激素和部分中脑(特别是参与介导一般适应综合征(gas)的中脑区域)相互作用的机制。
47.如本文所使用的术语“束缚”是指保证实验模式动物正常呼吸的前提下,使其承受负面压力的行为。是本发明的压力应激的造模方式。在一些实施例的,压力应激的造模方式包括但不限于给予小鼠恶劣的饲养条件、电击、打架、围困等。
48.如本文所使用的术语“无菌pbs”、“pbs”是指无菌的磷酸缓冲盐溶液(phosphate buffersaline),即pbs缓冲液。pbs缓冲液一般作为溶剂,起溶解保护试剂的作用。它是生物化学研究中使用最为广泛的一种缓冲液,主要成分为na2hpo4、kh2po4、nacl和kcl,由于 na2hpo4和kh2po4具有二级解离,使得pbs缓冲液的缓冲的ph值范围很广;而nacl和 kcl主要作用为增加盐离子浓度。本发明中使用无菌pbs缓冲液作为枸杞糖肽(lbgp)的缓冲液,配置lbgp溶液。同时,实验过程中将给予无菌pbs缓冲液的小鼠,作为给予小鼠lbgp 的pbs溶液小鼠的对照,获得更具说服力的实验结果。
49.如本文所使用的术语“mpfc”是指内侧前额叶皮质,其位于大脑前端,它是控制一系列情绪和行为的中枢。
50.如本文所使用的术语“prl”、“prl脑区”是指前边缘皮质,是前额叶皮质的一部分。
51.如本文所使用的术语“ru486”是指米非司酮,是糖皮质激素受体(gr)的拮抗剂,已经在难治愈的精神病性抑郁症临床试验中,显示出了一些积极效果。
52.如本文所使用的术语“灌胃”、“灌胃给药”是指一般给药前,实验动物禁食12~16h,之后将动物固定,使用灌胃器,将药液由动物口直接注入到动物胃中。
53.如本文所使用的术语“dmso”即二甲基亚砜,其广泛用作溶剂和反应试剂。同时,dmso 也是一种渗透性保护剂,能够降低细胞冰点,减少冰晶的形成,减轻自由基对细胞损害,改变生物膜对电解质、药物、毒物和代谢产物的通透性。本技术使用dmso作为ru486的溶剂。
54.如本文所使用的的术语“cort”是指,糖皮质激素,是机体内极为重要的一类调节分子,它对机体的发育、生长、代谢以及免疫功能等起着重要的调节作用,是机体应激反应最重要的调节激素,其可与靶细胞胞浆内的糖皮质激素受体(gr)结合而影响参与炎症的一些基因转录。
55.如本文所使用的术语“糖皮质激素受体”、“gr”是保守的核受体超家族中的一员,属于核转录因子,包括3个功能区,即氨基端的转录活化区、羧基端的糖皮质激素结合区和中间的dna结合区。在机体内gr主要存在于细胞胞浆中,被激活后通过与核内靶基因上的一段特定dna序列结合从而调控基因的转录,发挥各种生物效应。
56.如本文所使用的术语“小胶质细胞”是指是大脑中常驻的先天免疫细胞,其在脑部感染,损伤和神经退行性疾病相关的神经炎症中起重要作用。
57.如本文所使用的术语“小胶质细胞激活”是指小胶质细胞能够快速响应脑内微环境变化,当面对有害刺激时,小胶质细胞会发生形态、数量和功能的快速改变,即激活状态。
58.如本文所使用的术语“ibal”是指钙离子结合适配分子1。在巨噬细胞与小胶质细胞中表达,并在这些细胞活化过程中表达升高。用来指示激活的小胶质细胞。
59.nectin3:连接蛋白细胞粘附分子3,其dna序列为seq id no.1。
60.cx3cr1:c-x3-c趋化因子受体1,其dna序列为seq id no.2。可以诱导并招募单核细胞,巨噬细胞等参与炎症反应。
61.per2:周期昼夜节律调控器2,其dna序列为seq id no.3。一种调控昼夜节律的基因。
62.bhlhe41:基本螺旋-环-螺旋族成员e41,其dna序列为seq id no.4。一种调控昼夜节律的基因。
63.acer2:碱性神经酰胺酶2,其dna序列为seq id no.5。一种调控细胞凋亡和自噬的基因。
64.il1r1:白细胞介素受体,1型,其dna序列为seq id no.6。表达在t细胞和间质细胞中,与免疫反应相关。
65.elisa检测:酶联免疫吸附测定,指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体特异性结合进行免疫反应的定性和定量的检测方法。
66.如本文所使用的术语“旷场实验”、“open field test”又称敞箱实验,是评价实验动物在新异环境中自主行为、探究行为与紧张度的一种方法。以实验动物在新奇环境之中某些行为的发生频率和持续时间等,反应实验动物在陌生环境中的自主行为与探究行为。
旷场实验观察研究实验动物神经精神变化、进入开阔环境后的各种行为,例如动物对新开阔环境的恐惧而主要在周边区域活动,在中央区域活动较少,但动物的探究特性又促使其产生在中央区域活动的动机,也可观察由此而产生的焦虑心理。中枢兴奋药物可以明显增加自主的活动而减少探究行为,一定剂量的抗精神病药物可以减少探究行为而不影响自主活动。
67.如本文所使用的术语“高架十字迷宫实验”、“elevated plus maze”是指利用动物对新异环境的探究特性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态。高架十字迷宫具有一对开放臂和一对闭合臂,啮齿类动物由于嗜暗性会倾向于在闭合臂中活动,但出于好奇心和探究性又会在开放臂中活动。在面对新奇刺激时,动物同时产生探究的冲动与恐惧,这就造成了探究与回避的冲突行为,从而产生焦虑心理。而抗焦虑药物能明显增加进入开臂的次数与时间。高架十字迷宫被广泛应用于新药开发/筛选/评价、药理学、毒理学、预防医学、神经生物学、动物心理学及行为生物学等多个学科的科学-研究和计算机辅助教学等领域,是开展行为学研究尤其是焦虑抑郁研究的经典实验。
68.如本文所使用的术语“神经炎症反应”是指神经系统内发生的炎症反应。
69.如本文所使用的术语“树突棘”是指在神经元的树突上,树突膜突起形成的棘状突起,是神经元间形成突触的主要部位。树突棘在数量和形态上都具有易变性。在本发明中,进行束缚处理过的小鼠树突分支较少,相对于未处理过的小鼠其树突棘明显减少。
70.如本文所使用的术语“nectin3”、“cx3cr1”、“per2”、“bhlhe41”、“acer2”、“ii1r1”等是指几个具体的与枸杞糖肽抗焦虑相关的基因。表达在一些实施例中,其表达量与是否对小鼠进行试验处理有关。例如,进行束缚处理过的小鼠per2、bhlhe41、acer2、ii1r1等基因的表达水平均显著下降,但进行束缚处理的同时,对小鼠给予10mg/kg lbgp,该现象将有所缓解;进行束缚处理过的小鼠nectin3、cx3cr1等基因的表达水平均显著上调,但进行束缚处理的同时,对小鼠给予10mg/kg lbgp,该现象将有所缓解。
71.如本文中所使用的术语“免疫学检测”是指,利用抗原-抗体之间的特异性相互作用 /结合亲和力来进行的测定,其一般可用于检测特定抗原或者抗体在样品中的存在或水平。此类免疫学测定是本领域技术人员公知的,包括但不限于,elisa检测,elispot检测, western印迹,表面等离子共振法等。
72.如本文所使用的术语“rt-pcr”是本领域熟知的技术,其依靠逆转录酶将mrna逆转录形成cdna,然后通过标准pcr反应对所述cdna进行扩增。进行rt-pcr的操作方法和试剂盒是本领域熟知的,且可从商家购得。
73.慢性压力应激可能导致诸多精神疾病,其发病机制与下丘脑-垂体-肾上腺(hpa)轴应激系统异常相关。近年来有研究显示压力应激可导致中枢神经系统的炎症反应。本发明通过研究慢性压力应激影响内侧前额叶皮质(mpfc)的神经炎症反应,调节神经炎症达到缓解焦虑样行为的目的。
74.本发明使用的模式动物为4-5周雄性c57/bl小鼠,通过对小鼠束缚处理,使其在压力应激下产生焦虑情绪,验证枸杞糖肽在缓解这一过程中的作用机理。在一些实施例中,实验开始前,先通过旷场实验和高架十字迷宫实验,筛选出适合参与本发明实验的小鼠。例如,实验前将小鼠放入旷场中适应5分钟后,把待测小鼠轻柔地放入十字中心,并进行摄像和记录,以便得出小鼠在开放臂的停留时间等指标,并将指标异常小鼠剔除,以加强实验的
完整性。
75.以下将通过具体实施例对本发明进行进一步阐述。
76.实施例1、建立小鼠压力应激模型
77.选取4-5周雄性c57/bl小鼠数只,并将其分为对照组、模型组及给药组,每组不少于3 只。其中,对照组小鼠不束缚处理,并仅对其给予一种或者两种药物溶剂;模型组小鼠进行束缚处理,也仅对其给予一种或者两种药物溶剂;给药组小鼠进行束缚处理,且对其给一种或两种药物。此处所说的药物是指lbgp或者ru486,其中lbgp的溶剂为pbs,ru486的缓冲液为dmso。表1为根据本发明一个实施例的对小鼠分组及实验处理方式。
78.表1实验动物处理与分组
79.序号组别实验处理1对照1组灌胃无菌pbs,无束缚2模型1组灌胃无菌pbs,束缚3给药lbgp 1组灌胃lbgp,束缚4对照2组灌胃无菌pbs并注射dmso溶液,无束缚5模型2组灌胃无菌pbs并注射dmso溶液,束缚6给药lbgp 2组灌胃lbgp并注射dmso溶液,束缚7给药ru486组灌胃lbgp并注射ru486溶液,束缚
80.在本发明中,所有动物群居(3-4只/笼)在恒温恒湿黑白交替的环境中(12小时白光/12 小时黑暗),并为其提供充足的食物与洁净的水。
81.图1为根据本发明一个实施例的小鼠压力应激模型,如图1所示,模型共构建7天,在模型构建开始前一周,将要参与是呀你的小鼠在陌生环境中适应一周后,模型构建开始前一天早上8点开始,对要参与实验的小鼠进行旷场实验和高架十字迷宫实验,筛选出精神情绪状态正常的小鼠,将指标异常小鼠剔除,进行下一步实验。
82.从应激模型构建开始后,每天对小鼠使用无菌pbs/lbgp灌胃处理和/或进行注射 dmso/ru486,实验结束后获取lbgp对小鼠压力应激下焦虑情绪的影响相关实验数据。在一些实施例中,灌胃和注射开始时间为上午。例如,每天上午9点对小鼠进行无菌pbs/lbgp 灌胃处理,上午11点对小鼠注射dmso/ru486。
83.与此同时,应激模型构建开始后,在小鼠生理活跃期每晚19:00开始束缚应激。在一些实施例中,束缚应激过程中,将小鼠置于锥形透明裱花袋中,用橡皮筋捆绑小鼠尾部使其无法逃脱,无法转动身体。同时在裱花袋尖端开小口以供小鼠正常呼吸。束缚好的小鼠放回鼠笼,3小时后(22:00)停止束缚。该模型连续构建七天。
84.应激模型构建完成后,于次日清晨8点,再次进行旷场实验和高架十字迷宫实验,以及其他生理学、分子学、免疫学等实验,以探索lbgp对小鼠压力应激下焦虑情绪的影响。
85.本领域技术人员应当了解,所有实验均为所有对照组、模型组以及给药组小鼠参与。
86.实施例2、药物干预方式
87.本发明中,药物干预是指枸杞糖肽(lbgp)对小鼠在压力应激下焦虑情绪产生的干预。本发明通过研究lbgp对焦虑情绪的影响,以及ru486对lbgp的拮抗作用,获得lbgp对焦虑情绪干预的分子及细胞机制。其中,在一些实施例中,lbgp通过灌胃方式对小鼠给药,
ru486 通过腹腔注射方式对小鼠进行给药。
88.在一些实施例中,灌胃给药包括:固定小鼠,使其头、颈、身体呈一条直线。灌胃针头从小鼠嘴角进入,压住舌头,抵住上颚小心向前推进。参考图1所示,在一些实施例中,束缚当天(d0开始)早上9:00,将已灭菌的12号灌胃针与1.0ml注射器相组合,对小鼠进行灌胃处理。在一些实施例中,灌胃剂量为3-15mg/kg/只,体积约为0.2ml/只,其中给药组灌胃lbgp 溶液,对照组和模型组灌胃无菌pbs溶液,其为lbgp溶液的溶剂,持续灌胃七天。在一些实施例中,lbgp溶液的浓度约为3-15mg/kg。在一些实施例中,lbgp溶液的浓度约为3mg/kg、 5mg/kg、10mg/kg、12mk/kg以及15mk/kg。其中,当lbgp溶液的浓度约为10mg/kg时,对小鼠压力应激产生的焦虑情绪具有较好的缓解效果。
89.在一些实施例中,本技术中提到的mg/kg为对实验个体使用的药物含量,例如,对小鼠使用10mg/kg lbgp灌胃处理的含义是根据小鼠的重量,对1kg小鼠使用10mg枸杞糖肽灌胃处理,枸杞糖肽的使用量与实验个体的体重成正相关。例如,小鼠重量为2kg,对其进行10mg/kg lbgp 灌胃处理,则表示对本只小鼠灌胃20mg枸杞糖肽。
90.在一些实施例中,腹腔注射包括对小鼠腹腔注射给药。在一些实施例中,对小鼠灌胃结束2小时后,用1.0ml注射器对小鼠进行腹腔注射给药,注射前后均需用沾有碘酒的医用消毒棉棒对注射处进行擦拭,以防感染。其中,注射剂量为0.2ml/只。给药ru486组注射ru486 (20mg/kg),对照组、模型组和给药lbgp组均等量注射其溶剂dmso,持续注射七天。
91.实施例3、行为学检测
92.在一些实施例中,通过旷场实验和/或高架十字迷宫实验,检测压力应激模型构建前、后小鼠的精神状态。本实施例主要用于检测持续7天压力应激造模结束后小鼠的精神状态。
93.旷场实验:持续七天的压力应激造模结束后一天早8:00将小鼠放入旷场实验室适应1小时,保持实验环境安静,其温度湿度与小鼠饲养房间相同。然后将小鼠置于25cm x25 cm x30 cm 的透明箱底面中心位置,同时进行摄像和计时。摄像装备架设在反应箱正上方2m处,其视野可覆盖整个旷场内部。用enthvision xt 7.0软件对小鼠在旷场内移动的总距离与在中心区域停留时间进行记录,观察15分钟后停止摄像与记录。将小鼠取出并清洁反应箱内壁及底面,喷 75%酒精去除气味,以便下次实验继续使用。
94.高架十字迷宫实验:实验前将小鼠放入旷场中适应15分钟,然后把待测小鼠轻柔的放入十字中心,同时进行摄像和记录。每只鼠观察约5分钟,用enthvision xt 7.0软件记录小鼠在开放臂停留的时间。实验结束后将小鼠取出并用75%酒精清洁开放臂及闭合臂,以便下次实验继续使用。
95.图2a为根据本发明一个实施例的各组实验小鼠在旷场实验中心区域停留时间比较,如图2a所示,给药lbgp 1组小鼠均较只束缚不给予lbgp的模型1组小鼠在中心区域的停留时间长,其中给药约10mg/kg lbgp组小鼠在旷场实验中心区域停留时间与对照1组小鼠的停留时间基本相同。
96.图2b为根据本发明一个实施例的各组实验小鼠在高架十字迷宫实验中的开放臂上停留时间比较,如图2b所示,给药lbgp 1组小鼠均较只束缚不给予lbgp 1组小鼠在开放臂上探索的时间长。其中,给药约10mg/kg lbgp组小鼠在高架十字实验中开放臂上探索时间长于其他组小鼠在高架十字实验中开放臂上探索时间,与对照1组小鼠的停留探索时间
基本相同。
97.图2a和图2b中结果体现出了lbgp的给予可在一定程度上缓解由压力应激的焦虑情绪。
98.实施例4、枸杞糖肽改善压力应激导致的mpfc神经元树突异常
99.图3a-c为根据本发明一个实施例的各组小鼠mpfc中锥体神经元形态的高尔基染色原始图片,图3d-f为根据本发明一个实施例的重构小鼠mpfc脑区代表性锥体神经元树突网络图,从中看到,图3a、图3d对照1组小鼠mpfc脑区锥体神经元树突分支明显多于图3b、图3e中压力应激模型1组小鼠mpfc脑区锥体神经元树突分支,且图3a、图3d对照1组小鼠mpfc脑区锥体神经元树突长度延伸明显长于图3b和图3e中模型1组小鼠。但是,如图3c、图3f所示,对给药lbgp 1组小鼠给予10mg/kg lbgp后,模型1组小鼠mpfc脑区锥体神经元树突分支数与长度均有所改善,接近对照1组。
100.图4a为根据本发明一个实施例的各实验组小鼠mpfc脑区锥体神经元树突分支长度分布图。从图4a中看到,当半径约为62到,时,给药lbgp 1组小鼠的mpfc脑区锥体神经元树突分支长度最长;随着神经树突半径的进一步增大,模型1组小鼠的椎体神经元树突分支长度越来越短。从图上看,模型1组小鼠的mpfc脑区锥体神经元树突半径最长只达到115长只,给药 lbgp 1组小鼠的mpfc脑区锥体神经元树突半径最长可达到240长可左右,而对照组小鼠的 mpfc脑区锥体神经元树突半径最长可达到275长可左右。以上数据可明显看出,对压力应激模型下的小鼠给予10mg/kg lbgp,可在一定程度上缓解压力应激对小鼠神经元长度的伤害。
101.图4b为各实验组小鼠mpfc脑区锥体神经元树突分支密度分布图。从图4b中可看到,神经元树突半径为50半径时,各组小鼠的mpfc脑区锥体神经元树突分支密度达到最高,且给药 lbgp 1组小鼠的mpfc脑区锥体神经元树突分支密度高于其他两组。随着神经元树突半径的进一步增大,三组小鼠的mpfc脑区锥体神经元树突分支密度均呈现下降趋势,但是对照1组和给药lbgp 1组小鼠的mpfc脑区锥体神经元树突分支密度基本相同,均高于模型组小鼠的 mpfc脑区锥体神经元树突分支密度。以上数据结合图4b可明显看出,对压力应激模型下的小鼠给予10mg/kg lbgp,可在一定程度上缓解压力应激对小鼠神经元树突分支密度的伤害。
102.图5a-c为根据本发明一个实施例的各组小鼠mpfc锥体神经元顶端树突40倍油镜白光拍摄高尔基染色原始图。其中,从图5a中看到对照1组小鼠mpfc锥体神经元顶端树突,其树突棘形态清晰,密度均匀。从图5b中看到压力应激模型组小鼠mpfc锥体神经元顶端树突,其树突棘密度相比图5a较为稀疏。从图5c中看到给药lbgp 1组小鼠mpfc脑区锥体神经元顶端树突,其树突棘密度较高,且明显高于图5a和图5b中显示的树突棘密度。
103.图5d为根据本发明一个实施例的各实验组小鼠mpfc脑区锥体神经元顶端树突棘密度统计图。如图5d所示,模型1组小鼠脑区椎体神经元顶端树突棘密度低于对照1组,给药lbgp 1 组小鼠脑区椎体神经元顶端树突棘密度最高。从而可以得出结论:lbgp可改善压力应激小鼠 mpfc脑区椎体神经元形态异常。
104.实施例5、筛选枸杞糖肽抗焦虑的可能因子
105.方法:通过全转录组测序,检测各组小鼠mpfc脑组织样本中不同基因的表达的组间差别,筛选部分在压力应激模型组中上调(或下调),同时在枸杞糖肽给药组中下调(或上
调) 的基因,对初步筛选出的感兴趣基因进行荧光定量pcr(rt-pcr)验证。
106.图6a为根据本发明一个实施例的枸杞糖肽抗焦虑因子筛选结果柱状图。由图6a中不同组别比较中基因转录显著上调或下调的数目可知,给药lbgp 1组小鼠与模型1组相比较,基因转录显著上调的数目是54个,显著下调的数目是23个;给药lbgp 1组小鼠与对照1 组相比较,基因转录显著上调的数目是24个,显著下调的数目是30个;模型1组小鼠与对照1组小鼠相比较,基因转录显著上调的数目是56,显著下调的数目是28个。
107.图6b为根据本发明一个实施例的枸杞糖肽抗焦虑因子筛选结果文氏图。由图6b中所示的不同组别间有显著差异的基因数量可知,给药lbgp 1组小鼠与对照1组小鼠有显著差异的基因数目是54个,给药lbgp 1组小鼠与模型1组小鼠有显著差异的基因数目是77个,模型1组小鼠与对照1组有显著差异的基因的数目是84个。其中方框中显示有17个基因为既在给药lbgp 1组小鼠中表达水平显著变化,又在模型组小鼠中表达水平显著变化。
108.图7为根据本发明一个实施例的关键性差异基因的表达水平柱状图。如图7a-f所示,在对初步筛选出的感兴趣基因进行荧光定量pcr验证时发现,相关基因nectin3和相关基因 cx3cr1在模型1组小鼠中的表达显著上调,而在给药lbgp 1组小鼠中的表达水平接近对照1 组中的表达水平;相关基因per2、相关基因bhlhe41、相关基因acer2、相关基因ii1r1在模型1组小鼠中的表达显著下调,而在给药lbgp 1组小鼠中的表达水平接近对照1组中的表达水平。因此可知lbgp可以恢复相关基因表达,使相关基因表达水平接近正常水平,从而通过缓解局部炎症改善焦虑症状。
109.实施例6、枸杞糖肽缓解压力应激导致的小胶质细胞激活
110.本发明通过使用免疫荧光染色的方法,观察控制情绪的mpfc脑区小胶质细胞活性。
111.图8a为根据本发明一个实施例的prl脑区和mo脑区在pfc脑区的分区示意图;图8b为根据本发明一个实施例的各组小鼠prl脑区小胶质细胞免疫荧光染色结果图;图8c为根据本发明一个实施例的各组小鼠prl脑区小胶质细胞形态示意图(40倍油镜拍摄);图8d为根据本发明一个实施例的prl脑区小胶质细胞ibal阳性细胞数目。如图8b-d所示,模型1组小鼠的prl脑区小胶质细胞的数量相较于对照1组明显增多,且小胶质细胞形态发生改变。而给药lbgp 1组小鼠的prl脑区小胶质细胞的数量多于对照1组小鼠,但明显少于模型1组小鼠,且细胞形态相较于对照1组几乎没有明显变异。
112.图8e为根据本发明一个实施例的各组小鼠mo脑区小胶质细胞免疫荧光染色结果图;图8f为根据本发明一个实施例的各组小鼠mo脑区小胶质细胞形态示意图(40倍油镜拍摄);图8g为根据本发明一个实施例的mo脑区小胶质细胞ibal阳性细胞数目。如图8e-g所示,模型1组小鼠的mo脑区小胶质细胞的数量相较于对照1组明显增多,且小胶质细胞形态发生改变。而给药lbgp 1组小鼠的mo脑区小胶质细胞的数量维持与对照1组小鼠的数量接近,且细胞形态相较于对照1组无明显变异。
113.由此可得出结论:压力应激增加了小鼠mpfc脑区的小胶质细胞激活数目,而lbgp可缓解激活小胶质细胞激活,进一步提示了lbgp可能通过抑制神经炎症对抗焦虑的作用。不仅如此,压力应激还会导致小鼠小胶质细胞形态发生改变,进一步提示小胶质细胞激活,而 lbgp可在一定程度上缓解该现象。
114.实施例7、枸杞糖肽调节糖皮质激素水平,枸杞糖肽抗焦虑作用依赖于糖皮质激素
受体激活
115.方法1:elisa检测。
116.图9a为根据本发明一个实施例的各实验组小鼠血清中cort含量统计图。如图9a所示,给药lbgp 1组小鼠血清中cort含量高于模型1组的,与对照1组小鼠血清中cort含量接近。
117.图9b为根据本发明一个实施例的各组小鼠mpfc中cort表达水平统计。如图9b所示,模型1组小鼠cort表达水平低于对照1组小鼠,给药lbgp 1组小鼠mpfc中cort表达水平最高。
118.由此可得出结论:慢性压力应激抑制小鼠血清中cort表达,而lbgp可以维持体内正常 cort浓度。
119.方法2:行为学实验。为进一步探究了lbgp对压力应激相关焦虑的缓解作用是否同cort 有关,本技术对压力应激并给予lbgp的小鼠同步注射gr拮抗剂ru486,并进行焦虑行为学检测。
120.图10a为根据本发明一个实施例的各实验组小鼠在旷场实验中心区停留时间比较。如图 10a所示,给药lbgp 2组小鼠在旷场实验中心区停留时间长于仅束缚的模型2组小鼠,但同时给予lbgp和ru486并束缚的给药ru486组小鼠与压力应激模型2组小鼠相比,在中心区域停留时间没有显著性差异。
121.图10b为根据本发明一个实施例的各实验组小鼠在高架十字实验开放臂探索时间比较。如图10b所示,给予lbgp并束缚的给药lbgp 2组小鼠在高架十字实验开放臂探索时间要长于给予ru486并束缚的给药ru486组小鼠和模型2组小鼠在高架十字实验开放臂探索时间,同时给予lbgp和ru486并束缚的给药ru486组小鼠与压力应激模型2组小鼠相比,在开放臂探索停留时间接近。由此可得出结论:ru486逆转lbgp对压力应激产生焦虑样行为的缓解作用。
122.方法3:免疫荧光染色。对四组小鼠mpfc脑区进行免疫荧光染色,观察ru486对神经炎症和小胶质细胞的影响。
123.图11a为根据本发明一个实施例的小鼠prl脑区小胶质细胞免疫荧光染色结果图;图11b为根据本发明一个实施例的prl脑区小胶质细胞ibal阳性细胞数目。如图11a和图11b所示,给药lbgp 2组小鼠与对照2组小鼠的prl脑区小胶质细胞数目接近,给药 ru486组小鼠与模型2组小鼠的prl脑区小胶质细胞数目接近,均高于给药lbgp 2组小鼠和对照2组小鼠。
124.图11c为根据本发明一个实施例的小鼠mo脑区小胶质细胞免疫荧光染色结果图;图11d为根据本发明一个实施例的小鼠mo脑区小胶质细胞ibal阳性细胞数目。如图11c 和图11d所示,给药lbgp 2组小鼠较对照2组小鼠的mo脑区小胶质细胞数目略多,给药ru486组小鼠与模型2组小鼠的mo脑区小胶质细胞数目接近,均高于给药lbgp 2 组小鼠和对照2组小鼠。
125.由此可得结论,ru486阻断gr通路后,prl脑区ibal阳性细胞数目相较lbgp动物显著上升。压力应激小鼠中较低的cort水平与神经炎症和小胶质细胞激活有关,而lbgp则可能通过提升cort水平并激活下游信号通路,抑制了神经炎症的发生和小胶质细胞激活,从而缓解焦虑样行为。ru486导致小鼠mpfc小胶质细胞激活。
126.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1