灵芝孢子提取物在缓解化疗药物引起胃肠道副作用方面的应用的制作方法
本发明涉及灵芝孢子提取物在药物方面的应用,具体地说,涉及灵芝孢子提取物在缓解化疗药物引起胃肠道副作用方面的应用。
背景技术:
化疗是最常见的治疗癌症的方法,但往往伴随着不同程度的毒副作用。紫杉醇,是目前已知和公认的最有效的天然抗癌药物,在临床上已经广泛用于治疗乳腺癌、卵巢癌、肺癌、子宫癌等十几种癌症。然而,作为一种细胞毒类药物,紫杉醇在临床应用时,会产生严重的毒性和不良反应,包括骨髓瘤抑制、过敏反应、神经毒性、脱发等。其中,紫杉醇可导致明显的胃肠道反应(包括恶心、呕吐、腹泻及黏膜炎等),发生率高达60%,尤其好发于小肠,极大增加了患者痛苦,导致他们不愿接受化疗或者拒绝继续用药。
因此,寻找可有缓解化疗药物不良反应的物质已成为临床上亟待解决的问题。
灵芝是多孔菌科(polyproraceae)灵芝属(ganoderma)真菌的总称,在我国历史悠久,有着“仙草”美誉,被《本经》称为“上品”。灵芝孢子,是灵芝在生长成熟期从灵芝菌褶中弹射出来的极其微小的卵形生殖细胞。目前研究发现,灵芝孢子具有广泛的生物活性,如调节免疫、抗肿瘤、保肝解毒、调节血脂降低血糖等。
技术实现要素:
针对目前治疗肿瘤的药物,特别是紫杉醇存在胃肠道毒副作用大等问题,提供一种灵芝孢子提取物在减少抗肿瘤药物对机体胃肠道产生的毒副作用方面的应用。
第一方面,本发明提供灵芝孢子提取物在缓解化疗药物引起的胃肠道副作用方面的应用。
第二方面,本发明提供灵芝孢子提取物在制备缓解化疗药物引起的胃肠道副作用的药物的应用。
第三方面,本发明提供化疗药物与灵芝孢子提取物联用用于治疗肿瘤方面的应用,其中,灵芝孢子提取物用于缓解化疗药物引起的肠胃道副作用。
第四方面,本发明提供化疗药物与灵芝孢子提取物联用用于制备治疗肿瘤药物的应用,其中,灵芝孢子提取物用于缓解化疗药物引起的肠胃道副作用的辅助剂。
第五方面,本发明提供一种缓解缓解化疗药物引起的肠胃道副作用的制剂,所述制剂包括灵芝孢子提取物。
第六方面,本发明提供一种抗肿瘤的药物,包括化疗药物和灵芝孢子提取物及药学上可接受的载体,所述灵芝孢子提取物为缓解肠胃道副作用的辅助剂。
相对于现有的技术,本发明的有益效果如下:
本发明中的灵芝孢子提取物可用于制备辅助化疗药物、特殊医疗用途食品、功能性食品或保健品,特别适用于配合紫杉醇、顺铂等抗化疗药物在抗癌治疗中使用,可减少它们对机体产生的肠道毒副作用,为改善目前化疗药物胃肠道副作用提供了新的方向,具有良好的应用前景。
附图说明
发明人在对灵芝孢子提取物进行抗肿瘤试验的过程中,出乎意料地发现,当灵芝孢子提取物与化疗药物例如紫杉醇联用时,可以显著地降低化疗药物例如紫杉醇对于胃肠道的副作用,从而降低化疗药物的副作用并且提高病人的药物依从性。
第一方面,本发明提供灵芝孢子提取物在缓解化疗药物引起的胃肠道副作用方面的应用。
第二方面,本发明提供灵芝孢子提取物在制备缓解化疗药物引起的胃肠道副作用的药物的应用。
在上述应用中,缓解化疗药物引起的肠胃道副作用包括但不限于:缓解肠道损伤,改善肠道损伤,促进小肠组织修复,恢复肠道屏障完整性,逆转由紫杉醇产生的细胞毒作用,抑制细胞凋亡,抑制紫杉醇引起的微管聚集从而保护细胞,恢复紫杉醇引起的屏障功能损伤。
在上述应用中,化疗药物优选为紫杉醇。
在上述应用中,化疗药物与灵芝孢子提取物的重量比范围优选为1:4~1:64,例如紫杉醇与灵芝孢子提取物的重量比范围为1:8~1:32。
其中,本发明所述的灵芝孢子提取物包括现有方法提取得到的灵芝孢子提取物或者市售的灵芝孢子提取物。
例如,灵芝孢子提取物可以通过水提法或水提醇沉法中的一种获得。
第三方面,本发明提供化疗药物与灵芝孢子提取物联用用于治疗肿瘤方面的应用,其中,灵芝孢子提取物用于缓解化疗药物引起的肠胃道副作用。
第四方面,本发明提供化疗药物与灵芝孢子提取物联用用于制备治疗肿瘤药物的应用,其中,灵芝孢子提取物用于缓解化疗药物引起的肠胃道副作用的辅助剂。
在上述应用中,缓解化疗药物引起的肠胃道副作用包括但不限于:缓解肠道损伤,改善肠道损伤,促进小肠组织修复,恢复肠道屏障完整性,逆转由紫杉醇产生的细胞毒作用,抑制细胞凋亡,抑制紫杉醇引起的微管聚集从而保护细胞,恢复紫杉醇引起的屏障功能损伤。
在上述联用的应用中,化疗药物优选为紫杉醇。
在上述联用的应用中,化疗药物与灵芝孢子提取物的重量比范围优选为1:4~1:64,例如紫杉醇与灵芝孢子提取物的重量比范围为1:8~1:32。
其中,本发明所述的灵芝孢子提取物包括现有方法提取得到的灵芝孢子提取物或者市售的灵芝孢子提取物。
例如,灵芝孢子提取物可以通过水提法或水提醇沉法中的一种获得。
第五方面,本发明提供一种缓解缓解化疗药物引起的肠胃道副作用的制剂,所述制剂包括灵芝孢子提取物。
其中,所述制剂包括药物。
在上述制剂中,缓解化疗药物引起的肠胃道副作用包括但不限于:缓解肠道损伤,改善肠道损伤,促进小肠组织修复,恢复肠道屏障完整性,逆转由紫杉醇产生的细胞毒作用,抑制细胞凋亡,抑制紫杉醇引起的微管聚集从而保护细胞,恢复紫杉醇引起的屏障功能损伤。
在上述制剂中,化疗药物优选为紫杉醇。
在上述制剂中,化疗药物与灵芝孢子提取物的重量比范围优选为1:4~1:64,例如紫杉醇与灵芝孢子提取物的重量比范围为1:8~1:32。
其中,本发明所述的灵芝孢子提取物包括现有方法提取得到的灵芝孢子提取物或者市售的灵芝孢子提取物。
例如,灵芝孢子提取物可以通过水提法或水提醇沉法中的一种获得。
第六方面,本发明提供一种抗肿瘤的药物,包括化疗药物和灵芝孢子提取物及药学上可接受的载体,所述灵芝孢子提取物为缓解肠胃道副作用的辅助剂。
在上述抗肿瘤药物中,缓解化疗药物引起的肠胃道副作用包括但不限于:缓解肠道损伤,改善肠道损伤,促进小肠组织修复,恢复肠道屏障完整性,逆转由紫杉醇产生的细胞毒作用,抑制细胞凋亡,抑制紫杉醇引起的微管聚集从而保护细胞,恢复紫杉醇引起的屏障功能损伤。
在上述药物中,化疗药物优选为紫杉醇。
在上述药物中,化疗药物与灵芝孢子提取物的重量比范围优选为1:4~1:64,例如紫杉醇与灵芝孢子提取物的重量比范围为1:8~1:32。
在上述重量比范围内,化疗药物与灵芝孢子提取物的联合既可以实现极佳的抗肿瘤治疗效果,又可以显著实现缓解化疗药物引起的胃肠道副作用。
其中,本发明所述的灵芝孢子提取物包括现有方法提取得到的灵芝孢子提取物或者市售的灵芝孢子提取物。
例如,灵芝孢子提取物可以通过水提法或水提醇沉法中的一种获得。
本发明所述的化疗药物是一种治疗肿瘤的药物。化疗药物可杀灭肿瘤细胞,通过作用在肿瘤细胞生长繁殖的不同环节上,抑制或杀死肿瘤细胞。化疗药物治疗是目前治疗肿瘤的主要手段之一。
本发明提供一个灵芝孢子提取物的水提法的优选实施例,灵芝孢子提取物的水提法包括:以10~15倍重量水为溶剂,加热提取1~3h,过滤,浓缩,即为灵芝孢子提取物
本发明提供一个灵芝孢子的水提醇沉法的优选实施例,灵芝孢子的水提醇沉法包括:以10~15倍重量水为溶剂,加热提取1~3h,过滤,浓缩;所得浓缩液,加入无水乙醇使其的体积分数为70~90%,静置过夜,所得沉淀加水溶解,重复进行无水乙醇沉淀2~4次,最终沉淀加适量水溶解,透析,截取3~120kda分子量的成分,浓缩至干膏,即为灵芝孢子提取物。
本发明中所述的缓解化疗药物引起的肠胃道副作用包括但不限于:缓解肠道损伤,改善肠道损伤,促进小肠组织修复,恢复肠道屏障完整性,逆转由紫杉醇产生的细胞毒作用,抑制细胞凋亡,抑制紫杉醇引起的微管聚集从而保护细胞,恢复紫杉醇引起的屏障功能损伤。
本发明在接受紫杉醇给药的乳腺癌荷瘤动物上观察了灵芝孢子提取物的作用,以体重变化、结肠组织结构变化、结肠组织增殖/凋亡情况等为观察指标;同时在接受紫杉醇刺激的大鼠结肠上皮细胞模型中进一步观察灵芝孢子提取物的作用。结果表明,灵芝孢子提取物联合紫杉醇,可逆转紫杉醇引起的体重下降,并减轻紫杉醇诱导的小肠粘膜损伤,恢复结肠的自我更新能力;进一步,结果表明灵芝孢子提取物可逆转小肠上皮细胞中紫杉醇的微管蛋白聚合作用,抑制小肠上皮细胞凋亡,从而缓解紫杉醇引起的胃肠道毒副作用。
如本文所用,术语“药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。如本文所用,术语“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
如本文所用,术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在《雷明顿药物科学》(remington’spharmaceuticalsciences,mackpub.co.,n.j.1991)中可找到关于药学上可接受的赋形剂的充分讨论。
本发明的药物可含有液体,如水、盐水、甘油和乙醇等载剂。另外,这些载体中还可能存在辅助性的物质,如填充剂、崩解剂、润滑剂、助流剂、泡腾剂、润湿剂或乳化剂、矫味剂、ph缓冲物质等。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
应理解,所用活性物质的有效剂量可随待施用或治疗的对象的情况而变化。具体情况根据对象的个体情况(例如对象体重、年龄、身体状况、所需达到的效果)来决定,这在熟练专业人员(如医师)可以判断的范围内。
本文所述的药物可以为固态(如颗粒剂、片剂、冻干粉、栓剂、胶囊、舌下含片)或液态(如口服液)或其它合适的形状。给予途径可采用本领域常规的方式,例如口服、胃肠外(如静脉内、动脉内、腹膜内、肌肉内、真皮内或皮下给药)、皮下、腹膜内、肺内、鼻内、瘤内、局部给予。
下面结合附图和具体实施方式,对本发明灵芝孢子提取物在减轻化疗药物引起的小肠损伤方面的应用以及有益效果进行详细说明。
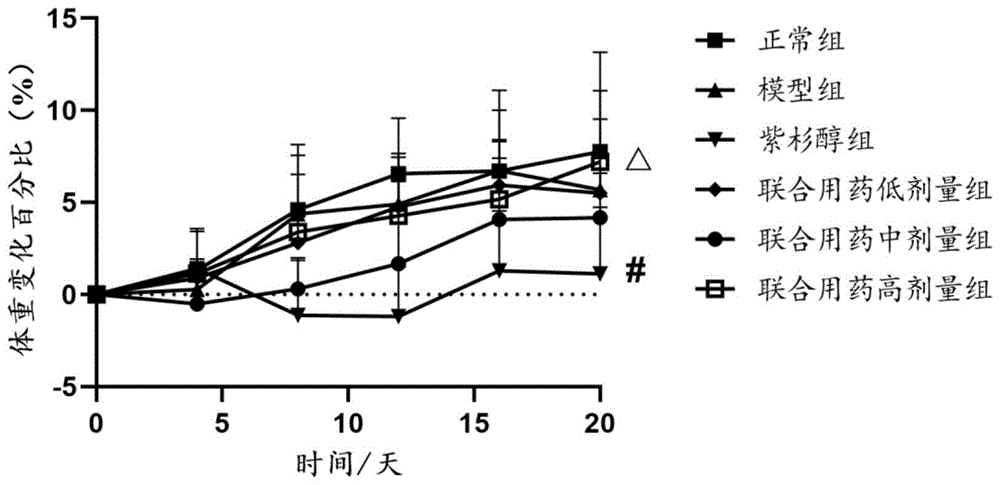
图1是本发明试验例1各组动物体重变化百分比比较图。
图2是本发明试验例1各组动物小肠he染色比较图。
图3是本发明试验例1各组动物小肠增殖水平比较图。
图4是本发明试验例1各组动物小肠凋亡水平比较图。
图5是本发明试验例1各组动物血清lps测定比较图。
图6是本发明试验例1各组动物小肠组织zo-1蛋白表达水平。
图7是本发明试验例1各组动物小肠组织e-cadherin蛋白表达水平。
图8是本发明试验例1各组动物小肠组织β-catenin蛋白表达水平。
图9是本发明试验例1各组动物小肠组织occludin蛋白表达水平。
图10是本发明试验例1各组动物小肠组织zo-1的mrna表达水平。
图11是本发明试验例1各组动物小肠组织e-cadherin的mrna表达水平。
图12是本发明试验例1各组动物小肠组织β-catenin的mrna表达水平。
图13是本发明试验例1各组动物小肠组织occludin的mrna表达水平。
图14是本发明试验例2灵芝孢子提取物对细胞活力影响结果。
图15是本发明试验例2紫杉醇对细胞活力影响结果。
图16是本发明试验例2灵芝孢子提取物联合紫杉醇对细胞活力影响结果。
图17是本发明试验例2各组细胞形态变化图。
图18是本发明试验例2各组细胞总凋亡计数比例结果。
图19是本发明试验例2各组细胞晚期凋亡计数比例结果。
图20是本发明试验例2各组细胞α-tubuin蛋白荧光表达比较图。
图21是本发明试验例2各组细胞中非聚合部分与聚合部分α-tubuin的比例结果。
图22是本发明试验例2各组细胞zo-1蛋白表达水平。
图23是本发明试验例2各组细胞e-cadherin蛋白表达水平。
图24是本发明试验例2各组细胞β-catenin蛋白表达水平。
图25是本发明试验例2各组细胞occludin蛋白表达水平。
具体实施方式
为了使本发明的目的、技术方案和有益技术效果更加清晰,以下结合实施例,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的实施例仅仅是为了解释本发明,并非为了限定本发明,实施例的参数、比例等可因地制宜做出选择而对结果并无实质性影响。
除非特别说明,本发明实施例采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
试验例1灵芝孢子提取物对紫杉醇引起的乳腺癌荷瘤小鼠小肠粘膜损伤的改善作用
1、材料与方法
(1)灵芝孢子提取物的制备
本实施例中所用的灵芝孢子提取物是采用申请号为cn201710638998.1发明专利的实施例1所述方法获得,但本发明中的灵芝孢子提取物并不限于此。
(2)造模与给药
取balb/c小鼠,雌性,6~8周龄。适应性饲养3~7天后,按体重随机分为正常组(10只)和荷瘤组(50只)。荷瘤组接种4t1乳腺癌细胞(1×105个/只),建立小鼠乳腺癌模型。造模24h后各组按表1给药21天,连续21天,正常组和模型组给予等体积的生理盐水。
表1
(3)取材与检测
实验过程中,每3天记录一次体重。末次给药后24h,脱臼处死各组动物,从眼眶静脉丛采集静脉血,部分置于洁净ep管中,静置后分离得到血清,用elisa试剂盒测定脂多糖(lipopolysaccharides,lps)含量。
同时剖取小肠约8cm(回肠结上端1cm处),部分组织进行苏木精-伊红染色(hematoxylin-eosinstaining,he)观察组织变化,并进行免疫组化实验(immunocytochemistry,ihc)观察小肠细胞增殖能力,原位末端脱氧核苷酸转移酶介导的dutp缺口末端标记实验(tdt-mediateddutpnick-endlabeling,tunel)观察小肠细胞凋亡水平;另取部分组织进行免疫印迹实验(westernblot,wb)检测小肠上皮连接蛋白表达水平,包括紧密连接蛋白1(zo-1)、钙黏蛋白e(e-cadherin)、β连环蛋白(β-catenin)、闭合蛋白(occludin)表达水平;剩下部分组织进行实时荧光定量聚合酶链式反应(real-timequantitativepolymerasechainreaction,rt-qpcr)检测上述小肠上皮连接蛋白所对应基因表达水平。其中与正常组比较,“*”“**”分别表示p<0.05,p<0.01;与模型组比较,“#”“##”分别表示p<0.05,p<0.01;与紫杉醇组比较,“△”“△△”分别表示p<0.05,p<0.01。
2、结果
如图1、图2所示,给药21天后,与正常组和模型组相比,紫杉醇组小鼠体重明显下降,小肠结构发生改变,主要集中在侧肌层疏松,肠绒毛明显缩短,而与紫杉醇组相比,联合用药组小鼠体重均有明显上升趋势,且小肠绒毛明显增加,间距明显缩短,结构得到恢复。说明灵芝孢子提取物能缓解由紫杉醇引起的肠道损伤症状。
ihc和tunel检测结果表明(图3、图4),与正常组和模型组相比,紫杉醇组小肠组织中pcna表达水平明显降低,细胞凋亡水平明显升高,而与紫杉醇组相比,联合用药组pcna表达水平明显上升而细胞凋亡水平明显下降。说明灵芝孢子提取物可促进小肠细胞增殖并抑制凋亡,对肠道损伤有明显改善作用。
elisa检测结果(图5)、wb分析结果(图6~9)以及rt-qpcr检测结果(图10~13)表明与正常组和模型组相比,紫杉醇组小鼠血清中lps含量明显上升,组织中小肠上皮连接蛋白(zo-1、e-cadherin、β-catenin、occludin)及其所对应基因表达水平均明显降低,而与紫杉醇组相比,联合用药组血清lps含量明显降低且小肠上皮连接蛋白及其所对应基因表达水平均明显上升。上述结果说明灵芝孢子提取物可缓解由紫杉醇引起的小肠损伤,促进小肠组织修复,恢复肠道屏障完整性。
试验例2灵芝孢子提取物对紫杉醇引起的大鼠小肠上皮细胞损伤的改善作用
1、材料与方法
(1)灵芝孢子提取物的制备
本实施例中所用的灵芝孢子提取物是采用申请号为cn201710638998.1发明专利所述方法获得,但本发明中的灵芝孢子提取物并不限于此。
(2)紫杉醇与灵芝孢子提取物分别对iec-6细胞活力的影响
将大鼠小肠上皮细胞(iec-6)培养于dmem完全培养基中(含1%青霉素-链霉素及10%胎牛血清),于37℃恒温、5%co2饱和湿度的无菌培养箱中培养。取生长对数时期的细胞,用磷酸缓冲盐清洗两遍,加入适量胰酶消化细胞,收集细胞,离心,加入适量上述培养基重悬,调整细胞浓度为1×105个/ml,然后接种于两块96孔板中。过夜培养后,加入紫杉醇溶液于其中一块孔板中,使其终浓度为0~245μm;加入灵芝孢子提取物溶液于另一块孔板中,使其终浓度为0~400μg/ml。培养24h后,于每孔中加入20μl噻唑蓝溶液(mtt),继续培养4h后,于酶标仪570nm处检测光密度od值,并计算各自ic50值与细胞活力百分比。
(3)灵芝孢子提取物对紫杉醇干预的iec-6细胞活力的影响
取生长对数时期的iec-6细胞,调整细胞浓度为1×105个/ml,接种于96孔板中。过夜培养后,除空白组外,设置9个给药组,每组加入同样浓度的紫杉醇注射液(4μm),再加入浓度梯度的灵芝孢子提取物溶液,使其终浓度为0~400μg/ml。培养24h后,于每孔中加入20μlmtt溶液,继续培养4h后,于酶标仪570nm处检测光密度od值,并计算细胞活力百分比。
(4)显微观察细胞形态及流式细胞术(flowcytometryanalysis,fcm)分析细胞凋亡水平
取生长对数时期的iec-6细胞,调整细胞浓度为1×105个/ml,接种于两块6孔板中。过夜培养后,按表2所示,设置5组。培养24h后,其中一块板于显微镜下观察细胞形态,另一块板收集细胞,按照细胞凋亡试剂盒操作说明,于流式细胞仪中分析细胞凋亡水平。
表2
(5)免疫荧光技术(immunofluorescence,if)与免疫印迹法(westernblot,wb)检测细胞微管蛋白表达水平
取生长对数时期的iec-6细胞,调整细胞浓度为1×105个/ml,接种于6孔板和24孔板中。过夜培养后,按表2所示,设置5组。培养24h后,收集24孔板中细胞,使用if技术观察各组细胞中微管蛋白(α-tubulin)表达水平;收集6孔板细胞,使用wb技术检测非聚合部分细胞α-tubulin表达水平与聚合部分细胞α-tubulin表达水平,并计算其比值。
(6)免疫印迹法(westernblot,wb)检测细胞连接蛋白表达水平
取生长对数时期的iec-6细胞,调整细胞浓度为1×105个/ml,接种于6孔板中。过夜培养后,按表2所示,设置5组。培养24h后,收集6孔板细胞,使用wb技术测定检测连接蛋白(zo-1、e-cadherin、β-catenin、occludin)表达水平。其中与空白对照组比较,“*”“**”分别表示p<0.05,p<0.01;与紫杉醇组比较,“#”“##”分别表示p<0.05,p<0.01。
2、结果
如图14、图15所示,给药24h后,1~256μm的紫杉醇对iec-6细胞具有明显的细胞毒性,而1.56~400μg/ml的灵芝孢子提取物对iec-6细胞无明显毒作用,且较高浓度的提取物(>100μg/ml)能提高iec-6细胞活力。如图16所示,将4μm紫杉醇与1.56~400μg/ml的灵芝孢子提取物共同作用于细胞后,100μg/ml,200μg/ml,400μg/ml浓度的提取物可提升由紫杉醇引起的细胞活力下降。说明灵芝孢子提取物可一定程度逆转由紫杉醇产生的细胞毒作用。
细胞形态观察(图17)与fcm(图18、图19)检测结果表明,与正常组相比,紫杉醇组细胞形态明显膨大,紧密连接消失,细胞凋亡水平显著上升,而与紫杉醇组相比,紫杉醇+高剂量组细胞形态有所缩小,出现紧密连接,细胞凋亡水平明显下降。说明灵芝孢子提取物能通过抑制细胞凋亡来改善紫杉醇引起的细胞死亡。
if观察(图20)与wb(图21)检测结果表明,与正常组相比,紫杉醇组细胞核破裂,出现不规则的微管聚合,非聚合部分细胞α-tubulin表达与聚合部分细胞α-tubulin表达比例明显降低,而与紫杉醇组相比,紫杉醇+高剂量组细胞核完整,微管排列规则有序,聚集减少,非聚合部分细胞α-tubulin表达与聚合部分细胞α-tubulin表达比例上升。说明灵芝孢子提取物能抑制紫杉醇引起的微管聚集,对细胞产生保护作用。
wb(图22~25)检测结果进一步表明,与正常组相比,紫杉醇组细胞连接蛋白(zo-1、e-cadherin、β-catenin、occludin)表达水平均明显降低,而与紫杉醇组相比,紫杉醇+高剂量组细胞连接蛋白表达水平均显著提升。上述结果说明灵芝孢子提取物能恢复紫杉醇引起的屏障功能损伤,修复肠细胞屏障,预防和改善紫杉醇化疗引起的肠道毒副作用。
以上所述,仅为本发明的较佳的具体实施例,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其构思加以等同替换或改变,都应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!