1-乙基-3,7-二甲基黄嘌呤在制备治疗肺炎药物中的应用
1.本发明涉及1-乙基-3,7-二甲基黄嘌呤在制备治疗肺炎药物中的应用,属于医药技术领域。
背景技术:
2.肺炎是威胁人类健康的重要疾病,发病率、病死率均较高。病毒、细菌、支原体感染是导致肺炎的主要原因。例如,肺炎支原体是介于细菌和病毒之间的病原体,肺炎支原体肺炎即是由肺炎支原体引起的肺部炎症,是一种常见的获得性肺炎。免疫损伤是支原体感染的重要发病机制。肺炎支原体引起肺炎同时也会引起各种肺外并发症,如脑炎、心肌炎、肝炎以及血液系统疾病等,对人体造成极大危害。
3.研究表明,微生物毒素可诱导细胞因子、炎症介质相结合,启动细胞内信号转导通路,促进tnf、il-1、il-6等促炎细胞因子的合成。细胞因子在重症肺炎发病中发挥重要作用。因此,单纯的抗微生物治疗不能显著、快速改善炎性反应,而抑制促炎细胞因子的产生可改变肺炎的临床症状,减少死亡率。有效调控机体炎症反应对于提高肺炎的治疗效果具有重要意义。
技术实现要素:
4.本发明的目的在于提供1-乙基-3,7-二甲基黄嘌呤在制备治疗肺炎药物中的应用。
5.本发明提供了式ⅰ所示的化合物或其盐在制备治疗肺炎的药物中的用途:
[0006][0007]
进一步地,所述的肺炎为病毒性肺炎、细菌性肺炎、支原体肺炎。
[0008]
进一步地,所述的病毒性肺炎为流感病毒、冠状病毒感染引起的肺炎。
[0009]
优选地,所述的流感病毒为甲型流感病毒。
[0010]
优选地,所述的冠状病毒为sars-cov、sars-cov-2。
[0011]
进一步地,所述的细菌性肺炎为肺炎克雷伯菌感染引起的肺炎。
[0012]
进一步地,所述的支原体肺炎为肺炎支原体感染引起的肺炎。
[0013]
进一步地,所述的药物降低肺指数。
[0014]
进一步地,所述的药物减轻肺部病变。
[0015]
进一步地,所述的药物降低肺炎死亡率。
[0016]
进一步地,所述的药物提高肺组织中ifn-γ水平。
[0017]
进一步地,所述的药物降低肺组织中tnf-α水平。
[0018]
进一步地,所述的药物降低外周血白细胞和/或中性粒细胞水平。
[0019]
进一步地,所述的药物降低血清中il-8、il-10、il-17水平。
[0020]
进一步地,所述的药物是以式ⅰ所示的化合物或其盐为活性成分,加入药学上可接受的辅料或者辅助性成分,制备而成的制剂。
[0021]
进一步地,所述的制剂为口服制剂、鼻腔黏膜给药制剂、口腔黏膜给药制剂或注射制剂。
[0022]
进一步地,所述的制剂为普通片剂、缓释剂、控释剂、泡腾片、颗粒剂、胶囊剂、口服液、鼻腔喷雾剂、舌下含片或针剂。
[0023]
本发明的优选技术方案中,所述药物含有治疗有效剂量的1-乙基-3,7-二甲基黄嘌呤活性成分,还含有一种或多种惰性的、无毒的、药理学合适的赋形剂的药物。优选地,所述赋形剂选自载体、溶剂、乳化剂、分散剂、湿润剂、粘合剂、稳定剂、着色剂、香料、矫味剂中至少一种。
[0024]
1-乙基-3,7-二甲基黄嘌呤有效的剂量可以根据给药方式、病人的年龄体重、病情严重程度以及其它相关的因素而改变,口服给药时推荐剂量为100-1000mg/次,每日1-3次;针剂推荐剂量为15-45mg/次,每日1次;喷雾剂吸入给药时推荐剂量为500-1000mg/次,每日1-3次。
[0025]
本发明提供了1-乙基-3,7-二甲基黄嘌呤在制备治疗肺炎药物中的应用。药理实验结果显示,1-乙基-3,7-二甲基黄嘌呤能明显抑制病毒、细菌、支原体感染引发的肺炎,降低感染小鼠的肺指数,降低tnf-α、il-8、il-10、il-17等炎性因子水平,提高ifn-γ水平,改善外周血的白细胞和中性粒细胞计数,表明1-乙基-3,7-二甲基黄嘌呤具有强效抗肺炎的作用。本发明的应用能够为肺炎的治疗提供新的药物来源,具有潜在的重大经济效应和社会效益。1-乙基-3,7-二甲基黄嘌呤制备的制剂具有作为治疗肺炎药物应用的前景,有望成为高效低毒治疗肺炎的创新中药,产业化前景广阔。
具体实施方式
[0026]
本发明提供了式ⅰ所示的化合物或其盐在制备治疗肺炎的药物中的用途:
[0027][0028]
本发明的发明人以咖啡因为先导化合物,对其进行结构修饰和优化,以期得到一种活性更好、毒性较小的治疗肺炎的药物。通过对构-效关系的考察发现,1、3、7位氮原子上的烷基取代基是保证黄嘌呤抗肺炎作用的关键基团。发明人还进一步筛选了多种不同的烷基,最终提供了式ⅰ所示的1-乙基-3,7-二甲基黄嘌呤,展现出最佳的抗肺炎效果。此外,1-乙基-3,7-二甲基黄嘌呤对肺部炎症模型的治疗效果显著优于对胰腺炎、肝炎、风湿性关节炎模型的治疗效果,具有开发成抗肺炎药物的巨大潜力。
[0029]
下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条
件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0030]
以下所称化合物cf即1-乙基-3,7-二甲基黄嘌呤,化学结构如式ⅰ所示:
[0031][0032]
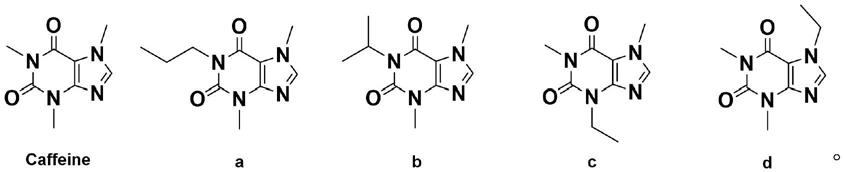
用于进行药效对比的咖啡因(caffeine)以及化合物a、b、c、d,其化学结构分别如下:
[0033][0034]
实施例1本发明普通片剂的制备
[0035]
将cf晶体,与约1/3的淀粉混匀,加淀粉浆混匀制成软材,16目筛制粒,60℃干燥,干粒过14目筛整粒,加剩余淀粉(预先在100-105℃干燥)与微晶纤维素,再通过14目筛,压片,即得。
[0036]
实施例2本发明针剂的制备
[0037]
cf粉末,加入纯水中,配成5mg/ml浓度,采用0.22μm一次性滤膜过滤除菌,封装入灭菌安培瓶待用。
[0038]
实施例3本发明喷雾剂的制备
[0039]
cf粉末溶于纯水、加入木糖醇、乙基麦芽酚作为矫味剂。
[0040]
实施例4本发明缓释剂的制备
[0041]
本发明制备的缓释片剂(以1片计)中cf的重量范围为60-120mg。
[0042]
a、将cf粉末60-120mg、稀释剂微晶纤维素20-75mg、填充剂淀粉50-150mg,及缓释材料羧甲基纤维素10-50mg过筛混合均匀;
[0043]
b、将混合后的药粉与作为粘合剂的5-75%的乙醇溶液或0.5-5%的羟丙甲纤维素混合12-18分钟,制成软材;
[0044]
c、将软材过16目尼龙筛制粒,60℃千燥,取出晾干,用14目铁丝筛整粒后,加入作为润滑剂起助流作用的硬脂酸镁3-4mg,混合使均匀;
[0045]
d、取样测定含量,计算片重,压片并按常规方法在片芯外层包薄膜衣。
[0046]
实施例5本发明控释剂的制备
[0047]
cf化合物粉末60-120mg、微晶纤维素200mg、k4m型羟丙甲纤维素70mg、k15m型羟丙甲纤维素65mg、k100m型羟丙甲纤维素70mg,加入至混合机中,于10r/min下混合10min,加入硬脂酸镁5mg和二氧化硅2.5mg,于10r/min下混合3min,用旋转压片机压片,片剂的硬度控制范围为:50~80n。按照usp apparatus type il(桨法),在100rpm的转速下,用1000ml温度保持在约37
±
0.5℃的含有2.0%十二烷基硫酸钠的蒸馏水作为溶出介质进行测试时,所
述剂型提供如下体外溶出度,即1小时后释放约5%至约50%的cf;6小时后释放约40%至约85%的cf;和12小时后释放不小于约70%的cf。
[0048]
实施例6本发明泡腾片的制备
[0049]
(1)取cf化合物粉末,加入部分填充剂,干燥备用;
[0050]
(2)将硼酸及泡腾剂分别干燥备用;
[0051]
(3)将白矾经煅备用;
[0052]
(4)将上述备用物粉碎,加入崩解剂,混匀,加入粘合剂,混匀,制粒,整粒,加入冰片、樟脑、苯扎溴铵的无水醇溶液,拌匀,压制成片。
[0053]
实施例7本发明舌下含片的制备
[0054]
首先将乳糖、糖粉用17%淀粉浆制备成空白颗粒,然后将10%cf乙醇溶液(按120%投料)拌于空白颗粒的细粉中(30日以下),过10目筛两次后,于40℃c以下干燥50-60分钟,再与事先制成的空白颗粒及硬脂酸镁混匀,压片得成品。
[0055]
实施例8本发明颗粒剂的制备
[0056]
取cf粉末、糖粉及糊精,混合均匀,用水或含水乙醇制成颗粒,干燥,整粒后分装成袋,包装,检验,入库。
[0057]
实施例9本发明口服液的制备
[0058]
将cf粉末加入纯化水,加热溶解,加入蜂蜜、活性炭煮沸,趁热过滤,滤液加入枸橼酸,加入纯化水调整至配制量,分装灭菌,即得。
[0059]
实施例10本发明胶囊剂的制备
[0060]
取cf粉末,再加入糊精等量递增法混匀,加70%乙醇制成“手捏成团,压之即散”的软材,挤压通过14~22目筛网制粒,60~80℃干燥,整粒,填充入2号胶囊。
[0061]
以下通过药效实验证明本发明的有益效果。
[0062]
试验例1本发明化合物对病毒性肺炎的治疗效果
[0063]
(一)材料
[0064]
c57小鼠、利巴韦林、cf片剂、cf针剂、cf喷雾剂、cf缓释剂、cf控释剂、cf泡腾片、cf舌下含片、cf颗粒、cf口服液、咖啡因、化合物a、b、c、d、甲型流感病毒鼠肺适应株fm1、tnf-αelisa试剂盒、动物干扰素inf-γelisa试剂盒、甲醛、乙醇。
[0065]
(二)分组与造模
[0066]
c57小鼠,随机分成57组,每组12只,共计684只,分别为正常组(normal)、模型组(model)、利巴韦林组(ribavirin);cf片剂组、咖啡因片剂组、化合物a片剂组、化合物b片剂组、化合物c片剂组、化合物d片剂组;cf针剂组、咖啡因针剂组、化合物a针剂组、化合物b针剂组、化合物c针剂组、化合物d针剂组;cf喷雾组、咖啡因喷雾组、化合物a喷雾组、化合物b喷雾组、化合物c喷雾组、化合物d喷雾组;cf缓释剂、咖啡因缓释组、化合物a缓释组、化合物b缓释组、化合物c缓释组、化合物d缓释组;cf控释剂组、咖啡因控释组、化合物a控释组、化合物b控释组、化合物c控释组、化合物d控释组;cf泡腾片组、咖啡因泡腾片组、化合物a泡腾片组、化合物b泡腾片组、化合物c泡腾片组、化合物d泡腾片组;cf舌下含片组、咖啡因舌下含片组、化合物a舌下含片组、化合物b舌下含片组、化合物c舌下含片组、化合物d舌下含片组;cf颗粒组、咖啡因颗粒组、化合物a颗粒组、化合物b颗粒组、化合物c颗粒组、化合物d颗粒组;cf口服液组,咖啡因口服液组、化合物a口服液组、化合物b口服液组、化合物c口服液
组、化合物d口服液组。适应性饲养2d后开始接种病毒,第1天接种流感病毒,正常组小鼠鼻腔滴注生理盐水,其余各组小鼠滴鼻接种50μl甲型h1n1流感病毒fm1株(血凝滴度为1:320),24h后,缓释组灌胃给药,针剂组尾静脉注射给药,喷雾组鼻腔滴注。第2到8天药物干预治疗,其中正常组和模型组小鼠以10ml/kg的体积灌服、喷雾或尾静脉注射生理盐水,利巴韦林组的小鼠灌服、鼻腔喷雾或尾静脉注射同体积的利巴韦林,各组的给药剂量均为58.5mg/kg,相当于人临床等效剂量。连续给药至第8天。每日观察各组小鼠感染病毒后全身的反应,包括毛发、活动状态、排便、摄食、呼吸等,记录小鼠每天的体质量和死亡情况。小鼠病毒感染后第9天,处死小鼠,称体质量,取出全肺后用生理盐水洗净,用干净滤纸吸掉水分,称肺质量,计算肺指数、肺指数抑制率、肺组织炎症性细胞因子tnf-α、动物干扰素inf-γ和死亡率。
[0067]
肺指数=肺质量/体质量
×
100%
[0068]
肺指数抑制率=[模型组平均肺指数-给药组平均肺指数]/[模型组平均肺指数-空白对照组平均肺指数]
×
100%
[0069]
(三)仪器
[0070]
干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/1.5ml eppendorf管。
[0071]
(四)数据统计
[0072]
采用spss 18.0处理数据,计量资料用x
±
s或x表示,以p<0.05为差异有统计学意义。
[0073]
(五)各组实验结果
[0074]
1.一般情况观察
[0075]
正常组小鼠精神状态良好,对外界环境反应敏锐。模型组小鼠感染病毒2d后,逐渐出现饮食减少、尿量减少的情况,毛松易脱落,呼吸短促,嗜睡,聚团蜷缩,畏寒发抖,活动呆板,精神萎靡。
[0076]
2.肺指数抑制率、死亡率
[0077]
表1
[0078]
[0079][0080]
3.肺组织炎症性因子tnf-α、动物干扰素inf-γ
[0081]
表2
[0082]
[0083][0084]
试验例2本发明化合物对细菌性肺炎的治疗作用
[0085]
(一)材料
[0086]
肺炎克雷伯菌标准株、注射用头孢哌酮/舒巴坦、肝素钠、盐酸氯胺酮、0.5%地塞米松磷酸钠、大鼠il-8、il-10elisa试剂盒、无菌生理盐水。
[0087]
(二)仪器
[0088]
干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/
1.5ml eppendorf管。
[0089]
(三)分组与造模
[0090]
鼠龄6周的健康标准(sd)大鼠(体质量180~220g),随机分组,每组12只,共计696只,分为正常组(normal)、模型组(model)、地塞米松磷酸钠+头孢哌酮+舒巴坦对照组、头孢哌酮+舒巴坦对照组;cf片剂组、咖啡因片剂组、化合物a片剂组、化合物b片剂组、化合物c片剂组、化合物d片剂组;cf针剂组、咖啡因针剂组、化合物a针剂组、化合物b针剂组、化合物c针剂组、化合物d针剂组;cf喷雾组、咖啡因喷雾组、化合物a喷雾组、化合物b喷雾组、化合物c喷雾组、化合物d喷雾组;cf缓释剂、咖啡因缓释组、化合物a缓释组、化合物b缓释组、化合物c缓释组、化合物d缓释组;cf控释剂组、咖啡因控释组、化合物a控释组、化合物b控释组、化合物c控释组、化合物d控释组;cf泡腾片组、咖啡因泡腾片组、化合物a泡腾片组、化合物b泡腾片组、化合物c泡腾片组、化合物d泡腾片组;cf舌下含片组、咖啡因舌下含片组、化合物a舌下含片组、化合物b舌下含片组、化合物c舌下含片组、化合物d舌下含片组;cf颗粒组,咖啡因颗粒组、化合物a颗粒组、化合物b颗粒组、化合物c颗粒组、化合物d颗粒组;cf口服液组、咖啡因口服液组、化合物a口服液组、化合物b口服液组、化合物c口服液组、化合物d口服液组,总共58组,每组12只,适应性饲养3d后开始接种。模型组、阳性药对照组和各给药组的大鼠称重后氯胺酮麻醉,经环状软骨下穿刺向气管内注入0.3ml肺炎克雷伯菌,并使细菌直接进入肺内,接种完成后将6组大鼠放回鼠笼,24h后,颗粒剂组灌胃给药,针剂组尾静脉注射给药,喷雾组鼻腔滴注;第6到10天药物干预治疗,其中正常组、模型组大鼠以10ml/kg的体积灌服、喷雾或尾静脉注射生理盐水为溶媒的该阳性药物,给药组的小鼠灌服、鼻腔喷雾或尾静脉注射同体积的cf、咖啡因或化合物a、b、c、d制剂,各组的给药剂量均为58.5mg/kg,相当于人临床等效剂量。分别与菌液接种后第6、8、10天收集1.5ml颈动脉血,全血静置,3000r/min速度下4℃离心10min,将血清收集起来置于-80℃保存待测,测定白细胞、中性粒细胞、il-8、il-10水平。
[0091]
(四)数据统计
[0092]
采用spss 18.0处理数据,计量资料用表示,以p<0.05为差异有统计学意义。
[0093]
(五)各组实验结果
[0094]
1.一般情况观察
[0095]
正常组大鼠精神状态良好,对外界环境反应敏锐。模型组大鼠感染克雷伯2d后,精神不振、活动和饮食逐渐减少,尿量减少,呼吸短促,嗜睡,体型日渐消瘦。
[0096]
2.肺指数抑制率和死亡率
[0097]
表3
[0098][0099][0100]
3.外周血的白细胞和中性粒细胞表4
[0101]
[0102][0103]
4.外周血炎症性因子il-8、il-10
[0104]
表5
[0105]
[0106]
[0107][0108]
试验例3本发明化合物对支原体肺炎的治疗作用
[0109]
(一)材料
[0110]
0.9%生理盐水、乙醚、无水乙醇、pbs缓冲液、酒精棉球、中性树胶、阿氏液、多聚赖氨酸、il-10、il-17elisa试剂盒;葡萄糖50%注射液、青霉素、pplo培养基。
[0111]
(二)仪器
[0112]
生物安全柜、干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/1.5ml eppendorf管。
[0113]
(三)分组与造模
[0114]
balb/c小鼠(20
±
2g),随机分组,每组12只,共计684只,分为正常组(normal)、模型组(model)、阿奇霉素对照组;cf胶囊组、咖啡因胶囊组、化合物a胶囊组、化合物b胶囊组、化合物c胶囊组、化合物d胶囊组;cf缓释组、咖啡因缓释组、化合物a缓释组、化合物b缓释组、化合物c缓释组、化合物d缓释组;cf控释组、咖啡因控释组、化合物a控释组、化合物b控释组、化合物c控释组、化合物d控释组;cf泡腾片组、咖啡因泡腾片组、化合物a泡腾片组、化合物b泡腾片组、化合物c泡腾片组、化合物d泡腾片组;cf舌下含片组、咖啡因舌下含片组、化合物a舌下含片组、化合物b舌下含片组、化合物c舌下含片组、化合物d舌下含片组;cf颗粒组、咖啡因颗粒组、化合物a颗粒组、化合物b颗粒组、化合物c颗粒组、化合物d颗粒组;cf口服液组、咖啡因口服液组、化合物a口服液组、化合物b口服液组、化合物c口服液组、化合物d口服液组;cf针剂组、咖啡因针剂组、化合物a针剂组、化合物b针剂组、化合物c针剂组、化合物d针剂组;cf喷雾组、咖啡因喷雾组、化合物a喷雾组、化合物b喷雾组、化合物c喷雾组、化合物d喷雾组;总共57组。适应性饲养5d后开始接种。模型组、阿奇霉素对照组、各给药组小鼠滴鼻法感染20ul的1
×
106cfu/ml肺炎支原体,24h后进行药物干预治疗,胶囊组取内容物溶于纯水形成悬浊液,灌胃给药,针剂组尾静脉注射给药,喷雾组鼻腔滴注。正常组和模型组小鼠以10ml/kg的体积灌服、喷雾或尾静脉注射生理盐水,阿奇霉素组的小鼠灌服、鼻腔喷雾或尾静脉注同体积的阿奇霉素,咖啡因、化合物a、b、c、d组小鼠灌服、鼻腔喷雾或尾静脉注同体积的相应化合物。各组的给药剂量均为58.5mg/kg,相当于人临床等效剂量。elisa法检测不同时间点小鼠血清中il-10、il-17水平,于造模后第7天禁食9h后称重并乙醚麻醉处死各组小鼠,摘取小鼠肺组织,用生理盐水洗净,用干净滤纸吸掉水分,称肺质量,计算肺指数、肺指数抑制率。
[0115]
肺指数=肺质量/体质量
×
100%
[0116]
肺指数抑制率=[模型组平均肺指数-给药组平均肺指数]/[模型组平均肺指数-空白对照组平均肺指数]
×
100%
[0117]
(四)数据统计
[0118]
采用spss 18.0处理数据,计量资料用表示,以p<0.05为差异有统计学意义。
[0119]
(五)各组实验结果
[0120]
1.一般情况观察
[0121]
正常组小鼠观察周期内精神始终良好,皮毛光泽,活动、进食和呼吸正常,体质量日益增加,肺组织颜色白、光泽,无炎性细胞浸润。模型组小鼠造模后活动减少,精神状态一般,皮毛无光泽,饮食及饮水量均减少,呼吸频率加快,体质量增长速度减慢,肺组织颜色深红,充血水肿,肺组织上皮细胞受损,肺泡壁明显增厚水肿,肺泡间隔断裂且明显增宽,肺间质炎性水肿,炎性细胞浸润。
[0122]
2.肺指数和肺指数抑制率
[0123]
从表6可以看出,模型组小鼠较正常组小鼠体质量明显减轻,肺质量明显增加,肺指数明显增高。模型组肺指数为0.95%,较正常组的肺指数(0.67%)明显增加(p<0.05),说明本实验中小鼠感染病毒模型可靠。阿奇霉素组肺指数为1.59%,显著低于模型组(p<0.05),表明阳性药物治疗模型可靠。cf胶囊剂组肺指数为0.68%,cf缓释组0.71%、cf控释组0.66%、cf泡腾片组0.69%、cf舌下含片组0.69%、cf颗粒组0.67%、cf口服液组0.67%、cf针剂组0.73%,cf喷雾剂0.71%,均显著低于模型组。说明在有效浓度范围,cf口服剂型、针剂、喷雾剂均能有效改善肺指数和肺指数抑制率,其抑制作用显著强于咖啡因和化合物a、b、c、d,并且与抗支原体药物联用能够提高治疗效果。
[0124]
3.小鼠血清中il-10、il-17水平
[0125]
从表6可以看出,阳性药物对照组和各给药组小鼠血清中il-10、il-17含量明显低于模型组(p<0.05)。说明cf的多种剂型均能有效抑制支原体感染引起的肺部炎性反应,且效果优于咖啡因和化合物a、b、c、d。
[0126]
[0127]
[0128][0129]
试验例4本发明化合物对不同炎性疾病的治疗作用
[0130]
炎症是一种机体对抗病原微生物入侵的基本生物学反应,可促进损伤细胞和组织
修复,并阻止其进一步的损伤。然而,过度的炎性反应也会导致组织器官乃至全身器官的损伤和坏死。目前,炎症是一种威胁人类健康的常见病和多发病,对于炎症的治疗,人们常使用糖皮质激素类甾体抗炎药及传统非甾体抗炎药。即使现有的抗炎药物能够有效控制感染性炎症和非感染性炎症,并能有效消除炎症造成的功能性损伤障碍,但长期使用会引发肾上腺皮质的功能衰退以及其他并发症。由于传统抗炎药具有选择性较差和副作用明显的缺点,所以在临床应用受到很大限制。近年来,随着人们对炎症机制研究的不断深入,以及广泛应用到分子生物学技术分析,临床上急需一类疗效好且副作用小的新型抗炎药相继问世。
[0131]
肺炎是主要的呼吸系统疾病之一,具有较高的发病率和死亡率。重症肺炎常常会引起呼吸衰竭病导致死亡,而炎性细胞因子在其发病中起重要作用,因此有效控制其水平是治疗肺炎的重要手段之一。病毒、细菌、支原体感染是导致肺炎的主要原因。微生物感染可诱导细胞因子、炎性介质的结合,激活机体的免疫系统,导致炎性细胞大量激活,释放大量细胞因子。单纯的抗微生物治疗并不能快速缓解炎性,改善疾病,而抑制细胞因子的产生释放可明显改善肺炎的临床病症,降低死亡率。
[0132]
胰腺炎是常见的胃肠道疾病,急性胰腺炎为高发病率高死亡率的一种常见消化系统疾病,且儿童患有急性胰腺炎也成为一个越来越普遍的问题。虽然现有诊断水平和治疗水平在不断的提高,但是急性胰腺炎的发病率、复发率和死亡率仍居高不下。对于急性胰腺炎的治疗,目前尚无特异性治疗方案,根据中国急性胰腺炎诊治指南(2014)和美国胃肠病学会《急性胰腺炎治疗指南》(2013),主要的治疗方案有营养支持、抗生素治疗、外科手术治疗和中西医结合治疗。
[0133]
肝脏作为机体的重要器官,承担机体的主要代谢、解毒、分泌等重要生理功能,同时它又是具有独特免疫学特性的淋巴器官,参与天然免疫和适应性免疫反应,若肝脏功能出现障碍,则可产生各种免疫性疾病。自身免疫性肝炎是一种病因不明确且伴有明显自身免疫现象,以炎症性坏死为主要病理改变的慢性肝脏疾病,该病的流行病学较广,严重危害人类健康,且带来较大经济损失。自身免疫性肝炎可导致血清转氨酶的升高,循环中存在自身抗体,高γ-球蛋白血症、肝组织学特征性改变及对免疫抑制治疗应答为特点的慢性炎症性肝病,可导致肝硬化和肝衰竭。因此,研究具有显著抗免疫性肝炎效果的药物是很有必要的。
[0134]
类风湿关节炎是一种以慢性破坏性关节病变为主要特征的全身性自身免疫疾病,主要损害关节软骨、骨、关节囊,严重时可导致关节畸形和功能丧失等后果。类风湿关节炎病变特点为滑膜炎,及其由此导致的关节软骨和骨质的破坏,最终可导致关节畸形。治疗方法主要包括一般治疗、药物治疗和外科手术和其他治疗等;但目前,尚不清楚治疗类风湿关节炎应首选何种抗风湿药物改善病情。类风湿关节炎若未得到及时和有效治疗,则其致残率高,因而对于类风湿关节炎的治疗目的主要在于控制病情,改善关节功能和预后,同时应强调早期治疗、联合用药和个体化治疗的原则。
[0135]
本试验例证明,1-乙基-3,7-二甲基黄嘌呤对肺部炎症的治疗效果,显著优于对胰腺炎、肝炎、风湿性关节炎模型的治疗。
[0136]
(一)材料
[0137]
甲型流感病毒鼠肺适应株fm1、tnf-αelisa试剂盒、动物干扰素inf-γelisa试剂
盒、甲醛、乙醇。
[0138]
(二)分组与造模
[0139]
c57小鼠72只,随机分成6组,每组12只,分别为正常组(normal)、模型组(model)、肺炎组、胰腺炎组、肝炎组和类风湿关节炎组,适应性饲养2d后开始接种造模。
[0140]
肺炎模型:氯胺酮麻醉,经环状软骨下穿刺向气管内注入0.1ml甲型流感病毒鼠肺适应株fm1,并使甲型流感病毒鼠肺适应株fm1直接进入肺内,接种完成后放回鼠笼。
[0141]
胰腺炎模型:nat造模,实验前禁食12h,不禁水,在无菌环境下进行手术。3.5%戊巴比妥钠腹腔注射,麻醉后,用酒精棉球将手术部位消毒,无菌纱布置于手术部位,于剑突下两手指宽度处剖腹,看到肝脏后开始往下切口,将生理盐水浸湿的棉签伸入腹腔,于肝脏背部寻找十二指肠,将其翻出后,置于无菌纱布上,寻找胰胆管和十二指肠乳头,以对准乳头方向用1ml注射器针头在十二指肠上穿一个孔,将24g留置针软管沿着乳头插入胰胆管中,用动脉血管夹将肝脏下方总胆管闭合,以0.1ml/100g剂量和0.1ml/1min速度注射牛黄胆酸钠(浓度为3.8%),此过程中注意将生理盐水滴加到暴露在外的胰腺和十二指肠上,保持湿润,注射完毕后慢慢将软管取出,继续闭合胆总管,3min后将血管动脉夹取下,还纳十二指肠,双层缝合腹腔。
[0142]
肝炎模型:尾静脉注射cona溶液(15mg/kg),对照组注射等体积的生理盐水。
[0143]
关节炎模型:腹腔注射10%水合氯醛溶液(3.5ml/kg),待麻醉完全后,固定于仰卧位。于膝关节腔内注射1g/l碘乙酸钠溶液0.1ml。第5天起每天驱赶动物奔跑30min,其余时间任其笼内自由活动。
[0144]
本组实验统一选用针剂进行静脉内注射给药,连续给药至第8天。每日观察各组小鼠感染病毒后全身的反应,包括毛发、活动状态、排便、摄食、呼吸等,记录小鼠每天的体质量和死亡情况。小鼠病毒感染后第9天,处死小鼠,称体质量,评价炎症性细胞因子tnf-α、il-6和死亡率。
[0145]
(三)仪器
[0146]
干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/1.5ml eppendorf管。
[0147]
(四)数据统计
[0148]
采用spss 18.0处理数据,计量资料用x
±
s表示,以p<0.05为差异有统计学意义。
[0149]
(五)各组实验结果
[0150]
1.一般情况观察
[0151]
正常组小鼠精神状态良好,对外界环境反应敏锐。模型组小鼠感染病毒2d后,逐渐出现饮食减少、尿量减少的情况,毛松易脱落,呼吸短促,嗜睡,聚团蜷缩,畏寒发抖,活动呆板,精神萎靡。
[0152]
2.死亡率
[0153]
正常组无死亡,模型组有较高的死亡情况,死亡率达到41.67%;肺炎组死亡率13.33%,胰腺炎组23.45%,肝炎组21.56%,类风湿关节炎组22.15%,说明在有效浓度范围。而cf就能降低个模型组的死亡率,其中cf(1-乙基-3,7-二甲基黄嘌呤)干预组肺炎组死亡率0%,胰腺炎组6.66%,肝炎组10.7%,类风湿关节炎组11.07%。
[0154]
3.血清炎症性因子tnf-α、il-6
[0155]
表7cf对于不同炎性疾病的治疗作用(n=12,)
[0156][0157][0158]
试验例5本发明化合物对新型冠状病毒肺炎covid-19的治疗作用
[0159]
(一)材料
[0160]
0.9%生理盐水、乙醚、无水乙醇、pbs缓冲液、酒精棉球、中性树胶、阿氏液、多聚赖氨酸、il-10、il-17elisa试剂盒;葡萄糖50%注射液、青霉素、pplo培养基。
[0161]
(二)仪器
[0162]
生物安全柜、干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/1.5ml eppendorf管。
[0163]
(三)分组与造模
[0164]
balb/c小鼠(20
±
2g),随机分组,每组12只,共计708只,分为正常组(normal)、模型组(model)、利巴韦林对照组;利巴韦林+氢化可的松组;氢化可的松组;cf胶囊组、咖啡因胶囊组、化合物a胶囊组、化合物b胶囊组、化合物c胶囊组、化合物d胶囊组;cf缓释组、咖啡因缓释组、化合物a缓释组、化合物b缓释组、化合物c缓释组、化合物d缓释组;cf控释组、咖啡因控释组、化合物a控释组、化合物b控释组、化合物c控释组、化合物d控释组;cf泡腾片组、咖啡因泡腾片组、化合物a泡腾片组、化合物b泡腾片组、化合物c泡腾片组、化合物d泡腾片组;cf舌下含片组、咖啡因舌下含片组、化合物a舌下含片组、化合物b舌下含片组、化合物c舌下含片组、化合物d舌下含片组;cf颗粒组、咖啡因颗粒组、化合物a颗粒组、化合物b颗粒组、化合物c颗粒组、化合物d颗粒组;cf口服液组、咖啡因口服液组、化合物a口服液组、化合物b口服液组、化合物c口服液组、化合物d口服液组;cf针剂组、咖啡因针剂组、化合物a针剂组、化合物b针剂组、化合物c针剂组、化合物d针剂组;cf喷雾组、咖啡因喷雾组、化合物a喷雾组、化合物b喷雾组、化合物c喷雾组、化合物d喷雾组;总共59组。利巴韦林,58.5mg/kg;氢化可的松,25mg/kg;化合物cf、咖啡因及化合物a、b、c、d均为58.5mg/kg;适应性饲养2d后开始接种。除空白对照组组小鼠鼻腔滴注生理盐水外,其他各组小鼠均经滴注鼻腔感染covid-19病毒(30μl)。24h后进行药物干预治疗,片剂组取内容物溶于纯水形成悬浊液,灌胃给药;针剂组尾静脉注射给药;喷雾组鼻腔滴注;缓释剂组灌胃给药;控释剂组灌胃给药;泡腾片组灌胃给药。正常组小鼠以10ml/kg的体积灌服、喷雾或尾静脉注射生理盐水,连续给药至第8天。小鼠病毒感染后第9天,处死小鼠,称体质量,取出全肺后用生理盐水洗净,用干净滤纸吸掉水分,称肺质量,计算肺指数、肺指数抑制率、肺组织炎症性细胞因子nf-κb、tnf-α和死亡率。
[0165]
肺指数=肺质量/体质量
×
100%
[0166]
肺指数抑制率=[模型组平均肺指数-给药组平均肺指数]/[模型组平均肺指数-空白对照组平均肺指数]
×
100%
[0167]
(四)数据统计
[0168]
采用spss 18.0处理数据,计量资料用表示,以p<0.05为差异有统计学意义。
[0169]
(五)各组实验结果
[0170]
1.一般情况观察
[0171]
正常组小鼠观察周期内精神始终良好,皮毛光泽,活动、进食和呼吸正常,体质量日益增加,肺组织颜色色白、光泽,无炎性细胞浸润。模型组小鼠造模后活动减少,精神状态一般,皮毛无光泽,饮食及饮水量均减少,呼吸频率加快,体质量增长速度减慢,肺组织颜色深红,充血水肿,肺组织上皮细胞受损,肺泡壁明显增厚水肿,肺泡间隔断裂且明显增宽,肺间质炎性水肿,炎性细胞浸润。
[0172]
2.肺部病变程度
[0173]
由表8可知,小鼠肺病变减轻率方面,化合物cf各不同剂型都能在一定程度上减轻肺病变,疗效均高于利巴韦林+氢化可的松组、利巴韦林组以及氢化可的松组。
[0174]
3.肺指数抑制率和死亡率
[0175]
由表8可知,实验建立的小鼠感染病毒模型可靠,其中化合物cf针剂组的肺指数与模型组比较显著降低(p<0.05),说明化合物cf不同剂型均能减轻流感病毒所致肺病变,药物有一定疗效。正常组无死亡,模型组有较高的死亡情况,死亡率达到46.67%。与模型组比较,化合物cf不同剂型组有均降低病毒感染小鼠死亡率的趋势。此外,化合物cf针剂组降低死亡率效果更优。
[0176]
表8
[0177]
[0178][0179]
4.肺组织炎症性因子nf-κb、tnf-α
[0180]
表9
[0181]
[0182][0183]
试验例6本发明化合物对sars-cov感染所致肺炎的治疗作用
[0184]
(一)材料
[0185]
0.9%生理盐水、乙醚、无水乙醇、pbs缓冲液、酒精棉球、中性树胶、阿氏液、多聚赖氨酸、nf-κb elisa试剂盒、tnf-αelisa试剂盒;葡萄糖50%注射液、青霉素、pplo培养基。
[0186]
(二)仪器
[0187]
生物安全柜、干燥机、离心机、光学显微镜、血气分析仪、酶标仪、电子天平、比浊管、0.5ml/1.5ml eppendorf管。
[0188]
(三)分组与造模
[0189]
balb/c小鼠(20
±
2g),随机分组,每组12只,共计708只,分为正常组(normal)、模型组(model)、利巴韦林对照组;利巴韦林+氢化可的松组;氢化可的松组;cf胶囊组、咖啡因胶囊组、化合物a胶囊组、化合物b胶囊组、化合物c胶囊组、化合物d胶囊组;cf缓释组、咖啡因缓释组、化合物a缓释组、化合物b缓释组、化合物c缓释组、化合物d缓释组;cf控释组、咖啡因控释组、化合物a控释组、化合物b控释组、化合物c控释组、化合物d控释组;cf泡腾片组、咖啡因泡腾片组、化合物a泡腾片组、化合物b泡腾片组、化合物c泡腾片组、化合物d泡腾
片组;cf舌下含片组、咖啡因舌下含片组、化合物a舌下含片组、化合物b舌下含片组、化合物c舌下含片组、化合物d舌下含片组;cf颗粒组、咖啡因颗粒组、化合物a颗粒组、化合物b颗粒组、化合物c颗粒组、化合物d颗粒组;cf口服液组、咖啡因口服液组、化合物a口服液组、化合物b口服液组、化合物c口服液组、化合物d口服液组;cf针剂组、咖啡因针剂组、化合物a针剂组、化合物b针剂组、化合物c针剂组、化合物d针剂组;cf喷雾组、咖啡因喷雾组、化合物a喷雾组、化合物b喷雾组、化合物c喷雾组、化合物d喷雾组;总共59组。利巴韦林,58.5mg/kg;氢化可的松,25mg/kg;化合物cf、咖啡因及化合物a、b、c、d均为58.5mg/kg;适应性饲养2d后开始接种。除空白对照组组小鼠鼻腔滴注生理盐水外,其他各组小鼠均经滴注鼻腔感染sars-cov(30μl)。24h后进行药物干预治疗,片剂组取内容物溶于纯水形成悬浊液,灌胃给药;针剂组尾静脉注射给药;喷雾组鼻腔滴注;缓释剂组灌胃给药;控释剂组灌胃给药;泡腾片组灌胃给药。正常组小鼠以10ml/kg的体积灌服、喷雾或尾静脉注射生理盐水,连续给药至第8天。小鼠病毒感染后第9天,处死小鼠,称体质量,取出全肺后用生理盐水洗净,用干净滤纸吸掉水分,称肺质量,计算肺指数、肺指数抑制率、肺组织炎症性细胞因子nf-κb、tnf-α和死亡率。
[0190]
肺指数=肺质量/体质量
×
100%
[0191]
肺指数抑制率=[模型组平均肺指数-给药组平均肺指数]/[模型组平均肺指数-空白对照组平均肺指数]
×
100%
[0192]
(四)数据统计
[0193]
采用spss 18.0处理数据,计量资料用表示,以p<0.05为差异有统计学意义。
[0194]
(五)各组实验结果
[0195]
1.一般情况观察
[0196]
正常组小鼠观察周期内精神始终良好,皮毛光泽,活动、进食和呼吸正常,体质量日益增加,肺组织颜色色白、光泽,无炎性细胞浸润。模型组小鼠造模后活动减少,精神状态一般,皮毛无光泽,饮食及饮水量均减少,呼吸频率加快,体质量增长速度减慢,肺组织颜色深红,充血水肿,肺组织上皮细胞受损,肺泡壁明显增厚水肿,肺泡间隔断裂且明显增宽,肺间质炎性水肿,炎性细胞浸润。
[0197]
2.肺部病变程度
[0198]
由表10可知,小鼠肺病变减轻率方面,化合物cf各不同剂型都能在一定程度上减轻肺病变,疗效均高于利巴韦林+氢化可的松组、利巴韦林组以及氢化可的松组。
[0199]
3.肺指数抑制率和死亡率
[0200]
由表10可知,实验建立的小鼠感染病毒模型可靠,其中化合物cf针剂组的肺指数与模型组比较显著降低(p<0.05),说明化合物cf不同剂型均能减轻流感病毒所致肺病变,药物有一定疗效。正常组无死亡,模型组有较高的死亡情况,死亡率达到49.72%。与模型组比较,化合物cf不同剂型组有均降低病毒感染小鼠死亡率的趋势。此外,化合物cf针剂组降低死亡率效果更优。
[0201]
表10
[0202][0203][0204]
4.肺组织炎症性因子nf-κb、tnf-α
[0205]
表11
[0206]
[0207][0208]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实例的限制,上述实例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1