基于凹凸棒土的靶向磁性温敏微凝胶、合成方法及其应用与流程
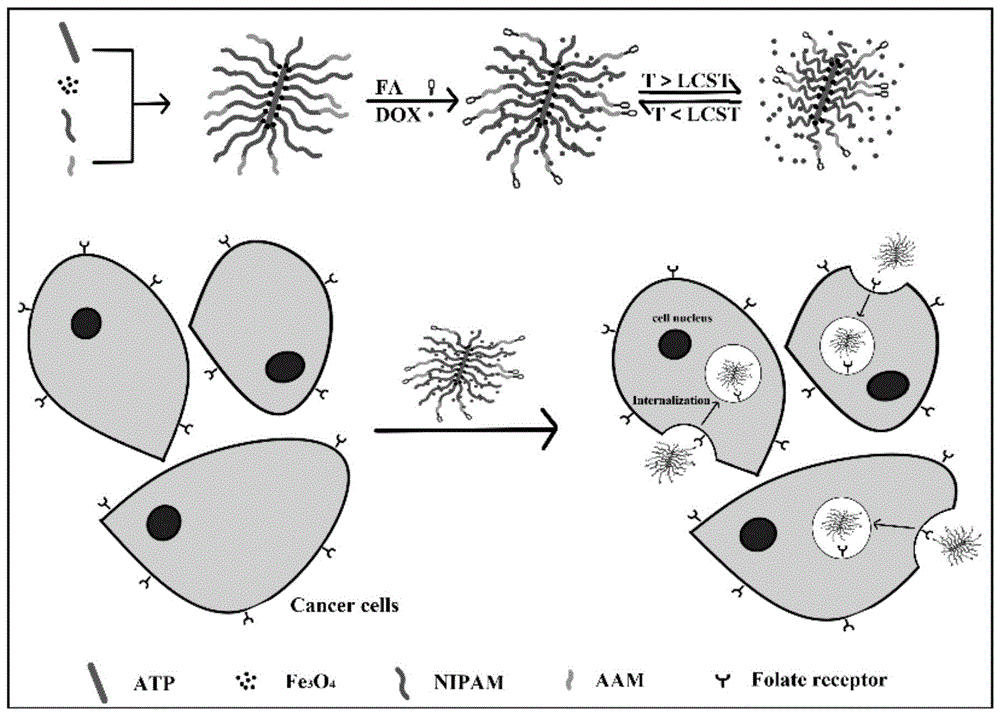
本发明涉及基于凹凸棒土的靶向磁性温敏微凝胶、合成方法及其在药物递送和体外试验中的应用,属于温敏聚合物材料技术领域。
背景技术:
根据国际癌症研究机构发布的报告,每年大约有1000万新的肿瘤病例,并且死于该疾病的患者不少于600万。在肿瘤的临床治疗中仍然存在的主要问题是如何准确和高效地将载有癌症药物的纳米载体递送至肿瘤部位,以实现理想的治疗效果。药物递送系统是一种能够通过控制释放速率、释放部位和调节体内释放时间来将治疗药物引入体内并提高其有效性和安全性的手段。将纳米载体用于癌症的靶向治疗已经取得了许多进展。
刺激响应性微凝胶已经进行了许多研究,并被应用于许多领域。这些材料具有许多优势,例如,由于这些材料的理化性质与活体组织相似,如高含水量,低界面张力等,因此它们具有良好的生物相容性。n-异丙基丙烯酰胺(nipam)是研究最为广泛的温敏材料。基于nipam的热敏纳米凝胶的最低临界溶液温度(lcst)约为32.0℃,温度接近人体的生理温度。此外,随着周围温度的升高,聚合物微凝胶的结构经历了从溶胀结构到塌陷聚集的相变,这为装载或释放小分子提供了机会,可以应用于肿瘤治疗中。通过调节温度能够可逆的调节溶胀和收缩状态,因此能够调节pnipam的纳米载体的负载和释放速率。此外,通过将共聚单体添加到pnipam中,可以调节lcst。亲水性共聚单体往往会增加lcst,相反,疏水性共聚单体会降低lcst,这提供了嵌入或释放小分子的机会,从而可以应用于靶向释药中。
在过去的几年中,有机和无机纳米复合材料成为材料科学研究的热点。凹凸棒土(atp)是一种富含水的镁铝硅酸盐粘土矿物,具有链层结构和独特的物理和化学特性,包括相对的渗透性,良好的化学稳定性等。由于磁性氧化铁纳米粒子的低毒性,良好的生物相容性和在生理环境中的高稳定性,它们在生物医学领域引起了极大的关注。由于这些特性,磁性纳米粒子已广泛用于诊断和治疗领域中的药物靶向输送中。具有很强的超顺磁性的fe3o4纳米粒子易于通过外部磁场分离,该性质广泛用于磁性分离中,并具有出色的可回收性。
叶酸(fa)是进行单碳转移反应所必需的一种维生素。由于fa对于核苷酸生物合成序列很重要,因此会因为细胞增殖而大量消耗。在正常细胞中使用了两种膜相关蛋白。前者是代谢几乎所有细胞中存在的生理性叶酸的主要方法。它们存在于退化的上皮细胞和活化的巨噬细胞中,他们优先通过受体介导的内吞作用结合并内化氧化的叶酸。尽管低浓度的还原性叶酸载体可能足以满足大多数正常细胞的需求,但fr通常在肿瘤细胞中过表达,fa与fr优先结合,从而使fa具有靶向性。
阿霉素对人体具有很多生化作用。它通过将自身嵌入dna中来抑制核酸的合成,这种机制能够导致癌细胞死亡,因此具有抗癌作用。它对急性白血病,淋巴瘤和其他实体瘤的化疗有重要影响,是一种非常有效的抗癌药物。
技术实现要素:
本发明基于乳液聚合法合成了fa-fe3o4/atp-p(nipam-aam)。atp具有较大的比表面积,可以提高载药效率。fa-fe3o4/atp-p(nipam-aam)可以通过在聚合之前调节两种单体的比例来提高lcst。dox是一种抗癌药物,在本研究用作模型药物进行了体外试验,以确认fa-fe3o4/atp-p(nipam-aam)可用于鉴定和破坏癌细胞(图1)。fa-fe3o4/atp-p(nipam-aam)可作为癌症治疗中的理想药物载体。
具体的技术方案是:
本发明的第一个方面,提供了:
一种基于凹凸棒土的靶向磁性温敏微凝胶,其是以凹凸棒土作为内核,其表面依次修饰有fe3o4、温敏凝胶聚合物以及叶酸。
在一个实施方式中,所述的温敏凝胶聚合物是pnipam。
本发明的第二个方面,提供了:
上述的基于凹凸棒土的靶向磁性温敏微凝胶的制备方法,包括如下步骤:
第1步,按重量份计,在超声的作用下,将0.1-0.3份的凹凸棒土和0.5-2份的fe(c5h7o2)3加入至20-40份的第一溶剂中,升温反应后,将产物固体物分离,洗涤后、干燥,得到fe3o4/atp;
第2步,按重量份计,将0.5-2份的去离子水、0.5-2份的fe3o4/atp分散于80-120份的第二溶剂中,再加入1-5份的硅烷偶联剂,超声分散均匀后,升温反应,将产物固体物分离,洗涤后、干燥,得到kh-570-fe3o4/atp;
第3步,按重量份计,将0.2-0.6份n-异丙基丙烯酰胺、0.02-0.06份聚丙烯酰胺、0.003-0.01份的n,n`-亚甲基双丙烯酰胺、0.001-0.003份的十二烷基苯磺酸钠加入至0.5-4份的kh-570-fe3o4/atp水分散液中,再加入20-40份去离子水分散,脱除氧气后,加入0.5-1.5份的过硫酸铵(aps)溶液和0.5-1.5份的硫代硫酸钠(sps)溶液,进行反应,反应后使用去离子水透析处理,得到的产物冻干后,得到fe3o4/atp-p(nipam-aam);
第4步,按重量份计,将0.002-0.006份n-羟基琥珀酰亚胺、0.001-0.004份1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和0.001-0.004份叶酸溶解于第三溶剂中,作为fa溶液;将0.01-0.03份的fe3o4/atp-p(nipam-aam)分散于15-25份的磷酸盐缓冲溶液(pbs)中,并用hcl调节ph至4.5-4.7后,再加入fa溶液,保持反应,反应结束后采用naoh调节ph至8.5-9.5,产物依次经过pbs和去离子水透析处理,产物干燥后得到fa-fe3o4/atp-pnipam-aam)。
在一个实施方式中,所述的第1步中第一溶剂是三乙二醇,反应过程的温度是250-300℃,反应时间是1-3h。
在一个实施方式中,所述的第2步中第二溶剂是甲苯,硅烷偶联剂是kh570;反应过程的温度是45-50℃,反应时间是2-8h。
在一个实施方式中,所述的第3步kh-570-fe3o4/atp水分散液的浓度0.025-0.04g·ml-1;过硫酸铵(aps)溶液和硫代硫酸钠(sps)溶液的浓度分别是1-5mg·ml-1和1-5mg·ml-1;反应时间是2-10h。
在一个实施方式中,所述的第4步中,第三溶剂是dmso,磷酸盐缓冲溶液的ph范围是7.2-7.6;反应时间是10-20h。
本发明的第三个方面,提供了:
上述的基于凹凸棒土的靶向磁性温敏微凝胶在用于制备缓释药物中的应用。
在一个实施方式中,所述的药物选自阿霉素。
在一个实施方式中,所述的应用还包括如下步骤:将靶向磁性温敏微凝胶、阿霉素和去离子水混合后,降温,使微凝胶溶胀,将阿霉素负载于微凝胶中。
在一个实施方式中,靶向磁性温敏微凝胶、阿霉素和去离子水的重量比是15-25:1-10:100000-300000。
在一个实施方式中,所述降温是指降温至0-10℃。
本发明的第四个方面,提供了:
凹凸棒石在用于制备提高阿霉素缓释效果的载体材料中的应用。
在一个实施方式中,所述的缓释效果是指负载量和释放量。
本发明的第五个方面,提供了:
凹凸棒石在用于制备提高fe3o4表面的含c=c键的化合物接枝效果的载体中的用途。
本发明的第六个方面,提供了:
凹凸棒石在用于制备负载有p(nipam-aam)温敏材料的载体中的应用。
有益效果
本文通过乳液聚合法合成了具有靶向性的磁性温敏微凝胶fa-fe3o4/atp-p(nipam-aam)。相变温度从32.0℃升高到38.5℃,接近人体温度,适用于体外细胞实验。体外细胞试验表明,fa-fe3o4/atp-p(nipam-aam)具有良好的生物相容性,同时具有靶向性可以有效地延长药物释放和作用的时间。体外药物释放实验表明,atp可以增加药物负载量和释放量。该材料有望将抗癌药物准确释导向到肿瘤细胞,从而减少副作用并达到缓释效果,扩大了温敏性微凝胶在靶向肿瘤治疗的应用范围。
附图说明
图1是fa-fe3o4/atp-p(nipam-aam)的合成和靶向过程示意图
图2是(a)atp;(b)fe3o4和(c)fe3o4/atp的xrd图谱
图3是(a)fe3o4和(b)fe3o4/atp的vsm图谱
图4是共沉淀法fe3o4/atp的vsm图谱
图5是油酸改性合成的fe3o4/atp-p(nipam-aam)的ir图谱
图6是ctab改性合成的fe3o4/atp-p(nipam-aam)的ir图谱
图7是atp,fe3o4,fe3o4/atp和kh-570-fe3o4/atp的红外光谱
图8是溶液聚合法合成fe3o4/atp-p(nipam-aam)ir图谱
图9是原位聚合法合成fe3o4/atp-p(nipam-aam)ir图谱
图10是原位聚合法合成fe3o4/atp-p(nipam-aam)tem照片
图11是fe3o4/atp,(b)fe3o4/atp-p(nipam-aam)的tem、sem图谱
图12是乳液聚合法合成fe3o4/atp-p(nipam-aam)ir图谱
图13是制备得到的fa-fe3o4/atp-p(nipam-aam)的表征结果,其中a区域是(a)atp;(b)fe3o4;(c)fe3o4/atp;(d)kh-570-fe3o4/atp;(e)p(nipam-aam);(f)fe3o4/atp-p(nipam-aam)的红外谱图;b区域是(a)atp(b)fe3o4/atpand(c)kh-570-fe3o4/atpand(d)fe3o4/atp-p(nipam-aam)的热重谱图;c区域是(a)fa,(b)fe3o4/atp-p(nipam-aam),(c)fa-fe3o4/atp-p(nipam-aam)的紫外谱图;d区域是fe3o4/atp-p(nipam-aam)的动态光散射谱图
图14是nipam与aam质量比为10:1时粒径随温度的变化dls曲线
图15是p(nipam-aam)和fe3o4/atp-p(nipam-aam)的dox释放量对比图。
图16是细胞毒性试验的结果对比,其中,(a)fa-fe3o4/atp-p(nipam-aam);(b)freedox;(c)dox负载的fa-fe3o4/atp-p(nipam-aam)
图17是游离dox和dox负载的fa-fe3o4/atp-p(nipam-aam)的细胞摄取图
具体实施方式
本发明通过乳液共聚制备叶酸(fa)接枝的磁性fa-fe3o4/凹凸棒土(atp)-p(n-异丙基丙烯酰胺(nipam)-丙烯酰胺(aam))复合微凝胶,并用vsm,tg,ir,uv,sem和tem进行表征。通过dls测定的低临界溶液温度(lcst)为约38.5℃,适合进行细胞实验。选择阿霉素(dox)作为模型药物。药物负载和释放试验表明,atp可以增加材料的负载量和释放量。体外细胞毒性实验表明,与游离dox相比,负载dox的fa-fe3o4/atp-p(nipam-aam)具有更好的生物相容性。体外细胞摄取试验表明,fa-fe3o4/atp-p(nipam-aam)能够到达指定位点,并能延长药物的释放时间。结果表明,fa-fe3o4/atp-p(nipam-aam)复合微凝胶有望用于药物靶向缓释中。
药品
n-异丙基丙烯酰胺(nipam,99%)n,n`-亚甲基双丙烯酰胺(mba,98%)和过硫酸铵(aps,98%)购自acrosorganicsco.,ltd.dmso,甲苯,乙酰丙酮铁,三甘醇,kh-570,n-羟基琥珀酰亚胺(nhs,98%),n-(3-二甲基氨基丙基)-n`-乙基碳酰二氨基氢化尿尿(edc,98%),溶解袋(mw:8000-14000)和叶酸(98%)购自阿拉丁化学有限公司(中国上海)。凹凸棒石购自洪金凹凸棒石仪器(中国)。十二烷基硫酸钠(sds)购自alphachemicalindustryco.,ltd.(3-4,5-二甲基噻唑-2-基)-2,5-二苯基四唑鎓溴化物(mtt)购自sigma-aldrich(st.louis,美国密苏里州)。胎牛血清(fbs)来自康宁(美国马萨诸塞州梅德福)。dulbecco的改良版eagle培养基(dmem碱性)(1倍),胰蛋白酶-edta(0.25%)和青霉素-链霉素溶液购自invitrogen-gibco(美国加利福尼亚州卡尔斯巴德)。
仪器
扫描电子显微镜(sem)图像在jeoljsm-6700f场发射扫描电子显微镜(日本)上进行。透射电子显微镜(tem)是在jeoljem-200cx透射电子显微镜(日本)上获得的。紫外可见(uv-vis)光谱是用nicoletcorporation的avatar-360ft-ir分光光度计获得的。通过在25℃下振动样品磁力计(vsm,agfm,伊朗)表征fe3o4/atp的磁性。通过使用x'pert-pro高级衍射仪通过x射线功率衍射(xrd)和cu(kα)辐射(波长:1.5406å)在40kv和40ma的2θ范围为5的条件下获得结构性能在室温下为-90°。使用分光光度计读板器(elx808,biotek,美国)在体外摄取图像中以570nm的波长探测mtt测定,并通过lsm700激光共聚焦显微镜(尼康a1)获得。
步骤1:fe3o4/atp的制备
fe3o4作为磁性材料,在本发明中能够起到三点作用:
能够在外界磁场下,起到磁导向的作用;能够在交变磁场下升温,对聚合物凝胶加热,使其收缩,从而达到释药的效果;能够利用其磁性,使复合材料易于回收分离。
溶剂热法:在超声条件下将0.2000g干燥的atp和1.000gfe(c5h7o2)3混合到30ml三乙二醇中,确保它们均匀混合。将混合物加热至270℃,反应持续2h。反应后,让产物冷却至周围温度。沉淀物用乙醇和去离子水洗涤几次。将产品放在磁铁上自然分离,并在真空烘箱中于50℃干燥过夜。
对照实验1:共沉淀法,将0.5g二价铁(feso4)与0.5gatp在30ml去离子水中分散均匀后,加入氨水还原生成fe3o4/atp。
图2中分别是fe3o4,atp/fe3o4和atp的xrd图。和atp相比,atp/fe3o4具有fe3o4的六个特征峰(30.1、35.44、43.08、53.58、57.16和62.78),表明fe3o4与atp结合。此外,位于26.52处的峰与atp的主衍射平面具有良好的一致性。结果表明已成功合成了atp/fe3o4。
图3分别是使用vsm在-5至5koe的磁场下获得的fe3o4和fe3o4/atp的磁滞回线。fe3o4和fe3o4/atp的磁化饱和度的最大值为9.73和6.16emu·g-1。与fe3o4相比,fe3o4/atp的饱和磁化强度降低了。饱和磁化强度的降低是由于成功复合了非磁性的atp。较纯fe3o4而言,由于复合了无磁性的atp而有所降低,但还有较强的磁性;而图4中,显示的是共沉淀法制备的fe3o4/atp磁滞回线,经过多次反复实验,共沉淀法合成的fe3o4/atp几乎无磁性,因此选择溶剂热法合成fe3o4/atp为本文中的优选方法。
步骤2:fe3o4/atp的改性
为了后续进行温敏单体在载体材料表面进行交联和聚合,需要在载体的表面修饰含有c=c键的基团,因此,设计了kh-570对载体材料表面进行修饰的构思,具体步骤是将硅烷偶联剂γ-甲基丙烯酰氧基丙基三甲氧基硅烷(kh-570)用作表面改性剂。将kh-570的乙烯基引入到fe3o4/atp的表面上,然后将该乙烯基用于与nipam的乙烯基连接从而实现kh-570的接枝。具体的步骤是:1.0ml去离子水和1.0gfe3o4/atp分散在100ml甲苯中,然后将3.0mlkh-570加入上述混合物中。将该溶液倒入250ml三颈烧瓶中,并在搅拌下在超声下溶解40分钟。然后将混合物在45-50℃下搅拌,整个过程持续4h。最终,kh-570改性的fe3o4/atp用甲苯和乙醇洗涤,用磁铁分离,在真空烘箱中于65°c干燥。
为了在fe3o4/atp表面引入c=c键,作为对照,还依次采用油酸(oa)、十六烷基三甲基溴化铵(ctab)进行了表面改性。
油酸(oa)改性fe3o4/atp
将1.0gfe3o4/atp纳米粒子重新分散于180ml的去离子水中,在氮气保护下,加热至60℃,然后在30min内往分散液中加入0.9g油酸和3mlnh3·h2o。加入之后,将混合液加热至80℃,出现沉淀。沉淀物用丙酮清洗3次,然后在真空干燥箱中干燥24h,温度保持为80℃。产物即为oa-fe3o4/atp。
十六烷基三甲基溴化铵(ctab)改性fe3o4/atp
取0.5g的fe3o4/atp,加入质量分数为fe3o4/atp20%的ctab,超声溶解分散30min,机械搅拌16h。将最后取得的产物用去离子水清洗,用磁铁进行分离多次,真空干燥过夜。
图5是油酸改性合成的fe3o4/atp-p(nipam-aam)的ir图谱,由图可以看出,在1038和580cm-1附近无si-o和fe-o峰,说明未合成成功。
图6是ctab改性合成的fe3o4/atp-p(nipam-aam)的ir图谱,由图可以看出,在1038和580cm-1附近无si-o和fe-o峰,说明没有atp和fe3o4;认定为未合成成功。
图7是atp,fe3o4,fe3o4/atp和kh-570-fe3o4/atp的红外光谱。图7当中的(a)是atp的曲线,它在1035cm-1处有一个明显的峰,对应于凹凸棒土中si-o的伸缩振动峰。(b)曲线中,580cm-1处为fe3o4的fe-o伸缩振动峰。(c)曲线同时具有了fe3o4和atp的特征吸收峰。与(c)曲线相比,(d)曲线中出现了-ch3和-ch2的拉伸振动峰,分别在2876cm-1和2930cm-1处,表明kh-570改性成功。
每个方法均经过多次平行实验,oa和ctab改性的fe3o4/atp均在后续的合成fe3o4/atp-p(nipam-aam)中合成失败。究其原因,可能是因为现有技术中的一些油酸和ctab改性的对象为fe3o4,而并非为fe3o4/atp,kh-570能与无机物表面的吸附水反应,atp表面有大量的羟基可与之形成牢固的黏合,而kh-570中的一部分官能团可与有机分子反应,因此更适用于本实验中fe3o4/atp的有机改性。因此选择kh-570为改性fe3o4/atp的优选方法。
步骤3:fe3o4/atp-p(nipam-aam)的制备
由于fe3o4/atp的材料表面形貌较为复杂,同时存在着凹凸棒石的一维纳米材料的特征,也同时含有fe3o4的纳米颗粒负载的特征,同时表面也存在着接枝的kh570,因此,如何能够将这样的一个特殊材料作为载体而制备出复合的温敏凝胶,存在着较大的不可预期性。本专利同样对合成过程进行了摸索。
乳液聚合法:将kh-570改性的fe3o4/atp分散在去离子水中,得到浓度为0.025-0.04g·ml-1的fe3o4/atp分散体。将0.4gnipam,0.04g的aam,5mgmba和2mgsds加入1-2mlfe3o4/atp分散液中然后将溶液用30ml去离子水分散。将上述溶液用氮气吹扫20-50分钟除去溶液中的氧气,将温度升至70°c后用注射器将1mlaps(3mg·ml-1)和1mlsps(2.5mg·ml-1)加入溶液中并搅拌6h。整个过程保持氮气气氛。反应完成后,将其冷却至室温,然后在去离子水中透析7天,以除去未反应的单体和杂质,得到fe3o4/atp-p(nipam-aam)。将产物冷冻干燥。
为进行对比,同时还采用了溶液聚合法、原位聚合法。
对照实验1:将kh-570改性的fe3o4/atp分散在去离子水中,得到浓度为0.025-0.04g·ml-1的fe3o4/atp分散体。将0.4gnipam,0.04g的aam和5mgmba加入1-2mlfe3o4/atp分散液中然后将溶液用30ml去离子水分散。将上述溶液用氮气吹扫20-50分钟除去溶液中的氧气,将温度升至70°c后用注射器将1mlaps(3mg·ml-1)和1mlsps(2.5mg·ml-1)加入溶液中并搅拌6h。整个过程保持氮气气氛。反应完成后,将其冷却至室温,然后在去离子水中透析7天,以除去未反应的单体和杂质,得到fe3o4/atp-p(nipam-aam)
对照实验2:首先合成p(nipam-aam)聚合物。取0.4g的nipam和0.04g的aam,超声溶解完全后氮气鼓泡除氧30min,磁力搅拌,温度升高至60~70℃时逐滴加入1mlaps(3mg·ml-1)和1mlsps(2.5mg·ml-1)。反应6h,全程保持氮气氛围。反应完成后,将其冷却至室温,然后在去离子水中透析7天,以除去未反应的单体和杂质,得到p(nipam-aam)。取0.2g的atp和1.0g的feso4,超声分散于上述制备的p(nipam-aam)中,机械搅拌16h,全程保持氮气氛围,快速加入2ml的氨水,反应半小时后,用磁铁进行分离,用清水反复清洗多次。
溶液聚合法合成fe3o4/atp-p(nipam-aam)时,得到的材料ir图谱如图8所示。溶液聚合法经过多次试验后均未能成功合成fe3o4/atp-p(nipam-aam)。由图可以看出,1547cm-1处-nh的弯曲振动峰,2876、2930和2973cm-1处-ch3和-ch2都不存在,表明p(nipam-aam)未能包覆在fe3o4/atp上或者量太少,认定为未能成功合成fe3o4/atp-p(nipam-aam)。
原位聚合法合成fe3o4/atp-p(nipam-aam)ir图谱如图9所示。可以看出,图中无1038cm-1左右处的si-o峰,聚合物中不存在atp,认定为未合成成功。原位聚合法合成fe3o4/atp-p(nipam-aam)tem图,如图10所示,可以看出,tem图中看不出atp的存在,认定为fe3o4/atp-p(nipam-aam)合成失败。原位聚合法通过多次实验后,均未能成功合成fe3o4/atp-p(nipam-aam)。
图11的(a)区域和(b)区域所示的透射电子显微镜(tem)图像显示了fe3o4/atp和fa-fe3o4/atp-p(nipam-aam)的形态和结构。相比于fe3o4/atp,fa-fe3o4/atp-p(nipam-aam)的外面有一层灰色的凝胶层。因此,可以说明fe3o4/atp已成功被p(nipam-aam)包覆。图11的(c)区域和(d)区域分别是fe3o4//atp和fa-fe3o4//atp-p(nipam-aam)的sem图。fe3o4/atp表面不规则。相比而言,外层明显较fe3o4/atp平整,fa-fe3o4/atp-p(nipam-aam)的表面明显带有一层凝胶。
乳液聚合法合成fe3o4/atp-p(nipam-aam)ir图谱如图12所示,由图可以看出,1385cm-1和1456cm-1是n-异丙基酰胺上的-ch伸缩振动峰,1547cm-1是-nh的弯曲振动峰,2876、2930和2973cm-1是-ch3和-ch2,1644cm-1是c=o双键的拉伸振动峰。si-o的弯曲振动峰为1035cm-1。580cm-1处为fe-o的伸缩振动峰,表明合成成功。
经过多次试验均失败的原因可能是,溶液聚合法中整个分散体系不稳定,在搅拌的过程中fe3o4/atp沉淀在最下方,而原位聚合法失败的原因可能是首先合成的p(nipam-aam)聚合物已经是一个比较稳定的体系,不容易再将fe3o4/atp合成上去。因此选择乳液聚合法为合成fe3o4/atp-p(nipam-aam)的优选方法。
步骤4:fa-fe3o4/atp-p(nipam-aam)的制备
nipam作为研究最广泛的智能材料之一,其温敏性使其在药物传递领域中有着广泛的应用。但是pnipam的lcst温度为32℃左右,低于人体生理温度,在细胞实验中的应用会有局限性,因此本发明加入aam以调节复合材料的lcst。通过调节aam与nipam的配比,将lcst提高至人体温度以上,更适用于细胞实验。
首先,将0.034mmn-羟基琥珀酰亚胺(nhs),1.3mg1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(edc)和1.3mg叶酸溶解在dmso中。将20mg的fe3o4/atp-p(nipam-aam)分散在20ml的pbs(ph7.4)中,并用hcl调节ph值至4.5-4.7。将上述fa溶液混合入fe3o4/atp-p(nipam-aam)溶液中,在黑暗环境下搅拌16小时后,用naoh将ph值调节至9.0结束反应,在pbs溶液(ph7.4)和去离子水(mwco14,000)中透析6天。将所得的fa-fe3o4/atp-pnipam-aam)真空干燥。
图13的a区域为atp,fe3o4,fe3o4/atp,kh-570-fe3o4/atp,p(nipam-aam)和fe3o4/atp-p(nipam-aam)的红外光谱。第2步中已定性表述过图13的a区域的(a)~(d)。在图13的a区域(e)曲线中,1385和1456cm-1是异丙基上的-ch伸缩振动峰,1547cm-1是-nh的弯曲振动峰,2876、2930和2973cm-1是-ch3和-ch2,1644cm-1是c=o双键的拉伸振动峰。si-o的弯曲振动峰为1035cm-1。与图13的a区域(e)相比,图13的a区域(f)中有si-o和fe-o的特征吸收峰,表明fe3o4/atp-p(nipam-aam)已成功接枝。
图13的b区域是atp、fe3o4/atp、kh-570-fe3o4/atp和fe3o4/atp-p(nipam-aam)的热重图。从图中可以看出,对比atp、fe3o4/atp,由于kh-570-fe3o4/atp有有机链段,失重率增加,而fe3o4/atp-p(nipam-aam)由于包裹了凝胶层,失重率较前三者大大增加,可以说明fe3o4/atp-p(nipam-aam)的成功合成。
图13的c区域是fa,fe3o4/atp-p(nipam-aam),fe3o4/atp-p(nipam-aam)的uv光谱。fa的吸收峰为225nm,fe3o4/atp-p(nipam-aam)的吸收峰为280nm。根据谱图显示可以说明成功合成了fa-fe3o4/atp-p(nipam-aam)。
fa-fe3o4/atp-p(nipam-aam)的热响应曲线如图13的d区域所示,通过dls监测流体力学直径在27.0-49.0℃的温度范围内的变化。与pnipam微凝胶的lcst(32.0℃)相比,fa-fe3o4/atp-p(nipam-aam)的lcst由于丙烯酰胺的亲水性基团提升至约38.5℃。该温度接近人体的温度,有望将其用于靶向持续释放抗癌药物的研究中。
另外,本专利中对nipam和aam的质量比进行了优化,质量比选择从10:1~14:1(nipam:aam),利用zeta电位仪测定各个比例的聚合物从30℃逐渐升温至45℃过程中的粒径,在达到lcst时,粒径会明显变小,从而可以估计其lcst。表1为不同比例的p(nipam-aam)的lcst的初步测定。
表1不同比例的p(nipam-aam)的lcst
当nipam与aam比例为10:1时,lcst稍高于人体正常体温,适用于细胞实验中。
nipam与aam质量比为10:1时粒径随温度的变化dls曲线如图14所示,从图13中可以看出,p(nipam-aam)的lcst在38.5℃左右,与表1中zeta电位仪测定的基本相同。因此选择nipam:aam质量比为10:1时作为最佳合成比。
经过反复实验,最终选择的合成条件为溶剂热法合成fe3o4/atp,利用kh-570对fe3o4/atp进行有机改性,nipam和aam的质量比确定为10:1,采用乳液聚合法合成fe3o4/atp-p(nipam-aam)。
体外研究
体外药物负载和释放研究
将20mgfe3o4/atp-p(nipam-aam)和5mgdox溶于20ml去离子水中。将混合物放入冰箱中,使其温度保持在4℃以使纳米凝胶完全溶胀。药物负载过程保持48小时。
将以上溶液放入去离子水中并透析4小时。每半小时更换一次水。用紫外可见分光光度计测量外部水的浓度,从而可以计算出载药率。在26至50℃之间每半小时测量一次dox吸光度,温度梯度为2℃。
通过uv可见分光光度计在225nm的波长处确定dox的负载和释放量。
图15是p(nipam-aam)和fe3o4/atp-p(nipam-aam)的dox释放量对比图。图15的(a)区域是p(nipam-aam)的光谱。从26.0到28.0℃时dox释放量的激增可能是由于游离dox负载在微凝胶上未透析干净。p(nipam-aam)和fe3o4/atp-p(nipam-aam)的趋势在26.0-30.0℃之间基本相同。从图中可以看出,由于纳米凝胶的溶胀,dox的释药量在38.5℃附近大大增加,这与dls的结果相对应。与p(nipam-aam)相比,fe3o4/atp-p(nipam-aam)的负载率从61.91%提高到66.84%,释放率从36.46%增加到44.55%。atp的优势显而易见,可以提高dox的负载能力和释放量。
细胞培养
人肝癌细胞(hepg2)购自美国典型培养物保藏中心(atcc)。将hepg2细胞在含有10%fbs和1%抗生素的dmem培养基中于37°c的heracell150培养箱(thermofisherscientificinc.,美国)中进行培养。
体外细胞毒性
mtt测定法用于确定fa-fe3o4/atp-p(nipam-aam)的细胞毒性。简而言之,将细胞以每孔2×105的密度接种到96孔板中。温育过夜后,用不同浓度的样品处理细胞。温育48小时后,添加mtt溶液的培养基。根据以下公式计算细胞存活率:
为了评估fa-fe3o4/atp-p(nipam-aam)聚合物的安全性,分别用6.25、12.5、25、50、100和200μg·ml-1的微凝胶溶液处理hepg2细胞。如图16的(a)柱所示,用不同浓度的fa-fe3o4/atp-p(nipam-aam)处理48小时,当浓度低于200g·ml-1时,对hepg2细胞没有产生明显的细胞毒性。当浓度达到200g·ml-1时,细胞活力为67.24%。可能是由于fe3o4/atp-p(nipam-aam)上大量的fa对癌细胞有杀伤作用。这表明合成的fa-fe3o4/atp-p(nipam-aam)聚合物是安全的,可在生物医学领域用作药物输送的载体。
图16是细胞毒性试验的结果对比,从图16的(b)柱和(c)柱可以看出,游离dox和负载dox的fa-fe3o4/atp-p(nipam-aam)np对hepg2细胞具有剂量依赖性的抑制作用。随着浓度的增加,细胞毒性增加,但当浓度低于100g·ml-1时,dox的细胞毒性高于负载dox的fa-fe3o4/atp-p(nipam-aam)的细胞毒性。这主要是由于dox具有很强的抗癌活性,可以使细胞凋亡。当浓度达到100g·ml-1或更高时,负载dox的fa-fe3o4/atp-p(nipam-aam)的细胞毒性略高于dox。它可能是由dox和fa对癌细胞的杀伤作用引起的。ic50(半数抑制细胞增殖的浓度)的值分别为72.207和98.247g·ml-1。负载dox的fa-fe3o4/atp-p(nipam-aam)对癌细胞的抑制作用弱于游离dox,可能是由于fa-fe3o4/atp-p(nipam-aam)纳米粒子的释放过程是缓慢释放的而不是一次性释放造成的。因此,对于高毒性的dox,有必要选择合适的载体来构建缓释系统来治疗传统癌症,并减少药物在过程中或正常部位的运输过早释放。
叶酸与叶酸受体fr会优先特异性结合,在癌症细胞表面fr过表达,因此对比正常细胞,叶酸会优先与癌症细胞结合,达到靶向性的效果。接枝在fe3o4/atp-p(nipam-aam)上后,该复合物整体具有靶向性,能够有效识别癌症细胞,避免在运输过程中药物的过早释放,造成对正常细胞的杀伤。
体外细胞摄取研究
将hepg2细胞以每孔3×105的密度接种在6孔板中,然后再培养16至20小时。在指定的时间点用200μg·ml-1的fa-fe3o4/atp-p(nipam-aam)处理细胞。然后除去培养基,将细胞用pbs洗涤3次,用4%多聚甲醛固定15分钟,用pbs洗涤3次,并加入1ml2μg·ml-1鬼笔环肽-fitc溶液15min。最后,将细胞用具有dapi的抗褪色固定培养基染色,并在lsm700激光共聚焦显微镜下观察。
为了进一步研究fa-fe3o4/atp-p(nipam-aam)对肝癌细胞的靶向作用,选择dox作为模型药物以试验细胞对微凝胶的摄取作用。使用hepg2细胞进行细胞摄取的定性测试。蓝色荧光信号是dapi阴性染色的细胞核,周围的红色荧光信号是dox的摄入量。如图17所示,将hepg2细胞与负载dox的fa-fe3o4/atp-p(nipam-aam)孵育3小时后,dox负载的fa-fe3o4/atp-p(nipam-aam)被hepg2细胞吞噬。在细胞质基质中观察到红色荧光信号。clsm测试的结果表明,当时间增加到6h时,游离dox组与孵育3h的hepg2细胞相比,游离dox组细胞的红色荧光信号几乎没有变化,而fa-fe3o4/atp-p(nipam-aam)的红色荧光信号与孵育3小时的组相比dox荧光信号显著增强。可以说明fa-fe3o4/atp-p(nipam-aam)具有持续释放药物的作用,可有效延长药物的作用时间。
- 还没有人留言评论。精彩留言会获得点赞!