一种黄芪多糖在防治糖皮质激素性骨质疏松中的应用的制作方法
本发明涉及医药发明领域,具体涉及一种黄芪多糖在防治糖皮质激素性骨质疏松中的应用。
背景技术:
骨质疏松(op)是一种以骨量降低、骨脆性增加、骨微结构破坏、易造成骨折为特征的全身性骨病[1-2],可分为原发性和继发性两大类。随着糖皮质激素(gcs)在临床上广泛应用,其长期应用所引起的糖皮质激素性骨质疏松(giop)已成为继发性骨质疏松最常见的原因[3],同时也是中青年骨质疏松症最常见的原因[4]。目前并无有效的治疗方法。近年来的研究表明,对成骨细胞骨生成活性的抑制,是糖皮质激素导致骨质疏松的主要原因[5-6]。维生素d是一种类固醇衍生物,可通过抑制成骨细胞凋亡、促进成骨细胞形成等多种作用维持骨骼的正常生长发育[7]。目前,临床将其作为治疗giop的基础药物之一。黄芪,古称黄耆,李时珍在《本草纲目》中释其名曰:“耆,长也。黄耆色黄,为补药之长,故名”。《本经逢原》中认为黄芪既能入肺而固表虚自汗,又能入脾而托已溃痈疡,还能补肾脏元气不足,利尿消肿,乃上中下内外三焦补虚之圣药。
中医学依据骨质疏松的症状及发病机理,将其归为“肾虚腰痛”“骨萎”“骨枯”“骨痹”的范畴,骨骼脆弱无力、易于发生骨折是由于肾精亏虚、骨髓乏源所致[25]。依据中医药理论,糖皮质激素被定性为“纯阳”之品,大剂量外源性糖皮质激素的长期应用,易导致肾阴亏虚,当对这种外源性纯阳之品进行撤减时,肾阳又因失去其“助养”而导致肾阳虚衰。其根本病机在于肾脏阴阳失调,肾元亏虚,筋骨失养而导致骨质疏松症的发生。文献记载黄芪具有补益肾气的作用,近年来有学者分析755首中药处方所治疗糖尿病及其并发症的病症类型分析发现黄芪是糖尿病肾病中医治疗的常用药材,使用频次2288次,占比7.7%,居用药首位[26]。药理研究表明,黄芪可不同程度改善广防己长期应用所诱发的大鼠肾功能损伤,降低血浆肌酐、尿素氮水平,减轻肾组织病理学改变[27]。多机制研究发现黄芪可通过免疫调节、抗氧化、降纤等作用对各种原发性慢性肾小球疾病及减少疾病复发方面起着重要作用。同时,黄芪在改善骨质疏松方面也有明显的有效性及安全性,实验研究发现黄芪可增强去卵巢大鼠碱性磷酸酶活性,抑制骨胶原、骨磷的丢失以防治骨质疏松,并且随着用药时程的增加,对骨组织的改善作用更为明显[28]。黄芪多糖是黄芪的主要水溶性化学成分之一,其主要生物学活性包括了免疫调节、抗氧化、抗炎、抗肿瘤及降血糖等作用[29]。研究表明黄芪多糖抑制大鼠系膜细胞增生、改善mspgn大鼠蛋白尿症状与抑制il-6的分泌密切相关[30]。黄芪多糖显著提高高糖诱导下肾小管上皮细胞的细胞活力、抑制其细胞凋亡与调节axin-1、β-catenin蛋白表达促使wnt信号通路失活相关[31]。陆讯等[32]采用单侧输尿管结扎法制造大鼠肾间质纤维化模型,灌胃给予不同浓度黄芪多糖治疗21d后发现黄芪多糖可以在一定程度上抑制肾间质纤维化的形成,保护肾脏。黄芪多糖的这种抗系膜细胞增生、抗肾小管上皮细胞凋亡及抗肾间质纤维化的保护作用或许就是黄芪“补肾虚”的具体表现之一。另有研究将不同浓度的黄芪多糖加入体外培养的大鼠原代成骨细胞培养液中发现黄芪多糖可通过促进bmp-2的表达、上调其下游的erkmapk和p38mapk的磷酸化水平来促进成骨细胞增殖、分化[33]。这或亦是“肾主骨”理论的实验依据之一。
糖皮质激素的长期使用、尤其是大剂量使用是临床继发性骨质疏松发生的常见病因,由此导致骨折发生率增加30%至50%[9]。成骨细胞是促进骨形成的重要功能细胞,成骨细胞的增殖和分化被抑制是骨质疏松形成机制的重要影响因素,长期超负荷使用糖皮质激素不仅可抑制成骨细胞增殖分化,还可导致成骨细胞凋亡,同时增强破骨细胞的骨吸收活性,导致骨量不可逆丢失,骨小梁减少或断裂,最终进展为骨质疏松。因此,提高成骨细胞增殖、分化水平是防治糖皮质激素性骨质疏松关键之一。bax、bcl-2蛋白均属bcl-2超家族的成员,改变线粒体膜的通透性是该类蛋白调节细胞色素c释放的重要机制,进而调控细胞的凋亡过程[10-11]。bax是促细胞凋亡蛋白的代表,分布在细胞浆中,与bcl-2结合形成的异源二聚体是抑制细胞凋亡所必需的,自身形成同源二聚体为促进凋亡所必需的。当bax接受到凋亡信号的刺激后,其分子构象发生了改变,bax由胞浆转移至线粒体外膜上,bax同源二聚化后,对抗bcl-2等抑制凋亡蛋白,最终活化细胞凋亡信号转导的共同通路促凋亡蛋白caspase家族成员蛋白酶[12]。半胱氨酸蛋白酶类和特异酶切天冬氨酸位点为caspase蛋白酶家族具有两大特点[13],该家族蛋白可通过系列酶解反应降低细胞dna修复能力,间接导致细胞凋亡,是凋亡信号传导的共同通路[14-15]。其中,caspase3是caspase家族调亡级联反应中的最终执行者[16]。前期研究表明,黄芪多糖在一定浓度范围内可显著提高mc-3t3-e1成骨细胞的增殖率[8]。
本发明团队前期离体实验研究发现,黄芪主要成分之一,黄芪多糖在一定浓度范围内可显著提高mc-3t3-e1成骨细胞的增殖率,并推断黄芪多糖治疗骨质疏松症可能与vdr具有一定程度的相关性[8]。本发明旨在观察黄芪多糖对地塞米松诱导的mc3t3-e1成骨细胞凋亡蛋白、维生素d受体及相关蛋白表达的影响,为进一步探讨黄芪多糖防治继发性骨质疏松的机制,以证实黄芪多糖在防治糖皮质激素性骨质疏松中的应用。
技术实现要素:
本发明的目的是提供一种黄芪多糖在防治糖皮质激素性骨质疏松中的应用。
本发明的具体内容如下:
本发明提供一种黄芪多糖在防治糖皮质激素性骨质疏松中的应用。
具体的,所述于黄芪多糖对地塞米松抑制mc-3t3-e1成骨细胞增殖抑制作用。
具体的,所述黄芪多糖降低地塞米松对mc-3t3-e1成骨细胞bax、caspase3蛋白表达的促进作用。
具体的,所述黄芪多糖对地塞米松诱导mc-3t3-e1成骨细胞vdr、cyp27b、cyp24a蛋白表达中的调节作用。
进一步的,黄芪多糖在防治糖皮质激素性骨质疏松制剂中的应用。
更进一步的,所述制剂为加入药学上可接受的辅料制备成药学上可接受的制剂。
更进一步的,所述药学上可接受的制剂为固体制剂或液体制剂。
更进一步的,所述固体制剂为颗粒剂、胶囊剂、片剂、丸剂、
更进一步的,所述固体制剂为散剂、冻干粉针剂。
更进一步的,所述液体制剂为注射制剂、口服液。
本发明所述的药学上可接受的辅料没有限定,可以是润滑剂、填充剂、矫味剂、崩解剂、抗氧化剂、表面活性剂或等本领域常用辅料中的一种或几种。
本发明有益效果:
1、本发明与现有技术相比:
本研究团队前期离体实验研究发现,黄芪主要成分之一,黄芪多糖在一定浓度范围内可显著提高mc-3t3-e1成骨细胞的增殖率,并推断黄芪多糖治疗骨质疏松症可能与vdr具有一定程度的相关性[8]。本发明旨在观察黄芪多糖对地塞米松诱导的mc3t3-e1成骨细胞凋亡蛋白、相关蛋白表达的影响,进一步探讨了黄芪多糖防治继发性骨质疏松的机制,证实了黄芪多糖在防治糖皮质激素性骨质疏松中的应用。
2、本发明通过mtt法检测黄芪多糖对地塞米松抑制mc-3t3-e1成骨细胞增殖作用的影响证实,与正常组比较,模型组(地塞米松)可在24h、36h、48h显著抑制mc-3t3-e1成骨细胞增殖(p<0.01),抑制率为23.14%~26.10%。黄芪多糖各剂量组可在不同程度上改善地塞米松对mc-3t3-e1成骨细胞增殖抑制作用。
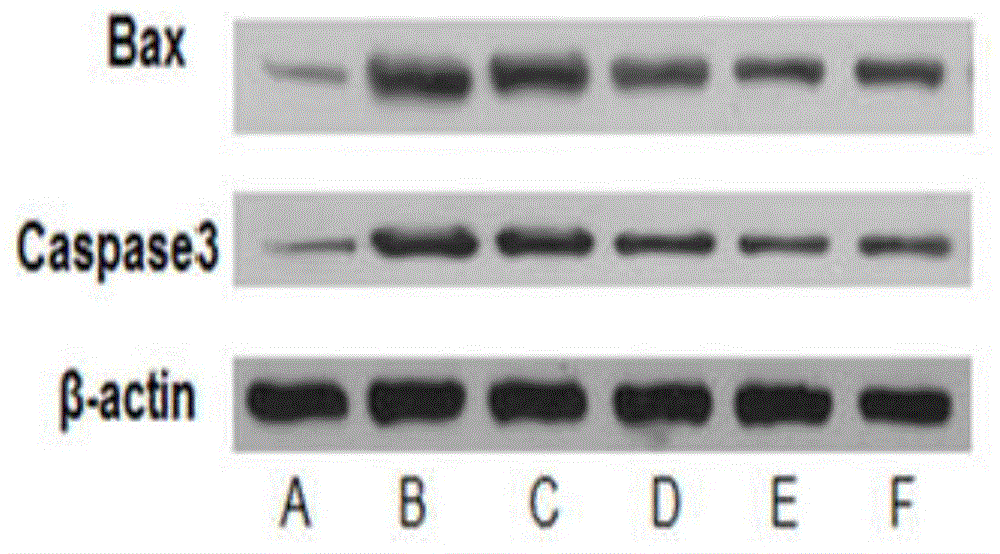
3、本发明通过westernblot方法检测黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞bax、caspase3蛋白表达的影响证实,模型组(地塞米松)bax、caspase3蛋白表达量显著高于正常组(p<0.01)。与模型组比较,黄芪多糖可显著降低地塞米松对mc-3t3-e1成骨细胞bax、caspase3蛋白表达的促进作用(p<0.01)。
4、本发明通过westernblot方法检测黄芪多糖对对地塞米松诱导mc-3t3-e1成骨细胞vdr、cyp27b、cyp24a蛋白表达证实,与正常组比较,模型组vdr、cyp27b蛋白表达量显著降低(p<0.01),cyp24a蛋白表达量则明显升高(p<0.01)。与模型组比较,黄芪多糖各剂量组可不同程度上调vdr、cyp27b蛋白表达量,以中高剂量组较为显著(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。与模型组比较,黄芪多糖在剂量为0.01μg·ml-1、0.1μg·ml-1、1μg·ml-1时均可下调cyp24a蛋白表达量(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。
附图说明
图1黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞bax、caspase3蛋白条带图(a.正常组;b.模型组;c.黄芪多糖低剂量组;d.黄芪多糖中剂量组;e.黄芪多糖高剂量组;f.维生素d组)。
图2黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞骨质疏松模型vdr、cyp24、cyp27蛋白条带图(a.正常组;b.地塞米松组;c.黄芪多糖低剂量组;d.黄芪多糖中剂量组;e.黄芪多糖高剂量组;f.维生素d组)。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
实施例1
1.材料与仪器
1.1mc-3t3-e1成骨细胞(购买于中国科学院上海细胞库)
1.2药物与试剂
黄芪多糖(北京索莱宝科技有限公司,批号:20161122);dmem培养基(美国hyclone公司,批号:ad18108064);地塞米松磷酸钠注射液(山东辰欣药业股份有限公司,批号:1711292121);胎牛血清(gibco公司,批号:1828728);dmso(北京索莱宝科技有限公司,批号:302a0332);mtt(北京索莱宝科技有限公司,批号:82920511);bca蛋白定量试剂盒(北京康为世纪生物科技有限公司,批号:30324);bax抗体(epitomics,批号:yh092606c);caspase3抗体(assay,批号:210879);vdr(abcam,批号:gr283190-2);cyp27抗体(abcam,批号:b6376)、cyp24抗体(博奥森,批号:af11172582);β-actin抗体(北京康为世纪生物科技有限公司,批号:40241);二抗(hrp兔)(康为世纪,批号:03802/30334);二抗(hrp鼠)(康为世纪,批号:03803/30339);eeclwesternblotkit(北京康为世纪生物科技有限公司,批号:30330)。
1.3仪器
cusa31311型co2培养箱(美国sheldon公司);ts-100f型倒置相差显微镜(日本尼康公司);msl-3020型三洋全自动高压灭菌锅(日本三洋有限公司);centrifuge5415d型号离心机(eppendorf);elx808iu型自动酶标仪(美国bio-tek公司);小型垂直电泳槽(美国bio-rad公司);chemidoctmxrs+化学发光凝胶成像系统(美国bio-rad公司)。
2.方法
2.1细胞培养与分组
将mc-3t3-e1成骨细胞单层贴壁生长在含有10%胎牛血清的dmem基础培养基中,置于37℃,5%co2培养箱中进行传代培养。将对数生长期的细胞随机分为6组,正常组(使用培养基正常培养无其他干预因素)、模型组(地塞米松10-6mol·l-1)、黄芪多糖低剂量组(地塞米松10-6mol·l-1+黄芪多糖0.01μg·ml-1)、黄芪多糖中剂量组(地塞米松10-6mol·l-1+黄芪多糖0.1μg·ml-1)、黄芪多糖高剂量组(地塞米松10-6mol·l-1+黄芪多糖1μg·ml-1)、维生素d组(地塞米松10-6mol·l-1+维生素10-5mmol·l-1)。
2.2mtt法检测黄芪多糖对mc-3t3-e1成骨细胞的增殖作用
取对数生长期细胞,用含10%胎牛血清dmem培养液重悬细胞,使细胞密度变成3×104个/ml。分别接种在3块无菌96孔培养板上,每孔100μl,待细胞贴壁后,同步24h后去除全培养液,用pbs洗涤一次,加入稀释于培养液的不同浓度的药物。实验分成6组,每组6个复孔,3块板分别培养24h、36h、48h后各取出1块培养板,加入mtt溶液(5mg·ml-1)20μl,于37℃、5%co2的培养箱,培养4h以上,终止培养,弃去上清液。每孔加入150μldmso,室温振荡10min,在酶标仪490nm波长处测定各孔的光密度(od值),并计算细胞增殖率。实验重复3次,计算平均值。
2.3westernblot方法检测黄芪多糖对mc-3t3-e1成骨细胞bax、caspase3、vdr、cyp24a、cyp27b蛋白表达
按上述分组的细胞,给药培养48h后收集细胞,按细胞蛋白提取试剂盒上说明进行mc-3t3-e1成骨细胞总蛋白的提取;取上清液,用bca试剂盒测定蛋白浓度,将制备好的蛋白样品加入10%的凝胶中电泳,转膜,5%脱脂牛奶封闭2.5h,tbst洗膜,10min×3;caspase3加入一抗(1:500)、bax加入一抗(1:1000)、vdr加入一抗(1:100)、cyp27b加入一抗(1:1000)、cyp24a加入一抗(1:100)、摇床孵育,4℃过夜;tbst洗膜,10min×3,加入caspase3二抗(1:200),bax二抗(1:200);加入vdr二抗(1:200)加入cyp27b二抗(1:5000),cyp24a二抗(1:5000),以β-actin作为内参基因,摇床孵育3h;使用eeclwesternblotkit试剂盒发光显影,,凝胶成像系统分析结果。目的蛋白相对表达量=目的蛋白表达量/同一样本内参表达量。
2.4统计学处理:均数±标准差(x±s)表示,采用spss18.0统计软件单因素方差分析。
3.结果
3.1mtt法检测黄芪多糖对地塞米松抑制mc-3t3-e1成骨细胞增殖作用的影响
与正常组比较,模型组(地塞米松)可在24h、36h、48h显著抑制mc-3t3-e1成骨细胞增殖(p<0.01),抑制率为23.14%~26.10%。黄芪多糖各剂量组及维生素d组均可在不同程度上改善地塞米松对mc-3t3-e1成骨细胞增殖抑制作用,以黄芪多糖高剂量组较为显著(p<0.01)。维生素d组在24h、48h亦可显著改善地塞米松对mc-3t3-e1成骨细胞增殖抑制作用(p<0.05),其功效与黄芪多糖中剂量组相当,见表1。
表1黄芪多糖对地塞米松抑制mc-3t3-e1成骨细胞增殖作用的影响(
注:与正常组比较*p<0.05,**p<0.01;与模型组比较#p<0.05,##p<0.05。
3.2westernblot方法检测黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞bax、caspase3蛋白表达的影响
模型组(地塞米松)bax、caspase3蛋白表达量显著高于正常组(p<0.01)。与模型组比较,黄芪多糖及维生素d均可显著降低地塞米松对mc-3t3-e1成骨细胞bax、caspase3蛋白表达的促进作用(p<0.01)。见图1,表2。
表2黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞bax、caspase3蛋白表达的影响(
注:与正常组比较*p<0.05,**p<0.01;与模型组比较#p<0.05,##p<0.01。
3.3westernblot方法检测黄芪多糖对对地塞米松诱导mc-3t3-e1成骨细胞vdr、cyp27b、cyp24a蛋白表达
与正常组比较,模型组vdr、cyp27b蛋白表达量显著降低(p<0.01),cyp24a蛋白表达量则明显升高(p<0.01)。与模型组比较,黄芪多糖各剂量组可不同程度上调vdr、cyp27b蛋白表达量,以中高剂量组较为显著(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。与模型组比较,黄芪多糖在剂量为0.01μg·ml-1、0.1μg·ml-1、1μg·ml-1时均可下调cyp24a蛋白表达量(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。同时,与模型组比较,维生素d可显著上调vdr、cyp27b蛋白表达量、下调cyp24a蛋白表达量(p<0.01),但其作用效果介于黄芪多糖中、高剂量组之间。见图2,表3。
表3黄芪多糖对地塞米松诱导的mc-3t3-e1成骨细胞骨质疏松模型vdr、cyp24a、cyp27b蛋白表达的影响(
注:与正常组比较*p<0.05,**p<0.01;与模型组比较#p<0.05,##p<0.01。
实施例2
取黄芪多糖苷作为原料药,加入1/9的淀粉或糊精,制粒,得颗粒剂。
实施例3
取黄芪多糖作为原料药,加入1/9的淀粉或糊精,混匀,装入胶囊,得胶囊剂。
实施例4
取黄芪多糖作为原料药,加入及1/11的淀粉或糊精混合均匀,干燥,制成丸剂。
实施例5
取黄芪多糖作为原料药,加入1/10的淀粉,制粒,压片,制成片剂。
实施例6
取黄芪多糖作为原料药,加入10倍量的注射用水,浸泡1小时,过滤,灭菌,得注射剂。
实施例7
取黄芪多糖作为原料药,加入9倍量的注射用水,浸泡1小时,过滤,冻干,得冻干粉剂。
实施例8
取黄芪多糖作为原料药,加入6倍量纯净水,混合均匀,浸泡1.5小时,过滤,灭菌,得口服液。
综述:
糖皮质激素的长期使用、尤其是大剂量使用是临床继发性骨质疏松发生的常见病因,由此导致骨折发生率增加30%至50%[9]。成骨细胞是促进骨形成的重要功能细胞,成骨细胞的增殖和分化被抑制是骨质疏松形成机制的重要影响因素,长期超负荷使用糖皮质激素不仅可抑制成骨细胞增殖分化,还可导致成骨细胞凋亡,同时增强破骨细胞的骨吸收活性,导致骨量不可逆丢失,骨小梁减少或断裂,最终进展为骨质疏松。因此,提高成骨细胞增殖、分化水平是防治糖皮质激素性骨质疏松关键之一。bax、bcl-2蛋白均属bcl-2超家族的成员,改变线粒体膜的通透性是该类蛋白调节细胞色素c释放的重要机制,进而调控细胞的凋亡过程[10-11]。bax是促细胞凋亡蛋白的代表,分布在细胞浆中,与bcl-2结合形成的异源二聚体是抑制细胞凋亡所必需的,自身形成同源二聚体为促进凋亡所必需的。当bax接受到凋亡信号的刺激后,其分子构象发生了改变,bax由胞浆转移至线粒体外膜上,bax同源二聚化后,对抗bcl-2等抑制凋亡蛋白,最终活化细胞凋亡信号转导的共同通路促凋亡蛋白caspase家族成员蛋白酶[12]。半胱氨酸蛋白酶类和特异酶切天冬氨酸位点为caspase蛋白酶家族具有两大特点[13],该家族蛋白可通过系列酶解反应降低细胞dna修复能力,间接导致细胞凋亡,是凋亡信号传导的共同通路[14-15]。其中,caspase3是caspase家族调亡级联反应中的最终执行者[16]。前期研究表明,黄芪多糖在一定浓度范围内可显著提高mc-3t3-e1成骨细胞的增殖率[8]。本实验研究显示黄芪多糖高剂量组可显著改善地塞米松对mc-3t3-e1成骨细胞增殖抑制作用(p<0.01)。维生素d组亦可显著改善地塞米松对mc-3t3-e1成骨细胞增殖抑制作用,其功效与黄芪多糖中剂量组相当(p<0.05)。进一步研究表明,黄芪多糖各剂量组及维生素d对地塞米松诱导的mc-3t3-e1成骨细胞中促细胞凋亡代表性蛋白bax及凋亡的最终执行者caspase3蛋白表达均有显著抑制作用(p<0.01)。这表明黄芪多糖可有效保护mc-3t3-e1成骨细胞,显著改善地塞米松对其抑制状态及促凋亡作用。另有文献报道黄芪多糖不仅可显著促进化疗性骨髓抑制小鼠骨髓干细胞的增殖[17],还可促进该类细胞中bcl-2基因的表达、抑制其中bax和caspase9基因的表达[18]。
维生素d是治疗糖皮质激素性骨质疏松基础用药之一,其在生物体内的主要存在形式为25(oh)d3和1,25(oh)2d3。25(oh)d3在血清中较为稳定,含量最多,其血清浓度可代表机体维生素d的营养状况,为评估维生素d是否缺乏的可靠指标,亦可作为骨质疏松防治过程中可靠观察指标[19]。1,25(oh)2d3则是维生素d在生物体内发挥作用的主要活化形式。维生素d进入体内需经过两次羟化反应形成具有生物活性的1,25(oh)2d3,1,25(oh)2d3继而通过与维生素d受体(vitamindreceptor,vdr)结合发挥相应功能。1,25(oh)2d3本身又可诱导vdr的转录[20]。维生素d受体属于核受体,广泛存在于机体细胞内,参与免疫反应、细胞生长和凋亡等多种过程[21]。维生素d的许多生物学功能都是通过vdr介导调节靶基因转录来实现的[22]。
1,25(oh)2d3的活化与失活依赖于cyp27b基因和cyp24a基因编码的羟化酶[23],且二者为同源酶,共存于肾小管组织线粒体。肾小管细胞内的cyp27b的活性受甲状旁腺激素(parathyroidhormone,pth)刺激,受包括1,25(oh)2d3在内的多种因素抑制,但其机制尚不清楚[24]。cyp24a基因编码的羟化酶是1,25(oh)2d3的灭活酶,主要存在于肝肾,可以将1,25(oh)2d3羟化为1,24,25(oh)3d3而使其失活。本实验研究显示,与正常组比较,应用地塞米松造模后,模型组vdr、cyp27b蛋白表达量显著降低(p<0.01),cyp24a蛋白表达量则明显升高(p<0.01)。而维生素d可显著上调该模型细胞vdr、cyp27b蛋白表达量、下调cyp24a蛋白表达量(p<0.01)。
中医学依据骨质疏松的症状及发病机理,将其归为“肾虚腰痛”“骨萎”“骨枯”“骨痹”的范畴,骨骼脆弱无力、易于发生骨折是由于肾精亏虚、骨髓乏源所致[25]。依据中医药理论,糖皮质激素被定性为“纯阳”之品,大剂量外源性糖皮质激素的长期应用,易导致肾阴亏虚,当对这种外源性纯阳之品进行撤减时,肾阳又因失去其“助养”而导致肾阳虚衰。其根本病机在于肾脏阴阳失调,肾元亏虚,筋骨失养而导致骨质疏松症的发生。文献记载黄芪具有补益肾气的作用,近年来有学者分析755首中药处方所治疗糖尿病及其并发症的病症类型分析发现黄芪是糖尿病肾病中医治疗的常用药材,使用频次2288次,占比7.7%,居用药首位[26]。药理研究表明,黄芪可不同程度改善广防己长期应用所诱发的大鼠肾功能损伤,降低血浆肌酐、尿素氮水平,减轻肾组织病理学改变[27]。多机制研究发现黄芪可通过免疫调节、抗氧化、降纤等作用对各种原发性慢性肾小球疾病及减少疾病复发方面起着重要作用。同时,黄芪在改善骨质疏松方面也有明显的有效性及安全性,实验研究发现黄芪可增强去卵巢大鼠碱性磷酸酶活性,抑制骨胶原、骨磷的丢失以防治骨质疏松,并且随着用药时程的增加,对骨组织的改善作用更为明显[28]。黄芪多糖是黄芪的主要水溶性化学成分之一,其主要生物学活性包括了免疫调节、抗氧化、抗炎、抗肿瘤及降血糖等作用[29]。研究表明黄芪多糖抑制大鼠系膜细胞增生、改善mspgn大鼠蛋白尿症状与抑制il-6的分泌密切相关[30]。黄芪多糖显著提高高糖诱导下肾小管上皮细胞的细胞活力、抑制其细胞凋亡与调节axin-1、β-catenin蛋白表达促使wnt信号通路失活相关[31]。陆讯等[32]采用单侧输尿管结扎法制造大鼠肾间质纤维化模型,灌胃给予不同浓度黄芪多糖治疗21d后发现黄芪多糖可以在一定程度上抑制肾间质纤维化的形成,保护肾脏。黄芪多糖的这种抗系膜细胞增生、抗肾小管上皮细胞凋亡及抗肾间质纤维化的保护作用或许就是黄芪“补肾虚”的具体表现之一。另有研究将不同浓度的黄芪多糖加入体外培养的大鼠原代成骨细胞培养液中发现黄芪多糖可通过促进bmp-2的表达、上调其下游的erkmapk和p38mapk的磷酸化水平来促进成骨细胞增殖、分化[33]。这或亦是“肾主骨”理论的实验依据之一。课题前期研究表明,黄芪多糖能够治疗骨质疏松症其机制与提高成骨细胞活性及调节mc-3t3-e1成骨细胞cyp24a、cyp27b及vdrmrna及蛋白表达水平有关[8,34]。本实验中,与模型组比较,黄芪多糖在剂量为0.1μg·ml-1、1μg·ml-1时可显著上调mc-3t3-e1成骨细胞vdr、cyp27b蛋白表达量(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。同时黄芪多糖各剂量组均可显著下调cyp24a蛋白表达量(p<0.01),且在剂量为1μg·ml-1时与正常组比较无显著性差异(p>0.05)。因此,黄芪多糖对cyp24a、cyp27b及vdr蛋白表达调节作用效果强于维生素d。
综上,本实验结果提示黄芪多糖及维生素d可抑制促细胞凋亡因子bax、caspase3蛋白表达,降低地塞米松对mc-3t3-e1成骨细胞增殖抑制作用以达到防治地塞米松诱导的继发性骨质疏松的目的,为中药黄芪防治糖皮质激素性骨质疏松提供了新的思路。
参考文献
[1]choudharys,halboutp.strontiumranelatepromotesosteoblasticdifferentiationandmineralizationofmurinebonemarrowstromalcells:involvementofprostaglandins[j].jboneminerres,2007,22(7):1002-1010.
[2]王新祥,张允岭,黄启福.对骨质疏松症中医主要病机和现代病因学的认识与探讨[j].中国中医结合学报,2010,8(12):1119-1121.
[3]migliaccios,bramam,malavoltan.managementofglucocorticoids-inducedosteoposis:roleofteriparatide.therclinriskmanag,2009(5):305-310.
[4]grossmanjm,gordonr,ranganathvk,etal.ameicancollegeofrheumatology2010recommendationsforthepreventionandtreatmentofglucocorticoid-inducedosteoporosis.arthritiscareres(hoboken),2010,62(11):1515-1526.
[5]debbydenuyl,irenee.m.bultink,willemf.lems.advancesinglucocorticoid-inducedosteoporosis.currrheumatolrep,2011,13(3):233-240.
[6]maricicm.updateonglucocorticoid-inducedosteoporosis.rheumdisclinnortham,2011,37(3):415-431.
[7]b.lanske,m.s.razzaque,vitamindandaging:oldconceptsandnewinsights[j].jnutrbiochem,2007,18(12):771-777.
[8]柴艺汇,高洁,田兴中,等.黄芪多糖对mc-3t3-e1成骨细胞cyp27b,cyp24amrna及蛋白表达的影响[j].中国实验方剂学杂志,2018,24(13):147-151.
[9]briotk,rouxc.glucocorticoid-inducedosteoporosis[j].nihonrinshojapanesejournalofclinicalmedicine,2008,16(11):1812-1816.
[10]elmores.apoptosis:areviewofprogrammedcelldeath[j].toxicolpathol,2007,35(4):495.
[11]ouyangl,shiz,zhaos,etal.programmedcelldeathpathwaysincancer:areviewofapoptosis,autophagyandprogrammednecrosis[j].cellprolif,2012,45(6):487-498.
[12]tanko,funs,chansl,etal.map1isamitochondrialeffectorofbax[j].proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2005,102(41):14623-14628.
[13]mazumders,plesead,almasana.caspase-3activationisacriticaldeterminantofgenotoxicstress-inducedapoptosis[j].methodsinmolecularbiology,2008,1219(414):13-21.
[14]riedlsj,salvesengs.theapoptosome:signallingplatformofcelldeath[j].natrevmolcellbid,2007,8(5):405-413.
[15]duncanjs,turowecjp,vilkg,etal.regulationofcellproliferationandsurvival:convergenceofproteinkinasesandcaspases[j].biochimicaetbiophysicaacta-biomembranes,2010,1804(3):505-510.
[16]broughtonbr,reutensdc,sobeycg.apoptoticmechanismsaftercerebralischemia[j].stroke,2009,40(5):331-339.
[17]崔运浩,初杰,范颖,等.当归多糖、黄芪多糖及其配伍对化疗性骨髓抑制小鼠骨髓干细胞增殖和pi3k/akt信号转导通路的影响.中华中医药学刊,2019,37(6):1471-1478.
[18]崔运浩,初杰,范颖,等.当归多糖、黄芪多糖及其配伍对化疗性骨髓抑制小鼠骨髓干细胞凋亡和脱核因子的影响[j].辽宁中医药大学学报,2019,21(8):38-43.
[19]hanleyda,cranneya,jonesg,etal.vitamindinadulthealthanddisease:areviewandguidelinestatementfromosteoporosiscanada.cmaj.2010,182(12):610-618.
[20]sunx,zemelmb.1alpha,25-dihydroxyvitamindandcorticosteroidregulateadipocytenuclearvitamindreceptor.intjobes(lond),2008,32(8):1305-1311.
[21]carlbergc,quackm,herdickm,etal.centralroleofvdrconformationsforunderstandingselectiveactionsofvitamind3analogues[j].steroids,2001,66:213.
[22]teicherta,arnoldla,otienos,etal.quantificationofthevitamindreceptorcoregulatorinteraction[j].biochemistry,2009,48(7):1454.
[23]yaos,hongcc,lunettak,etal.abstract2794:geneticvariationsinvitamind-relatedpathwaysandbreastcancerriskinafricanamericanwomen[j].cancerresearch,2015,75(15supplement):2794-2794.
[24]谢忠建,程群,丁悦.维生素d代谢和作用[j].中华骨质疏松和骨矿盐疾病杂志,2018,11(1):26-33.
[25]李宁,谢兴文,陈欣,“肾主骨,生髓”理论在骨质疏松症研究中的应用[j].中国中医骨伤科杂志,2011,19(4):70-72.
[26]夏中尚,杜正彩,侯小涛,等.基于755首中药处方治疗糖尿病用药规律的研究[j].中草药,2018,49(3):739-744.
[27]梁琦,谢鸣,倪诚,等.广防己配伍黄芪肾毒性的代谢组学研究[j].浙江中医药大学学报,2010,34(1):42-43.
[28]潘静华,张海啸,李芳芳,等.黄芪对去卵巢大鼠骨组织的动态影响[j].中国中医基础医学杂志,2010,16(3):251-253.
[29]ruiwen,lichanyi,chenhongyuan,etal.progressofstructurecharacterizationandbiologicalactivitiesofastragaluspolysaccharides[j].traditionalchinesedrugresearch&clinicalpharmacology,2019,30(2):264-270.
[30]李智军,魏连波,贺丰,等.黄芪多糖治疗大鼠系膜细胞增生性肾炎的实验研究[j].中国中西医结合肾病杂志,2000,1(4):206-213.
[31]鲍芳,宋杰,代喆,等.黄芪多糖通过失活wnt信号通路抑制高糖诱导下肾小管上皮细胞凋亡[j].中药材,2019,42(2):414-417.
[32]陆讯,魏明刚.黄芪多糖对肾间质纤维化大鼠的保护作用[j].中华中医药杂志,2014,29(6):1998-2001.
[33]孔祥鹤,牛银波,王婷梅,等.黄芪多糖对大鼠原代成骨细胞的影响极其机制研究[j].中草药,2011,42(10):2065-2069.
[34]柴艺汇,高洁,陈云志,等.黄芪多糖对小鼠mc-3t3-e1成骨细胞维生素d受体mrna及蛋白表达的影响[j].时珍国医药,2018,29(6):1281-1283.
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!