一种带状疱疹疫苗组合物及其制备方法和应用与流程
本发明属于疫苗领域,特别涉及一种带状疱疹疫苗组合物及其制备方法和应用。
背景技术:
几乎所有儿童在长大成人前均感染过水痘-带状疱疹病毒(varicella-zostervirus,vzv),初次感染产生水痘,水痘自愈后病毒潜伏在神经节内,年龄老化或其他原因导致的细胞免疫应答削弱(如感染hiv或免疫抑制)会诱导体内病毒的再活化,从而导致带状疱疹的发生。
merk减毒苗zostavax对50-59,60-69以及70岁以上人群的保护率分别为70%,64%和38%左右。这种保护率随年龄增长的降低主要归因于伴随免疫系统老化出现的细胞免疫应答削弱。另外,由于相对于制备低滴度的水痘疫苗,技术方面制备和储存高病毒滴度的带状疱疹减毒活疫苗技术难度较大,国内疫苗企业尚无相关产品上市。
gsk的带状疱疹基因工程亚单位疫苗shingrix使用中国仓鼠卵巢细胞(chinesehamsterovary,cho)表达的保守性病毒糖蛋白e(ge)作为抗原,使用佐剂as01b有效增强针对vzv-ge特异的细胞免疫应答,使其在50岁以上健康人群中的保护率高达97.2%(对50-59,60-69和70岁以上人群保护率分别为96.6%,97.3%和91.3)且在包括hiv携带者在内的免疫缺陷人群中表现出了良好的安全性和有效性。as01b的关键成分qs21是一种仅能从南美皂角树quillajasaponaria的皂角苷经反向高效液相色谱提取的多糖混合物,目前无法人工合成,存在来源受限(全球年产量仅为600万人份(与其2018年销售量相符)且主要出产国智利已经开始限制对相关皂角树的采伐)、制备过程质量控制难度大(纯化组分为成分复杂的非单体、活性成分对温度敏感)、因具有溶血活性需要加入脱毒剂等严重局限性。另外根据shingrix的使用说明,其中的佐剂成分as01b在使用前需同抗原临时混合(bedsidemix),间接提示该脂质体佐剂系统用于疫苗时稳定性有待进一步提高。
以上背景导致带状疱疹亚单位疫苗价格昂贵(150-200美元/针剂),但仍供不应求(2018年93.3%的疫苗在美国本土销售,目前美国以外基本有价无市)。
技术实现要素:
针对上述存在的问题,本发明的目的在于提供一种带状疱疹疫苗组合物及其制备方法和应用,在有效增强针对vzv-ge特异的细胞免疫应答,使其可用作带状疱疹亚单位疫苗的同时,有效降低疫苗成本、提高疫苗产量。
本发明的目的是通过以下技术方案实现的:
一种带状疱疹疫苗组合物,其中包含水痘-带状疱疹糖蛋白e(ge)、聚乳酸-聚羟基乙酸共聚物(plga)、双链聚胞嘧啶核苷酸片段(polyi:c)和富含gc的单链寡聚脱氧核苷酸片段(cpgodn)。
进一步的,单针剂的疫苗组合物中各原料的含量为:
进一步的,所述ge为使用中国仓鼠卵巢细胞(cho)分泌表达制备的病毒糖蛋白e的亲水性胞外区。
进一步的,所述plga的乳酸和羟基乙酸的摩尔百分比范围在45:55至85:15之间,特性粘度范围5-100ml/g,重均分子量7000-170000,分子量分布系数不超过2.5。
进一步的,所述polyi:c的平均分子量在0.2-8kb之间。
进一步的,所述cpgodn包括a、b、c三类,具体形式包括天然结构和硫代氧化形式。
进一步的,所述疫苗组合物为直径介于20-400纳米的颗粒组合物。
进一步的,所述疫苗组合物通过皮下或肌肉注射用以预防水痘或带状疱疹。
本发明的另一方面:
所述疫苗组合物的制备方法,采用微流控设备或双乳化媒蒸发法制备所述疫苗组合物。
所述疫苗组合物的应用,所述疫苗组合物可用于制备预防或改善水痘和/或带状疱疹和/或带状疱疹后神经痛的药物。
本发明相比现有技术的有益效果为:
1、本发明所述的带状疱疹疫苗组合物中,利用plga制备成纳米颗粒:①可有效促进抗原提呈细胞吞噬和高效递送抗原,并实现疫苗的缓释持续刺激机体产生针对vzv-ge特异的细胞免疫应答。②可避免通过加入硫酸卡那霉素和氯化钙的方式提升polyi:c的稳定性而在疫苗中引入本该严格控制的抗生素。③纳米颗粒包裹的非硫代氧化形式cpgodn可有效避免核酸酶的降解,可以起到同成本较高的硫代氧化形式cpgodn近似的效果(两者在体内裸露形式的半衰期分别为5-10min和30-60min);另一方面,在被提呈细胞吞噬前逃逸出的非硫代氧化形式cpgodn可迅速被体内的核酸酶降解,从而有效避免了cpgodn从疫苗注射部位非特异性扩散可能引起的系统性炎症副作用,符合安全佐剂“局域性”和“一过性”的特点;
2、本发明所述的带状疱疹疫苗组合物,使用的polyi:c可被分布于内吞体内的tlr3摄取,进而促进相应树突状细胞的成熟和起始下游的细胞免疫应答。逃逸至细胞质中的短链(>20bp)和长链(>1kb)polyi:c可能分别激活胞浆中的retinoicacid-induciblegene1(rig-i)和melanomadifferentiation-associatedprotein5(mda5)抗病毒天然免疫应答通路进而触发相应的获得性免疫应答;
3、cpgodn可被分布于内吞体内的tlr9摄取,导致干扰素的大量分泌,并通过促进抗原的交叉提呈有效活化抗原特异性cd8+t细胞。其中cpgodn的a类可刺激树突状细胞产生i型干扰素、活化自然杀伤细胞,b类可快速从早期内体转移至晚期内体、刺激b细胞增殖、刺激浆细胞样树突状细胞成熟和tnf-α、il-6及il-12的产生,c类兼具a类和b类的作用特点、平衡促进体液免疫和细胞免疫应答。逃逸至细胞质中的可形成局部茎环结构的c型cpgodn则可能通过激活cyclicgmp-ampsynthase(cgas)继而通过stimulatorofifngenes(sting)天然免疫通路,诱导相关获得性免疫应答;
4、本发明同时利用polyi:c与cpgodn,两者在诱导抗原特异的细胞免疫应答方面具有很好的协同作用;
5、本发明所述的带状疱疹疫苗组合物中的cpgodn,既可使用硫代氧化形式,也可利用天然结构形式;其中非硫代氧化形式cpgodn相较于硫代氧化形式cpgodn成本极其低廉,包裹入plga避免核酸酶水解后可获得通过化学修饰引入硫代氧化基团来抵抗酸酶水解的昂贵的硫代氧化形式cpgodn相近的免疫刺激效果;
6、本发明所述的带状疱疹疫苗组合物经动物实验证实能特异性增强针对水痘-带状疱疹糖蛋白e的体液免疫应答和细胞免疫应答,可用作带状疱疹疫苗;本发明通过使用plga包裹polyi:c和cpgodn避免核酸酶降解进一步降低核酸佐剂的用量和成本,并且所述疹疫苗组合物中包括抗原、载体和核酸佐剂可一起冻干,进一步降低了疫苗生产和包装成本。
附图说明
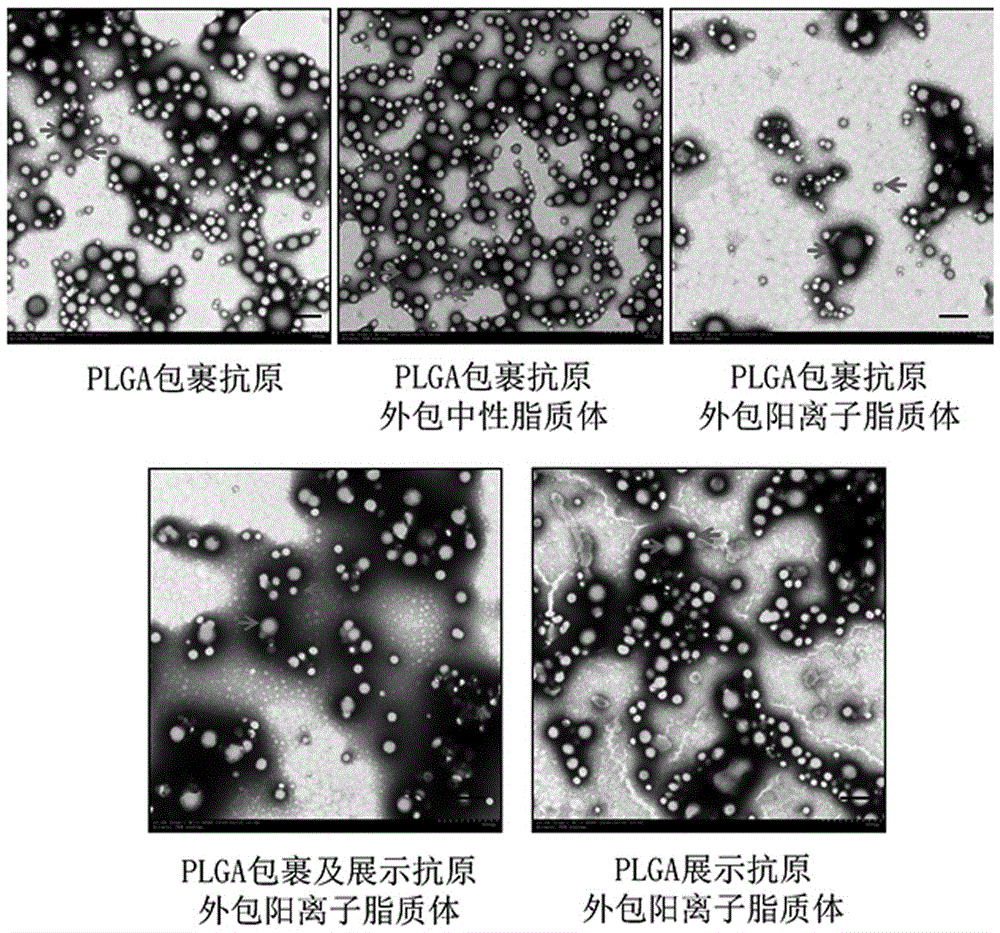
图1显示经实施例5-9,使用双乳化媒蒸发法制备的纳米颗粒疫苗透射电镜照片;
图2显示实施例1-9制备的疫苗,经实施例10和实施例11测得特异性针对ge抗原的igg抗体生成情况;
图3-图8分别显示实施例1-9制备的疫苗,经实施例10、12和13测得异性针对ge抗原分泌ifn-γ和il-2的细胞数量;
图9-图12分别显示实施例1-9制备的疫苗,经实施例10、12和14测得异性针对ge抗原产生ifn-γ和il-2的细胞比例。
具体实施方式
按照下表1中单针剂疫苗组成,直接混合制备非纳米颗粒非核酸佐剂疫苗(实施例1-4)投料100%,plga纳米颗粒疫苗(实施例5-9)投料200%(即包封率50%)计算50针剂疫苗投料。
表1单针剂疫苗组成
注:其中①-④为混合制备对照,⑤-⑨为双乳化媒蒸发法制备的纳米颗粒疫苗。
实施例1——称取cho表达的ge胞外区糖蛋白(购自普健生物科技有限公司)0.5毫克,溶解于2.5毫升pbs混匀,即得混合制备组①ag。
实施例2——称取ge0.5毫克,非硫代氧化形式cpgbw006、cpg2395(合成自上海生工生物工程有限公司)各0.25毫克,lmwpolyi:c(购自invivogen)1.25毫克,溶解于2.5毫升pbs混匀,即得混合制备组②ag+cpg+polyi:c。
实施例3——称取ge0.5毫克,溶解于1.25毫升pbs,与等体积铝佐剂(购自thermofisher)混匀,即得混合制备组③ag+alum。
实施例4——称取ge0.25毫克,溶解于0.625毫升pbs,与等体积完全弗氏佐剂(购自merk)或不完全弗氏佐剂(购自merk)混匀,即得混合制备组④ag+freund’s。
以下实施例5-9使用双乳化溶媒蒸发法制备纳米颗粒疫苗:
实施例5——称取ge1毫克,cpgbw006、cpg2395各0.5毫克,polyi:c2.5毫克,溶解于0.3毫升pbs混匀后,加入已溶有30毫克plga(50/50,7000-17000da,购自sigma)和6.5毫克阳离子脂质体2,3-二油酰基-丙基-三甲胺(1,2-dioleoyl-3-trimethylammonium-propane,即dotap,购自sigma)的1毫升二氯甲烷(购自sigma)溶液,冰上超声1分钟制备油包水乳剂(w/o),超声条件为使用工作30秒,间隔5秒钟,超声功率30%。加入4毫升2%质量体积比(v/w)的聚乙烯醇(polyvinylalcohol,即pva,购自sigma)pbs溶液同样条件冰上超声5分钟形成双乳剂(w/o/w),室温磁力搅拌过夜至二氯甲烷完全蒸发。双乳剂产物21000rpm离心30min,蒸馏水洗涤沉淀再次离心收集后冻干,即得plga包裹抗原外包阳离子脂质体的纳米颗粒疫苗⑤dotap-in。
实施例6——称取ge0.5毫克,cpgbw006、cpg2395各0.5毫克,polyi:c2.5毫克,溶解于0.3毫升pbs混匀后,加入已溶有30毫克plga和6.5毫克阳离子脂质体dotap的1毫升二氯甲烷溶液,冰上超声1分钟制备油包水乳剂(w/o),超声条件同实施例5。加入4毫升2%(v/w)pva的pbs溶液同样条件冰上超声5分钟形成双乳剂(w/o/w),室温磁力搅拌过夜至二氯甲烷完全蒸发。双乳剂产物21000rpm离心30min,蒸馏水洗涤沉淀再次离心收集。加入溶有0.5毫克ge的pbs溶液1毫升重悬沉淀后4℃孵育过夜。蒸馏水洗涤三次21000rpm离心30min后收集沉淀冻干,即得plga包裹及展示抗原外包阳离子脂质体的纳米颗粒疫苗⑥dotap-half。
实施例7——称取cpgbw006、cpg2395各0.5毫克,polyi:c2.5毫克,溶解于0.3毫升pbs混匀后,加入已溶有30毫克plga和6.5毫克阳离子脂质体dotap的1毫升二氯甲烷溶液,冰上超声1分钟制备油包水乳剂(w/o),超声条件同实施例5。加入4毫升2%(v/w)pva的pbs溶液同样条件冰上超声5分钟形成双乳剂(w/o/w),室温磁力搅拌过夜至二氯甲烷完全蒸发。双乳剂产物21000rpm离心30min,蒸馏水洗涤沉淀再次离心收集。加入溶有1毫克ge的pbs溶液1毫升重悬沉淀后4℃孵育过夜。蒸馏水洗涤三次21000rpm离心30min后收集沉淀冻干,即得plga展示抗原外包阳离子脂质体的纳米颗粒疫苗⑦dotap-out。
实施例8——称取ge1毫克,cpgbw006、cpg2395各0.5毫克,polyi:c2.5毫克,溶解于0.3毫升pbs混匀后,加入已溶有30毫克plga的1毫升二氯甲烷溶液,冰上超声1分钟制备油包水乳剂(w/o),超声条件同实施例5。加入4毫升2%(v/w)pva的pbs溶液同样条件冰上超声5分钟形成双乳剂(w/o/w),室温磁力搅拌过夜至二氯甲烷完全蒸发。双乳剂产物21000rpm离心30min,蒸馏水洗涤沉淀再次离心收集冻干即得plga包裹抗原的纳米颗粒疫苗⑧plga。
实施例9——称取ge1毫克,cpgbw006、cpg2395各0.5毫克,polyi:c2.5毫克,溶解于0.3毫升pbs混匀后,加入已溶有30毫克plga和6.5毫克中性脂质体二油酰基卵磷脂(1,2-dioleoyl-sn-glycero-3-phosphocholine,即dopc,购自sigma)的1毫升二氯甲烷溶液,冰上超声1分钟制备油包水乳剂(w/o),超声条件同实施例5。加入4毫升2%(v/w)pva的pbs溶液同样条件冰上超声5分钟形成双乳剂(w/o/w),室温磁力搅拌过夜至二氯甲烷完全蒸发。双乳剂产物21000rpm离心30min,蒸馏水洗涤沉淀再次离心收集沉淀冻干即得plga包裹抗原外包中性脂质体的纳米颗粒疫苗9dopc。
实施例5-9结果见附图1,使用双乳化溶媒蒸发法制备的纳米颗粒疫苗在透射电镜下呈现两种形式,其中一种直径约200nm(图1右指向箭头所示),接近于水痘-带状疱疹病毒直径(180-200nm),主要存在于不含阳离子脂质体的纳米颗粒组(包括上述不含脂质体成分的实施例8plga组和含有中性脂质体成分的实施9dopc组)。另外一种直径约50nm(图1左指向箭头所示),存在于所有制备的纳米颗粒疫苗中,是含有阳离子脂质体的纳米颗粒(上述实施例5-7)的主要构成形式。
实施例10——动物免疫
间隔两周,肌肉注射实施例1-9制备的疫苗50μl免疫c57bl/6小鼠3次(8只/组,雌性,初免年龄6-8周,体重16-18g,购自北京维通利华实验动物技术有限公司),终免2周后摘取脾脏,心脏取血4℃放置过夜后3000rpm离心10分钟取血清,准备进行后续免疫学分析。
实施例11——抗体滴度检测
溶解于pbs的捕获抗原ge胞外区糖蛋白2μg/ml每孔100μl加入96孔酶标板(购自康宁),4℃过夜包被后tbst(0.05%tween20(sigma)inpbs)洗板1次,每孔200μl加入5%(w/v)溶于pbs的脱脂奶粉37℃封闭1h,弃掉牛奶后tbst洗4次,每孔100μl加入1%牛奶梯度稀释的实施例10制备的抗血清37℃孵育1h,tbst洗5次后加入1%牛奶稀释的二抗(1:5000,goatanti-mouseigg:hrp购自biorad)37℃孵育1h,tbst洗5次后每孔加入100μl按照1:1比例配好的显色液(购自bd),室温下避光放置10分钟后,加入100μl1m磷酸终止反应,并于450nm处检测光吸收值。取od450<0.15临界的血清稀释浓度作为抗体滴度。
实施例10-11结果见附图2,经间隔两周肌肉注射3次疫苗两周后(实施例10,图2a),抗体滴度检测(实施例11,图2b)显示不包裹阳离子脂质体和中性脂质体的纳米颗粒疫苗(图2b中plga组,实施例8)免疫的小鼠显示出较其他纳米颗粒疫苗(实施例5、6、7、9)免疫小鼠后最高的抗体滴度(592981),该抗体滴度仅次于非纳米颗粒疫苗中混合弗氏佐剂(图2b中ag+freund’s,实施例4)免疫小鼠产生的抗体滴度(816702,p=0.4339统计无显著差异),远高于经plga和阳离子脂质体同时包裹和展示ge的纳米颗粒疫苗(图2b中dotap-half组,实施例6)产生的抗体滴度(140972,p=0.0077),且高于相同抗原和核酸佐剂组分但未经纳米颗粒疫苗包裹的对照疫苗组(图2b中ag+cpg+polyi:c组,实施例2,抗体滴度214633,p=0.0370)。
实施例12——脾脏淋巴细胞分离
实施例10制备的脾脏置细胞过滤网(falconcellstrainer70μm,购自bd),加入3ml不含抗生素和血清的rpmi-1640培养基(购自gibco)使用2ml注射器针芯研压至组织培养皿,与3mlpbs混匀后转移至已加入3ml淋巴细胞分离液(购自杭州联科生物技术股份有限公司)的15ml尖底离心管(购自康宁),室温1500rpm水平离心15分钟,取第二层环状乳白色淋巴细胞转至含有5mlpbs的15ml尖底离心管,室温1500rpm水平离心20分钟。弃上清后5mlpbs重悬计数,再次室温1500rpm水平离心20分钟,使用含有双抗(购自gibco)和10%胎牛血清(购自bi)的1640完全培养基重悬细胞至1×107细胞/ml。100μl/孔细胞加入96细胞培养板孔板(购自康宁)至最终细胞量1×106细胞/孔。
实施例13——酶联免疫斑点实验(enzymelinkedimmunospotassay,elispot)
每组8只用于elispot检测的小鼠进一步分为4只/组,分别用于il-2及ifn-γ的检测。检测试剂盒均购自bd,并按照说明书进行操作,具体步骤如下:包被液稀释捕获抗体后100μl/孔加入elispot平板,4℃包被过夜后弃包被液,200μl/孔封闭液洗板1次,每孔200μl加入封闭液室温封闭2h,弃封闭液后加入含有10μg/ml终浓度ge或肽库(见表2)、或5μg/ml的ge和5μg/ml的肽库混合的1640完全培养基100μl并加入实施例12等体积稀释好的脾脏细胞(1×107细胞/ml)37℃细胞培养箱过夜。800g离心5分钟后弃上清,200μl/孔去离子水清洗2次(每次浸泡5分钟),200μl/孔清洗液1清洗3次,100μl/孔加入经稀释液稀释的检测抗体室温孵育2小时后,200μl/孔清洗液1清洗3次(每次浸泡2分钟),100μl/孔加入经稀释液稀释的酶偶合物streptavidin-hrp室温孵育1小时,200μl/孔清洗液1清洗4次(每次浸泡2分钟),200μl/孔清洗液2清洗2次后加入100μl底物溶液反应至合适时间,去离子水清洗终止反应。晾干后使用elispot读板仪器(德国aiddiagnostikagmbh)斑点计数。
实施例12-13结果见附图3-图8,酶联免疫斑点实验显示,10μg/ml终浓度ge或肽库在刺激疫苗免疫后小鼠脾脏淋巴细胞分泌ifn-γ(图3与图4)或il-2(图6与图7)能力上并无明显差异,5μg/ml终浓度的ge和5μg/ml的肽库混合后对il-2的分泌可能略有提升(图8与图6或图7比较),但对ifn-γ的分泌无明显影响(图5与图3或图4比较)。其中纳米颗粒疫苗plga(实施例8)和同时包裹和展示ge的dotap-half(实施例6)免疫后的脾脏细胞在各种刺激中均表现出了较强的ifn-γ(图3-5)和il-2(图6-7)分泌能力,plga组(实施例8)在各种刺激中分泌的ifn-γ和il-2均高于dotap-half组(实施例6)但无显著统计差异(ns),且两者经各种刺激后ifn-γ和il-2分泌均高于非纳米颗粒疫苗(实施例1-4)中表现最好的混合弗氏佐剂组(图3-8中ag+freund’s,实施例4)和相同抗原混合核酸佐剂组(图3-8中ag+cpg+polyi:c,实施例2)。经肽库或ge-肽库的混合刺激后,plga组(实施例8)相较于混合弗氏佐剂组(实施例4)或相同抗原混合核酸佐剂组(实施例2)表现出了显著增强的ifn-γ(图4-5)和il-2分泌能力(图7-8)。
实施例14——流式细胞分析
实施例12分离的脾脏淋巴细胞每孔加入终浓度为5μg/ml的ge或肽库(纯度﹥98%,购自吉尔生化上海有限公司,氨基酸序列见表2),连同5μl/孔的fastimmune(购自bd)37℃细胞培养箱孵育2h,加入蛋白运输抑制剂brefeldina(购自biolegend)37℃细胞培养箱过夜。800g离心5分钟后弃上清,250μlstainingbuffer(购自biologend)清洗一次,加入50μl含有5μg/mlcd16/32抗体(购自biolegend)的stainingbuffer重悬后4℃孵育10分钟封闭fc受体。加入50μlstainingbuffer稀释好的抗体fitc-cd4及percp-cd8(均购自biolegend),4℃避光染色30分钟,使用250μlstainingbuffer清洗1遍,加入200μlfixationbuffer(购自biolegend)悬浮固定细胞膜室温避光孵育20分钟。离心去上清,250μlpermeabilizationwashbuffer(购自biolegend)清洗2次,加入用50μlpermeabilizationwashbuffer稀释好的抗体apc-il-2及pe-ifn-γ(均购自biolegend)悬浮细胞,室温避光30分钟,250μlpermeabilizationwashbuffer清洗一次,250μlpbs清洗一次,100μlpbs悬浮后使用流式细胞分析仪(bdaccuric6flowcytometer)检测。
表2肽库组分
实施例12和14结果见附图9-图12,流式细胞分析结果显示,无论经由5μg/ml终浓度的ge或肽库刺激,纳米颗粒疫苗plga(实施例8)和同时包裹和展示ge的dotap-half(实施例6)免疫后的小鼠脾脏t细胞中表达il-2(能刺激已被特异性抗原启动的t细胞增殖)和ifn-γ(活化t细胞,诱导th1细胞分化)的抗原特异性cd4+t细胞(图9和图10)和cd8+t细胞(图11和图12)占比最高,其中两者在抗原特异性的cd8+t细胞中占比无统计学差异(ns),但经ge(p=0.0106,fig.4a)或肽库(p=0.0305,fig.4b)刺激后活化的抗原特异性的cd4+t细胞占比plga组显著高于dotap-half组(p<0.05)。
实施例15——统计分析,使用graphpadprism7.0软件,采用one-wayanova方法对实施例11、13、14所得数据进行统计学分析,其中p≥0.05为无显著差异,标注为ns;显著差异中p<0.05标示为*,p<0.01标示为**;p<0.001标示为***,p<0.0001标示为****。
实施例15的结果见附图2-12。
- 还没有人留言评论。精彩留言会获得点赞!