氢分子的应用及其缓解炎症性肠病小鼠模型的构建方法与流程
本发明涉及外源性氢分子(h2)干预改善肠道菌群及其代谢以促进肠黏膜稳态恢复的氢医学研究领域。具体讲,提供了氢分子的应用及其缓解炎症性肠病小鼠模型的构建方法。
背景技术:
炎症性肠病(inflammatoryboweldisease,ibd)是一类以肠道黏膜溃疡为主要病变特点的肠道慢性复发性炎症性疾病,主要包括克罗恩病(crohn'sdisease,cd)和溃疡性结肠炎(ulcerativecolitis,uc),其是由遗传因素、环境因素、肠道菌群和宿主免疫系统等的复杂相互作用导致的异常免疫反应和慢性肠道炎症,但确切发病机制尚未完全阐明,治疗困难,已严重影响到患者的身心健康和生活质量。目前,民生经济发展与饮食西式化融入使亚洲国家ibd患者的增加趋势明显,ibd的临床与基础研究已成为亚洲消化病学界的研究热点。对其发病机制和新型临床辅助治疗剂的研究将为改善患者生活质量提供帮助。
已有文献报道,饮用富氢水(hydrogenrichwater,hrw)或腹腔注射富氢生理盐水(hydrogenrichsaline,hrs)能够缓解ibd小鼠/大鼠肠黏膜损伤,但使h2发挥显著作用的动物模型研究体系尚不完善,其缓解ibd的作用机制也不清楚。其一,上述文献报道均是在建模期间或建模后进行h2处理,上述文献认为h2通过其抗氧化、抗炎特性缓解uc炎症损伤,但具体作用机制是否只是如此,并没有更深层次的研究报道。
技术实现要素:
为了解决上述技术问题,本发明提供了一种氢分子的应用及其缓解炎症性肠病小鼠模型的构建方法。本发明通过增加对健康动物hrs预处理,寻找到了h2有效发挥缓解uc症状的时间窗,为开发h2临床辅助治疗新策略提供了实验依据;本发明的第二目的是基于此模型,研究该模型下小鼠的肠道特征,构建一种h2医学效应研究体系,从而发现h2作用的新机制,即h2可以促进肠道短链脂肪酸(shortchainfattyacids,scfas)生成。
本发明采用的技术方案是:一种氢分子的应用,氢分子在制备促进肠道短链脂肪酸生成药物中的应用。
进一步的,所述氢分子载体形式为纳米气泡富氢生理盐水。
进一步的,所述富氢生理盐水的制备方法为利用多功能氢分子发生器将纯h2溶解于生理盐水中20min,即得h2饱和的富氢生理盐水。
进一步的,所述富氢生理盐水中h2浓度不低于3.0ppm。
一种氢分子缓解炎症性肠病小鼠模型的构建方法,包含有以下步骤:
(1)制备纳米气泡富氢生理盐水;
(2)采用6-8周龄、体重20-22g雄性c57bl/6j小鼠,做如下处理,1-17天均注射、灌胃富氢生理盐水,从第11天开始将正常饮水更换为饮用2.5%葡聚糖酸钠(dextransulfatesodium,dss),共饮用7天,即可得到氢分子缓解炎症性肠病小鼠模型。
进一步的,所述纳米气泡富氢生理盐水,每次新鲜制备,能保证h2浓度在3.0ppm。
进一步的,所述富氢生理盐水给予方式为腹腔注射联合灌胃,腹腔注射剂量和时间为5ml/kg,am9:00,1次/天;灌胃剂量和时间为10ml/kg、am9:00和pm15:00,2次/天。
本申请前期研究发现,增加uc建模前的h2预处理过程,较建模后再进行h2处理组,能够更大限度上抑制体重下降、缓解炎症损伤。此外,在本申请构建的“氢分子缓解炎症性肠病小鼠模型体系”下,外源性h2可通过上调肠道特定产scfas菌丰度促进scfas生成,时空调控结肠上皮细胞代谢重编程促进肠腔厌氧环境恢复和肠道黏膜免疫稳态维持,肠道“微生物氢代谢”的改善最终缓解了uc小鼠炎症损伤。本模型体系揭开了h2作用的微生物及免疫学机制,展示了外源性h2干预可改善uc肠道“微生物氢代谢”的独特研究视角。因此,寻找h2有效发挥缓解uc症状的时间窗,建立一种稳定、有效的新型h2干预模型体系,开发新型h2临床辅助治疗策略具有重要意义。
附图说明
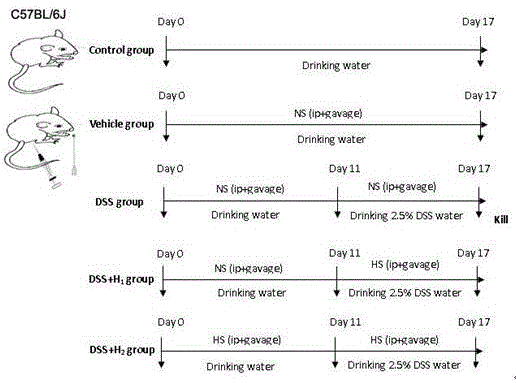
图1为本发明各处理方案设计图。
图2为建模期间小鼠体重变化图。
图3为结肠长度测量统计图。
图4为血清促炎细胞因子tnf-α、il-6表达量变化统计图。
图5为远端结肠组织石蜡切片he染色光镜像。
图6a、6b为16srdna测序分析hs处理抑制了uc小鼠肠道菌群物种多样性的下降。
图7为16srdna测序分析hs处理对uc小鼠肠道菌群门分类水平(phylum)和目分类水平(order)物种丰富度的调控作用。
图8a、8b、8c为16srdna测序分析hs处理对uc小鼠肠道菌群科分类水平(family)物种丰富度的调控作用。
图9a、9b为16srdna测序分析hs处理对uc小鼠肠道菌群属分类水平(genus)物种丰富度的调控作用。
图10a、10b、10c为16srdna和宏基因组测序分析hs处理对uc小鼠肠道菌群种分类水平(species)物种丰富度的调控作用。
图11a、11b、11c为气相色谱联合质谱法(gc-ms)测定肠道scfas含量图。
图12为结肠上皮代谢标志信号分子inos、ppar-γ表达量检测图。
图13为哌莫硝唑(pmdz)免疫荧光染色结肠上皮光镜像。
图14为结肠黏膜黏液层的扫描电镜像。
图15为肠上皮细胞间紧密连接蛋白claudin-1和occludin表达量检测图。
图16为荧光素异硫氰酸酯(fitc-dextran)肠上皮渗透性实验检测肠上皮屏障功能图。
具体实施方式
下面结合附图和实施例对本发明的实施方式作进一步详细描述。
(1)“氢分子缓解炎症性肠病小鼠模型”的构建。
纳米气泡富氢生理盐水制备:利用多功能氢分子发生器(nb-b81,上海纳诺巴伯纳米科技有限公司)将纯h2溶解于生理盐水(normalsaline,ns)中20min,获得h2饱和的富氢生理盐水(hydrogenrichsaline,hrs)。每次实验临用前新鲜制备hrs,以保证h2浓度在3.0ppm。
b.动物模型和h2医学效应研究体系构建:采用6-8周龄、体重20-22g雄性c57bl/6j小鼠。动物分组:①健康对照组(control):不做处理,全程正常饲喂、饮水。②假手术对照组(vehicle):小鼠腹腔注射ns(i.p.5ml/kg,am9:00,1次/天)并且灌胃ns(10ml/kg、am9:00和pm15:00,2次/天),共17天;17天正常饲喂、饮水。③dss诱导肠炎组(dss):从第11天开始饮用dss水,共饮用7天,诱导建立小鼠急性uc模型。除在第11-17天将正常饮水改为饮用2.5%(wt/vol)dss(36-50kda,mpbiomedicals,santaana,usa)水外,其它处理同vehicle。④dss+h1组:第1-10天注射、灌胃ns,第11-17天注射、灌胃hrs,其它操作同dss组。⑤dss+h2组即氢分子缓解炎症性肠病小鼠模型:增加dss建模前hrs的10天预处理,即1-17天均注射、灌胃hrs,其它操作同dss组。17天结束,处死各组动物。具体方案设计如图1所示。
(2)h2缓解uc小鼠炎症损伤的测定:
①对建模期间小鼠体重及建模结束后结肠长度进行测量,如图2、3所示,hrs处理能够缓解体重下降和结肠缩短,且dss+h2组比dss+h1组缓解效果更好。
②模型构建结束后,取小鼠眼内眦血,离心取上清,按照elisa试剂盒说明书步骤,对不同处理组小鼠血清进行了tnf-α、il-6表达检测,如图4所示,hrs处理显著抑制了促炎细胞因子tnf-α、il-6的表达。
③取小鼠远端结肠组织,石蜡切片、he染色,观察肠黏膜损伤,如图5所示,control和vehicle组黏膜完整、肠腺丰富,dss组有上皮脱落、坏死,肠腺减少,dss+h2组肠黏膜损伤明显缓解。
(3)h2靶向uc小鼠肠道菌群的测定:
处死动物前,对新鲜粪便组织进行16srdna和宏基因组测序,分析肠道菌群物种丰富度和多样性变化。如图6a、6b所示,α和β多样性分析表明,hrs处理抑制了dss作用后uc小鼠肠道菌群物种多样性的下降。在门水平上,hrs处理抑制了dss诱导的变形菌门(proteobacteria)丰度的增加,促进了拟杆菌门(bacteroidetes)和厚壁菌门(firmicutes)丰度的恢复(见图7);在目水平上,hrs处理促进了专性厌氧菌—梭菌目(clostridiales)丰度的增加(见图7);在科水平上,hrs处理促进了丁酸生产菌—毛螺旋菌科(lachnospiraceae)肠道有益菌理研菌(rikenellaceae)和s24_7丰度的增加。此外,hrs处理抑制了dss诱导的潜在致病菌肠杆菌科(enterobacteriaceae)和拟杆菌科(bacteroidaceae)丰度的增加(见图8a、8b、8c);在属水平上,hrs处理促进了丁酸生产菌—普氏菌属(prevotella)丰度的增加,抑制了潜在致病性埃希菌属(escherichia)丰度的增加(见图9a、9b);在种水平上,hrs处理抑制了黏液溶解菌akkermansiamuciniphila(a.muciniphila)和ruminococcusgnavus(r.gnavus)和机会致病性大肠杆菌(e.coli)丰度的增加,促进了丁酸生产菌eubacteriumventriosum(e.ventriosum),roseburiahominis(r.hominis)和roseburiafaecis(r.hominis)丰度的增加(见图10a、10b、10c)。
(4)h2对uc小鼠肠道短链脂肪酸(scfas)生成的调控作用测定:
处死动物前,取新鲜粪便组织,利用气相色谱联合质谱法(gc-ms),测定新鲜粪便组织scfas含量,包括乙酸盐(acetate)、丙酸盐(propionate)、丁酸盐(n-butyrate)、异丁酸盐(iso-butyrate)、正戊酸盐(n-valerate)和异戊酸盐(iso-valerate)的含量。
如图11a、11b、11c所示,外源性hrs处理,可以上调uc小鼠肠道乙酸盐(acetate)和丁酸盐(n-butyrate)的产生量,其它种类scfas含量,肠炎组(dss)和hrs处理组(dss+h2)并无显著差异。因此,我们认为,粪便样本的细菌代谢物对小鼠的炎症状态具有高度敏感性,对其进行scfas含量测定能够充分体现hrs的作用效果。
(5)h2重塑uc小鼠肠道上皮代谢的测定:
①用核蛋白提取试剂从结肠组织提取核蛋白,通过westernblot进行inos、ppar-γ蛋白表达分析。如图12所示,hrs处理能够下调促炎信号inos表达、缓解炎症损伤对ppar-γ的抑制作用,这表明在结肠上皮细胞损伤修复的代谢重编程中,h2可能通过增加肠道产丁酸菌的丰度促进丁酸盐生成,激活ppar-γ信号,诱导结肠上皮细胞代谢向β-氧化方向发展,进而促进了肠腔厌氧环境的恢复。
②取远端结肠组织制作石蜡切片,免疫荧光检测结肠上皮缺氧程度,哌莫硝唑(pmdz)探针(红)显示缺氧水平,如图13所示,红色荧光强度越强,表明细胞的缺氧程度越高,dss+h2组较dss组结肠上皮的红色荧光信号显著增强,上皮缺氧状态明显提高,这表明,hrs处理促进了肠腔厌氧环境的恢复。
(6)h2增强uc小鼠肠道屏障的测定:
①肠黏膜表面扫描电镜像观察黏液层厚度变化,如图14所示,hrs处理缓解了dss诱导的结肠黏膜表面粘液减少,以此增强了肠屏障功能。
②使用rapa裂解液从结肠组织中提取总蛋白,通过westernblot检测肠上皮细胞间紧密连接蛋白claudin-1和occludin的表达情况,如图15所示,hrs处理抑制了dss诱导的肠上皮细胞间紧密连接蛋白claudin-1和occludin表达量的下降,以此增强了肠屏障功能。
③荧光素异硫氰酸酯(fitc-dextran)肠上皮渗透性实验检测肠上皮屏障功能。通过灌胃4kda荧光素异硫氰酸酯(fitc-dextran),4h后检测外周血fitc-dextran信号(激发波长488nm,发射波长520nm)。如图16所示,dss+h2组较dss组,外周血fitc-dextran信号显著降低。表明,hrs处理增强了uc小鼠肠上皮屏障功能。
- 还没有人留言评论。精彩留言会获得点赞!