mRNA疫苗递送载体及制备方法、mRNA疫苗及制备方法与流程
本发明涉及生物医药领域,特别涉及一种mrna疫苗递送载体及制备方法、mrna疫苗及制备方法。
背景技术:
近年来,以肿瘤疫苗为内涵的肿瘤疫苗免疫法在推动肿瘤精准治疗方面取得了突破性进展,尤其治疗性疫苗在治疗恶性实体肿瘤、转移瘤、病毒性传染病等方面显示出了巨大的潜力。在肿瘤疫苗的发展中,抗原通常以蛋白质多肽或dna质粒作为疫苗的功能成分被用作传统疫苗的研发。而今,基于mrna(messengerrna,信使rna)为功能成分的疫苗治疗方法逐渐展现出多方面的价值,并成为常规疫苗策略的有力替代品。例如:多肽抗原合成成本较高,合成工艺复杂、耗时较长;而dna的抗原表达效率不理想,同时有造成基因突变的风险。而mrna形式的抗原不仅可以在非分裂以及难以转染的细胞中实现高效的蛋白质表达,譬如树突状细胞,并且其固有的免疫原性可以促进特定的免疫应答。由于以mrna为基础的疫苗具有作用高效快速、安全性高、制备成本较低、易于推广等特征,因此与基于蛋白短肽和质粒dna的疫苗相比具有更大的发展潜力与优势。
目前,在许多基础研究和临床试验中,mrna疫苗的细胞内递送已证明了能够完成编码抗原蛋白质合成、加工递呈进而激活t细胞的功能,从而获得高效率的抗肿瘤免疫治疗的效果。在过去几年中,体外转录mrna已成为热点药物。但是由于mrna自身带高负电荷、易降解、稳定性差等特点,mrna的递送仍面临若干挑战。目前主要的mrna体内递送手段是利用鱼精蛋白或者纳米脂质体来提高mrna的稳定性和促进细胞对mrna的摄取。然而鱼精蛋白包裹mrna还没有用于肿瘤疫苗,其用于治疗自身免疫疾病的产品目前正在临床试验;而纳米脂质体用于mrna肿瘤疫苗体内递送需要淋巴结注射,对临床操作难度较高,其治疗效果也还有待临床试验的验证。因此,mrna肿瘤疫苗的临床应用前景虽然光明,但是如何稳定安全的实现mrna疫苗在体内的表达和激活免疫反应仍然是一个技术难题。
有效的mrna肿瘤疫苗需要克服稳定性差、效率有限、毒性高和成本高等问题,实现mrna的有效递送及编码抗原的高效表达,从而引起特异性的抗肿瘤免疫反应。作为一种全新的治疗方法,肿瘤纳米疫苗的一个优势是可以实现同时递送肿瘤抗原及免疫佐剂。随着纳米医学的发展,许多纳米工程制剂,包括基于聚合物的纳米材料和基于脂质体的纳米材料,已经设计用于在体内递sirna(smallinterferingrna,小干扰rna)或其他小寡核苷酸,但用于mrna疫苗递送的材料还非常有限。由于mrna的结构及自身物理化学特征,现有的纳米材料对于mrna递送仍不够有效,以mrna为基础的肿瘤疫苗的发展与临床应用仍面临许多问题。
技术实现要素:
本发明的主要目的在于提出一种mrna疫苗递送载体,旨在解决现有的mrna疫苗在体内无法稳定安全表达和激活免疫反应的技术问题。
为实现上述目的,本发明提出一种mrna疫苗递送载体,该mrna疫苗递送载体包括类脂分子a和类脂分子b,所述类脂分子a由溴壬烯和三氟甲基辛-2-烯-1-醇反应合成,所述类脂分子b由环二赖氨和三氟甲基1,2环氧十二烷反应合成。
优选地,所述溴壬烯和三氟甲基辛-2-烯-1-醇的摩尔比为1:2,所述环二赖氨和三氟甲基1,2环氧十二烷的摩尔比为1:6。
本发明还提出一种mrna疫苗递送载体制备方法,该mrna疫苗递送载体制备方法包括以下步骤:
(1)将溴壬烯和三氟甲基辛-2-烯-1-醇按照1:2的摩尔比混合,并加入过量的甲醇;再对混合后的溶液进行油浴加热,并控制反应温度为80℃,反应时间为48h;待反应结束后,对反应得到的产物进行旋蒸,旋蒸后得到油状混合物,该油状混合物即为类脂分子a;
(2)将环二赖氨和三氟甲基1,2环氧十二烷按照1:6的摩尔比混合,并加入过量的甲醇;再对混合后的溶液进行油浴加热,并控制反应温度为80℃,反应时间为48h;待反应结束后,对反应得到的产物进行旋蒸,旋蒸后得到油状混合物,该油状混合物即为类脂分子b;
(3)将所述类脂分子a、类脂分子b及稳定剂混合,即得到所述mrna疫苗递送载体。
本发明还提出一种mrna疫苗,该mrna疫苗包括编码特定抗原的mrna和权利要求1或2所述的mrna疫苗递送载体,所述mrna疫苗递送载体包括类脂分子a和类脂分子b,所述类脂分子a由溴壬烯和三氟甲基辛-2-烯-1-醇反应合成,所述类脂分子b由环二赖氨和三氟甲基1,2环氧十二烷反应合成。
优选地,所述稳定剂包括二油酰磷脂酰乙醇胺、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000。
优选地,所述mrna疫苗递送载体中的类脂分子a和类脂分子b的总质量与所述二油酰磷脂酰乙醇胺、胆固醇及二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000的质量比为20:10:5:1。
优选地,所述mrna疫苗递送载体中的类脂分子a、类脂分子b的质量与mrna的质量比为48:112:1。
优选地,所述mrna编码流感抗原。
本发明还提出一种mrna疫苗制备方法,该mrna疫苗制备方法包括以下步骤:
(1)将类脂分子a和类脂分子b溶于浓度为10mg/ml的二甲基亚砜中,并加热至70℃,待其完全溶解至透明澄清状态;
(2)再向所述二甲基亚砜中加入mrna、稳定剂,涡旋混匀;
(3)混匀后,将所述步骤(2)的混合物按二甲基亚砜与水为1:9的体积比滴加相应体积的无菌水,滴加完毕后再次涡旋混匀;
(4)静置一段时间,超滤去除二甲基亚砜,超滤时用无菌水进行洗涤,超滤后剩余液体即为所述mrna疫苗。
优选地,所述超滤时使用孔径为100kda的超滤管进行。
与现有技术相比,本发明实施例的有益技术效果在于:本发明实施例所提供的mrna疫苗递送载体可在体内实现稳定安全的表达和激活免疫反应,其具备特异性好、稳定性好、递送效率高、毒性低、安全有效等特点。
附图说明
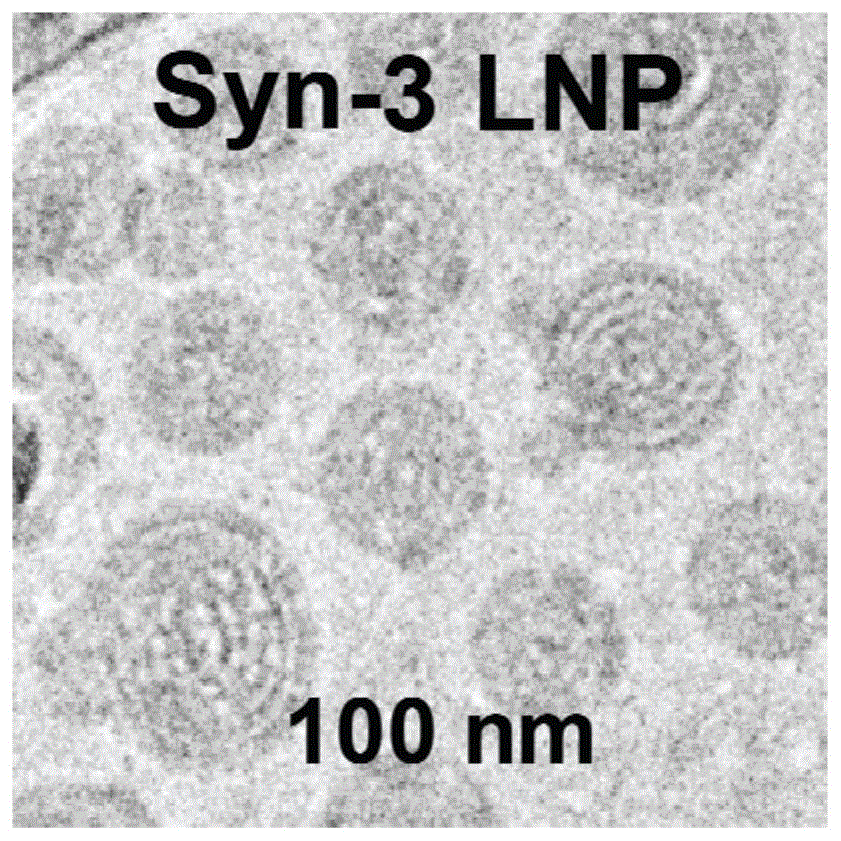
图1为本发明syn3-mrna纳米疫苗颗粒的形态及大小;
图2为纳米脂质体疫苗激活免疫因子分泌行为的表征示意图;
图3为纳米脂质体疫苗激活免疫细胞活化行为的表征示意图;
图4为纳米脂质体疫苗抑制肿瘤生长的表征示意图。
具体实施方式
下面结合附图和具体实施例对本发明的技术方案作进一步的详述,但本发明并不限于以下实施例。如未特别指出,以下所涉及的试剂均可通过商业途径购得。为方便起见,部分操作未详述操作的参数、步骤及所使用的仪器,应当理解,这些都是本领域技术人员所熟知并可重复再现的。
本发明所提供的类脂分子a和类脂分子b是一种阳离子类脂聚合物,其在组合中为具有阳离子特性的类脂聚合物,在与mrna及稳定剂混合进行纳米沉淀时可以自组装形成纳米球,以将mrna包裹在中间。
可降解类脂分子a的合成原料为溴壬烯和三氟甲基辛-2-烯-1-醇,其合成反应的原理为:
不可降解类脂分子b的合成原料为环二赖氨和三氟甲基1,2-环氧十二烷,其合成反应的原理为:
需要说明的是,上述两个合成反应原理中的fx3和cdk11f分别为类脂分子a和类脂分子b的代表符号,其并非类脂分子a和类脂分子b的化学名称,也并非类脂分子a和类脂分子b化学名称的简写,仅仅只是为了方便描述所用。
本发明中的抗原编码mrna是通过使用试剂盒体外转录所合成的,首先,建立一个可以方便快速的负载并稳定表达抗原表位的质粒载体。在mrna抗原合成中,选择使用免疫试验中常用的抗原,譬如卵清蛋白(ovalbumin,ova)以及trp2蛋白(小鼠黑色素瘤细胞b16中表达),以作为编码抗原来进行实验。而在体外转录mrna合成时,如果目的是合成编码蛋白的全长序列,则对转录的效率和稳定性要求比较高,而且不能用于表达多个不同蛋白来源的抗原表位。因此更好的策略是选择设计mrna编码抗原短肽的部分序列进行表达,如ova257-264(ova蛋白257-264位的短肽含有可以被识别的抗原表位,是研究中常使用的抗原肽)和trp2180-188,这两种抗原肽表位是已被证实的可以被mhc递呈、体外转录合成的mrna,分别命名为ovamrna和trp2mrna。对mrna的不同位点进行修饰,包括5’端修饰和3’端加上100多个多聚a以及使用接头序列和信号肽连接抗原表位,从而以增强体外转录的mrna的稳定性。所设计的抗原表位序列可以根据需要进行更换并且也可以同时放置多个来自不同肿瘤抗原的表位,因此适用于靶向单个或多个抗原的疫苗制作。
mrna肿瘤疫苗的制备过程为:首先根据实验计算所用的纳米材料及mrna的用量,将类脂分子fx3和cdk11f按3:7比例混合制成syn3溶液(浓度为10mg/ml,溶剂为dmso),使用前加热至70℃待其完全溶解至透明澄清状态;按照质量比例(类脂分子混合物syn3:mrna为160:1),分别按顺序加入类脂分子混合物syn3、mrna和稳定剂dope、cholesterol、dspe-peg2000(溶剂dmso,类脂分子混合物syn3:dope:cholesterol:dspe-peg2000为20:10:5:1);试剂添加结束后,使用振荡仪vortex混匀;混匀后,将其按比例(dmso:水=1:9)加入相应体积无菌水中,注意要将无菌水一边使用vortex涡旋,一边将混合好的材料滴加到水中,待全部液体滴加完毕后使用vortex将其完全混匀;彻底混匀后静置10min,使用孔径为100kda的超滤管进行超滤以去除有机试剂dmso,超滤时使用无菌水进行洗涤纳米疫苗颗粒,超滤后剩余液体即为以fx3和cdk11f为递送载体的mrna肿瘤疫苗(syn3-mrna纳米疫苗)。需要说明的是,dope为二油酰磷脂酰乙醇胺,cholesterol为胆固醇,dspe-peg2000为二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000,dmso为二甲基亚砜。
经鉴定,所制备的syn3-mrna纳米疫苗是一种阳离子类脂聚合物将mrna包裹在中心形成纳米颗粒的形式。这种纳米颗粒的粒径约为100纳米,并且在一定时间内(7天)对其进行监测后,发现其具有较好的稳定性。纳米颗粒形成后mrna被阳离子类脂聚合物包裹在中央,从而保护mrna不被核酸酶降解。而所使用的稳定剂dape-peg2000可以使纳米粒更稳定,不易受生理环境的影响,从而延长循环时间,降低细胞对材料的吞噬,使其具备更好的生物兼容性。如图1所示,其为syn3-mrna纳米疫苗颗粒在透射电子显微镜下的形态及大小。
将体外转录合成的ovamrna(编码ova257-264的mrna),使用15种不同生物材料作为递送载体,制备得到ovamrna纳米疫苗。将这15种纳米疫苗和小鼠树突状细胞dc2.4共孵育,然后以此刺激b3z细胞(ova特异的t细胞,可以识别mhc递呈的ova抗原表位并被激活)分泌细胞因子il-2。通过elisa检测细胞因子il-2的分泌量,图2b结果显示,syn-3作为mrna的递送载体显示出最高的t细胞激活程度,比其他6种不同比例的两种脂质分子混合(0:10、1:9、2:8、4:6、6:4、10:0)作为载体刺激了更高水平的细胞因子il-2的分泌。该实验中使用ova257-264蛋白短肽刺激dc2.4作为阳性对照,作为递送载体的7种不同生物材料的配比如下表所示:
图2中,a是体外抗原提呈实验示意图。编码抗原的mrna被树突细胞摄取,翻译表达编码抗原并加工并提呈给t细胞,激活的t细胞分泌细胞因子il-2。b则表示,elisa结果显示,在体外抗原提呈实验中,分别使用7种配比的生物材料作为mrna疫苗载体,其中类脂分子混合物syn-3负载ovamrna时诱导t细胞激活分泌il-2的水平最高。c则表示,elisa结果显示,疫苗制备时syn-3与ovamrna的最佳质量比为160:1。将syn-3为递送载体的疫苗与lip2000(lip2000即lipfectamine2000,生物实验常用的一种脂质体试剂用于核酸转染)对比。通过elisa检测细胞因子il-2的分泌量,d结果显示syn-3作为mrna的递送载体较脂质体lipofeactamine2000显示出更高水平的细胞因子il-2和ifn-γ的分泌。
为了验证syn-3-ovamrna(编码ova257-264)纳米疫苗在小鼠体内刺激抗原提呈并激活特异性t细胞的效果,通过动物实验对其作用进行验证。首先分为三组进行实验(对照组,ova+alum对照组,syn-3-ovamrna纳米疫苗组),其中ova+alum组中alum为目前临床中已经批准使用的免疫佐剂氢氧化铝,可以有效的提高机体对ova蛋白的免疫效应。通过对小鼠腹股沟部进行皮下注射间隔7天共免疫2次,7天后引流部位淋巴结,并通过流式检测分析抗原特异性t细胞的比例(cd8+ova-tetramer+),步骤如图3a所示。如图3b所示,可以看到syn-3-ovamrna纳米疫苗免疫组的淋巴结内抗原特异性t细胞的比例的明显升高。由此可见,本发明的syn-3-mrna纳米疫苗可以激活抗原的提呈并促进抗原特异性t细胞的激活。
随后,为了验证syn-3-mrna纳米疫苗可以针对肿瘤特异性抗原发挥预防性抗肿瘤的效果,并且比传统的方法(alum氢氧化铝佐剂在欧洲被批准作为疫苗佐剂在临床使用,protamine鱼精蛋白作为mrna载体在进行临床试验)具有更好的效果,通过实验来验证其抑制肿瘤生长的功能。首先,使用构建的胰腺癌bxpc3作为小鼠肿瘤模型来进行实验,肿瘤细胞接种(背部皮下接种胰腺癌bxpc3细胞,每只小鼠接种106个细胞)。实验分组为:对照组,ova+alum组,protamine-ovamrna组,syn-3-ovamrna组;protamine已被证实的可以作为递送mrna的载体,因此将其设置为对照组;ova+alum为实验中常用的免疫刺激。细胞溶液接种14天后,肿瘤体积约50mm3,静脉注射免疫制剂,观察肿瘤的生长。实验结果显示syn-3-ovamrna纳米疫苗作为预防性的肿瘤疫苗能够有效抑制肿瘤的生长(图4b),而ova+alum组和protamine-ovamrna组并没有显示很好的肿瘤抑制效果。图4b所示为各组中每只小鼠的肿瘤生长曲线。因此,胰腺癌小鼠肿瘤模型中,syn-3-ovamrna作为预防性的肿瘤疫苗可以有效的抑制肿瘤的生长。
以上所述的仅为本发明的部分或优选实施例,无论是文字还是附图都不能因此限制本发明保护的范围,凡是在与本发明一个整体的构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明保护的范围内。
- 还没有人留言评论。精彩留言会获得点赞!