一种支架材料、其制备方法及应用与流程
本发明属于缓释制剂技术领域,尤其涉及一种支架材料、其制备方法及应用。
背景技术:
肿瘤的手术切除仍然是肿瘤治疗的首选方法,然而,术后的复发和转移成为制约手术治疗成功的关键问题。以结肠癌为例,早期发现的结肠癌在完全切除时其5年生存率高达85%,而中晚期结肠癌的术后5年生存率骤降为17%。这背后的一个重要原因是中晚期结肠癌肿瘤浸润广泛,手术切除不干净,或者手术时转移已经发生。另外,某些肿瘤如中晚期卵巢癌、结肠癌侵入腹腔后所形成的腹膜转移瘤呈弥散状生长,手术无法有效地切除干净,造成术后的5年生存率极低。
术后化疗是中晚期肿瘤术后的主要辅助手段。适当的术后化疗可以清除微小残余病灶,预防转移及肿瘤复发的出现。但是,由于手术创口的出现,术后化疗一般要在手术2~3周以后开始实施,这个间隙为肿瘤的复发创造了早期条件。另外,系统大剂量给药的方式也对患者造成强烈的副作用、对免疫系统造成很大的影响,不利于对肿瘤的长期控制,导致总体治疗效果一般。
相对于术后化疗,应用载体材料局部缓释药物实施中晚期肿瘤的术后辅助治疗具有显著的实际意义。借助于外科医生的手术机会,缓释材料可以被安置在肿瘤附近,局部持续缓释药物,可以避免治疗空歇期的出现并避免造成高浓度药物的强烈毒副作用。
基于这样的思想,2019年amiji报道了用聚二恶烷酮(pds)制备的可降解编织物植入材料腹腔内缓释紫杉醇用于转移性卵巢癌的治疗。由于pds的缓慢降解特性,该植入材料可以在腹腔内存在超过60天,持续缓释紫杉醇,取得比游离紫杉醇腹腔灌注治疗明显的治疗优势。这一基于pds的植入编织物虽然具有非常长的缓释时间,然而,腹腔内植入异物太长的存留时间可能会引起炎性反应,形成黏连甚至肠梗阻。
芜湖先声中人药业有限公司开发的中人氟安(聚乳酸-羟基乙酸共聚物(plga)担载氟尿嘧啶植入物)是一种有效用于食管癌、结肠癌、直肠癌、胃癌等的术后化疗的植入剂,目前已经上市。然而,由于构建植入剂的plga只对小分子化疗药物具有负载能力,对于一些常规的蛋白类、多肽类、核酸类大分子药物难以实现在植入部位的有效缓释,并且由于植入剂难以固定在术后部位同样容易引发肠黏连与肠阻滞。
美国的mgipharma公司开发的gliadelwafer(卡氮芥缓释膜片)是用于脑癌治疗的专利药,其使用方法为手术切除脑瘤时,在经手术创建的空腔中植入负载药物的plga膜片,这种缓释膜片同样存在着载药种类局限,应用范围有限的问题。
因此亟需开发一种新型的植入材料用于癌症的术后化疗。水凝胶材料由于其生物相容性良好、力学性能可调、担载药物种类多,是一种比较有前景的局部缓释药物载体形式。特别是,水凝胶用于药物装载几乎没有限制,不仅可以用于小分子药物的装载,由于其含水结构,还可以用于蛋白类药物的装载,因此,水凝胶已被广泛用于局部药物缓释。水凝胶的使用形式可以是局部注射后原位成胶,也可以冻干制备成支架材料,以植入的方式实施。后一种方式可能是更方便被外科医生使用。
目前,多种类型的水凝胶已经广泛应用于局部药物缓释。xiao等利用nca开环聚合的方法,将聚谷氨酸接枝到4臂peg的末端,通过聚谷氨酸的β折叠构建了一种物理交联型凝胶,凝胶可以有效担载并缓释多肽胰岛素与牛血清蛋白,但是通过物理交联的方式得到的水凝胶强度较弱,在体内的滞留时间短,难以应用于临床。federicacorrente等采用了紫外光照射成胶的方法,借助光引发剂制备出了以葡聚糖、甲基丙烯酸酯合成的物质(dex-ma)和硬葡聚糖(scl)为原料的可注射水凝胶。与物理交联型水凝胶相比,其力学性能有了显著提高。pacellis等也采用了类似的方法成功制备了力学性能良好的水凝胶,原料为聚乙二醇双甲基丙烯酸酯(peg-dma)和被甲基丙烯酸改性过的吉兰糖胶。虽然这种方法可以有效地形成强度较高的水凝胶,但是通过紫外光交联的方式对于一些蛋白或者光敏感的药物活性进行破坏,因此这种交联方式存在着诸多限制。此外,凝胶的形成过程需要时间,储存不方便,对于外科医生来讲不容易掌握,也限制了此类材料向临床应用的推广。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种制备条件温和且相容性较好的支架材料、其制备方法及应用。
本发明提供了一种支架材料,由多臂氨基聚乙二醇与多醛基葡聚糖交联得到。
优选的,所述多臂氨基聚乙二醇选自2~8臂氨基聚乙二醇。
优选的,所述多臂氨基聚乙二醇选自式(i)~式(iii)所示的一种或多种:
其中n与m均为聚合度,1≤m≤500;1≤n≤500;1≤p≤200
其中r为三季戊四醇除去8个羟基的基团。
优选的,所述多醛基葡聚糖如式(iv)所示:
其中q,k为聚合度,10≤q≤500,10≤k≤500。
优选的,所述多臂氨基聚乙二醇与多醛基葡聚糖的质量比为1:(0.05~10)。
优选的,所述支架材料的尺寸为0.1~20cm。
本发明还提供了一种支架材料的制备方法,包括:
s)将多臂氨基聚乙二醇与多醛基葡聚糖在水溶液中反应,得到支架材料。
优选的,所述s)具体为:
将多臂氨基聚乙二醇水溶液与多醛基葡聚糖水溶液混合反应,得到支架材料;
所述多臂氨基聚乙二醇水溶液中氨基化合物的浓度为1mg/ml~300mg/ml;
所述多醛基葡聚糖水溶液中醛基化合物的浓度为1mg/ml~300mg/ml。
本发明还提供了上述的支架材料在担载药物中的应用。
本发明还提供了上述的支架材料在制备抗肿瘤药物中的应用。
本发明提供了一种支架材料,由多臂氨基聚乙二醇与多醛基葡聚糖交联得到。与现有技术相比,本发明提供的支架材料通过醛基与氨基的席夫碱作用形成交联网格,在担载药物时可将药物封装在支架内部,材料富含的醛基可以与含有氨基的药物发生偶联,从而使得药物有效滞留在交联网格中,进而使得药物可以在病灶部位局部缓释,有效地解决了药物的体内代谢快、利用率低的问题,在维持体内药物浓度、减少给药剂量、提高药物利用率、避免药物耐药等应用方面具有广阔的发展前景,并且该支架材料制备简单温和,对于所担载的药物种类没有选择性,适应范围广且生物相容性良好。
附图说明
图1为本发明实施例1中得到的多醛基葡聚糖的1hnmr图;
图2为本发明实施例4中得到的负载dox的支架材料的外观形貌照片与支架材料的扫描电镜图;
图3为本发明实施例4中得到的负载dox的支架材料的dox的体外释放曲线图;
图4为本发明实施例5中得到的负载igg的支架材料的igg的体外释放曲线图;
图5为本发明实施例13制备的支架材料用于结肠癌的腹腔转移瘤模型的治疗效果(空白对照组control,支架担载apd-1组bi@apd-1,支架担载dox组bi@dox,支架共载dox与apd-1组bi@apd-1+dox);
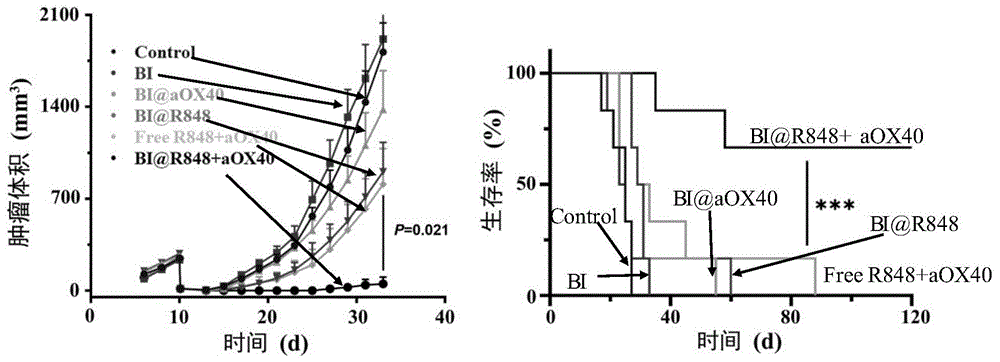
图6为本发明实施例14制备的支架材料用于结肠癌的术后复发模型的治疗效果(空白对照组control,空白支架组bi,支架担载雷喹莫特组bi@r848,支架担载抗ox40抗体组bi@aox40,纯药雷喹莫特与抗ox40抗体组freer848+aox40,支架共载雷喹莫特与抗ox40抗体组bi@r848+aox40)。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种支架材料,由多臂氨基聚乙二醇与多醛基葡聚糖交联得到。
在本发明中,所述多臂氨基聚乙二醇优选为2~8臂氨基聚乙二醇,更优选为式(i)~式(iii)所示的一种或多种,再优选为八臂氨基聚乙二醇,:
其中m、n和p均为聚合度,
1≤m≤500;1≤n≤500;1≤p≤200,其中r为三季戊四醇除去8个羟基的基团。
所述多醛基葡聚糖优选为如式(iv)所示:
其中n,p为聚合度,10≤q≤500,10≤k≤500。
所述多臂氨基聚乙二醇与多醛基葡聚糖的质量比优选为1:(0.05~10),更优选为1:(0.1~5),再优选为1:(0.15~5),最优选为1:(0.2~2);在本发明提供的一些实施例中,所述多臂氨基聚乙二醇与多醛基葡聚糖的质量比优选为1:1。
本发明提供的支架材料优选为凝胶材料或冻干材料,便于储存及临床使用;所述支架材料的尺寸优选为0.1~20cm。
本发明提供的支架材料通过醛基与氨基的席夫碱作用形成交联网格,在担载药物时可将药物封装在支架内部,材料富含的醛基可以与含有氨基的药物发生偶联,从而使得药物有效滞留在交联网格中,进而使得药物可以在病灶部位局部缓释,有效地解决了药物的体内代谢快、利用率低的问题,在维持体内药物浓度、减少给药剂量、提高药物利用率、避免药物耐药等应用方面具有广阔的发展前景,并且该支架材料制备简单温和,对于所担载的药物种类没有选择性,适应范围广且生物相容性良好。
本发明还提供了一种上述支架材料的制备方法,包括:s)将多臂氨基聚乙二醇与多醛基葡聚糖在水溶液中反应,得到支架材料。
其中,本发明对所有原料的来源并没有特殊的限制,为市售即可;所述多臂氨基聚乙二醇与多醛基葡聚糖均同上所述,在此不再赘述。
在本发明中,优选将多臂氨基聚乙二醇水溶液与多醛基葡聚糖水溶液混合反应;所述多臂氨基聚乙二醇水溶液中多臂氨基聚乙二醇的浓度优选为1mg/ml~300mg/ml,更优选为10mg/ml~250mg/ml,再优选为30mg/ml~220mg/ml,最优选为50mg/ml~200mg/ml;在本发明提供的一些实施例中,所述多臂氨基聚乙二醇水溶液中多臂氨基聚乙二醇的浓度优选为100mg/ml;所述多臂氨基聚乙二醇水溶液优选为多臂氨基聚乙二醇的磷酸盐缓冲液;所述多臂氨基聚乙二醇水溶液的ph值优选为7~7.5,更优选为7.2~7.5,再优选为7.4;所述多醛基葡聚糖水溶液中多醛基葡聚糖的浓度优选为1mg/ml~300mg/ml,更优选为10mg/ml~250mg/ml,再优选为30mg/ml~220mg/ml,最优选为50mg/ml~200mg/ml;在本发明提供的一些实施例中,所述多醛基葡聚糖水溶液中多醛基葡聚糖的浓度优选为100mg/ml;所述多醛基葡聚糖水溶液优选为多醛基葡聚糖的磷酸盐缓冲液;所述多醛基葡聚糖水溶液的ph值优选为7~7.5,更优选为7.2~7.5,再优选为7.4;所述多臂氨基聚乙二醇水溶液与多醛基葡聚糖水溶液的质量比优选为1:(0.05~10),更优选为1:(0.1~5),再优选为1:(0.15~5),再优选为1:(0.2~2),再优选为1:(0.5~1.5),最优选为1:1。
混合反应后,可得到液态凝胶支架材料;或者混合反应后,优选进行冷冻干燥,得到固态冻干支架材料;所述冷冻干燥的温度优选为-80℃;所述冷冻干燥优选先冷冻10~14h,更优选为12h,然后再冻干20~26h,更优选为22~26h,再优选为24h。
所述支架材料的形状、尺寸可根据用途来设定。
本发明提供的制备方法简单,原料来源广泛且生物相容性良好,可以实现批量生产,可以实现产业化。
本发明还提供了一种上述支架材料在担载药物中的应用。
由于本发明提供的支架材料能够在温和水溶液中实现,因此对所担载的药物种类没有选择性,并且能够有效地保护那些易变质失活类药物(如蛋白类、和酸类),实现药物的局部缓释;本发明所担载的药物可为小分子药物也可为大分子药物,并无特殊的限制,适用范围广。
所述支架材料可通过在形成支架材料前,将一种或多种药物溶解在氨基化合物与醛基化合物混合后的溶液中进行药物担载;也可形成支架材料之后,将药物滴加到支架材料中或者将支架材料浸泡入药物溶液中,进行药物担载。
在本发明中,所述药物优选为临床使用化疗药物、免疫激动剂与抗体类药物中的一种或多种,更优选为小分子药物类阿霉素(dox)、雷喹莫特(r848)等,多肽类多粘菌素b、卡培立肽等,蛋白类药物pd-1抗体、抗ox40抗体(aox40)等。
所述药物、多臂氨基聚乙二醇与多醛基葡聚糖的质量比优选为1:(0.01~1000):(0.01~1000),更优选为1:(1~500):(1~500),再优选为1:(50~200):(50~200)。
本发明还提供了一种上述支架材料在制备抗肿瘤药物中的应用;担载药物的支架材料可通过手术将其固定在中肿瘤附近,可通过手术将其固定在腹腔内肿瘤附近或者通过手术植入将其固定在原发肿瘤切除部位的附近。
为了进一步说明本发明,以下结合实施例对本发明提供的一种支架材料、其制备方法及应用进行详细描述。
以下实施例中所用的试剂均为市售。
实施例1
将20g(0.50mmol)的葡聚糖(dex,分子量为40000da)溶于300ml水中,搅拌溶解后加入8.6g(0.15mmol溶液)的高碘酸钠,密封,在温度为25℃的条件下,搅拌反应24h。反应结束后,用去离子水透析3天,经冻干,得到具有式(iv)结构的多醛基葡聚糖。
利用核磁共振对实施例1中得到的多醛基葡聚糖进行分析,得到核磁共振氢谱图,如图1所述。图1为得到的多醛基葡聚糖的1hnmr图。
实施例2
空白凝胶支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的多醛基葡聚糖(odex)分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml。然后将250μl的4臂peg-nh2溶液中与250μl的odex溶液混合(peg-nh2与odex的质量比为1:1),涡旋10s后,将混合物置于模具中,得到空白的凝胶支架材料。
实施例3
空白支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的多醛基葡聚糖(odex)分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml。然后将250μl的4臂peg-nh2溶液中与250μl的odex溶液混合(peg-nh2与odex的质量比为1:1),涡旋10s后,将混合物置于模具中,然后在-80℃下冷冻12h,然后冻干24h,得到冻干的空白支架材料。
实施例4
负载dox支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的多醛基葡聚糖(odex)分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml。然后将300μgdox加入250μl的4臂peg-nh2溶液中,然后与250μl的odex溶液混合(peg-nh2与odex的质量比为1:1),涡旋10s后,将混合物置于模具中,然后在-80℃下冷冻12h,然后冻干24h,得到负载dox的支架材料。
图2为得到实施例4中得到的负载dox的支架材料的外观形貌照片与支架材料的扫描电镜图,由扫描电镜图可以观察到其微观的内部交联结构。
实施例5
负载igg支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml,然后将150μg的igg与250μl溶解后的4臂peg-nh2和250μl溶解后的odex混合涡旋(peg-nh2与odex的质量比为1:1),10s后,将混合物置于模具中,静置,得到负载igg的凝胶支架材料。
实施例6
负载apd-1支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml,然后将250μl溶解的4臂peg-nh2和250μl溶解的odex混合(peg-nh2与odex的质量比为1:1),涡旋10s后,将混合物置于模具中,然后在-80℃下冷冻12h,冻干24h后,将150μg的apd-1抗体溶液加入到冻干后的支架内,得到负载apd-1的支架材料。
实施例7
负载dox与apd-1的支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml,然后将溶解后的250μl的4臂peg-nh2和250μl的odex与300μg的dox混合涡旋(peg-nh2与odex的质量比为1:1),10s后,将混合物置于模具中,然后在-80℃下冷冻12h,冻干24h后,将150μg的apd-1抗体加入到冻干后的支架内,得到可植入的共载dox与apd-1的支架材料。
实施例8
负载r848支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4)两者的浓度均为100mg/ml,然后将溶解后的250μl的4臂peg-nh2和250μl的odex与150μgr848混合涡旋(peg-nh2与odex的质量比为1:1),10s后,将混合物置于模具中,然后在-80℃下冷冻12h,冻干24h后,得到可植入的负载r848的支架材料。
实施例9
负载aox40抗体支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml,然后将溶解后的250μl的4臂peg-nh2和250μl的odex混合涡旋(peg-nh2与odex的质量比为1:1),10s后,将混合物置于模具中,然后在-80℃下冷冻12h,冻干24h后,将15μg的aox40抗体加入到冻干后的支架内,得到可植入的负载aox40的支架材料。
实施例10
负载r848与aox40抗体的支架材料的制备
将分子量为10000的4臂peg-nh2和实施例1中得到的odex分别溶解于pbs中(ph=7.4),两者的浓度均为100mg/ml,然后将150μgr848加入4臂peg-nh2溶液中。将250μl的4臂peg-nh2和250μl的odex混合(peg-nh2与odex的质量比为1:1),涡旋10s后,将混合物置于模具中,然后在-80℃下冷冻12h,冻干24h后将15μg的aox40抗体加入到冻干后的支架内,得到可植入的共载r848与aox40抗体的支架材料。
实施例11
小分子药物dox的体外释放
将实施例2中得到的负载dox的支架材料置于释放瓶中,在支架上加入ph7.4或ph6.5的磷酸盐缓冲液2.0ml,然后将样品置于37℃震荡箱中孵育,在预先设定的时间12h,24h,48h,72h,96h,120h,144h,168h,取覆盖在支架上的释放液1ml用于检测,再补加1ml新的缓冲液,通过荧光分光光度计(dox的激发波长为480nm,发射波长为560nm)来定量药物浓度,得到dox的释放曲线,如图3所示。
实施例12
大分子药物igg(蛋白预先被cy5标记)的体外释放
将实施例3得到的负载igg的支架置于释放瓶中,在支架上加入ph7.4或ph6.5的磷酸盐缓冲液2.0ml,然后将样品置于37℃震荡箱中孵育,在预先设定的时间12h,24h,48h,72h,96h,120h,144h,168h,取覆盖在支架上的释放液1ml用于检测,再补加1ml新的缓冲液,通过荧光分光光度计(igg-cy5的激发波长为649nm,发射波长为670nm)来定量药物浓度,得到igg的释放曲线,如图4所示。
实施例13
负载dox与apd-1抗体的植入支架用于结肠癌的腹腔转移瘤模型的治疗
取bablc小鼠(体重16-18g左右)35只,随机分为五组,分别为空白对照组、实施例2中得到的负载dox的支架治疗组、实施例4中得到的负载apd-1的支架治疗组、实施例5中得到的共载dox与apd-1的支架治疗组、游离dox与apd-1治疗组(dox的植入剂量均为15mg/kg,apd-1的植入剂量为150μg/只)。经腹腔注射500万ct26细胞一周后,通过手术将支架植入到腹腔内,继续观察一周后,对小鼠实施安乐死,取出腹腔内肿瘤进行拍照与称重,得到治疗效果如图5所示。
实施例14
负载r848与抗ox40抗体(aox40)的支架材料用于结肠癌的术后复发模型的治疗
取bablc小鼠(体重16-18g左右)60只,随机分为六组,分别为空白对照组、空白支架组(按照实施例6的方法制备只是没有负载r848)、实施例6中得到的负载r848的支架治疗组、实施例7中得到负载aox40的支架治疗组、实施例8中得到的共载r848与aox40的支架治疗组、游离r848与aox40治疗组(r848的剂量均为150μg/只,aox40的剂量为15μg/只)。小鼠皮下注射150万ct26细胞,待肿瘤体积长到200~300mm3后,通过手术将肿瘤切除90%,然后将支架植入到残留的肿瘤上,继续观察肿瘤体积,得到治疗效果如图6所示。
- 还没有人留言评论。精彩留言会获得点赞!