糖酵解抑制剂在制备防治猪繁殖与呼吸综合征病毒感染的药物中的应用的制作方法
本发明属于兽用防治药物技术领域,具体涉及糖酵解抑制剂在制备防治猪繁殖与呼吸综合征病毒感染的药物中的应用。
背景技术:
猪繁殖与呼吸综合征的病原是猪繁殖与呼吸综合征病毒(porcinereproductiveandrespiratorysyndromevirus,prrsv),该病毒属于动脉炎病毒科,系单股正链rna病毒。该病毒感染可引起孕期母猪生殖障碍、各年龄段猪呼吸系统障碍、猪体免疫抑制、促进继发感染的疾病,给国内外猪类养殖行业造成了巨大经济损失。商品疫苗尚不理想。疫苗对毒株间的交叉保护能力并不完全,且活病毒在猪体内复制的过程存在病毒毒力返强及与野毒重组成新毒株的可能。所以,尽管prrsv疫苗能够对仔猪提供一定的保护作用,但prrsv易重组、缺失等特点造成的自身多样性使之能逃避疫苗的免疫监视作用而成为prrs防治面临的巨大挑战。针对拮抗prrsv感染的药物是重要的研究方向。
许多宿主抗病毒因子,如干扰素刺激基因(isgs)、viperin、mx2、2’、5’-寡腺苷酸合成酶1(oas1)、干扰素诱导的四肽重复蛋白3(ifit3)、ch25h等已被报道具有抗prrsv感染的抗病毒活性。另外,一些micrornas、sirna和shrna也被证明可以抑制prrsv的复制。但是,这些蛋白或小分子rna容易被动物体内的酶所降解,因此很难进行体内实验。同时还有一些抗病毒化合物或天然化合物也有拮抗prrsv的作用。但是,这些药物抗病毒机制及其猪体抗病毒作用研究尚不深入,且因prrsv容易发生变异,针对prrsv的抗病毒药物容易引起病毒产生耐药性突变,从而使药物失效。因此,寻找新的有效的抗病毒药物的研究思路至关重要。
技术实现要素:
本发明的目的在于提供糖酵解抑制剂在制备防治猪繁殖与呼吸综合征病毒感染的药物中的应用。
本发明的目的可以通过以下技术方案实现:
糖酵解抑制剂在制备防治猪繁殖与呼吸综合征病毒感染的药物中的应用。
作为一种优选技术方案,所述的糖酵解抑制剂为己糖激酶抑制剂和/或乳酸脱氢酶抑制剂。
进一步优选的,所述的己糖激酶抑制剂为2-脱氧-d-葡萄糖(2-dg);所述的乳酸脱氢酶抑制剂选自草氨酸钠和黄培素中的至少一种。
上述的药物是以糖酵解抑制剂为有效成分制成的药物。
上述的药物中还含有药学上可接受的载体。
上述药物的剂型为兽药学上可接受的任一一种剂型。
在本发明的研究中,首先发现细胞中的甘油醛-3-磷酸脱氢酶(dehydrogenase,glyceraldehydephosphate,gapdh)可以通过其糖酵解酶活性促进prrsv的复制。进一步发现糖酵解第一步反应关键酶己糖激酶的抑制剂2-脱氧-d-葡萄糖(2-deoxy-d-glucose,2-dg)和最后一步的关键酶乳酸脱氢酶的抑制剂草氨酸钠和培黄素在体外具有抗prrsv感染的能力。鉴此,我们进行了猪体试验,发现口服草氨酸钠和培黄素可显著抑制prrsv在猪体内复制,对prrsv感染仔猪具有治疗功效,具有重要应用价值。
本发明的有益效果:
本发明研究发现糖酵解抑制剂可用于防治猪繁殖与呼吸综合征病毒感染,尤其是通过口服乳酸脱氢酶抑制剂草氨酸钠或培黄素可显著抑制prrsv在猪体内复制,首次发现糖酵解抑制剂尤其是乳酸脱氢酶抑制剂(草氨酸钠或培黄素)作为prrsv拮抗药物的新用途,其抗prrsv的药效成分明确,质量可控,安全无毒,在猪繁殖与呼吸综合征防治方面具有很好的应用前景。
附图说明
图1为过表达gapdh促进prrsv复制。
图2为敲减gapdh抑制prrsv复制。
图3为gapdh以酶活性依赖方式促进prrsv的复制。
图4为糖酵解抑制剂2-dg降低prrsv复制水平。
图5为草氨酸钠降低prrsv在marc-145细胞上复制水平。
图6为培黄素降低prrsv在marc-145细胞上复制水平。
图7为prrsv感染和药物治疗仔猪的临床症状。
图8为prrsv感染和药物治疗仔猪肺脏病毒载量测定结果。
图9为prrsv感染和药物治疗仔猪肺脏肉眼病理变化。
图10为prrsv感染和药物治疗仔猪肺脏组织病理变化。
具体实施方式
下面结合具体实施例,进一步阐明本发明。
1.材料与方法
1.1细胞与病毒
高致病性prrsv毒株bb0907和marc-145细胞由实验室保存且为现有技术中已经公开的常规毒株和细胞。
1.2主要试剂
草氨酸钠(sodiumoxamate)购自南京金益柏生物科技有限公司,纯度>98%;2-脱氧-d-葡萄糖(2-deoxy-d-glucose,2-dg)购自sigma;培黄素(galloflavin)购自apexbio;增强型cck8试剂盒购自碧云天生物技术有限公司;抗prrsvn蛋白的抗体(2h7)由本实验室研究生制备并保存;标记alex594羊抗鼠荧光二抗购自碧云天生物技术有限公司;反转录酶hiscriptii1ststrandcdnasynthesiskit和
本发明中所使用的生物化学技术均为本领域中的常规技术:在以下实验过程中,除非特殊说明,所有实验操作均按照以下实验手册或文献中的部分进行,包括:[美]j.沙姆布鲁克等,分子克隆实验指南;赵永芳等,生物化学技术原理及其应用(第二版);朱检等,生物化学实验[m]。
1.3质粒构建
根据genbank数据库中猴源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,gapdh,genbank:nm_001195426.1)和猪源gapdh(pgapdh,genbank:af017079.1)的基因序列,利用primerpremer5软件,设计特异性pcr引物,并在引物两端分别添加ecori和nhei酶切位点和保护性碱基(表1)。分别以marc-145细胞和猪肺泡巨噬细胞(pam)的cdna为模板,使用primerstar高保真酶进行扩增。为构建gapdh单氨基酸或双氨基酸突变体c152s、h179f和c152s&h179f,设计包含gapdh突变位点的引物(表1),使用primerstar高保真酶,通过融合pcr扩增gapdh突变体。通过双酶切及连接,将目的片段克隆至pcaggs载体质粒中。
表1pcr引物序列
1.4rna干扰
将marc-145细胞接种在24孔板中,当细胞汇合度达到60%时,转染10nmol和15nmol的sigapdh或15nmol的sinc,转染24小时后,感染0.01moiprrsv,于37℃温箱中孵育1h,清洗细胞表面后换上含2%fbs的新鲜dmem营养液,继续37℃培养36h,收集细胞进行westernblotting。干扰片段的序列为:sigapdh:5'-cgggaagcucacuggcaug-3';sinc:5'-uucuccgaacgugucacgutt-3'。
1.5gapdh酶活性检测
采用gapdh活性检测试剂盒(ab204732,abcam),分别检测gapdh-ha和其突变体(c152s、h179f和c152s&h179f)的酶活性。该方法是基于nad+向nadh的转化,通过检测反应体系在37℃条件下,30min内450nm处吸光度的变化来对gapdh的酶活性进行计算。具体操作方法见说明书。
1.6细胞毒性的测定
用含有不同浓度草氨酸钠(1~250mm)、培黄素(0~2.5mm)和2-脱氧-d-葡萄糖(0~20μm)的10%fbs-dmem培养marc-145细胞,37℃孵育48h。细胞活力用增强型cck8试剂盒检测。同时采用dmso作为阴性对照。
1.7病毒滴度测定
marc-145细胞用96孔板培养,细胞汇合度达到70%时,吸弃营养液,并用pbs洗涤细胞表面3次;将经十倍连续稀释的prrsv加入细胞中,37℃孵育1h;用新鲜的2%fbs-dmem替代培养基;在接种后5天(dpi)采用终点稀释分析测定病毒滴度。采用reed-muench法计算50%细胞感染剂量(tcid50)。
1.8仔猪治疗实验设计
20头5周龄的商品仔猪(购自江苏南通某农户),经elisa和pcr分别检测,prrsv,pcv2,prv及csfv抗体和抗原均为阴性。随机分为3组(每组5只):第一组为阳性对照组(positive)—prrsv感染组和未治疗组;第二组为草氨酸钠治疗组(+oxamate)—prrsv感染组和草氨酸钠处理治疗组;第三组为培黄素治疗组(+gal)—prrsv感染组和培黄素处理治疗组;第三组为阴性对照组(mock)—未感染和未经治疗组。对阳性对照组和治疗组仔猪鼻内注射和肌肉注射各1mlprrsvbb0907株(3*105tcid50),感染24小时,治疗组每日口服草氨酸钠(7mg)和培黄素(10μg);感染后,每天监测仔猪的健康状况、直肠温度和体重;于攻毒后第1、4、7、10和14天采集血清样本;所有仔猪于第14天剖杀,收集血清和肺组织,测定病毒载量和组织病理学检查。
1.9实时荧光定量pcr
1.9.1相对荧光定量检测细胞内prrsvmrna的相对水平
按照omegarna病毒提取试剂盒的操作说明,提取细胞rna。反转录为cdna后,以按照omegarna病毒提取试剂盒的操作说明,提取rna。反转录后进行相对荧光定量,所用引物序列见表2:
表2qpcr引物序列
根据2-△△ct的方法,利用ct值计算样品中各基因的mrna的相对含量。
1.9.2绝对荧光定量检测肺脏和血清中prrsvrna的含量
将约1g的肺组织在3mlpbs中匀浆。经三次冻融后,5000rpm离心10min,收取组织匀浆上清;采集的血液经5000rpm离心5min,收取血清;鼻拭子置于1mlpbs中涮洗2min,5000rpm离心10min,收取鼻拭子稀释液;按照omegarna病毒提取试剂盒的操作说明,提取rna;每8μl提取的rna样品加入2μl5*qrtsupermix(10μl反应体系),充分混合后,在pcr仪上进行逆转录反应,反应程序为:25℃10min;50℃30min;85℃5min。产物冻于-70℃,保存备用;以上述cdna为模板,sybrgreen实时pcr检测血清,肺组织和鼻拭子中prrsv核酸含量。引物序列为f:5’-aataacaacggcaagcagcag-3’;r:5’-cctctggactggttttgttgg-3’。反应体系为:2×powersybrgreenpcrmastermix(abi公司)10μl,cdna2μl,引物f/r浓度均为400nmo1/l。反应在abi7300realtimepcr仪上进行。反应程序为:预变性95℃2min;95℃15s,61℃31min;共40个循环。用含有prrsvorf7基因的重组质粒构建标准曲线,进而利用ct值,根据标准曲线计算出肺组织,血清及鼻拭子中的prrsv病毒含量。
1.10临床症状及病理学观察
1.10.1临床症状观察及统计
攻毒后每天测取仔猪直肠温度;观察临床症状,包括被毛、皮肤、吃食情况、有无腹泻、精神状态等。攻毒前后测量仔猪体重。临床症状统计方法如下:根据临床表现(精神状态、被毛、有无腹泻)、呼吸和咳嗽状况,对这三种指标分别进行打分,分值在1~4分之间。症状越严重分值越高,1分表示正常,2分表示症状轻微,3分表示症状严重,死亡猪的各项指标均为4分。攻毒后每天分别对各组仔猪进行评分,三项指标分数之和即为每天每头猪的临床分数,根据攻毒后14天的统计结果,进行数据分析。
1.10.2肺脏大体病变计分方法
根据每个肺叶所占比例分配分数:尖叶和心叶各占10分,膈叶占27.5分,副叶占5分,总分100分。根据每个部分的病变程度进行打分,病变面积越大得分越高,各部分的总和为该肺脏的最后得分,进行三次独立的打分后,对每组的肺脏得分进行统计学分析。攻毒后14天将仔猪全部剖杀,解剖并观察各仔猪肺部的病理变化。水肿,间质增宽及肉变进行观察与统计。
1.10.3病理切片制备与观察
从猪肺脏组织上取下不大于4mm×2cm2的组织块,进行4%多聚甲醛固定;酒精梯度脱水;二甲苯透明;石蜡包埋;修片;切片;苏木精,伊红染色。镜下观察肺组织切片,病理评分规则为:0-无病变,1-轻度,局灶性多灶性间质性肺炎(<50%),2-中度,多局灶性合并(50-75%),3-重度,斑片状合并广泛(75-90%),4-重度弥漫性(>90%)。应用graphpad7软件对数据统计分析,比较各组差异,p<0.05表示差异显著(ns表示p>0.05;*表示p<0.05;**表示p<0.01;***表示p<0.001;****表示p<0.0001)。
2.结果
2.1发现gapdh糖酵解活性在prrsv复制过程中发挥重要作用
2.1.1gapdh有利于prrsv复制
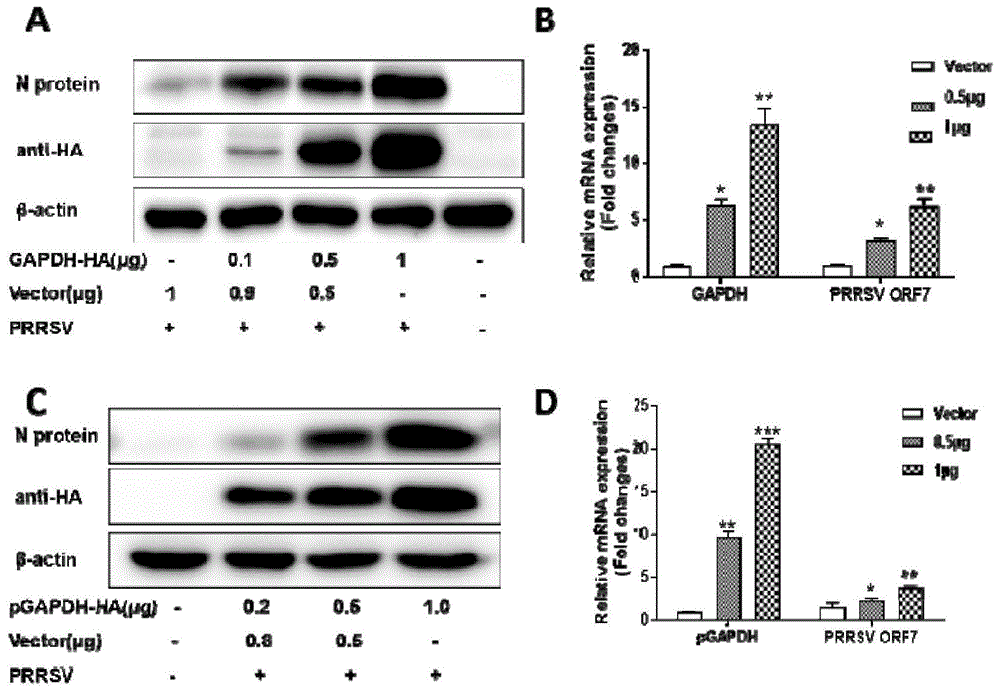
将猴源gapdh真核表达质粒转染至marc-145细胞,24h后接种0.1moi的prrsv,感染36h后收集细胞裂解物,检测prrsv复制情况,结果为:过表达gapdh,prrsv复制明显增加,prrsv-n蛋白的表达水平和病毒rna水平随着gapdh表达的增多而逐渐增多(图1a和1b)。猪源gapdh(pgapdh)与猴源gapdh的氨基酸序列同源性为97%。我们将pgapdh转染细胞测定prrsv复制水平,结果显示,猪源gapdh(pgapdh)与猴源gapdh促进prrsv复制效果相似(图1c和d)。
为了进一步明确gapdh对prrsv复制的影响,我们设计了针对gapdh基因的sirna(sigapdh),转染至marc-145细胞(转染剂量10nm和15nm),同时设立无关干扰对照组(转染15nm的sinc),转染后24h,感染0.1moiprrsv。培养30h,收集细胞并进行裂解,用westernblotting检测prrsvn蛋白相对含量。结果如图2所示。与sinc对照组细胞相比,sigapdh可有效减少内源性gapdh表达(p<0.01),并且显著降低了prrsvn蛋白的表达(p<0.01)。
2.1.2gapdh通过糖酵解活性促进prrsv复制
将gapdh酶活性相关的关键氨基酸进行突变,构建了三个gapdh突变体重组质粒:gap-c152s、gap-h179f和gap-c152s&h179f。转染marc-145细胞,westernblotting检测,三种突变体的蛋白表达量基本一致(图3a),收集marc-145细胞,测定gapdh酶活性,图3b结果显示:相对野生型gapdh,突变了152位的半胱氨酸(cys-152)的两个突变体的gapdh的酶活性显著降低。然后我们通过转染三种突变体并感染prrsv,培养36h,westernblotting检测prrsv-n蛋白水平,结果如图3c所示:第152位的半胱氨酸(cys-152)突变体gapdh不能促进prrsv复制。当将gap-c152s进行回复性突变后,则恢复其显著促进prrsv复制作用(图3d)。综合上述结果,gapdh通过其糖酵解活性,促进prrsv的复制,第152位的半胱氨酸(cys-152)是其重要活性位点。
2.2发现糖酵解抑制剂显著抑制prrsv复制
2.2.12-dg在marc145细胞中具有抑制prrsv作用
为了探索细胞糖酵解过程对prrsv复制的影响,采用糖酵解抑制剂2-dg对细胞的糖酵解过程进行抑制。首先,采用cck8细胞毒性检测法确定2-dg对marc-145细胞的细胞毒性,发现其在20μm以内对细胞几乎无毒性(图4a)。marc-145细胞感染prrsv(0.01moi)后,分别用0、2.5、5、10和15μm2-dg处理marc-145细胞。36小时后,用westernbloting检测2-dg在marc-145细胞上对prrsv的抑制效率,如图4b显示,2-dg在浓度为5μm时即对prrsv产生大约50%的抑制效率。为了进一步确定2-dg的抗prrsv活性,分别对细胞培养液中的病毒tcid50和细胞内的prrsvorf7mrna水平进行检测,结果显示病毒滴度和orf7mrna水平呈剂量依赖性下降(图4c和图4d)。
2.2.2草氨酸钠在marc-145细胞中具有抑制prrsv作用
为了进一步验证糖酵解对prrsv的影响,用糖酵解最后一步关键酶—乳酸脱氢酶的抑制剂草氨酸钠(sodiumoxamate,-oxamate,so)处理感染了prrsv的marc-145,同时设立对照组,检测病毒复制水平是否具有差异。首先采用cck8细胞毒性检测法确定so对marc-145细胞的细胞毒性,发现其在100mm时对细胞开始产生毒性(图5a)。marc-145细胞感染prrsv(0.01moi)后,用0、25和50mm的so处理marc-145细胞。感染后36h时,分别用westernbloting、tcid50和rt-pcr检测prrsvn蛋白表达水平、病毒滴度和prrsvorf7mrna水平,结果显示so可以降低细胞内的prrsv复制,且呈剂量依赖性下降(图5b-5d)。
2.2.3培黄素在marc-145细胞中具有抑制prrsv作用
用乳酸脱氢酶的抑制剂培黄素(galloflavin,gal)处理感染了prrsv的marc-145,同时设立对照组,检测病毒复制水平是否具有差异。首先采用cck8细胞毒性检测法确定gal对marc-145细胞的细胞毒性,发现其在500μm时对细胞开始产生毒性(图6a)。marc-145细胞感染prrsv(0.01moi)后,用10、50和100μm的gal处理marc-145细胞。感染后36h时,用westernbloting检测prrsvn蛋白表达水平,结果显示gal可以降低细胞内的prrsv复制,且呈剂量依赖性下降(图6b)。同时,采用tcid50和rt-pcr检测prrsvorf7mrna水平和病毒滴度,结果显示gal可以降低prrsv的mrna水平和,且呈剂量依赖性下降(图6c-d)。
2.3草氨酸钠和培黄素对prrsv感染仔猪具有治疗作用
2.3.1临床症状
病毒感染后0-14天,每天测定仔猪直肠温度(图7a),仔猪体重(图7b)及临床症状(图7c),结果为:阴性对照组仔猪在实验过程中均未出现临床发热,无明显临床症状,且生长速度正常。阳性对照组仔猪在病毒感染后第10-14天持续高热(≥40.5℃),表现出食欲不振、嗜睡、毛发粗糙、呼吸困难、眼周水肿、轻度腹泻等临床症状;体重增长率与阴性对照组相比明显降低(p<0.001)。而草氨酸钠治疗组和培黄素治疗组仔猪体温未超过40.5℃,临床症状不明显,精神状态和食欲较正常,无呼吸困难或咳嗽等呼吸系统症状,与阳性对照组相比,临床症状明显减轻(p<0.001);体重增长速度与阴性对照组相似(p>0.05)。
2.3.2病毒血症和肺组织病毒载量检测结果
分别于1、4、7、10、14dpi处采集血清,采用qrt-pcr法测定prrsv基因组cdna拷贝数,结果为:草氨酸钠治疗组和培黄素治疗组仔猪的血清中病毒含量显著低于阳性对照组(图8a)。14dpi剖杀仔猪,检测每头仔猪肺部病毒载量,结果为:两组治疗组仔猪肺内prrsv病毒载量明显低于阳性对照组(图8b)(p<0.0001)。
2.3.3仔猪肺脏肉眼病变
攻毒后第14d剖杀仔猪,对每组仔猪的肺脏进行肉眼病变观察,并统计打分。结果显示,阴性对照组仔猪肺脏眼观完全正常,无明显病变;阳性对照组仔猪肺组织有明显的肺组织实变和出血;而治疗组仔猪的肺部病变明显轻于阳性对照组(图9a)。肺脏肉眼病变评分统计结果显示,与阳性对照组仔猪肺脏病变得分相比,草氨酸钠治疗组仔猪的肺脏病变计分明显降低(p<0.01),培黄素治疗组肺脏病变计分显著更低(图9b)(p<0.001)。
2.3.4仔猪肺脏病理学变化
肺脏组织病理学变化观察结果为:阳性对照组仔猪肺组织有明显的肺泡间隔增厚、肺泡间隔散在出血、炎性细胞增多和气管内炎性渗出物增多的现象;草氨酸钠治疗组仔猪肺脏组织病变出现轻度肺泡间隔增厚和炎性细胞侵润,而培黄素治疗组仔猪肺脏组织的病变显著减轻,与阴性对照组仔猪肺脏组织相似(图10a)。肺脏组织显微病变评分统计结果显示,阴性对照组和治疗组肺脏组织病变计分均显著低于攻毒对照组(图10b)(p<0.01)。
3.讨论
prrsv可以感染任何年龄的猪,主要引起怀孕母猪流产、早产、产死胎、弱胎及木乃伊胎等繁殖障碍,仔猪和育肥猪出现呼吸道症状。prrsv于1987年在美国首次被报道,随后在全球迅速传播。我国在1996年由中国农业科学院哈尔滨兽医研究所首次从疑似prrs病例中分离到美洲型prrsv(ch-1a株)。2006-2007年高致病性hp-prrsv席卷我国各省,给养猪业带来了巨大损失。世界动物卫生组织将其列为b类疾病,中华人民共和国动物防疫法》将经典的prrs列为二类动物疫病、高致病性prrs列为一类动物疫病。
目前在我国,prrsv的预防除了加强管理,严格消毒等措施外,疫苗免疫是预防prrs的主要措施,主要以灭活苗和弱毒苗为主。但因其易发生变异、多毒株同时感染及持续感染等特征,使疫苗免疫并不能完全控制prrsv的传播。而且,目前为止对其尚无特效药物。因此,开发新的有效药物对prrs的防治至关重要。
寻找有效抑制病毒复制是有效的治疗方法,但完成筛选体外病毒抑制药物,分析其体内代谢动力学及毒副作用较为复杂;且prrsv具有易变异的特点,抗病毒药物的使用可能导致耐药毒株的出现。为了突破这一瓶颈,可以从宿主角度分析并探寻治疗方案,代谢免疫学是现代免疫学的前沿研究方向。将宿主免疫反应与其代谢改变相结合进行研究,可以发现针对相应靶点的药物,从而减轻病毒感染对宿主造成的损伤。
本研究通过发现gapdh可以通过其糖酵解活性促进prrsv复制,将糖酵解与prrsv复制相连接。在正常哺乳动物细胞中,葡萄糖通过糖酵解而被氧化,进入三羧酸循环(tca),产生atp用于细胞内的生命活动。本研究发现经典糖酵解抑制剂2-dg对prrsv的感染具有抑制作用,确定了宿主细胞内的糖酵解过程在prrsv复制中发挥重要作用。同时,发现了另外糖酵解过程乳酸脱氢酶抑制剂草氨酸钠和培黄素均可抑制prrsv复制。2-dg成本高,应用在临床性价比较低,因此选用草案酸钠和培黄素进行仔猪治疗实验,结果显示:草氨酸钠和培黄素可以减轻由prrsv引起的厌食、发热(40至41℃),昏睡、沉郁、呼吸困难等临床症状;大大降低感染仔猪的病毒血症、肺部病毒载量;减轻由prrsv引起的间质性肺炎。表现出了作为prrsv治疗药物的巨大潜力。本研究首次发现prrsv拮抗药物草氨酸钠和培黄素,其抗prrsv的药效成分明确,质量可控,安全无毒,在猪繁殖与呼吸综合征防治方面具有很好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!