皮下植入式医疗设备及处理其信号的方法与流程
本发明涉及处理皮下植入式心脏设备的信号的方法,并且涉及此类皮下植入式心脏设备,尤其是皮下植入式除颤器。
背景技术:
常规(即静脉型)植入式自动除颤器(也称为“植入式心律转复除颤器”,即“icd”)包括除颤脉冲发生器和微处理器监视及控制单元,它们被容纳在一般植入于胸袋中的金属壳体中。该壳体连接到一个或多个引脚,这些引脚插入锁骨下静脉直至它们到达心脏。在心脏内,引脚的末端附连到心腔内壁,在此它们记录反映心脏的电生理功能的电图(egm)。在egm的基础上,给予(或中断)除颤形式的治疗(除颤电击),以终止致命的室性快速性心律失常,诸如室性心动过速和心室纤颤。
此类经静脉植入式自动除颤器(以及心脏刺激器或“心脏起搏器”以及类似设备)的最弱元件是心内引脚。事实上,引脚断裂是心脏起搏器故障的最常见原因之一。取出所植入的icd引脚(或所植入的心脏起搏器引脚)是经受高发病率和高死亡率的过程,并且通常只在不能使用抗生素治疗的严重的系统性感染的情况下执行。在大多数情形中,断裂的引脚与设备断开连接并留在心脏中。新引脚随后被植入在旧引脚旁边,并且连接到植入式自动除颤器。然而,该解决方案只有在静脉中留有足够空间时是可能的,因为更多引脚的存在可导致静脉阻塞。因此,使用心内引脚对于年轻患者而言不是理想的,他们在他们的寿命期间可能需要许多引脚。
与心内引脚相关联的上述问题的一种解决方案包括使用皮下引脚来替换它们。以此方式,在没有与心脏或与血液接触的情况下,系统性感染的风险被消除并且静脉不再被阻塞。此外,不同于提取心内引脚,提取皮下引脚造成较少创伤并且没有任何死亡风险,因为皮下引脚没有接触心脏。结果,在断裂的情况下,引脚可被非常安全地移除,并且随后可以用新皮下引脚来替换,而没有对患者造成任何风险。
皮下植入式设备的主要挑战与在皮下记录的信号的信噪比的下降有关并与成功除颤所需的能量的增加有关。并非记录egm,皮下植入式设备记录皮下心电图(ecg),这捕获在空间上平均在远场的电生理活动。因而在皮下信号中,p波和t波比r波更大,从而使得难以检测r-r间隔,而多种快速性心律失常检测算法是基于r-r间隔的。非心脏噪声源(诸如肌电位)也可使皮下信号降级并干扰检测算法,从而扰乱处理和治疗。另外,与心内信号相比,皮下信号往往对姿势变化更敏感。总体而言,这些困难造成了与常规植入式自动除颤器相比更复杂的检测规程。用于处理心内电图信号的算法或方法(如从ep2105843a1和ep2368493a1知悉的)被配置成使得将真正室性心动过速(vt)和室上性心动过速(svt)区分开成为可能。然而,这些已知算法没有适配成基于在皮下采集的信号来检测快速性心律失常。事实上,因为皮下除颤器更易于经受对噪声和p波或t波的过检测或“过感测”,所以在皮下除颤器的特定情形中,有必要使得在噪声或p波或t波被过感测时诊断vt或心室纤颤(vf)的风险最小化。例如,在植入式自动除颤器中,对所采集的信号的错误解释会造成不适当的电击,这对患者而言可能是痛苦的或甚至是有害的。
鉴于上述限制,存在如下需求:改进经由皮下引脚采集的信号的处理,尤其是以便能够确认是否存在快速性心律失常以及能够将对t波或p波(或噪声)的过感测与快速性心律失常区分开。
技术实现要素:
本发明的目标因而是改进借助皮下医疗设备的皮下引脚采集的信号的处理,尤其是改进使用皮下引脚记录的快速性心律失常发作的检测或“感测”和辨别的灵感度和特异度。
本发明通过提供一种皮下植入式有源医疗设备,尤其是皮下心脏除颤器,来实现这一目标,该皮下植入式医疗有源设备包括:壳体;以及连接到壳体的皮下植入式引脚;该皮下植入式引脚包括形成至少两个偶极子多个感测电极,其中从该至少两个偶极子并发地收集至少两个电信号;第一偶极子具有小于第二偶极子的长度的长度;设备还包括控制器,所述控制器被配置成通过在所定义的心脏周期序列期间基于经由第一偶极子和经由第二偶极子并发地采集的电信号确定相似度准则来确定是否存在快速性心律失常,使得经由第一偶极子执行去极化峰的检测,这对应于r波的检测。
基于经由第一偶极子采集的信号来检测去极化峰使得改进r波的皮下检测的质量成为可能,因为皮下引脚的第一偶极子短于皮下引脚的第二偶极子,并且因此与第二偶极子相比,较少暴露到对噪声的过感测的风险或在检测qrs复合波时出错的风险。事实上,第一偶极子的诸电极之间所覆盖的距离很短,由此降低信号被外部源降级的风险。例如,在电极之间存在能引入肌电位的较少肌肉量。
在提供皮下植入式有源医疗设备中,本发明可借助以下实施例来被进一步改进。
在本发明的一个实施例中,可在包括qrs复合波且以r波的检测为中心的时窗上考虑经由皮下植入式引脚的第一偶极子和第二偶极子采集的信号,r波的检测是只经由第一偶极子来执行的。
因而,经由第一偶极子采集的信号的r-r间隔可被确定,并且时窗(例如,范围在80毫秒(ms)到150ms中的时窗,并且尤其是100ms的时窗)能以经由第一偶极子执行的r波的检测为中心。r波的检测因而没有在第二偶极子上执行,以不增加任何进一步计算成本。与来自第一偶极子的信号并发地采集的来自第二偶极子的信号,尤其是仅在时窗期间,可被记录在该设备的存储器中。
在本发明的一个实施例中,控制器可被配置成:将经由第一偶极子采集的信号和经由第二偶极子采集的信号相组合,以及基于根据经由第一偶极子采集的信号对经由第二偶极子采集的信号的表示,确定因变于时间来参数化并且表示患者的心脏活动的二维曲线,相似度准则是通过所述二维曲线与表示正常窦性心律的参考二维曲线之间的比较(尤其是通过相关)来定义的。
由控制器确定二维曲线使得将经由第一偶极子采集的信号与经由第二偶极子采集的信号相组合成为可能:因而使得将来自皮下引脚的两个偶极子的信息同时纳入考虑成为可能,尤其是通过考虑——取决于偶极子——不同电信号形态,从而对获得与所采集的信号(它们是更相关的)的原点相关的参数作出贡献。具体而言,与所采集的信号的原点相关的此类参数参与确定相似度准则。
在本发明的一个实施例中,控制器还可被配置成根据切线向量的诸坐标中的至少一者在所述二维曲线的多个点中的每一对相继点之间的符号改变来标识所采集的信号中不合需噪声的存在或缺失。更确切而言,控制器可被配置成通过确定切线向量的诸坐标中的至少一者在所述二维曲线的多个点中的每一对相继点之间的改变符号的次数并通过将该次数与指示不合需噪声的预定阈值次数相比较,来标识不合需噪声的存在。
事实上,对于非有噪心脏周期,在两个偶极子上采集的信号之间存在关系或比率,这意味着二维曲线是以基本上统一的方式来表示的。相反,对于有噪心脏周期,即对于包括源自心外的伪像的周期,二维曲线可被不规则地表示。此类不规则表示可由切线向量的诸坐标中的至少一者在二维曲线的每一对相继点之间改变符号的次数来表征。控制器因而被适配成借助快速且在软件资源方面成本高效的计算来标识所采集的信号中噪声的存在。该设备的控制器可被配置成通过增加用于检测r波的阈值或通过延长不应期来去往“噪声模式”达特定时长,例如30秒,
在本发明的一个实施例中,控制器还可被配置成通过确定多数准则来确定快速性心律失常的存在或缺失,多数准则是基于相似度准则通过计算在所采集的信号与标识正常窦周期的参考信号之间相似的周期的数目来确定的。
因而,使用多数准则,可以推导出快速性心律失常发作的存在事实上认。相反,可以得出t波和/或p波的过感测已发生,并且因此不需要特定治疗。该设备因而可被配置成能够区分t或p波(或噪声)的过感测与快速性心律失常;这在皮下除颤器的特定情形中是必要的,与经静脉除颤器相比,皮下除颤器更易于过感测噪声和/或p或t波。
在本发明的一个实施例中,皮下植入式引脚还可包括除颤电极。另外,控制器可被配置成在相似度准则指示存在要治疗的快速性心律失常时借助除颤电极触发除颤操作。
因而,皮下植入式医疗设备被适配成不仅检测快速性心律失常发作,如有必要还通过给予除颤电脉冲来治疗此类疾病。
在本发明的一个实施例中,皮下植入式有源医疗设备还可按以下方式包括加速度计和/或陀螺仪:控制器被配置成借助于该加速度计和/或陀螺仪来确定患者的姿势。
控制器还被配置成通过将所述二维曲线与所确定的姿势中的参考二维曲线相比较来确定相似度准则,这一参考二维曲线表示正常窦性心律。
与心内信号相比,皮下信号对姿势更敏感。因而,通过使得检测患者的姿势成为可能,可使得对所采集的电信号的解释更加精细并且因此被改进。
本发明的目的还通过通过一种在所定义的心脏周期序列期间处理在第一偶极子和第二偶极子上在时域中并发地采集的电信号的方法流水线,这些偶极子由皮下植入式医疗设备的皮下植入式引脚的电极形成,该方法包括以下步骤:1)通过根据经由第一偶极子采集的信号标绘经由第二偶极子采集的信号,确定因变于时间来参数化并表示患者的心脏活动的二维曲线,并且确定所述二维曲线的多个点处的切线向量;以及2)根据切线向量的诸坐标中的至少一者在所述二维曲线的多个点中的每一对相继点之间的符号改变来标识所采集的信号中不合需噪声的存在或缺失;和/或3)基于所述二维曲线与表示正常窦性心律的参考二维曲线之间的相似度准则来确认快速性心律失常发作的存在或缺失。
确定二维曲线的步骤1)使得将使用第一偶极子采集的信号与使用第二偶极子采集的信号相组合成为可能:因而使得将来自皮下引脚的两个偶极子的信息同时纳入考虑成为可能,尤其是通过考虑——取决于偶极子——不同电信号形态,从而对获得与所采集的信号(它们是更相关的)的原点相关的参数作出贡献。另外,在皮下采集的信号尤其暴露到不合需噪声,该方法的步骤2)使得标识不合需噪声的存在或缺失成为可能,并且借助相同的二维曲线来这样做,从而使得降低软件资源方面的计算成本成为可能,因为在所采集的信号的处理期间有噪周期未被处理或纳入考虑。最后,该方法的步骤3)使得辨别快速性心律失常的存在或缺失成为可能,这一辨别还可基于所述二维曲线来实现。本发明的用于处理信号的方法因而尤其针对皮下植入式医疗设备来适配和优化。
在提供处理电信号的方法中,本发明可借助以下实施例来被进一步改进。
在本发明的一个实施例中,该方法的步骤1)之前可伴有初始分析步骤,尤其是分析心率和/或心率,以检测所采集的信号中的快速性心律失常发作的潜在存在,并且在该初始分析步骤中,基于皮下植入式引脚的诸偶极子之一采集的信号与预定快速性心律失常阈值相比较。
具体而言,这一初始比较步骤是针对来自偶极子的信号来实现的,并且包括检测qrs复合波,尤其是检测r波。这一初始比较步骤因而包括将r-r间隔与预定快速性心律失常阈值相比较。因为这一步骤需要在两个偶极子中的仅一者上检测r波,所以本发明的方法的计算成本可被最小化。
在本发明的一个实施例中,步骤1)、步骤2)和/或步骤3)可只有当在初始分析步骤中在所采集的信号检测到快速性心律失常发作的潜在存在时执行。
因而,该处理信号的方法的步骤1)、2)和3)没有系统性地执行,而是只在怀疑存在快速性心律失常发作的情况下执行。通过避免不必要的计算步骤,这使得进一步降低该方法的计算成本成为可能。
在本发明的一个实施例中,在步骤2)中,如果切线向量的诸坐标中的至少一者在所述二维曲线的多个点中的每一对相继点之间的改变符号的次数大于指示不合需噪声的预定阈值次数,则可标识不合需噪声的存在。
事实上,对于非有噪心脏周期,在两个偶极子上采集的信号之间存在关系或比率,这意味着二维曲线是以基本上统一的方式来表示的。相反,对于有噪心脏周期,即对于包括源自心外的伪像的周期,二维曲线可被不规则地表示。此类不规则表示可由切线向量的诸坐标中的至少一者在二维曲线的每一对相继点之间改变符号的次数来表征。该方法的步骤2)因而提供快速且成本高效的计算步骤来标识信号中的不合需噪声。
在本发明的一个实施例中,指示不合需噪声的预定阈值数目可以相对于所述二维曲线的多个点中的全部点来定义。
因而,不合需指示的标识可通过考虑二维曲线的多个点中的全部点来穷尽性地确定,即通过将曲线的每一点处包含的信息纳入考虑。
在本发明的一个实施例中,步骤3)是基于如下信号来执行的:在初始分析步骤中已在其中检测到快速性心律失常发作的潜在存在,并且其中在步骤2)中没有标识出不合需噪声。
为了减轻尤其是与在皮下采集的信号相关的限制,诸如对噪声的过感测,该方法保证用于确认快速性心律失常发作的存在或缺失的步骤只针对在步骤2)中认为有效的周期的信号(即,针对非有噪周期的信号)来触发。
在本发明的一个实施例中,在步骤2)中标识不合需噪声的存在可随后伴有信号处理步骤,在此期间,在步骤2)中被标识为有噪的心脏周期被忽略;并且随后再次伴有初始分析步骤。
因而,所采集的信号中不合需噪声的存在不一定使得信号不可使用。
在本发明的意,步骤3)还可包括确定多数准则,所述多数准则是基于相似度准则通过确定在所采集的信号与标识正常窦周期的参考信号之间相似的周期的数目来确定的。另外,在本发明的一实现中,所述多数准则与表示快速性心律失常发作的存在的预定多数阈值相比较,从而使得确认快速性心律失常发作的存在或缺失成为可能。
因而,使用多数准则和所定义的多数阈值的值,可以推导出快速性心律失常发作的存在事实上认。相反,可以得出t波和/或p波的过感测已发生,并且因此不需要特定治疗。该处理信号的方法因而可使得区分t或p波(或噪声)的过感测与快速性心律失常成为可能;这在皮下除颤器的特定情形中是必要的,与经静脉除颤器相比,皮下除颤器更易受过感测噪声和/或p或t波的影响。
附图说明
本发明及其优点借助优选实施例和实现来在下文更详细地解释,这些优选实施例和实现具体地参考以下附图来描述,附图中:
图1是本发明的皮下植入式设备的图解视图;
图2是通过示出本发明的皮下植入式设备植入在患者体内的透明度来看到的图解视图;
图3是本发明的用于处理信号的方法的流程图;
图4a是图3中示出的用于处理信号的方法的详细流程图;
图4b是图3中示出的用于处理信号的方法的详细流程图;
图5示出了非有噪循环的二维曲线;
图6示出了有噪循环的二维曲线;
图7示出了被定义用于辨别快速性心律失常的存在的分布;
图8示出了由本发明的方法分类成正常窦性心律的信号;以及
图9示出了由本发明的方法分类成快速性心律失常事件的信号。
具体实施方式
在下文通过使用作为示例并参考附图的优势实施例和实现来更详细地描述了本发明。所描述的实施例和实现仅是可能的配置,并且应当铭记,在实现本发明时如上所述的个体特征可以彼此独立地提供或者完全被省略。
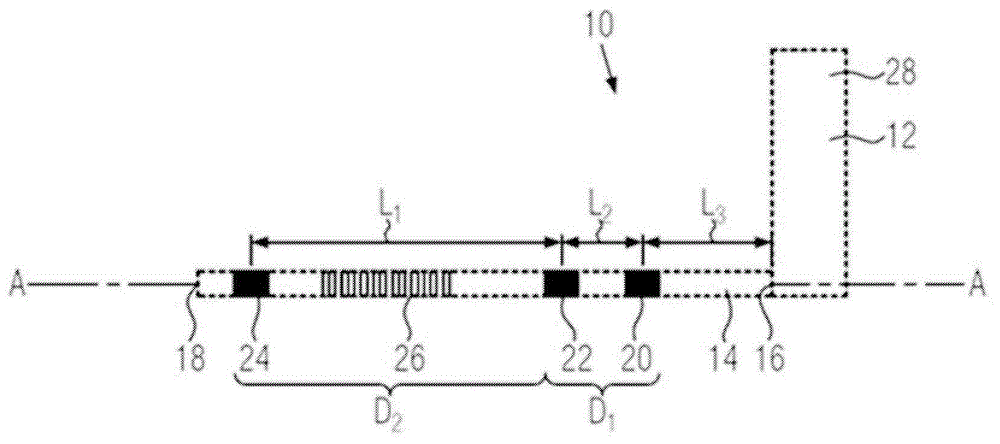
图1示出了皮下除颤器类型10的皮下植入式医疗设备10。图2示出了所述皮下植入式设备10处于已植入状态。
皮下除颤器10包括壳体12,其生成脉冲并且皮下植入式引脚14连接到该壳体12。
皮下植入式引脚14是至少部分地柔性的并且具有两个端部16和18:连接到壳体12的近端16以及自由远端18。
在图2和3中示出的实施例和实现中,皮下植入式引脚14包括三个检测或“感测”电极20、22、24以及一个除颤电极26。在一变型中,皮下植入式引脚14可包括三个以上感测电极。
皮下植入式引脚14还包括导线(未示出),使得将引脚14的电极20、22、24电连接到壳体12处的电触点(未示出)成为可能,这本身是本领域现有技术已知的。
皮下植入式引脚14的感测电极20、22、24使得检测被用于推导患者的心脏活动的电信号成为可能。
然而,在皮下检测或感测电生理活动因多种伪像而降级,诸如肌电噪声或外部环境的干扰。另外,因为引脚14是皮下类型的,所以感测电极20、22、24没有与心肌(即,心脏肌肉)直接接触。检测电极20、22、24的适当定位使得改进检测并采集的电生理信号的质量成为可能,从而使得相应地改进r波(即,去极化峰值)的检测质量成为可能。另外,所采集的信号的最优处理使得进一步改进r波的检测质量成为可能。
为了改进r波的检测以及为了使p和t心脏波的检测最小化,具体而言以促进测量r-r间隔,皮下植入式设备10具有感测电极20、22、24的特定定位。具体而言,如在图2和3中所示,第一感测电极20和第二感测电极22被定位在壳体12与除颤电极26之间,而第三感测电极24被置于引脚14的远端18与除颤电极26之间。除颤电极26因而被定位在第二感测电极22和第三感测电极24之间。因而,在从引脚14的近端16到引脚14的远端18的方向上,引脚按以下次序包括:第一感测电极20;第二感测电极22、除颤电极26以及第三感测电极24。
感测电极20、22、24的特定定位只是在相关于图1的长度方面来描述的,图1示出了引脚14处于未植入状态,其中它未被弯曲并且它沿轴a对准。
第一感测电极20和第二感测电极22形成长度为l1的第一偶极子d1。
在图1和2中示出的实施例中,第二感测电极22和第三感测电极24形成长度为l2的第二偶极子d2。在一变型中,第二偶极子d2可由第三感测电极24和第一感测电极20形成。在另一变型中,壳体12可用作电极并且与感测电极20、22、24之一形成偶极子。
第一偶极子d1的长度l1短于第二偶极子d2的长度l2。具体而言,长度l1在范围5毫米(mm)到50mm中,并且更具体而言在范围10mm到20mm中,而长度l2在范围80mm到400mm中。此外,第一感测电极20与壳体12之间的距离l3在范围80mm到300mm中。
皮下植入式医疗设备10还包括容纳在壳体12中的控制器28。设备10的控制器28被配置成经由皮下植入式引脚14的第一偶极子d1并经由第二偶极子d2检测在皮下记录的电生理信号。控制器28被配置成在第一偶极子d1处检测心脏信号的r波。
因为第一偶极子d1短于第二偶极子d2,所以第一偶极子d1较少暴露给过感测(即,过检测)的风险,尤其是因为它较不易于记录源自肌肉的噪声。另外,尽管设备10被植入在皮下,但第一偶极子d1被定位成靠近左肺心切迹并在其上方。第一偶极子d1的这一特定定位使得检测具有更可相对于p波和t波区分开的r波的电生理信号成为可能;在这一位置检测到的p波和t波相对于r波被最小化。
在另一实施例中,皮下植入式有源医疗设备10可按以下方式包括加速度计和/或陀螺仪:控制器28被配置成借助于该加速度计和/或陀螺仪来确定患者的姿势。
在另一实施例中,经由第一偶极子检测r波可以与在多个“第二偶极子”上(即,在长于第一偶极子的多个偶极子上例如:由第二感测电极22和第三感测电极24形成的偶极子;由第一感测电极20和第三感测电极24形成的偶极子;以及形成在壳体12与感测电极20、22、24之一之间的偶极子)检测心脏信号相组合。
经由第一偶极子d1和经由第二偶极子d2采集的电信号用作处理信号以用于检测任何快速性心律失常的存在的目的的算法的输入信号。在处理之前,使用已知技术使信号经历适当的滤波、归一化、和/或定中心预处理是可能的。
这一处理信号的方法在下文参考图3来笼统地描述,并且随后参考图4a和4b更详细地描述。
处理信号的方法30可被应用于以上参考图1和2描述的皮下植入式医疗设备10。
图3中示出的方法30包括第一步骤100,在此期间记录在时域内并发地经由第一偶极子d1和经由第二偶极子d2采集的信号。所述信号可以在以检测到的r波为中心的预定时窗上记录。在一变型中,信号可被持续地记录,尤其是在疑似快速性心律失常的时段期间。设备10的控制器28自身可包括在其中存储所采集的信号的存储器。
在方法30的第二步骤200期间,只根据经由第一偶极子d1采集的信号来检测快速性心律失常发作的潜在存在。这一第二步骤200可基于对心律或心率的分析。在一变型中,步骤200可包括形态分析。如果没有怀疑存在快速性心律失常发作(参见图3中的箭头202),则方法30循环回第一步骤100。相反,如果怀疑存在快速性心律失常发作(参见图3中的箭头204),则处理信号的方法30进至第三步骤300。因而,处理信号的方法30的以下步骤不一定执行,如果没有怀疑存在快速性心律失常发作的话。这使得尤其是在软件资源和功率方面降低成本成为可能。
在第三步骤300中,通过根据经由第一偶极子采集的信号标绘经由第二偶极子采集的信号,来确定因变于时间来参数化并且表示患者的心脏活动的二维曲线。另外,确定所述二维曲线的多个点处的切线向量。所述向量可以是经归一化的向量。
第三步骤300之后是第四步骤400,在此期间,基于所述二维曲线的多个点中的每一对相继点之间的切线向量的坐标中的至少一者的符号改变来标识所采集的信号中的不合需噪声的存在或缺失。检测不合需噪声的存在的这一方法使得首先归因于它具有的少量步骤并且其次归因于它不需要对所采集的信号的振幅的任何分析而降低计算成本成为可能。
如果检测到不合需噪声的存在(参见图3中的箭头402),则第四步骤400后伴有步骤404,其中忽略在步骤400中在所采集的信号中检测到的任何不合需噪声的分量。步骤404之后是第二步骤200(参见图3中的箭头406),如上所述。相反,如果在信号中没有检测到不合需噪声的存在(参见图3中的箭头408),则处理信号的方法30进至第五步骤500。
在第五步骤500中,基于根据所述二维曲线与参考二维曲线(其表示正常窦周期)之间的相似度的准则确定的多数准则来确认快速性心律失常发作的存在或缺失,该多数准则在下文更详细地描述。
处理信号的方法30及其步骤100到500在下文参考图4a和4b的流程图更详细地描述。共享相同百位数字的附图标记指的是相同步骤,尤其是以上参考图3描述并在下文被参考的步骤100到500中的任一者。
第一步骤100(在此记录在时域内并发地经由第一偶极子d1和经由第二偶极子d2采集的信号)之后伴有步骤102,在此期间,在每次检测到去极化峰值之后,即在每次检测到r波之后,通过固定宽度且以所述去极化峰值为中心的时窗来隔离对应心跳。例如,时窗可具有在范围80ms到150ms中的宽度,以检测到的r波的峰值为中心,尤其是具有100ms的宽度(对应于1000赫兹(hz)的采样频率的100个点)。这一100毫秒的值使得隔离qrs复合波以分析其形态成为可能。设备10的控制器28被配置成将多个相继的检测到的周期保持在其存储器中。r波的检测使得尤其是确定r-r间隔成为可能。
在本发明的有利实施例中,r波的检测是只基于经由第一偶极子d1采集的信号来执行的。r波的检测因而没有在第二偶极子d2上执行,以不增加任何计算成本。另外,因为第一偶极子d1短于第二偶极子d2,所以第一偶极子d1较不易于降级,尤其是因为它较不易于记录源于肌肉的噪声。事实上,第一偶极子d1的几何长度l1=5mm到50mm,尤其是l1=10mm到20mm,使得第一偶极子d1能够较不易受肌电位影响。另外,在引脚被植入时,偶极子d1的位置使得最优化r波与p波比率和r波与t波比例的检测并从而降低过感测的风险成为可能。然而,与第一偶极子d1的信号并发地采集的第二偶极子d2的信号被保持在存储器中并且在处理信号的方法30的步骤300中使用。
在方法30的第二步骤200期间,确定快速性心律失常发作的潜在存在(这一潜在存在基于经由较短偶极子d1采集的信号的r-r间隔):如果在前一步骤102中计算得到的r-r间隔小于预定快速性心律失常阈值,则怀疑存在快速性心律失常发作。在一变型中,快速性心律失常发作的潜在存在可通过考虑多个周期上(例如,5个周期到20个周期上,且尤其是8个周期上)的移动平均来确立。预定快速性心律失常阈值可具有固定值或可调整值,尤其是可针对每一患者编程的值。
如参考图3解释的,如果没有怀疑存在快速性心律失常发作(参见图4a中的箭头202),则方法30循环回第一步骤100。相反,如果怀疑存在快速性心律失常发作(参见图4a中的箭头204),则处理信号的方法30进至第三步骤300。
在第三步骤300,以二维曲线的形式来表示经由第一偶极子d1和经由第二偶极子d2同时并在皮下记录的相继心跳,其中第一偶极子d1沿横坐标而第二偶极子d2沿纵坐标,这些心跳中的一部分位于包括qrs复合波且以r波为中心的时窗内。在一变型中,第二偶极子d2可以沿横坐标而第一偶极子d1沿纵坐标。此类二维曲线在图5中示出。如在图5中所示,二维曲线不是闭环,因为它只对应于完整心脏循环的一部分,即对应于隔离在时窗内的qrs复合波。
所采集的信号的二维分析,即两个维度中的分析,不应以本身限制性的方式来被解释,通过将本说明书的教导外推到其中经由三个或更多个偶极子在皮下且并发地采集信号的情形,本发明同样很好地适用于分析更高阶的多维空间(三维或更高)。
如在图4a中所示,方法30的步骤400(在该步骤中,标识所采集的信号中不合需噪声的存在或缺失)包括三个相继的子步骤401、403和405。
在步骤400的第一子步骤401中,计算在步骤300确定的二维曲线的每一点处的切线向量的坐标。
在步骤400的第二子步骤403中,方法30的算法计算每一切线向量的两个坐标中的至少一者在二维曲线上的两个相继点之间改变符号的次数。
第二子步骤403因而使得表征二维曲线的曲率成为可能。事实上,对于非有噪心脏周期,经由两个偶极子d1和d2采集的信号之间存在关系,这意味着二维曲线是以基本上统一的方式来表示的。相反,对于有噪心脏周期,即对于包括源自心外的伪像的周期,二维曲线可被不规则地表示,如在图6中所示。根据本发明,此类不规则表示(参见图6)随后由切线向量的诸坐标中的至少一者在二维曲线的每一对相继点之间改变符号的次数来表征。
在步骤400的第三子步骤405中,方法30的算法将符号改变的所述次数与指示不合需噪声的预定阈值次数相比较。指示不合需噪声的预定阈值次数可以相对于所述二维曲线的多个点中的全部点来定义。在一变型中,指示不合需噪声的这一预定阈值次数可被定义为针对特定数目的给定连贯点的绝对阈值。
如果在信号中没有检测到不合需噪声的存在(参见图4a和4b中的箭头408),则处理信号的方法30进至第五步骤500。
相反,如果在信号中检测到不合需噪声的存在(参见图4a中的箭头402),则步骤400的子步骤405后伴有步骤404,其中忽略在步骤400中在所采集的信号中检测到的不合需噪声的分量。在一变型中,在特定给定数目的检测到的有噪周期之后,该算法触发称为“噪声模式”的模式,在该模式中,参数(尤其是用于检测r波的阈值)被临时修改达特定时长,例如30秒。在另一变型中,在噪声模式中,该算法延长不应期达特定预定义时长。
步骤404后伴有步骤407(参见图4a中的箭头406),在此期间再次基于信号来计算r-r间隔,其中不合需噪声已被忽略并且因此未被纳入考虑。步骤407随后伴有上述步骤200,在此期间,信号的r-r间隔(已从中清除了不合需噪声)与指示快速性心律失常的阈值相比较。
如在图4b中所示,方法30的步骤500(其中确认快速性心律失常的存在或缺失)包括三个相继子步骤501、503、505和509。
在步骤500的第一子步骤501中,其中信号没有包含不合需噪声,但其中r-r间隔小于指示快速性心律失常的阈值(参见方法30的步骤200),开始比较分析,尤其是相似度分析。因而,在子步骤501中,在步骤300中确定的二维曲线与表示正常窦性心律并且例如预记录在控制器28的存储器中的参考二维曲线相比较。
在一变型中,作为正常窦周期的补充,步骤501可包括通过考虑表示“p波”的参考和表示“t波”的参考来确定相似度准则。因而,这一变型的步骤501使得表示潜在p/t过感测成为可能,因为同时,将存在“与t参考的相似度”或“与p参考的相似度”。
为了将每一周期与表示正常窦性心律的参考的相似之处进行分类,在步骤501确定相似度准则。使用该相似度准则,每一周期被分类成“与正常窦性心律相似”或“不与正常窦性心律相似”。
为了确定相似度准则,确定每一曲线在每一点处的切线向量。随后,确定两个曲线在每一点处的切线向量之间的均值角度随后,确定两个曲线在每一点处的切线向量的范数之间的相关系数。最后,均值角度和相似度系数被表示在图表上,如在图7中所示,从中可确定诸曲线是否彼此相似。图7中的图表表示每一周期分类成与窦参考“相似”或与窦参考“不相似”。在分类成“不相似”的情况下,在方法30的这一阶段,不可能知悉该周期表示过感测还是快速性心律失常。这是在步骤500的子步骤503处确定多数准则的原因。
多数准则可以是在所记录的最后n个非有噪心跳上的与表示正常窦性心律(nsr)的参考的那些周期相似的周期ci的数目的函数。在一变型中,相似度转置也可由比率ci比n(ci/n)来定义,其中n是所记录的最后非有噪心跳的数目。在步骤501,各周期与参考的各周期的相似度因而借助相似度准则来被确定。
在步骤500的子步骤505中,这一多数准则(即,ci或比率ci/n的值)与表示快速性心律失常发作的缺失的预定多数阈值cref相比较。
如果检测到与窦参考相似的大多数周期(例如,最后12个周期中的8个ci),则没有确认存在快速性心律失常。方法30随后被重新初始化,以使得步骤505后伴有该算法的第一步骤100(参见图4b中的箭头506),即采集新电信号的步骤。
相反,如果检测到与窦参考相似的大多数周期(例如,最后12个周期中的2个ci),则在步骤509确认存在快速性心律失常。
因而,取决于多数准则是否越过预定阈值cref,该算法得出快速性心律失常发作存在还是缺失。
图8示出了一示例,其中8个心跳的第一序列(n=8)包括与表示正常窦性心律的周期相似的3个周期(ci=3)。不与表示正常窦性心律的周期相似的5个周期由符号“o”来指示。因而,在图7所示的示例中,该第一序列的多数准则等于比率3/8。
在图8所示的8个心跳的第二序列中,多数准则等于比率4/8。
在cref被预定为大于或等于3/8的值时,在心跳的第一序列和图3的信号的第二序列的分析之后,该算法不确认快速性心律失常发作的存在。
图9示出了一示例,其中没有周期与表示正常窦性心律的周期相似。因而,在图8所示的示例中,n=8且ci=0。图9中所示的示例的多数准则因而是零,并且因而必定小于阈值cref。在此情形中,随后在步骤509中确认快速性心律失常发作的存在,并且在多个移动窗上检查快速性心律失常发作的存在。
表示正常窦性心律的参考二维曲线是通过取患者的正常窦性心律的至少最后两个周期的均值和/或中值来确定的。
在其中皮下植入式医疗设备10包括加速度计和/或陀螺仪的实施例中,作为补充,设备10的控制器28可被配置成通过将所述二维曲线与在所述预定姿势中并表示正常窦性心律的参考二维曲线相比较来确定相似度准则。因而,通过使得检测患者的姿势成为可能,可使得对所采集的电信号的解释更加精细并且因此被改进。另外,针对每一姿势在正常窦性心律处确定的参考二维曲线可以彼此比较,以只在存储器中保持随姿势显著不同的那些参考二维曲线。这使得尤其是节省存储存储器成为可能。此外,每一姿势的参考曲线可被更新,例如每日或每星期。
在步骤509之后,设备10的控制器28可被配置成借助皮下植入式引脚14的除颤电极26触发除颤操作。
设备10的控制器28被配置成执行方法30的各步骤和各子步骤中的每一者。
所描述的实施例和实现仅仅是可能的配置,并且应当记住,各实施例和实现的个体特征可被组合或彼此独立地提供。
- 还没有人留言评论。精彩留言会获得点赞!