一种抗体偶联药物的制备及其高通量筛选方法与流程
本发明属于生物技术领域、特别是抗体偶联药物领域,具体涉及一种抗体偶联药物制备及其高通量筛选方法。
背景技术:
抗体偶联药物(antibody-drugconjugate,adc),其兼具小分子药物强大的杀伤力和单克隆抗体高度的靶向性,已经成为肿瘤靶向治疗的研究和开发热点。随着高活药物分子的不断发现,连接子的设计和偶联技术已经日益成熟,寻找针对特定靶点的高特异性靶向抗体对抗体偶联药物研发显得尤为重要。
现有的用于adc的抗体筛选过程主要分四步。融合细胞在经过一段时间的培养以后,首先测试其上清液中各克隆的抗体亚型;然后使用elisa及流式细胞仪筛选出抗原结合阳性的克隆;其次扩大培养阳性克隆并将得到的抗体与连接有毒素的二抗共同进行体外细胞毒实验筛选出内吞阳性的克隆;最后取若干阳性克隆的抗体进行小分子的偶联。整个抗体筛选过程较长,结合活性的检测意义有限。此外,直接将抗体与连有毒素的二抗共同用于筛选抗体的内吞活性,其结果难免与直接用adc进行筛选有出入,进而可能会导致由于假阴性而丢失克隆。另外,现有方法需制备一定量的抗体才能合成adc并用于体外筛选,这就决定了其需要一定的时间和投入来产生抗体,而且通量也不可能很高。
目前已有的高通量偶联技术,主要有两类:一类是利用抗体内部的链间二硫键进行偶联;一类是将纯化的抗体在液体的反应体系中进行赖氨酸的偶联。第一类方法的主要局限在于需要先检测各抗体克隆的亚型,以确定可打开二硫键个数,进而决定偶联的药物与无药物的连接子的比例。而第二类方法则需要预先纯化好抗体,并保证所有抗体样品在相近的条件下进行偶联。
因此,现有技术中存在对筛选过程更短、筛选效率更高、筛选费用更少的高通量抗体偶联技术的需要。
发明概述
本发明开发了一种抗体的高通量赖氨酸偶联方法。它是用蛋白g(proteing)重组蛋白填料将杂交瘤上清液中少量抗体固定在96孔板(例如96孔深孔板)中,然后与小分子药物进行高通量赖氨酸偶联,并直接在96孔板中完成纯化和洗脱的一种方法。它能够在杂交瘤细胞上清液中抗体亚型、纯度、含量和浓度均不确定的情况下,无需预先纯化,也无需事先完成抗体的表征,且可将大量不同亚型的抗体在同一个实验中同时展开高通量偶联,即可高通量快速制得具有相近药物/抗体比例(drug-antibodyratio,dar)的抗体偶联药物。
本发明开发的一种高通量赖氨酸偶联方法,能够高通量快速制得具有相似物理化学性质的抗体偶联药物,通过进一步的体外细胞毒性实验,能够高效筛选出处于杂交瘤阶段的有效抗体用于抗体偶联药物的开发。这种方法无需对上清液中的抗体进行纯化,能对微克级的抗体进行偶联,使对抗体的筛选发生在更早的环节,从而达到提高筛选的准确率并减少费用开支的目的。且本发明制备的抗体偶联药物具有稳定的dar值,同时对于某些亚型抗体能很好地控制产物中高聚物(aggregation)的水平。在不确定抗体量和纯度的情况下,能够通过本发明的方法得到具有相似的dar值以及较低高聚物水平的抗体偶联药物。
本发明相对于现有技术,不需要预先测定抗体亚型,也不需要预先确定反应体系中抗体的浓度或总量。而且通过优化条件,还可以将最后的偶联产物控制在一定的dar及高聚体水平范围内,显著降低了工作量,增加了通量。
在方法优化过程中,本发明人采用曲妥珠单抗(即赫赛汀)为模型抗体,通过全因子实验(designofexperiments,doe)确定抗体偶联药物反应中控制dar的关键因素,以及控制高聚物水平的方法,并且使产物的回收率达到40%以上;随后采用不同亚型和不同用量的抗体对该方法进一步验证;最后采用本发明的方法,以含不同亚型抗体的细胞培养基模拟杂交瘤上清液为反应起始物快速制备具有相近物理化学性能的抗体偶联药物。
本发明采用针对dar的全因子实验(doe)筛选出赖氨酸偶联时dar值主要效应因素,通过一系列方法优化出最佳结合、偶联和洗脱的条件,确保在不清楚抗体含量和纯度的情况下,所得的抗体偶联药物的dar值稳定在一定区域,同时保证产物收率以满足后期细胞实验筛选。
本发明还引入琥珀酸盐缓冲液精纯方法,有效控制所得adc产物的高聚物水平。未通过精纯而得到的adc产品有明显更高的高聚物水平。该方法对higg1亚型抗体特别有效。
本发明在采用曲妥珠单抗为模型抗体优化得到最佳高通量偶联方法后,接着采用多种不同亚型的已纯化抗体以及在细胞培养基中的抗体验证该高通量偶联方法,以检验该方法的普适性。
因此,在一个方面,本发明提供制备抗体偶联药物的方法,所述方法包括:
提供包含抗体的样品;
将抗体固定于固相基质上;
使抗体与药物分子反应以制备抗体偶联药物;
纯化所制备的抗体偶联药物;和
洗脱所制备的抗体偶联药物。
在一个实施方案中,通过使抗体与固相基质上的蛋白g接触而将抗体固定于固相基质上。
在另一个实施方案中,使抗体与药物分子反应包括使抗体与药物分子进行赖氨酸偶联。
在又一个实施方案中,所述药物分子浓度为约100-300μm、优选为约200-300μm。
在另一个实施方案中,纯化所制备的抗体偶联药物包括用缓冲液冲洗以除去未反应的游离药物分子。
在又一个实施方案中,纯化所制备的抗体偶联药物进一步包括用琥珀酸盐缓冲液精纯所制备的抗体偶联药物。
在另一个实施方案中,琥珀酸盐缓冲液的浓度为约10mm-100mm,优选为约20mm。
在又一个实施方案中,采用振荡器进行振荡洗脱。
在另一个实施方案中,所述振荡器的反应振荡速度为约200rpm-800rpm,优选约400rpm。
在又一个实施方案中,使抗体与药物分子反应以制备抗体偶联药物时,ph为约6.5-7.5。
在另一个实施方案中,使抗体与药物分子反应以制备抗体偶联药物时,反应时间为约18-24小时。
在又一个实施方案中,所述抗体选自以下的一种或多种:双特异性抗体、抗体片段、单域抗体、纳米抗体等。
在另一个实施方案中,抗体的亚型选自以下的一种或多种:migg1、migg2a、migg2b、migg2c、migg3、rigg1、rigg2a、rigg2b、higg1、higg2、higg3和higg4。
在又一个实施方案中,抗体的量约为约20μg-1000μg,优选为约20-200μg。
在另一个实施方案中,抗体可与固相基质上的填料接触而固定于固相基质上。
在又一个实施方案中,所述填料为以下的一种或多种:蛋白g(proteing)、蛋白a(proteina)、离子交换树脂等。
在另一个实施方案中,所用孔板可选用各种规格,优选96孔板,更优选96孔深孔板。
在又一个实施方案中,所提供的抗体的量为为约20μg-1000μg,优选为约20-200μg;并且,抗体与药物分子反应步骤中,所提供的药物分子浓度为约100-300μm、优选为约200-300μm,所提供的ph为约6.5-7.5。
在又一个实施方案中,采用约400rpm-800rpm、优选约400rpm的反应振荡速度。
在另一方面,本发明提供高通量筛选抗体偶联药物的方法,所述方法包括:
提供包含抗体的样品;
将抗体固定于固相基质上;
使抗体与药物分子反应以制备抗体偶联药物;
纯化所制备的抗体偶联药物;
洗脱所制备的抗体偶联药物;
测定所制备的抗体偶联药物的细胞毒性、任选体外细胞毒性;和/或
根据所测定的细胞毒性结果筛选出含有效抗体的样品。
在本发明中,将抗体固定于固相基质上可以采用本领域常用的固定方法将待固定的抗体固定于固相基质材料上。本领域常用的固定方法例如用蛋白g(proteing)重组蛋白填料将杂交瘤上清液中少量抗体固定在96孔板(例如96孔深孔板)中,但并不限于此。例如还可采用重组蛋白a(proteina)、离子交换树脂等。
在本发明中,偶联反应所使用的小分子化合物可以为smcc-dm1,但并不限于此。例如还可采用以spdb、spp、acbut等连接赖氨酸的连接子的多种小分子毒素,包括但不限于calicheamicin、pbd、duocarmycin、anthracycline、irinotecan、amanitin、tubulysin、auristatin及其衍生物。
在本发明中,结合反应所使用的结合缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的偶联缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的有机溶剂可以为n,n-二甲基乙酰胺(dma),但并不限于此。例如还可采用二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、乙腈(acn)、异丙醇(ipa)等。
在本发明中,纯化所使用的冲洗缓冲液为含有体积比10%dma的对应反应缓冲液和100%对应缓冲液,但并不限于此。例如还可采用含有体积比为10%dmso对应反应缓冲液、含有体积比为10%dmf对应反应缓冲液、含有体积比为10%acn对应反应缓冲液,含有体积比为10%ipa对应反应缓冲液等。
在本发明中,洗脱缓冲液可以为甘氨酸缓冲液,例如甘氨酸水溶液,但并不限于此。例如还可以采用柠檬酸水溶液等。
在本发明中,中和缓冲液可以为碱性缓冲液,例如磷酸盐缓冲液,例如na2hpo4水溶液,但并不限于此。例如还可以采用硼砂水溶液、硼酸钠缓冲液,三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)等。
在本发明中,精纯缓冲液可以为琥珀酸盐缓冲液,例如琥珀酸钠缓冲液,例如琥珀酸钠水溶液。
附图说明
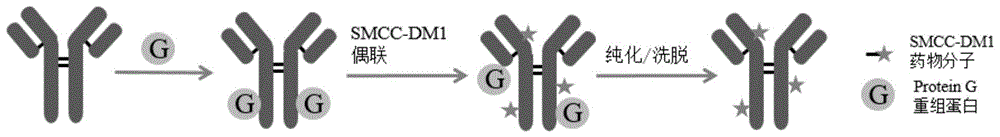
图1为实施例中高通量赖氨酸偶联方法合成抗体偶联药物的示意图。在方法优化实施例中,采用曲妥珠单抗作为模型单克隆抗体、smcc-dm1作为药物分子进行偶联,用蛋白g重组蛋白对单克隆抗体进行结合。实施例中adc的合成包括以下几步:蛋白g重组蛋白与单克隆抗体在孔板中结合,药物分子与单克隆抗体在孔板中固相反应,连续纯化除去未反应的游离药物分子,洗脱液洗脱将抗体偶联药物与蛋白g分离,离心收集得到产物并分析结果。
图2为实施例中smcc-dm1药物分子的化学结构示意图。
图3为实施例一中抗体偶联药物的sec-hplc测试条件和在不同进样量时sec-dar结果图;
图4为实施例二中抗体偶联药物针对dar的doe实验条件及结果;
图5为实施例二中采用minitab软件分析基于抗体偶联药物dar的doe实验结果;
图6为实施例三中探究抗体药物偶联中抗体量对sec-dar的影响;
图7为实施例四中抗体药物偶联中药物分子浓度对sec-dar的影响;
图8为实施例五中抗体药物偶联中反应时间对sec-dar的影响;
图9为实施例六中抗体药物偶联中后精纯处理对产物高聚物的影响;
图10为实施例七中抗体药物偶联中反应振荡速度对产物sec-dar和高聚物的影响(实验1);
图11为实施例七中抗体药物偶联中反应振荡速度对产物sec-dar和高聚物的影响(实验2);
图12为实施例八中抗体药物偶联中洗脱条件对产物收率和高聚物的影响;
图13为实施例中高通量赖氨酸偶联的最佳优化方法;
图14为实施例九中不同亚型单抗的高通量赖氨酸偶联结果图;
图15为实施例十中不同亚型单抗孵育的细胞培养液的高通量赖氨酸偶联结果图。
发明详述
定义
在本文中,冠词“一种(a)”、“一个(an)”和“所述(the)”用于指代一个或多于一个(即至少一个)的该冠词的语法对象。举例来说,“一种/一个多肽复合物”指一种/一个多肽复合物或多于一种/一个多肽复合物。
用于本发明的术语“约”或“大约”是指与参照定量、水平、值、数量、频率、百分比、维度、大小、量、重量或长度相差30、25、20、25、10、9、8、7、6、5、4、3、2或1%的定量、水平、值、数量、频率、百分比、维度、大小、量、重量或长度。在特定实施方式中,当术语“约”或“大约”位于数值之前时,表示所述值加上或减去15%、10%、5%或1%的范围。
在本公开内容的全文中,除非上下文另有规定,否则词语“包含”、“包括”和“含有”将被理解为表示包括所述的步骤或要素或一组步骤或要素,但不排除任何其他步骤或要素或一组步骤或要素。短语“由……组成”所表示的是包括并且限于短语“由……组成”所接的内容。因此,短语“由……组成”表示所列出的要素是需要的或必需的,并且没有其他要素可存在。短语“基本由……组成”所表示的是包括列于此短语之后的任意要素,并且限于有助于或不妨碍所列的要素的如在本公开内容的中详述的活性或作用的其他要素。因此,短语“基本由……组成”表示所列出的要素是需要的或必需的,但其他要素是可选地并可取决于其是否影响所列出的要素的活性或作用而存在或不存在。
在本公开内容的全文中提及的“一个实施方式”、“实施方式”、“特定实施方式”、“相关实施方式”、“某种实施方式”、“另外的实施方式”或“进一步的实施方式”或其组合表示所描述的与所述实施方式相关的特定特征、结构或特性包含于本公开内容的至少一个实施方式中。因此,在本说明书全文各处出现前述用语未必都指同一实施方式。此外,所述特定特征、结构或特性可在一个或多个实施方式中以任意适宜方式组合。在本公开内容中,“实施方式”和“实施方案”可互换使用。
本发明中使用的术语“抗体”涵盖任意可结合某特定抗原的免疫球蛋白、单克隆抗体、多克隆抗体、多特异性抗体或双特异性(双价)抗体。一个天然的完整抗体包含两条重链和两条轻链。每条重链由一个可变区(“hcvr”)以及第一、第二和第三恒定区(分别为ch1、ch2、ch3)组成,而每条轻链由一个可变区(“lcvr”)以及一个恒定区(l)组成。哺乳动物的重链可分为α、δ、ε、γ和μ,哺乳动物的轻链可分为λ或κ。抗体呈“y”型,“y”型结构的主干由两条重链的第二和第三恒定区组成,其通过二硫键结合。“y”型结构的每条臂包含其中一条重链的可变区和第一恒定区,其与一条轻链的可变区和恒定区结合。轻链和重链的可变区负责抗原的结合。每条链的可变区均含有三个高变区,称互补决定区(cdr)(轻(l)链的cdr包含lcdr1、lcdr2、lcdr3,重(h)链的cdr包含hcdr1、hcdr2、hcdr3)。抗体的cdr边界可通过kabat、chothia或al-lazikani命名法命名或识别(相关命名法可参见例如al-lazikani,b.等,standardconformationsforthecanonicalstructuresofimmunoglobulins,j.mol.biol.,273(4):927-948(1997);chothia,c.等,domainassociationinimmunoglobulinmolecules.thepackingofvariabledomains,jmolbiol.,186(3):651-663(1985);chothia,c.和lesk,a.m.,canonicalstructuresforthehypervariableregionsofimmunoglobulins,j.mol.biol.,196(4):901-917(1987);chothia,c.等,conformationsofimmunoglobulinhypervariableregions,nature,342(6252):877-883(1989);kabate.a.等,sequencesofproteinsofimmunologicalinterest,第5版,u.s.departmentofhealthandhumanservices,publichealthservice,nationalinstitutesofhealth(1991))。其中,三个cdr由被称为框架区(fr)的侧面连续部分间隔开,框架区比cdr更加高度保守并形成一个支架支撑超变环。hcvr和lcvr各包含4个fr,并且cdr和fr自氨基端至羧基端依以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的恒定区不参与抗原结合,但具有多种效应功能。抗体依据重链恒定区的氨基酸序列可以分成几类。根据是否含有α、δ、ε、γ和μ重链,抗体可分别分为五个主要的分类或异形体:iga、igd、ige、igg和igm。几个主要的抗体分类还可分为亚类,如igg1(γ1重链)、igg2(γ2重链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)等。
本文所用术语单克隆抗体指由基本上同质的抗体群体获得的抗体,即除了可能少量存在的天然发生的突变之外,组成所述群体的单个抗体是相同的。单克隆抗体是高度特异的,针对单个抗原位点。另外,与包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品相反,每种单克隆抗体针对抗原上的单个决定簇。除了其特异性之外,单克隆抗体优势在于它们可以被合成但不被其它抗体所污染。所述修饰语“单克隆”指从基本上同质的抗体群体获得的抗体的特征,不能理解为需要以任何特定方法生产所述抗体。例如,根据本发明使用的单克隆抗体能够通过杂交瘤方法制备,所述杂交瘤方法由
本发明中使用的术语“双特异性抗体”是指含有两种特异性抗原结合位点的人工抗体。
本发明中使用的术语“抗体片段”包含全长抗体的一部分,通常为其抗原结合或可变区。抗体片段的实例包括fab、fab’、f(ab’)2和fv片段;双抗体;线性抗体;抗独特型抗体;和任何免疫特异性结合肿瘤相关抗原或细胞表面受体、病毒抗原、微生物抗原的表位结合片段等等。
本发明中使用的术语“单域抗体(singledomainantibody,sdab)”又称纳米抗体(nanobody),其仅有一个重链可变区结构域(vhh)。单独克隆并表达出来的vhh区具有与原重链抗体相当的结构稳定性以及同等的抗原结合活性,vhh是目前己知的可结合目标抗原的最小单位。
本发明中使用的术语“抗体偶联药物(antibody-drugconjugate,adc)”涵盖由重组单克隆抗体(mab)通过连接子共价结合小分子药物的偶联物,其不仅具有高度细胞毒性的小分子药物的抗肿瘤效力,而且具有单克隆抗体的高选择性/靶向性、稳定性,并且具有有利的药代动力学特征。抗体分子主要发挥靶向投递作用,小分子药物发挥治疗效应。但有些抗体同时存在抗肿瘤的药效学作用,例如,据报道,kadcyla中阿多曲妥珠单抗(ado-trastuzumab)和美坦新(美登素)存在协同作用。单克隆抗体可以例如为曲妥珠单抗,或者结合一种或多种肿瘤相关抗原或细胞表面受体的抗体。
理想的adc药物设计需要考虑(1)抗体的选择:靶点清晰,肿瘤细胞中高表达而正常组织低表达;支持药物加载、稳定、能向细胞内化;良好的药代动力学特性;非特异性结合少;(2)连接位点:一般有赖氨酸或半胱氨酸残基,可改构进行定向偶联;(3)连接子:在循环中稳定,在细胞内能被释放(如在溶酶体内酶切释放,或抗体降解后释放);(4)细胞毒药物:高度的药效学作用,无免疫原性,通过修饰能与连接子结合,机制清晰等等。
本发明中使用的术语“固相基质”是指填料中除去配基(如重组蛋白g或重组蛋白a)以外的一切组成。它是由生物大分子构成的无定形交联胶状物,具有一定孔隙,常见的基质材料有琼脂糖交联凝胶等。
本发明中使用的术语“高通量筛选”是指以分子水平和/或细胞水平的实验方法为基础,以自动化操作系统执行实验过程,以灵敏快速的检测仪器采集实验结果数据,以计算机分析处理实验数据,在同一时间检测筛选数以千万的样品,并以得到的相应数据库支持运转的技术体系,它具有微量、快速、灵敏和准确等特点,同时节省了实验材料,降低了筛选成本。
本发明中使用的术语“赖氨酸偶联”是指adc常用的偶联方式之一。赖氨酸是抗体中最常见的连接位,其氨基可以与连接子的羧基反应,形成生物体中最可靠的酰胺键。赖氨酸偶联技术是利用双功能团交联试剂,对抗体的赖氨酸残基进行随机修饰,再与美登素衍生物或其他类似物的巯基反应实现偶联。kadcyla即采用了该技术。由于igg单克隆抗体上有几十个赖氨酸残基可供修饰,因此双功能交联试剂与赖氨酸残基的连接是非特异性的,小分子药物与抗体结合数量和位置呈随机正态分布模式。
本发明中使用的术语“填料”是一种能够与抗体结合的层析介质例如亲和层析介质的统称。填料对不同种属和亚型的抗体均具有很强的特异性结合能力。填料一般由基质和配基组成,以蛋白g为例,基质采用6%的交联琼脂糖凝胶,配基为重组蛋白g。
本发明中使用的术语“缓冲液”是指由“弱酸及其共轭碱之盐类”或“弱碱及其共轭酸之盐类”所组成的缓冲对配制的,能够在加入一定量其他物质时减缓ph改变的溶液。常见缓冲液包括但不限于盐酸-柠檬酸钠、柠檬酸-柠檬酸钠、乙酸-乙酸钠、k2hpo4-kh2po4、na2hpo4-nah2po4、硼酸-氢氧化钠、三羟甲基甲氨基丙磺酸、n,n-双(2-羟乙基)甘氨酸、三羟甲基氨基甲烷、n-三-(羟甲基)甲基氨基乙酸、4-(2-羟乙基)-1-哌嗪乙烷磺酸半钠盐、n-三(羟甲基)甲基-2-氨基乙磺酸、3-(n-吗啡啉)乙磺酸、哌嗪-n,n'-二(2-乙磺酸)、2-吗啉乙磺酸。缓冲液的缓冲能力是有一定限度的。不同的缓冲液可具有不同的缓冲能力。
本发明中使用的术语“全因子实验”是指一种安排实验和分析实验数据的数理统计方法,是所有因子的所有水平的所有组合都至少进行一次实验,可以估计所有的主效应和所有的各阶交互效应。全因子实验设计能够对实验进行合理安排,以较小的实验规模(实验次数)、较短的实验周期和较低的实验成本,获得理想的实验结果并得出科学的结论。
抗体的高通量赖氨酸偶联方法
本发明开发了一种抗体的高通量赖氨酸偶联方法。它是用蛋白g(proteing)重组蛋白填料将杂交瘤上清液中少量抗体固定在96孔板(例如96孔深孔板)中,然后与小分子药物进行高通量赖氨酸偶联,并直接在96孔板中完成纯化和洗脱的一种方法。它能够在杂交瘤细胞上清液中抗体亚型、纯度、含量和浓度均不确定的情况下,无需预先纯化,无需事先完成抗体纯化和表征,且可将大量不同亚型的抗体在同一个实验中同时展开高通量偶联,即可高通量快速制得具有相近药物/抗体比例(drug-antibodyratio,dar)的抗体偶联药物。
本发明开发的一种高通量赖氨酸偶联方法,能够高通量快速制得具有相似物理化学性质的抗体偶联药物,通过进一步的体外细胞毒性实验,能够高效筛选出处于杂交瘤阶段的有效抗体用于抗体偶联药物的开发。这种方法无需对上清液中的抗体进行纯化,能对微克级的抗体进行偶联,使对抗体的筛选发生在更早的环节,从而达到提高筛选的准确率并减少费用开支的目的。且本发明制备的抗体偶联药物具有稳定的dar值,同时对于某些亚型抗体能很好地控制产物中高聚物(aggregation)的水平。在不确定抗体量和纯度的情况下,能够通过本发明的方法得到具有相似的dar值以及较低高聚物水平的抗体偶联药物。
本发明相对于现有技术,不需要预先测定抗体亚型,也不需要预先确定反应体系中抗体的浓度或总量。而且通过优化条件,还可以将最后的偶联产物控制在一定的dar及高聚体水平范围内,显著降低了工作量,增加了通量。
在本发明的方法优化过程中,本发明人采用曲妥珠单抗(即赫赛汀)为模型抗体,通过全因子实验(designofexperiments,doe)确定抗体偶联药物反应中控制dar的关键因素,以及控制高聚物水平的方法,并且使产物的回收率达到40%以上;随后采用不同亚型和不同用量的抗体对该方法进一步验证;最后采用本发明的方法,以含不同亚型抗体的细胞培养基模拟杂交瘤上清液为反应起始物快速制备具有相近物理化学性能的抗体偶联药物。
本发明采用针对dar的全因子实验(doe)筛选出赖氨酸偶联时dar值主要效应因素,通过一系列方法优化出最佳结合、偶联和洗脱的条件,确保在不清楚抗体含量和纯度的情况下,所得的抗体偶联药物的dar值稳定在一定区域,同时保证产物收率以满足后期细胞实验筛选。
本发明还引入琥珀酸盐缓冲液精纯方法,有效控制所得adc产物的高聚物水平。未通过精纯而得到的adc产品有明显更高的高聚物水平。该方法对higg1亚型抗体特别有效。
本发明在采用曲妥珠单抗为模型抗体优化得到最佳高通量偶联方法后,接着采用多种不同亚型的已纯化抗体以及在细胞培养基中的抗体验证该高通量偶联方法,以检验该方法的普适性。
制备抗体偶联药物的方法
因此,在一个方面,本发明提供制备抗体偶联药物的方法,所述方法包括:提供包含抗体的样品;将抗体固定于固相基质上;使抗体与药物分子反应以制备抗体偶联药物;纯化所制备的抗体偶联药物;和洗脱所制备的抗体偶联药物。
在一个实施方案中,通过使抗体与固相基质上的填料例如重组蛋白g、蛋白a(proteina)或离子交换树脂接触而将抗体固定于固相基质上。
在另一个实施方案中,使抗体与药物分子反应包括使抗体与药物分子进行赖氨酸偶联。
在本发明中,所述药物分子浓度约为100-300μm、优选为200-300μm。
在本发明中,偶联反应所使用的小分子化合物可以为smcc-dm1,但并不限于此。例如还可采用以spdb,spp,acbut等连接赖氨酸的连接子的多种小分子毒素,包括但不限于calicheamicin,pbd,duocarmycin,anthracycline,irinotecan,amanitin,tubulysin,auristatin及其衍生物。也包括采用这些连接子连接的其他分子,包括但不限于各种抗病毒,抗菌的化合物以及调节细胞内蛋白,mrna或基因表达的各种化合物或寡核苷酸。
在本发明中,结合反应所使用的结合缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的偶联缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的有机溶剂可以为n,n-二甲基乙酰胺(dma),但并不限于此。例如还可采用二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、乙腈(acn)、异丙醇(ipa)等。
在本发明中,纯化所制备的抗体偶联药物包括用缓冲液冲洗以除去未反应的游离药物分子。纯化所使用的冲洗缓冲液为含有体积比约10%dma的对应反应缓冲液和约100%对应缓冲液,但并不限于此。例如还可采用含有体积比为约10%dmso对应反应缓冲液、含有体积比为约10%dmf对应反应缓冲液、含有体积比为约10%acn对应反应缓冲液,含有体积比为约10%ipa对应反应缓冲液等。
在本发明中,洗脱缓冲液可以为甘氨酸缓冲液,例如甘氨酸水溶液,但并不限于此。例如还可以采用柠檬酸水溶液等。
在本发明中,中和缓冲液可以为碱性缓冲液,例如磷酸盐缓冲液,例如na2hpo4水溶液,但并不限于此。例如还可以采用硼砂水溶液、硼酸钠缓冲液,三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)等。
在本发明中,纯化所制备的抗体偶联药物进一步包括用琥珀酸盐缓冲液精纯所制备的抗体偶联药物。
在本发明中,琥珀酸盐缓冲液的浓度为约10mm-100mm,优选为约20mm。
在本发明的一个实施方案中,采用振荡器进行振荡洗脱。
在本发明的另一个实施方案中,所述振荡器的反应振荡速度为约200rpm-800rpm、优选约400rpm。
在又一个实施方案中,使抗体与药物分子反应以制备抗体偶联药物时,ph为约6.5-7.5。
在另一个实施方案中,使抗体与药物分子反应以制备抗体偶联药物时,反应时间为约18-24小时。
在又一个实施方案中,所述抗体选自以下的一种或多种:双特异性抗体、抗体片段、单域抗体、纳米抗体等。
在另一个实施方案中,抗体的亚型选自以下的一种或多种:migg1、migg2a、migg2b、migg2c、migg3、rigg1、rigg2a、rigg2b、higg1、higg2、higg3和higg4。
在又一个实施方案中,抗体的量约为约20μg-1000μg,优选约20μg-200μg。
在另一个实施方案中,抗体可与固相基质上的填料接触而固定于固相基质上。
在又一个实施方案中,所述填料为以下的一种或多种:蛋白g(proteing)、蛋白a(proteina)、离子交换树脂、mabselectsure、captol、离子交换树脂等。
在另一个实施方案中,固相基质包括孔板,优选96孔板,更优选96孔深孔板。
在又一个实施方案中,所提供的抗体的量为约20-1000μg,优选约20-200μg;并且,抗体与药物分子反应步骤中,所提供的药物分子浓度为约100-300μm、优选为约200-300μm,所提供的ph为约6.5-7.5。
在又一个实施方案中,采用约400rpm-800rpm、优选约400rpm的反应振荡速度。
高通量筛选抗体偶联药物的方法
在另一方面,本发明提供高通量筛选抗体偶联药物的方法,所述方法包括:提供包含抗体的样品;将抗体固定于固相基质上;使抗体与药物分子反应以制备抗体偶联药物;纯化所制备的抗体偶联药物;洗脱所制备的抗体偶联药物;测定所制备的抗体偶联药物的体外活性;和/或根据所测定的细胞毒性结果筛选出含有效抗体的样品。其中所述体外活性检测包括对细胞毒性、免疫细胞的活化或抑制,抗菌活性,抗病毒活性,基因表达调控等的检测
在本发明中,将抗体固定于固相基质上可以采用本领域常用的固定方法将待固定的抗体固定于固相基质材料上。本领域常用的固定方法例如用蛋白g(proteing)重组蛋白填料将杂交瘤上清液中少量抗体固定在96孔板(例如96孔深孔板)中,但并不限于此。例如还可采用重组蛋白a(proteina)、离子交换树脂等。
在本发明中,偶联反应所使用的小分子化合物可以为smcc-dm1,但并不限于此。例如还可采用以spdb、spp、acbut等连接赖氨酸的连接子的多种小分子毒素,包括但不限于calicheamicin、pbd、duocarmycin、anthracycline、irinotecan、amanitin、tubulysin、auristatin及其衍生物。也包括采用这些连接子连接的其他分子,包括但不限于各种抗病毒,抗菌的化合物以及调节细胞内蛋白,mrna或基因表达的各种化合物或寡核苷酸。
在本发明中,结合反应所使用的结合缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的偶联缓冲液可以为磷酸盐缓冲液,但并不限于此。例如还可采用三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)、4-羟乙基哌嗪乙磺酸缓冲液(hepesbuffer)、醋酸钠缓冲液(sodiumacetatebuffer)等。
在本发明中,偶联反应所使用的有机溶剂可以为n,n-二甲基乙酰胺(dma),但并不限于此。例如还可采用二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、乙腈(acn)、异丙醇(ipa)等。
在本发明中,纯化所使用的冲洗缓冲液为含有体积比10%dma的对应反应缓冲液和100%对应缓冲液,但并不限于此。例如还可采用含有体积比为10%dmso对应反应缓冲液、含有体积比为10%dmf对应反应缓冲液、含有体积比为10%acn对应反应缓冲液,含有体积比为10%ipa对应反应缓冲液等。
在本发明中,洗脱缓冲液可以为甘氨酸缓冲液,例如甘氨酸水溶液,但并不限于此。例如还可以采用柠檬酸水溶液等。
在本发明中,中和缓冲液可以为碱性缓冲液,例如磷酸盐缓冲液,例如na2hpo4水溶液,但并不限于此。例如还可以采用硼砂水溶液、硼酸钠缓冲液,三(羟甲基)氨基甲烷-盐酸缓冲液(tri-hclbuffer)等。
在本发明中,精纯缓冲液可以为琥珀酸盐缓冲液,例如琥珀酸钠缓冲液,例如琥珀酸钠水溶液。
抗体药物偶联过程
本发明的抗体药物偶联过程可包括如下步骤:
1)结合过程:在固相基质例如96孔深孔板(whatman,7700-2803)的不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入填料例如50μl蛋白g(ge,17-0618-02),并用结合缓冲液(例如50mm磷酸盐缓冲液,ph7.0)冲洗。本领域技术人员知晓每次每孔所加结合缓冲液的量,例如100μl。然后,向每个反应孔中加入对应的抗体并将96孔板进行孵育,例如将其放入振荡器中,例如孵育18小时。孵育结束后将96孔板离心,收集流出液,并检测所有孔中流出液中是否有流穿的抗体。
2)反应过程:96孔板离心离去结合缓冲液后,用对应的反应缓冲液(例如50mm磷酸盐缓冲液,ph6.5、50mm磷酸盐缓冲液,ph7.0、50mm磷酸盐缓冲液,ph7.5)冲洗并去除,随后向每个孔中再加入一定量的对应的反应缓冲液。在各孔中加入相应量的小分子药物例如smcc-dm1药物分子溶液(smcc-dm1溶解于dma中,浓度为5mg/ml)和有机溶剂(例如dma、dmf或dmso)。混合均匀后,将96孔板进行孵育,例如将其放入振荡器中,例如孵育24小时。反应完成后,对所有反应孔除去未反应的游离药物分子,例如依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。
3)洗脱过程:纯化结束后,向每个反应孔中加入一定量的洗脱缓冲液(例如100μl的100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入一定量的中和缓冲液(例如10μl的1mna2hpo4水溶液),将孔板进行孵育,而后将96孔板离心收集得到产物。
具体实施方式
为了促进对本发明的理解,以下将参考某些实施方式,并且将使用特定语言来描述本发明。然而,应当理解的是,这些具体实施方式并不意图限制本发明的范围。本说明书中所描述的实施方式中的任何改变和进一步的修改,以及本发明的任何进一步应用,均为本领域技术人员通常会想到的。
下述实施例中所述试验方法,如无特别说明,均为常规方法;所述试剂和生物材料,如无特别说明,均可从商业途径获得。
下述实施例中,所述百分含量如无特别说明,均为质量百分含量。
下述实施例对本发明的具体实施做进一步说明,但本发明并不仅限于这些实施例。
实施例一抗体偶联药物在sec-hplc测试时进样量的摸索
本实施例中抗体偶联药物的药物/抗体比例(drugantibodyratio,dar)通过sec-hplc(sec:sizeexclusivechromatography)检测得到,sec-hplc测试条件如图3a所示,其中uv检测波长为252nm和280nm。为确认sec-hplc检测时所需抗体偶联药物的最低进样量,在本实施例中,同一个抗体偶联药物依次进样4、6、8、10、15、20、25、30、40μg进行sec-hplc检测,并分析它们的dar值。
图3b为抗体偶联药物在不同进样量时sec-dar结果图。结果表明:抗体偶联药物在进样量为4-40μg条件下,通过sec-hplc测得的dar值基本没差别。因此在进行sec-hplc测试时,抗体偶联药物的最低进样量设定为5μg。
实施例二抗体偶联药物目标dar的doe实验
在偶联反应过程中,决定抗体偶联药物的dar的影响因素有药物分子浓度、反应液ph、抗体量、蛋白g量、反应时间、反应体积、有机溶剂dma(dimethylacetamide)比例及反应温度等。本发明人认为药物分子浓度、反应液ph和抗体量是影响dar的主要因素,因此采用minitab软件设计了针对上述三个因素的全因子实验(doe实验)。如图4所示,在此doe实验中,反应液ph设定在6.5-7.5,药物分子浓度设定在100-300μm,抗体量设定在20-200μg,其它结合、反应和洗脱条件如图4a所示。
实验步骤简述如下:1)结合过程:在96孔深孔板(whatman,7700-2803)的不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g(ge,17-0618-02),并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次每孔加100μl的结合缓冲液。而后向每个反应孔中加入对应的抗体量(20μg、110μg和200μg),并将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用对应的反应缓冲液(50mm磷酸盐缓冲液,ph6.5、50mm磷酸盐缓冲液,ph7.0、50mm磷酸盐缓冲液,ph7.5)冲洗3次并真空抽滤去除,随后向每个孔中再加入90μl对应的反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液(smcc-dm1溶解于dma中,浓度为5mg/ml)和有机溶剂(dma、dmf或dmso),药物分子反应浓度分别为100μm、200μm和300μm。每个反应孔中加入的有机溶剂的总体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育24小时。反应24小时后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。3)洗脱过程:纯化结束后,向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图4b为抗体偶联药物针对dar的doe实验结果图。从该图的结果可以看到sec-dar随着药物浓度的增加而增加,随着反应液ph的增加而降低,随着抗体量的增加有小幅降低但并不明显。比如当ph为6.5药物浓度为300μm时,抗体量从20μg增加到200μg,sec-dar仅仅从3.41降低到2.93。
图5为采用minitab软件分析基于抗体偶联药物dar的doe实验结果。主效应(maineffect)是指当一个因子从低水平向高水平移动时,响应的平均值的增加或减少量的多少,其变化量越大表明主效应越强。从图5a中可看到药物分子浓度的主效应最强,其次是反应缓冲液的ph,最后才是抗体量。交互作用(interaction)是指一个因素各个水平之间反应量的差异随其它因素的不同水平而发生变化的现象,用于说明同时研究的若干因素的效应是否独立。从图5b的交互作用图可以看到,抗体量与药物浓度和ph差不多均为平行线,也即几乎没有交互作用。也即说明抗体量的变化对药物分子浓度和ph对dar影响效应很小。
实施例三探究抗体药物偶联中抗体量对sec-dar的影响
在该实施例中,偶联的抗体量从20μg逐步增加到200μg,其它条件如反应缓冲液的ph和药物分子浓度等如图6所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次每个孔加100μl的结合缓冲液。而后向每个反应孔中加入对应的抗体量(20μg逐步增加到200μg),并将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤去除,随后向每个孔中再加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度:300μm),各反应孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育24小时。反应24小时后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。3)洗脱过程:纯化结束后,向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图6为该实施例中抗体偶联药物sec-dar随抗体量不同的结果图。结果可以看到在其它反应条件一样时,反应抗体量从20μg逐步增加到200μg,sec-dar可以很好的保持在3-4之间,同时本发明人也注意到采用此偶联条件时几乎所有产物的高聚体水平都超过了30%。
实施例四探究抗体药物偶联中药物分子浓度对sec-dar的影响
在该实施例中,抗体偶联过程药物分子浓度从100μm逐步增加到300μm,同时反应过程中振荡器的振荡速度由800rpm降低到400rpm。其它条件如反应缓冲液的ph和抗体量等如图7所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。而后向每个反应孔中均加入40μg的抗体量,将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤去除,随后向每个孔中再加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度从100μm增加到300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育24小时。反应24小时后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。3)洗脱过程:纯化结束后,向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图7为该实施例中抗体偶联药物sec-dar随药物分子浓度变化的结果图。可以看到在其它条件恒定时,产物的sec-dar随着药物分子浓度增高呈线性增高。当药物分子浓度从100μm增加到200μm时,产物高聚物水平也逐渐增大;药物分子浓度从200μm增加到300μm时,产物高聚物水平趋于稳定。
实施例五探究抗体药物偶联中反应时间对sec-dar的影响
在该实施例中,抗体偶联过程反应时间从1小时逐步增加到24小时,同时反应过程中振荡器的振荡速度由800rpm降低到400rpm。其它条件如反应缓冲液的ph和抗体量等如图8所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。而后向每个反应孔中均加入40μg的抗体量,将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤除去,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育不同时间(1小时、5小时、18小时和24小时)。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。3)洗脱过程:纯化结束后,向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图8为该实施例中抗体偶联药物sec-dar随反应时间变化的结果图。结果可以看到在其它条件恒定时,产物的sec-dar随着反应时间增加呈线性增高。同时发现随反应时间从18小时增加到24小时,产物高聚物水平变化不大。
实施例六探究抗体药物偶联中后精纯处理对产物高聚物的影响
在该实施例中,药物分子浓度设定为200μm和300μm,对反应后处理设定有和没有琥珀酸盐缓冲液精纯,每个反应都重复两组平行样。其它条件如反应缓冲液的ph和抗体量等如图9所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。而后向每个反应孔中均加入40μg的抗体量,将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤去除,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为200μm或300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育18小时。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%反应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。其中一半反应冲洗纯化结束后将反应体系转移到另一块96孔板中立即洗脱,而另一半反应冲洗纯化结束后用琥珀酸盐缓冲液(20mm琥珀酸钠缓冲液,ph5.0)精纯处理4小时。3)洗脱过程:两个各自纯化结束后,依次向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图9为该实施例中抗体偶联药物高聚物水平与反应后精纯与否的比较图。结果可以看到药物分子浓度无论是在200μm还是300μm,当反应后处理过程均用琥珀酸盐缓冲液进行精纯处理,产物的高聚物水平均显著降低。也即说明在曲妥珠单抗为模型单克隆抗体情况下,琥珀酸盐缓冲液精纯反应后处理体系能显著降低产物的高聚物水平。
实施例七探究抗体药物偶联中反应振荡速度对产物sec-dar和高聚物的影响
在该实施例中,反应的振荡速度设定为800rpm和400rpm,同时还增加了不同抗体量(50、100、150和200μg)以进一步说明不同振荡速度对产物sec-dar和高聚物水平的影响。其它条件如反应缓冲液的ph和抗体量等如图10或图11所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。而后向每个反应孔中均加入40μg的抗体量(实验1)或不同抗体量(实验2,50μg、100μg、150μg和200μg),将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤除去,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育18小时。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。实验1冲洗纯化结束后立即洗脱;实验2反应冲洗纯化结束后用琥珀酸盐缓冲液(20mm琥珀酸钠缓冲液,ph5.0)精纯处理4小时。3)洗脱过程:纯化结束后,依次向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到产物。
图10和11为该实施例抗体偶联反应中振荡速度对产物sec-dar和高聚物水平影响的结果图。图10和图11分别对应实验1和实验2。结果可以看到实验1中当反应振荡速度由800rpm降低到400rpm时,产物的sec-dar基本没有变化,但高聚物水平明显降低。实验2中当反应振荡速度设定为400rpm,同时设定了不同抗体量的反应(50μg、100μg、150μg和200μg),且反应纯化后用琥珀酸盐缓冲液精纯处理,产物的sec-dar没有抗体量增加而变化,产物收率随着抗体量增加而增加,而高聚物水平经精纯处理后相比又显著降低。因此,当反应振荡速度设定为400rpm且经精纯处理时,产物的sec-dar和高聚物水平相对最为理想。
实施例八探究抗体药物偶联中洗脱条件对产物收率和高聚物的影响
在该实施例中,设定了不同的洗脱条件,如一个是加入洗脱液后静置2分钟,另一个是加入洗脱液后在振荡器中振荡2分钟(振荡速度:400rpm),同时实施例中抗体量设定了50μg、100μg和200μg3种不同量。其它条件如反应缓冲液的ph和抗体量等如图12所示。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。不同抗体量(50μg、100μg和200μg),将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤除去,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育18小时。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。冲洗纯化结束后用琥珀酸盐缓冲液(20mm琥珀酸钠缓冲液,ph5.0)精纯处理4小时。3)洗脱过程:纯化结束后,依次向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),其中一组反应将洗脱液静置2分钟,另一组反应将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到所有产物。
图12为该实施例抗体偶联中洗脱条件对产物收率和高聚物影响的结果图。结果表明当反应液洗脱时采用振荡器振荡2分钟(400rpm)时,产物的sec-dar没有变化,高聚物水平有一定增加,而收率则得到增加至少10%。因此,本发明人把洗脱条件设定为振荡器400rpm振荡2分钟。
实施例九探究不同亚型的单抗进行高通量赖氨酸偶联
在该实施例前,本发明人先总结了高通量赖氨酸偶联的最佳方法。如图13所示为高通量赖氨酸偶联中最佳的结合过程条件,最佳反应过程条件和最佳洗脱过程条件。在该实施例中采用了5种不同亚型的单克隆抗体,分别为小鼠igg2a、igg2b(migg2a、migg2b);大鼠igg1(rigg1);人igg4和igg1(higg4、higg1),此外各种亚型的单克隆抗体量均设定为50μg、100μg和200μg。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。不同抗体量(50μg、100μg和200μg),将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤除去,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育18小时。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。冲洗纯化结束后用琥珀酸盐缓冲液(20mm琥珀酸钠缓冲液,ph5.0)精纯处理4小时。3)洗脱过程:纯化结束后,依次向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到所有产物。
图14为该实施例九采用不同亚型单抗的高通量赖氨酸偶联的结果。结果表明对五种不同亚型的单克隆抗体采用图13所示高通量赖氨酸偶联方法合成抗体偶联药物时,产物的sec-dar几乎都很好的控制在3左右,同时产物收率基本超过40%,满足产物所要求的dar范围以及满足后续细胞实验所需量。为此,图13所示高通量赖氨酸偶联方法可用于其它亚型单克隆抗体偶联。
实施例十探究含不同亚型的单抗上清液进行高通量赖氨酸偶联
在该实施例中,本发明人同样采用如图13所示为高通量赖氨酸偶联中最佳的结合过程条件,最佳反应过程条件和最佳洗脱过程条件。在该实施例中采用了5种不同亚型的单克隆抗体,且单克隆抗体均以一定浓度事先孵育于细胞培养液中,5种单克隆抗体分别为migg1、migg2a、migg2b、higg4和higg1,此外每种亚型的单克隆抗体量均设定为150μg,每个反应均有两组平行样品。实验步骤简述如下:1)结合过程:在96孔深孔板中不同位置设定好不同的并列反应,并编好相应编号。向对应的每个孔板深孔中加入50μl蛋白g,并用结合缓冲液(50mm磷酸盐缓冲液,ph7.0)冲洗3次,每次向每孔中加100μl的结合缓冲液。加入不同亚型抗体上清液(150μg),将96孔板放入4℃恒温培养箱中振荡(振荡速度:800rpm)孵育18小时。孵育结束后将96孔板离心,收集流出液,并用nanodropproteina280检测所有孔中流出液中是否有流穿的抗体。2)反应过程:96孔板离心离去结合缓冲液后,用反应缓冲液(50mm磷酸盐缓冲液,ph6.5)冲洗3次并真空抽滤除去,随后向每个孔中加入90μl反应缓冲液。在各孔中加入相应量的smcc-dm1药物分子溶液和有机溶剂(药物分子浓度为300μm),每孔中有机溶剂总加入体积均为10μl。混合均匀后,将96孔板放入4℃恒温培养箱中振荡(振荡速度:400rpm)孵育18小时。反应结束后,对所有反应孔进行纯化除去未反应的游离药物分子,依次采用含有体积比10%dma的对应反应缓冲液和100%对应缓冲液冲洗3次,并真空抽滤除去冲洗缓冲液。冲洗纯化结束后用琥珀酸盐缓冲液(20mm琥珀酸钠缓冲液,ph5.0)精纯处理4小时。3)洗脱过程:纯化结束后,依次向每个反应孔中加入100μl的洗脱缓冲液(100mm甘氨酸水溶液,ph2.0),同时向下方收集产物的96孔板中加入10μl的中和缓冲液(1mna2hpo4水溶液),将孔板置于振荡器中振荡2分钟(振荡速度:400rpm),而后将96孔板离心(1500×g,6分钟)收集得到所有产物。同时产物采用液相质谱检测最终产物的游离药物分子含量。
图15为该实施例十采用不同亚型单抗孵育的细胞培养液的高通量赖氨酸偶联的结果图。结果表明对五种不同亚型的单克隆抗体采用图13所示高通量赖氨酸偶联方法合成抗体偶联药物时,产物的sec-dar都控制在2.5-3.3左右,同时产物收率大部分都超过50%,满足产物所要求的dar范围以及满足后续细胞实验所需量。同时所有抗体偶联药物产物中游离药物分子含量都小于2%,说明此纯化方法可以很好除去游离药物分子。因此,图13所示高通量赖氨酸偶联条件可用于杂交瘤细胞培养上清中单克隆抗体的偶联。
本说明书中的相关实施例只是用于对本发明的内容进行阐述,而不是对本发明的内容进行限制;因此在与本发明的权利要求书相当的含义和范围内的任何改变,都应该认为是包括在权利要求书的范围内。
本说明书中引用的所有文献通过引用并入本文,如同每个单独的文献被具体地和单独地指明通过引用并入。此外,本文所述的任何理论、机制、证明或发现旨在进一步增强对本发明的理解,并且不意图以任何方式将本发明限制到这样的理论、机制、证明或发现。尽管已经在附图和本说明书中详细地示出和描述了本发明,但是本说明书应当被认为是说明性的而不是限制性的。
- 还没有人留言评论。精彩留言会获得点赞!