一种治疗尿酸性肾病的药物的制作方法
本发明涉及尿酸性肾病治疗技术领域,尤其是一种治疗尿酸性肾病的药物。
背景技术:
尿酸是嘌呤代谢的终末产物,人体内的尿酸基本上以尿酸单钠盐的游离态形式存在于血液中,其中80%由细胞核蛋白分解代谢产生,20%由摄入富含嘌呤的食物分解代谢产生。人体每日生成并排泄的尿酸为600~700mg,其中1/3由肠道、2/3由肾脏排出。正常情况下,人体每天尿酸的产生和排泄基本上保持动态平衡。但是,当人体内尿酸合成增加,排泄减少,就会使血中尿酸浓度呈过饱和状态,男性空腹血尿酸水平高于420μmol/l,女性高于360μmol/l,即为高尿酸血症(hyperuricemia)。
当血液中尿酸浓度过高,呈过饱和状态时,尿酸沉积于肾组织即可引发尿酸性肾病(hyperuricemicnephropathy),最终可致肾功能不全。尿酸性肾病的肾脏病变主要为间质性肾炎和肾小管功能受损,肾损害与血尿酸升高的水平和持续时间长短成正比。
高尿酸血症诱发肾脏损害的机制主要包括尿酸的直接损伤和间接损伤。尿酸的直接肾脏损伤主要为尿酸转换而成的单盐-水化合物或尿酸盐结晶大量沉积在肾小管和肾间质中,造成肾脏的实质性损害,如炎性反应和纤维化的形成。同时尿酸结石对肾脏所形成的梗阻将引发的一系列的并发症如感染、出血、积水、恶性变等。尿酸的间接肾脏损伤主要包括:血尿酸增高对血管内皮的损伤、高尿酸导致肾素-血管紧张素-醛固酮(ras)系统激活、高尿酸血症刺激炎性级联反应、高尿酸血症导致机体代谢综合征发生、高尿酸血症引起肾脏肾小管上皮细胞转分化为肾间质成纤维细胞等,加重慢性肾脏病进展。
现有众多证据显示,高尿酸导致尿酸性肾病,高尿酸血症不仅是心血管疾病独立危险因素,亦是肾脏病的独立危险因素,其危险性甚至超过了蛋白尿对肾脏的损害。而尿酸性肾病导致肾脏纤维化最终导致肾功能衰竭,已有的常规治疗尿酸性肾病药物存在较大局限性,毒副作用明显。目前迫切需要探索出一种新的治疗尿酸性肾病所致的肾脏纤维化的方法和药物,以减轻尿酸性肾病治疗时对患者身体产生的毒副作用。
技术实现要素:
基于上述问题,本发明的目的在于提供可有效治疗尿酸性肾病所致的肾脏纤维化的药物,该药物安全有效,且无肝肾毒性。
为实现上述目的,本发明采取的技术方案为:一种溴结构域蛋白4的抑制剂在制备预防或治疗尿酸性肾病的药物中的用途。
作为本发明所述的用途的优选实施方式,所述的尿酸性肾病为肾炎或肾脏纤维化。
作为本发明所述的用途的优选实施方式,所述溴结构域蛋白4的抑制剂为i-bet151。
作为本发明所述的用途的优选实施方式,所述预防或治疗尿酸性肾病的药物剂型为胶囊剂、片剂、口服制剂、微囊制剂或注射剂。
作为本发明所述的用途的优选实施方式,所述的预防或治疗尿酸性肾病的药物为降低血肌酐、血尿素氮或尿微量白蛋白含量的药物。
作为本发明所述的用途的优选实施方式,所述的预防或治疗尿酸性肾病的药物为抑制纤粘蛋白、波形蛋白、α-平滑肌肌动蛋白、转化生长因子β1蛋白、磷酸化信号传导子及转录激活子3或细胞外信号调节激酶及磷酸化状态的表达的药物。
本发明还提供一种预防或治疗尿酸性肾病的药物,所述药物包括brd4的抑制剂和药学上可接受的载体。
作为本发明所述的药物的优选实施方式,其中所述brd4的抑制剂为i-bet151。
本发明还提供溴结构域蛋白4作为标志物在制备尿酸性肾病诊断试剂盒中的用途。
本发明的有益效果为:
相比现有尿酸性肾病治疗药物存在较大局限性,毒副作用明显的问题,本发明采用不同于以往的新治疗机制,提供一种治疗尿酸性肾病的新药物(brd4的抑制剂),该药物对肝肾无毒副作用,治疗肾脏纤维化的效果显著。
附图说明
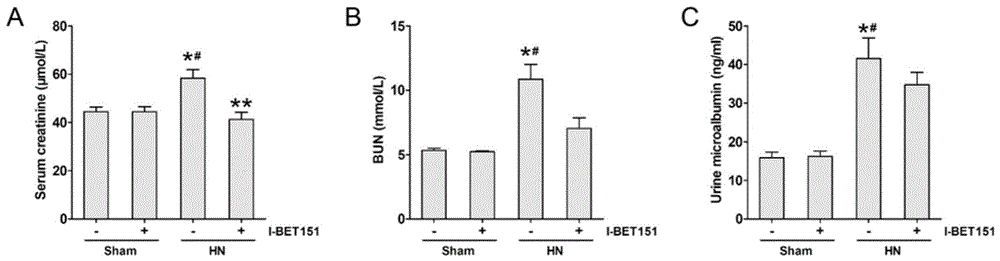
图1为本发明大鼠血标本的生化指标检测。
图2为本发明大鼠肾组织病理学he和masson染色结果图,其中显示尿酸性肾病模型出现明显纤维化表现,采用brd4抑制剂i-bet151治疗后纤维化得到明显改善。
图3为本发明免疫组化免疫组化定性检测纤粘蛋白(fibronectin)的表达的结果图。
图4为本发明免疫组化定性检测α-平滑肌肌动蛋白(α-sma)的表达的结果图。
图5为本发明免疫组化定性检测细胞外信号调节激酶2(erk2)的磷酸化状态(p-erk1/2)表达的结果图。
图6为western-blot结果图,其中显示采用i-bet151治疗可显著抑制brd4的表达水平。
图7为western-blot结果图,其中显示采用i-bet151治疗可显著抑制纤维化指标fibronectin的表达水平。
图8为western-blot和免疫组化结果图,其中显示采用i-bet151治疗可显著抑制emt指标vimentin和α-sma的表达水平。
图9为western-blot结果图,其中显示采用i-bet151治疗可显著抑制致纤维化指标tgf-β1的表达水平。
图10为western-blot及免疫组化结果图,其中显示采用i-bet151治疗可显著抑制尿酸性肾病炎症信号通路中p-stat3和p-erk1/2的表达水平。
具体实施方式
本申请的发明人首次发现brd4(溴结构域蛋白-4)参与尿酸性肾病肾脏纤维化的发病过程。本发明揭示了brd4参与尿酸性肾病器官纤维化发病过程中的表观遗传新机制,而且提示brd4可作为防治尿酸性肾病肾脏纤维化的新治疗靶点。
在一些实施例中,本发明通过brd4抑制剂腹腔注射给药表观遗传调控修饰来抑制和延缓尿酸性肾病肾脏纤维化,该药物安全有效,且无肝肾毒性。本发明的药物是一种抑制尿酸性肾病肾脏纤维化,防治和延缓肾功能衰竭的新药物。
在一些实施例中,本发明针对尿酸性肾病肾脏纤维化,采用腹腔注射brd4的特异性抑制剂进行治疗,并对尿酸性肾病模型进行表观遗传调控,给药方法简单便捷,对肝肾无毒副作用。本发明主要通过抑制炎症和上皮细胞转分化机制抑制纤维化成分生成,可以明显抑制尿酸性肾病导致的肾脏纤维化,从而达到保护肾脏的效果。
在一些实施例中,本发明制作尿酸性肾病大鼠模型,i-bet151处理尿酸性大鼠模型,收获动物;并行组织病理学、免疫组化、westernblot标本的制备和储存,集中进行生化指标检测、组织学、免疫组化、westernblot检测纤维化指标及相关信号通路,以验证brd4抑制剂治疗尿酸性肾病导致的肾脏纤维化的效果。
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。如无特别说明,本发明中的试剂浓度均为质量浓度;如无特别说明,本发明中的实验方法均为常规方法;如无特别说明,本发明中的试剂、材料、细胞、实验动物等均可从市场上或其它公开渠道获得。
实施例1尿酸性肾病动物模型的构建
取24只雄性spf级sd大鼠,8周龄,体重为200-220g,适应性喂养7天后,随机分为4组,每组6只。
(1)大鼠尿酸性肾病模型的制备
根据大鼠体重以腺嘌呤0.1g/kg、氧嗪酸钾1.5g/kg的比例,用蒸馏水将两者混合后制成终浓度为80g/l的混悬液,以20ml/kg/d每日分两次灌胃给药,连续21天,诱导得到尿酸性肾病大鼠肾脏纤维化模型。所有动物实验均遵守中国实验动物管理和使用条例。
(2)实验分组
抑制剂i-bet151溶液:将二甲基亚砜(dmso)溶于pbs中制成0.1%dmso,然后将i-bet15130mg/kg溶于50μl的0.1%dmso中。
a.sham组(假手术组,n=6只):灌胃给药同等剂量的蒸馏水+每日腹腔注射同等剂量的0.1%dmso溶液,持续21天;
b.sham+i-bet151组(n=6只):灌胃给药同等剂量的蒸馏水+每日腹腔注射30mg/kg的i-bet151,持续21天;
c.hn组(大鼠尿酸性肾病模型组,n=6只):根据大鼠体重灌胃给药腺嘌呤和氧嗪酸钾的混悬液+每日腹腔注射同等剂量的0.1%dmso溶液,持续21天;
d.hn+i-bet151组(n=6只):根据大鼠体重灌胃给药腺嘌呤和氧嗪酸钾的混悬液+每日腹腔注射30mg/kg的i-bet151,持续21天;
四组均于实验第21天处死大鼠,获取肾脏组织待检。
实施例2血标本的留取及生化指标检测
取血前禁食12h,内眦静脉取血2ml或根据大鼠体重按照1ml/kg剂量腹腔注射3%戊巴比妥钠麻醉后腹主动脉取血5ml。室温2500rpm离心15min,取血清至无菌eppendorf管中,-80℃冻存待测血生化指标。分别将实施例1中各组大鼠的血标本及尿液标本通过全自动生化分析仪测定血肌酐、血尿素氮及尿微量白蛋白。结果如图1所示。
图1a显示:与sham组比较,hn模型组血肌酐(serumcreatinine,scr)水平升高,当注射i-bet151后,scr显著下降(p<0.05),说明注射i-bet151可降低尿酸性肾病大鼠模型(hn)的scr,临床上检测血肌酐是常用的了解肾功能的主要方法之一,血肌酐高出正常值多数情况下意味肾脏受损,说明注射i-bet151可缓解肾脏受损情况。
图1b显示:与sham组比较,hn模型组血尿素氮(bun)水平升高,当注射i-bet151后,bun显著下降(p<0.05),说明注射i-bet151可降低hn的bun,血尿素氮(bun)测定是一项用于检查排尿功能是否正常的辅助检查方法,说明注射i-bet151可缓解排尿功能受损情况。
图1c显示:与sham组比较,hn模型组尿微量白蛋白(urinemicroalbumin)水平升高,当注射i-bet151后,尿微量白蛋白含量显著下降,说明注射i-bet151可降低hn的尿微量白蛋白水平(p<0.05),尿微量白蛋白测定可反映早期肾病、肾损伤情况,说明注射i-bet151可缓解肾损伤情况。
实施例3肾脏组织形态学观察
取实施例1中得到的各组大鼠肾脏组织,用4%的多聚甲醛固定。常规梯度乙醇脱水,二甲苯透明,石蜡包埋,4μm的连续石蜡切片,用he以及masson染色观察肾脏组织病理变化。光镜下观测肾小管间质浸润和肾脏厚度,纤维化程度,采用image-pro-plus软件进行评价。
结果如图2所示:he染色结果显示hn模型中肾间质区炎性细胞浸润,肾小管扩张,i-bet151治疗后病变明显减轻;masson染色结果显示与sham组比较,hn模型显示肾间质区纤维化主要成分为胶原等细胞外基质的蓝染区明显增加,表明i-bet151治疗明显减轻hn肾脏纤维化。
实施例4免疫组化检测
免疫组化检测:将实施例1构建的大鼠肾脏组织块速冻于液氮并转冻于-80℃,4微米冰冻切片,应用碱性磷酸酶-抗碱性磷酸酶(apaap)单克隆抗体免疫组化技术,单克隆抗体分别针对cd68+、α-sma,mcp-1检测,按照相关试剂盒操作程序进行免疫组织化学染色。光镜下观察胞质中出现棕黄色或棕褐色颗粒为阳性。
结果如图3-图5所示,免疫组化检测结果显示,与sham组比较,hn模型组中3种纤维化指标:纤粘蛋白(fibronectin)、α-平滑肌肌动蛋白(α-sma)、细胞外信号调节激酶2(erk2)的磷酸化状态(p-erk1/2)表达量明显增多,而i-bet151明显抑制hn组肾组织中上述3种纤维化指标的表达。
实施例5westernblot检测
westernblot检测:实施例1构建的模型大鼠肾脏组织提取蛋白,聚丙烯酰胺凝胶电泳,硝化纤维素膜转印,一抗孵育,碱性磷酸酶标二抗孵育,底物染色,检测溴结构域蛋白4(brd4)、纤粘蛋白(fibronectin)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-sma)、转化生长因子β1蛋白(tgf-β1)、磷酸化信号传导子及转录激活子3(stat3、p-stat3)、细胞外信号调节激酶(erk1/2)及磷酸化状态(p-erk1/2)的表达量,计算机图像分析系统分析结果。
结果如图6-图10所示,western-blot结果显示,与sham组比较,hn模型组中9种蛋白:溴结构域蛋白4(brd4)、纤粘蛋白(fibronectin)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-sma)、转化生长因子β1蛋白(tgf-β1)、磷酸化信号传导子及转录激活子3(stat3、p-stat3)、细胞外信号调节激酶(erk1/2)及磷酸化状态(p-erk1/2)的表达量明显上调,而i-bet151明显抑制hn组肾组织中这9种蛋白的表达,且western-blot半定量结果显示hn肾组织中这9种蛋白表达被抑制(p均<0.05)。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 还没有人留言评论。精彩留言会获得点赞!