阿苯达唑或其药学上可接受的盐在治疗胆管癌药物中的作用的制作方法
本发明涉及一种化合物的新的制药用途,特别是涉及阿苯达唑或其药学上可接受的盐在在治疗胆管癌药物中的作用。
背景技术:
药物辅助性化疗是目前术后治疗胆管癌(包括icc、ehcc)最有效的方法之一。许多已有的传统化疗药物因其自身的副作用以及耐药性已成为阻碍肝内胆管癌预后化疗效果欠佳的重要因素,例如最常于治疗晚期胆管癌的化疗药物吉西他滨和顺铂仍然存在易引起轻中度消化系统反应以及肝肾功能异常等副作用,且作为一线用药方案也存在临床耐药的局限性。因此对已有的非化疗药物通过重新定位其在肝内胆管癌中的治疗作用以完善新的治疗方案是一个重要且新颖的研究方向。
阿苯达唑(abz)作为一种驱虫药物被广泛使用于临床治疗中,但对其在胆管癌中的治疗作用未有相关研究报导。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种阿苯达唑或其药学上可接受的盐在治疗胆管癌药物中的作用,为胆管癌的治疗提供了新思路。
为实现上述目的及其他相关目的,本发明提供阿苯达唑或其药学上可接受的盐在制备用于预防或者治疗胆管癌药物中的用途。
阿苯达唑可通过市售方式获得,结构式:
药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯甲磺酸,苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。
进一步地,所述肝内胆管癌可以是原发性的,也可以是继发性的。
所述阿苯达唑具有至少以下功效之一:
治疗肝内胆管癌;抑制肝内胆管癌细胞的增殖速率;促进肝内胆管癌细胞凋亡;抑制肝内胆管癌细胞克隆;影响肝内胆管癌细胞的周期;抑制肝内胆管癌发展。
本发明的另一方面提供了阿苯达唑在制备治疗促进肝内胆管癌细胞凋亡制剂中的应用。
本发明的另一方面提供了阿苯达唑在制备抑制肝内胆管癌细胞克隆制剂中的应用。
本发明的另一方面提供了阿苯达唑在制备抑制肝内胆管癌细胞的增殖制剂中的应用。
本发明的另一方面提供了一种用于预防或者治疗肝内胆管癌的药物,所述药物内的含有预防或者治疗有效量的阿苯达唑。
进一步地,所述药物中还包括人体可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、粉剂、及其组合。药物制剂应与给药方式相匹配。
进一步地,所述阿苯达唑为药物的唯一有效成份或者有效成份之一。
本发明的另外一个方面提供了一种用于治疗或者预防肝内胆管癌的药物组合物,所述药物组合物含有预防或者治疗有效量的阿苯达唑以及至少一种其他治疗或者预防肝内胆管癌的药物。
所述药物组合物可以是以下形式中的任意一种:
一)将阿苯达唑和其他治疗或者预防肝内胆管癌的药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同。
二)将阿苯达唑和其他治疗或者预防肝内胆管癌药物配置成复方制剂,在阿苯达唑和其他治疗胆管癌的药物采用相同给药途径给药并同时施加时,可采用将两者配制成复方制剂的形式。
上述其他治疗或者预防胆管癌药物包括但不限制于:抗体药物、化学药物或靶向型药物等,优选为化学药物,给药方式可以是胃肠道给药或者胃肠外给药。
所述药物或者药物组合物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
以药物组合物为例,本发明的组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。诸如片剂和胶囊之类的药物组合物,可通过常规方法进行制备。药物组合物如针剂、溶液、片剂和胶囊宜在无菌条件下制造。
本发明的药物、制剂或者药物组合物可通过常规的方式施用于所需的对象(如人和非人哺乳动物)。代表性的施用方式包括(但并不限于):口服或注射(包括静脉注射、静脉滴注、肌肉注射或皮下注射等中的一种或多种)等中的一种或多种给药途径。使用药物组合物时,是将安全有效量的药物施用于哺乳动物。当然,具体剂量和方法还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明的另外一个方面提供了一种非治疗性的胆管癌的预防或者治疗方法,为向对象施用有效量的阿苯达唑和/或向对象施用有效量的其他治疗或者预防胆管癌药物。
如上所述,本发明的具有以下有益效果:
我们通过进行一系列体外实验以检测abz在两种胆管癌细胞系中的作用,结果显示abz能显著抑制胆管癌细胞增殖,且促进其凋亡,提示abz对胆管癌也具有治疗作用。
附图说明
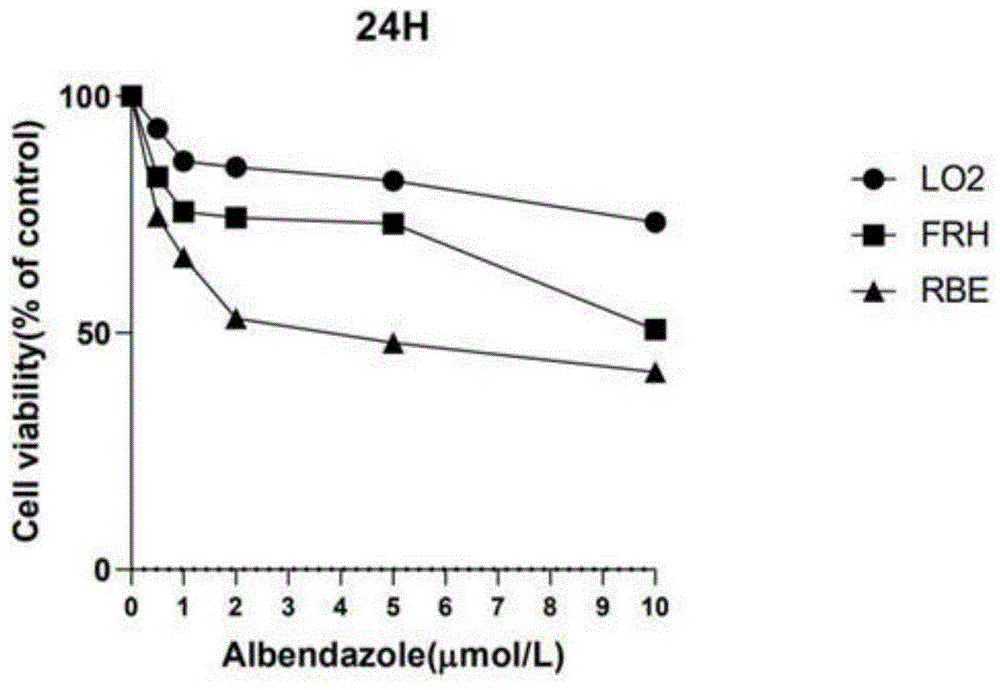
图1显示为abz对两种胆管癌细胞毒性。
图2a显示为abz对胆管癌细胞frh克隆形成影响。
图2b显示为abz对胆管癌细胞rbe克隆形成影响。
图3显示为abz对胆管癌细胞增殖的影响。
图4为流式细胞术显示abz对胆管癌细胞rbe凋亡影响。
图5显示为abz对胆管癌细胞rbe对凋亡相关蛋白表达的影响。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等
molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实验材料和试剂
胆管癌细胞系rbe:吉妮欧生物公司,lot:jno-20705
胆管癌细胞系frh:豪地华拓生物科技有限公司,lot:htx2093
肝细胞lo2:北纳生物编号:bncc100012
dmem培养基:gibco公司,lot:8120064
edta的胰酶:gibco公司,lot:2042303
蛋白裂解混合液:cwbio公司,lot:01408/40351
bca蛋白浓度试剂盒:trans公司,lot:#n20829
实施例1细胞培养实验
对不同种类的胆管癌细胞系rbe、frh,与正常肝细胞lo2使用10%胎牛血清和1%双抗(100mg/l青霉素和100mg/l链霉素)的dmem培养基,置于37℃、5%co2的细胞培养箱内培养。为以下实施例使用。
实施例2cck8实验检测细胞毒性
取对数生长期的胆管癌细胞与肝细胞以1×104个细胞/孔的密度接种于96孔板中,每孔100μl,于37℃培养箱孵育24h,每组使用不同浓度(0.25μm/ml、0.5μm/ml、1μm/ml、2μm/ml、5μm/ml)的abz孵育,pbs组为空白对照组,每组3个复孔,24h后每孔加入10μlcck8试剂,在37℃培养箱中避光孵育40min一定时间后,使用酶标仪读取450nm下的吸光值,并以此计算出细胞半数抑制浓度ic50,并选取处理效果最佳的abz浓度进行下一步实验。
实验结果如图1显示,与正常的肝细胞相比,abz在两种胆管癌细胞中的ic50值更低,提示abz对正常肝细胞的杀伤作用低于胆管癌细胞。
实施例3细胞克隆形成实验检测细胞增殖
将胆管癌细胞悬液以300个/孔的数量铺于6孔板中,以适当的细胞密度(根据增殖能力)接种于培养皿中。37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。待细胞贴壁后按abz最佳处理浓度5μm浓度处理,3天换一次培养基,静置培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次。加纯甲醇或1:3醋酸/甲醇5ml,固定15分钟。然后去固定液,加适量giemsa应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。用分子凝胶成像仪进行拍照,计算克隆形成率。
结果如图2显示abz处理能显著抑制胆管癌细胞克隆形成,提示abz能抑制胆管癌细胞增殖。
实验例4edu-488试剂盒检测细胞增殖
在5×105个细胞/孔的密度将胆管癌细胞rbe接种于6孔板中。细胞培养过夜并且恢复到正常状态后,进行abz处理24h;配制2x的edu工作液,将37℃预热的2x的edu工作液(20μm),等体积加入6孔板中,使6孔板中的edu终浓度变为1x。设计终浓度为10μm。继续孵育细胞2小时。edu标记细胞完成后,去除培养液,并加入1ml固定液(碧云天公司的4%的多聚甲醛,lot:p0099),室温固定15分钟。去除固定液,每孔用1ml洗涤液洗涤细胞3次,每次3-5分钟。去除洗涤液,每孔用1ml通透液(碧云天的免疫染色强力通透液lot:p0097),室温孵育10-15分钟。去除通透液,每孔用1ml洗涤液洗涤细胞1-2次,每次3-5分钟。去除上一步骤中的洗涤液。每孔加入0.5mlclick反应液,轻轻摇晃培养板以确保反应混合物可以均匀覆盖样品。室温避光孵育30分钟。吸除click反应液,用洗涤液洗涤3次,每次3-5分钟。对细胞核进行染色,按1:1000比例用pbs稀释hoechst33342(1000x)。吸除洗涤液后,每孔加1xhoechst33342溶液1ml,室温避光孵育10分钟。吸除1xhoechst33342溶液。用洗涤液洗涤3次,每次3-5分钟。最后在荧光显微镜下观察。
如图3显示,增殖细胞为绿色,细胞核为蓝色,abz处理能显著抑制胆管癌细胞rbe的增殖。
实施例5流式细胞术检测凋亡
取对数生长期的胆管癌细胞rbe以5×105个细胞/孔的密度接种于6孔板中,每孔2ml,处理浓度5μmabz孵育24h,dmso组为阴性对照组,pbs组为空白对照组,每组3个复孔,每孔加入200μl无edta的胰酶消化细胞并收集,500μl的bindingbuffer悬浮细胞,再加入5μlannexinv-fitc和5μlpi染液混匀后避光室温孵育15分钟,用流式细胞仪检测细胞凋亡,并使用flowjo分析凋亡情况。
结果如图4显示,abz处理可能促进胆管癌细胞rbe凋亡发生。
实施例6western-blot检测凋亡相关蛋白的表达
取对数生长期的胆管癌细胞rbe以5×105个细胞/孔的密度接种于6孔板中,每孔2ml,使用2μm、5μm浓度abz孵育24h,dmso组为阴性对照组,pbs组为空白对照组,每组3个复孔,24h后弃去培养基,pbs清洗两遍,每孔加入80μl蛋白裂解混合液(中强度ripa与10mmpmsf比例为1:100),冰上裂解30min后,使用刮子将细胞全部刮落并收集在1.5ml离心管中,12000rpm,4℃离心15min,去除细胞碎片,吸取上清液即为细胞总蛋白,并参照bca蛋白浓度试剂盒说明书测蛋白浓度。将上述收集的蛋白调整为总浓度为30μg,总体积为20μl,加入8μl的sds上样缓冲液、2μl1mol/l的dtt,在沸水中加热5-10分钟,使蛋白样品中蛋白失活变性,冷却后上样于凝胶孔中。用bio-rad系统浓缩胶中电压80v30min,分离胶中电压120v60min。电泳结束后将凝胶中的蛋白转入pvdf膜中,使用5%脱脂奶粉的tbst封闭,加入按比例稀释后的相应抗体,4℃过夜后使用hrp标记的二抗进行杂交,加入ecl发光剂进行曝光、显影及定影。所用一抗凋亡相关蛋白(bax、cleavedcaspase3、caspase8)及gapdh抗体用于检测相关蛋白的表达。
结果如图5显示,abz处理组中凋亡相关蛋白表达显著增加,提示abz可能促进胆管癌细胞发生caspase依赖的凋亡。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!