一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒、制备方法及应用与流程
本发明属于生物科学和药物载体技术领域,涉及一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒、制备方法及应用。
背景技术:
乳腺癌是女性最常被诊断出的癌症,也是导致女性癌症相关死亡率的主要原因。尽管目前已经在乳腺癌的诊断和治疗方面取得了非常大进步,但是对于转移性乳腺癌常被认为是很难治愈的。因此,为了在减轻疼痛和延长患者寿命的益处与治疗带来的伤害之间取得平衡,合理的治疗方案应基于肿瘤淋巴结转移的不同分期。而目前临床判定乳腺癌是否已经发生了转移所采用的手段主要是将含有放射性元素99mtc标记的纳米胶体或者伊文斯蓝染料注射到原位乳腺癌周围,来标记前哨淋巴结并实施前哨淋巴结切除活检(slnb)。但是实行淋巴结活检需要消耗大量的时间以及从某种程度上来说对活检的组织进行分析带有一定的主观性。另外,有报道前哨淋巴结的切除会引起一系列的并发症,比如淋巴水肿,肩关节功能障碍以及手臂麻木等问题。因此,开发一种在术中准确识别淋巴结肿瘤转移的新方法将有助于外科医生选择效果更合适地治疗方案,并能最大程度地减少因不必要的前哨淋巴结切除而引起的并发症。
肿瘤细胞浸润和炎症刺激条件下,都可能导致淋巴结发生肿大。目前已经开发了多种纳米探针用于快速预测前哨淋巴结肿瘤转移的状态,比如包括使用靶向性的荧光成像、微泡增强的超声成像、纳米颗粒增强磁共振成像(mri)、表面增强拉曼散射(sers)成像以及光声成像等。这些方法主要依赖于淋巴结中的巨噬细胞摄取纳米探针将信号减弱的肿瘤前哨淋巴结与信号增强的炎症性淋巴结区别开来。但是这很难检测到被肿瘤细胞完全占据的前哨淋巴结,因此使用这种间接的方式来预测乳腺癌肿瘤转移前哨淋巴结并不是最理想的方法。迫切需要发展基于转移性乳腺癌肿瘤本身的特征来开发新的工具,以将肿瘤转移的前哨淋巴结与炎症性淋巴结进行有效地区分。
技术实现要素:
为了解决现有乳腺癌淋巴结转移鉴定可靠性低的技术问题,本发明提供了一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒,该纳米颗粒能够高效标记乳腺癌细胞,并能够有效的靶向淋巴结,通过该纳米颗粒在不同状态淋巴结中光声显微成像信号分布的差异,可将肿瘤转移的淋巴结与炎症性淋巴结和正常淋巴结进行区分,提升乳腺癌淋巴结转移鉴定的准确性。
本发明还提供了一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒制备方法及应用。
本发明通过以下技术方案实现:
一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒,所述纳米颗粒包括磷脂、胆固醇酯、近红外探针、透明质酸-磷脂复合物和α螺旋多肽。
进一步的,所述磷脂包括dmpc和dspe-peg2000,所述透明质酸-磷脂复合物中的磷脂为dmpe,所述α螺旋多肽与磷脂相互作用,所述近红外探针为任意具有荧光/光声成像特性的脂溶性的光学探针或者水溶性的光学探针。
进一步的,所述脂溶性的光学探针为dir-boa,所述水溶性的光学探针为icg。
进一步的,所述透明质酸为任意分子量大小的透明质酸。
进一步的,所述α螺旋多肽为具有seqidno.1所示的氨基酸序列或包含seqidno.1的氨基酸序列。
为了便于说明,本发明将所述纳米粒子命名为α-ha-np,α螺旋多肽命名为r4f,其氨基酸序列为faekfkeavkdyfakfwd或含有faekfkeavkdyfakfwd的序列。
一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒的制备方法,包括:
将磷脂、胆固醇酯、近红外探针、透明质酸-磷脂复合物及氯仿溶液制备成混合溶液;
向混合溶液内通入氮气流吹干氯仿,再真空干燥、重悬、超声处理;
加入α螺旋多肽溶液混匀,纯化。
其中,各原料间的摩尔比为:
dmpc:c.o:近红外探针:dspe-peg200:ha-dmpe:r4f=3:0.1:0.2:0.0114:0.04:0.4。
一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒在乳腺癌淋巴结转移模型和炎症性淋巴结模型构建中的应用。
进一步的,所述应用包括:
在小鼠足弯或乳腺垫处注射乳腺癌肿瘤细胞,建立乳腺癌淋巴结转移模型;
在淋巴结内注射lps来构建淋巴结炎症模型;
在肿瘤部位和足垫分别注射所述纳米颗粒;
暴露出前哨淋巴结、炎症性淋巴结和正常淋巴结进行声光成像。
进一步的,在建立小鼠乳腺癌淋巴结转移模型的同时设置对照组炎症性淋巴结模型,注射乳腺癌肿瘤细胞,饲养1-3周后再注射纳米颗粒,淋巴结内注射lps2天之后足垫注射纳米颗粒,所述纳米颗粒注射6h后进行光声成像,检测纳米颗粒在不同淋巴结中的分布状况。
光声成像结果显示通过该纳米颗粒在不同状态淋巴结中光声显微成像信号分布的差异可将肿瘤转移的淋巴结与炎症性淋巴结和正常淋巴结进行区分,提升乳腺癌淋巴结转移鉴定的准确性。
本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
本发明一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒,该纳米颗粒通过透明质酸和α螺旋多肽双靶向乳腺癌细胞,标记效果好,能够很好的靶向淋巴结,并通过纳米颗粒在不同状态淋巴结中光声显微成像信号分布的差异可将肿瘤转移的淋巴结与炎症性淋巴结和正常淋巴结进行区分,提升乳腺癌淋巴结转移鉴定的准确性。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
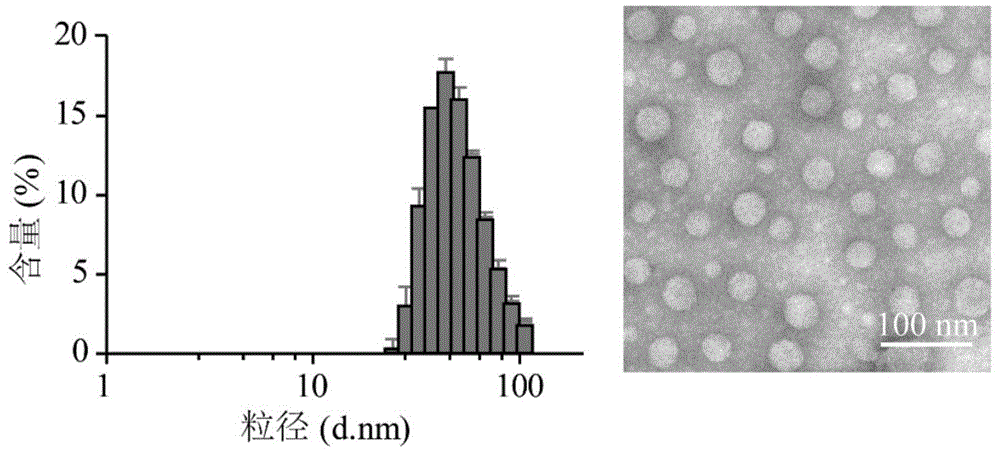
图1为所述α-ha-np的动态激光光散射(dls)图和透射电子显微镜成像(tem)图。
图2为α-ha-np对4t1乳腺癌细胞的毒性图。
图3为α-ha-np有效地靶向淋巴结图。
图4为α-ha-np对4t1乳腺癌细胞标记效果的流式图。
图5为α-ha-np在体靶向淋巴结中转移的4t1乳腺癌细胞共聚焦成像和定量分析图。
图6为α-ha-np在不同状态淋巴结中分布的光声成像图。
图7为不同状态淋巴结中α-ha-np光声信号曲线分布图。
图8为不同状态淋巴结中纳米颗粒的分布共聚焦成像图。
图9为肿瘤淋巴结转移早期的光声成像图。
图10为α-ha-np结构示意图:图中,c.o代表胆固醇酯,螺旋结构代表α螺旋多肽。
具体实施方式
下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等,均可通过市场购买得到或者可通过现有方法制备得到。
本发明实施例提供的技术方案为解决上述技术问题,总体思路如下:
为了解决乳腺癌淋巴结转移鉴定可靠性低的技术问题,迫切需要开发一种基于转移性乳腺癌肿瘤本身的特征来开发新的工具,以将肿瘤转移的前哨淋巴结与炎症性淋巴结进行有效地区分。为了满足以上需求,纳米探针的设计必须满足以下要求:1)生物安全性好;2)纳米探针通过主动或者被动的方式能够快速有效地迁移到前哨淋巴结;3)能同时携带近红外染料和选择性靶向乳腺癌细胞的特异性配体。
基于此,本发明开发了一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒,所述纳米颗粒包括磷脂、胆固醇酯、近红外探针、透明质酸和α螺旋多肽,起双靶向作用的单元分别是透明质酸和α螺旋多肽,分别与乳腺癌细胞的cd44和sr-b1受体结合,相比单靶向的纳米颗粒而言,标记效果大幅提升;并且能够有效地靶向淋巴结;该纳米颗粒在不同状态淋巴结中光声显微成像信号的分布存在差异,可利用该特性将肿瘤转移的淋巴结与炎症性淋巴结和正常淋巴结进行区分,提升乳腺癌淋巴结转移鉴定的准确性。
本发明的纳米颗粒可用于构建小鼠乳腺癌淋巴结转移模型,能够有效辅助对乳腺癌细胞淋巴结转移的研究及诊断。利用本发明纳米颗粒构建模型,准确率高,可有效的将肿瘤转移的淋巴结与炎症性淋巴结和正常淋巴结进行区分。
本发明中,各名词解释如下:
dmpc:二肉豆蔻酰磷脂酰胆碱
dir-boa:近红外染料
dspe-peg200:二硬脂酰磷脂酰乙醇胺-聚乙二醇
ha-dmpe:透明质酸-二肉豆蔻酰基磷脂酰乙醇胺
katushka:四聚体荧光蛋白
lps:脂多糖
icg:吲哚箐绿
下面将结合实施例及实验数据对本申请一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒、制备方法及应用进行详细说明。
实施例1
本发明实施例提供一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒的制备方法:
a1,首先称取14mgha溶解于5ml去离子中,加入6mg碳二亚胺(edac),37℃反应2h;然后在ha溶液中加入0.5mgdmpe磷脂,37℃条件下继续反应24h。通过纯化后,获得ha-dmpe聚合物,最后通过核磁共振氢谱(1hnmr)来验证ha-dmpe聚合物。
a2,分别称取dmpc(3μmol)、c.o(0.1μmol)、dir-boa(0.2μmol)、dspe-peg200(0.0114μmol)和ha-dmpe(0.04μmol)置于玻璃试管中,加入500μl氯仿溶液充分混合,并用封口膜将试管口封闭。
a3,真空干燥
将步骤a2的混合液先通入稳定的氮气流将试管内的氯仿吹干,然后将试管放入真空干燥器中干燥1h。
a4,超声
将步骤a3的试管中加入1ml的磷酸缓冲液,冲满氮气,使用涡旋震荡仪将试管底部药品充分重悬形成均匀的悬浊液,将试管在48℃超声1h。
a5,加入多肽
将步骤a4中的试管加入含有0.4μmolα螺旋多肽r4f的ddh2o溶液。混匀后4℃密封保存过夜。
a6,纯化
次日,使用fplc系统纯化,收集有效溶液浓缩备用。
双靶向纳米颗粒通过上述方法合成,其纳米粒径图参见图1,图1(左)为双靶向纳米颗粒的水合粒径图,显示为40nm左右。图1(右)为双靶向纳米颗粒的电镜图,显示该材料粒径均一且具有很好的分散性。
实施例2
实施例1中制备得到的双靶向纳米颗粒对4t1乳腺癌细胞的毒性作用见图2。图2显示在纳米颗粒的r4f多肽浓度为1-40μm的范围内,纳米颗粒与4t1乳腺癌细胞作用24h对乳腺癌细胞的存活基本上没有太大的影响。这些结果表明,基于透明质酸的纳米颗粒对于体内应用具有良好的生物相容性。
实施例3
实施例1中制备得到的α-ha-np靶向淋巴结的效果见图3。纳米颗粒从小鼠足垫皮下注射后,使用整体荧光成像系统观察不同时间点纳米颗粒在淋巴结中的聚集效果。成像结果显示双靶向的纳米颗粒α-ha-np能够快速的(小于10min)在腿弯淋巴结中聚集,并且淋巴结中的荧光信号强度要远强于对照组单一靶向的纳米颗粒α-np和ha-e。在6h时α-ha-np组淋巴结中的荧光信号强度分别是α-np和ha-e的3.0和2.3倍,在12h时,分别是3.2倍和2.5倍。这个结果说明双靶向的纳米颗粒能够快速高效地靶向淋巴结,为在体标记肿瘤转移的淋巴结奠定基础。
实施例4
实施例1中制备得到的α-ha-np靶向4t1乳腺癌细胞的效果见图4。该步骤如下:
1)消化4t1细胞,接种至96孔板中,每孔2×104个细胞,于37℃培养箱培养过夜。
2)将不同浓度的α-ha-np分别加入到96孔板中与4t1细胞孵育3h,体积为200μl。作为对照组,分别加入只含有r4f多肽和ha的纳米颗粒α-np和ha-e。
3)收集4t1细胞,使用pbs漂洗3次之后,流式检测4t1细胞的荧光信号强度。
流式结果显示,4t1摄取纳米颗粒呈现浓度依赖的方式。但是α-ha-np处理的4t1细胞中的荧光信号强度明显高于对照组4t1细胞中的荧光信号。这些结果说明双靶向的纳米颗粒α-ha-np能够有效地标记4t1乳腺癌细胞。
实施例5
实施例1得到的双靶向纳米颗粒在体标记淋巴结中转移的乳腺癌细胞效果见图5。
1)建立乳腺癌细胞淋巴结转移模型。消化表达katushka荧光蛋白的4t1细胞,使用pbs漂洗2次之后使用细胞计数仪计数,调节细胞浓度至2.5×107cell/ml。然后在balb/c小鼠的足弯处注射体积为20μl(5×105个)的4t1-katushka肿瘤细胞。
2)瘤内注射纳米颗粒。3周之后,在足弯肿瘤部位注射fitc标记的α-ha-np和α-np。
3)淋巴结共聚焦成像。6h之后取出腿弯淋巴结。先使用4%的多聚甲醛固定10h,然后使用30%蔗糖脱水8h之后进行淋巴结冰冻切片。最后进行淋巴结切片共聚焦成像。
共聚焦成像的结果,参见图5(a)所示,在淋巴结内部,有很多带有荧光信号的4t1-katushka细胞,说明肿瘤细胞成功的转移到了淋巴结内。同时我们也可以看到,与对照组fitc-α-np相比,注射了fitc-α-ha-np的荧光信号与4t1-katushka能够很好的重合,图5(b)的定量结果显示α-ha-np与肿瘤细胞的共定位系数要显著高于α-np组,说明α-ha-np不仅在体外能够很好的靶向4t1肿瘤细胞,同时也能对淋巴结中转移的乳腺癌细胞进行标记。图5中,上面4个图表示的α-ha-np组的淋巴结,下面表示的α-np组的淋巴结。4t1-katushka表示的是乳腺癌肿瘤细胞,fitc表示纳米颗粒,蓝色表示的是细胞核。
实施例6
通过光声显微成像来比较研究了双靶向纳米颗粒在不同状态淋巴结中分空间分布状况。具体方法如下:
1)建立乳腺癌细胞淋巴结转移模型和炎症性淋巴结模型。在小鼠的一侧足弯处注射体积为20μl(5×105个)的4t1肿瘤细胞;在小鼠的一侧腿弯淋巴结内注射lps(5mg/kg)来建立炎症性淋巴结模型,未做任何处理的组作为正常对照组。
2)注射纳米颗粒。对于肿瘤转移淋巴结,接种3周之后在原位肿瘤部位注射α-ha-np;对于炎症性淋巴结,lps注射两天之后在足垫注射α-ha-np;同时在未做任何处理的正常对照组足垫处注射相同剂量的α-ha-np。
3)光声成像。纳米颗粒注射6h后,将淋巴结暴露出来进行光声成像。
4)数据处理。制作光声成像的最大投射图以及归一化曲线分布图。
从成像的结果可以看出,在肿瘤转移的淋巴结中,纳米颗粒的光声信号主要分布在淋巴结的内部,而外部的信号则比较弱。但是炎症性淋巴结和正常淋巴结中的周围有很强的光声信号,而淋巴结内部的光声信号很弱。其结果参见图6,淋巴结直径和信号强度归一化之后的光声信号强度分布曲线参见图7。光声成像之后的淋巴结切片的共聚焦成像结果参见图8,图中,dapi代表细胞核。以上结果说明,通过光声成像我们可以将肿瘤转移的淋巴结与炎症性淋巴结以及正常淋巴结进行有效区分。而淋巴结切片的共聚焦成像结果也很明显的验证了光声成像的结果。
除了对肿瘤转移3周的淋巴结进行光声成像,对于更早期肿瘤转移的淋巴结(1周或者2周)中纳米颗粒的光声成像结果见图9所示。成像结果说明,对于更早期肿瘤转移的淋巴结中光声信号分布显示出了与肿瘤转移3周淋巴结相似的趋势。
最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
序列表
<110>华中科技大学
<120>一种双靶向乳腺癌细胞及其淋巴结转移灶的纳米颗粒、制备方法及应用
<140>202010715564.9
<160>1
<170>siposequencelisting1.0
<210>1
<211>18
<212>prt
<213>人工序列(1)
<400>1
phealaglulysphelysglualavallysasptyrphealalysphe
151015
trpasp
- 还没有人留言评论。精彩留言会获得点赞!