一种载药多功能磁性纳米气泡及其制备方法和应用与流程
本发明涉及医用纳米材料技术领域,具体涉及一种载药多功能磁性纳米气泡及其制备方法和应用。
背景技术:
化疗是抗癌治疗里最常用的方法之一,但是传统的化疗有杀死正常细胞,破坏人体免疫系统和容易复发等副作用。为了提高药物在肿瘤里的分布并减少副作用,目前出现了基于药物负载的纳米粒子的抗癌药物传递、制作靶向配体修饰的药物负载的纳米粒子等技术。
在基于纳米粒子的抗癌治疗过程中,应准确的监测纳米粒子的体内分布及肿瘤治疗效果。但目前的成像技术没有足够的空间分辨率进行精确的癌症诊断,所有成像技术都需要造影剂,而且每种成像技术都有其优点和局限性,需使用多种成像系统来提高诊断的准确性。
因此,需研发可同时用于诊断和化疗的多功能抗癌药物负载的纳米粒子,为提高诊断的准确性,该纳米粒子需具备多模式成像系统的造影剂功能,为提高靶向效率和治疗效果,该纳米粒子需具备靶向配体介导的肿瘤靶向功能和负载充分的抗癌药物能力。
目前跟上述多功能磁性纳米气泡有关联的现有技术有中国专利cn101987203a和美国登录专利us2018/0064831a1号。虽然这些现有技术有助于多功能磁性纳米气泡的研发,但仍有不合理的粒子大小(肿瘤内新生血管壁间宽度;600~800nm)、单一成像系统造影剂功能、缺乏配体修饰等局限性。
技术实现要素:
为了克服现有技术的缺陷,本发明的目的之一在于提供一种载药多功能磁性纳米气泡,以生物可降解高分子聚合物和磁性纳米气泡的混合物为壳体形成的空心纳米粒子,负载抗癌药物,填充超声成像用介质,具有增强的超声波和磁共振双重成像造影剂功能、配体-受体介导的肿瘤靶向功能、抗癌药物负载能力。
本发明的目的还在于提供一种载药多功能磁性纳米气泡的制备方法。
同时,本发明还在于提供一种载药多功能磁性纳米气泡的应用。
为了实现上述目的,本发明采用的技术方案如下:
一种载药多功能磁性纳米气泡,由外至内依次由肿瘤细胞膜表面受体特异结合的配体分子、连接分子、壳膜材料组成的空心纳米粒子;壳膜材料混合有磁性纳米颗粒,空心纳米粒子内负载药物和填充气体。
可选的,空心纳米粒子内填充的气体为二氧化碳或氟碳气体。进一步的,所述氟碳气体为八氟丙烷或十氟丁烷。
可选的,所述肿瘤细胞膜表面受体特异性结合的配体分子为叶酸;进一步的,连接分子为聚乙二醇,其分子量2000~5000g/mol;更进一步的,壳膜材料为聚乳酸-乙醇酸共聚物,其分子量7000~12000g/mol;聚乳酸-乙醇酸共聚物与聚乙二醇的摩尔比为1:1~3。
可选的,所述壳膜材料中磁性纳米颗粒的负载量为5~30wt%;磁性纳米颗粒为直径5~20nm的疏水性磁性纳米颗粒;磁性纳米颗粒为球形、立方体、八面体、四面体、棒状或其衍生结构。
可选的,所述磁性纳米气泡的直径为100nm~500nm。
可选的,负载药物选自阿霉素(doxorubicine)、表柔比星(epirubicin)、吉西他滨(gemsitabin)、顺铂(cisplatin)、卡铂(carboplatin)、甲基苄肼(procarbazine)、环磷酰胺(cyclophosphamide)、更生霉素(dactinomycin)、柔红霉素(daunorubicin)、依托泊苷(etoposide)、他莫昔芬(tamoxifen)、丝裂霉素(mitomycin)、博莱霉素(bleomycin)、普卡(plicamycin)、长春碱(vinblastine)、甲氨蝶呤(methotrexate)中的一种或多种。
上述载药多功能磁性纳米气泡的制备方法,包括以下操作步骤:
a)制备聚乳酸-羟基乙酸-叶酸plga-peg-fa聚合物:
用n,n'-二环己基碳二亚胺dcc和n-羟基琥珀酰亚胺nhs在二氯甲烷dcm中活化聚乳酸-乙醇酸plga,然后与聚乙二醇二胺反应,滴入低温二乙醚中沉淀、干燥,获得固体plga-pe-nh2高分子,溶解于二甲亚砜溶液dmso中,依次透析、干燥获得plga-peg-nh2高分子粉末;
用n,n'-二环己基碳二亚胺dcc活化叶酸fa,并逐滴的加入到溶解有plga-peg-nh2的二甲亚砜溶液中,plga-peg-nh2、fa、dcc摩尔比为1:2:2.5,在室温氮气保护下反应,反应完成后依次透析、去除未反应的叶酸、干燥,获得plga-peg-fa高分子粉末;
b)制备疏水性磁性纳米颗粒spio:
将氯化铁(iii)和氯化铁(ii)溶解于盐酸水溶液中,氯化铁(iii)和氯化铁(ii)的摩尔比为2:1,在干燥氮气保护下,将溶液滴加到含有油酸的naoh水溶液中,搅拌反应后将黑色沉淀物进行磁分离,使用无水乙醇洗涤三次,然后分散在二氯甲烷中,将溶液超生震荡,离心去除未分散的残留物,制得疏水性磁性纳米颗粒spio;
c)制备空心磁性纳米气泡:
搅拌条件下将spio二氯甲烷溶液与plga-peg-fa聚合物溶液混合,将药物溶液添加到有机相中,超声乳化后添加到5%聚乙烯醇pva溶液中,在冰浴中进一步超声处理,将所得双乳液用1%聚乙烯醇溶液稀释后,在室温下搅拌,蒸发残留二氯甲烷,离心后,除去上清液,清洗沉淀,重复离心和洗涤后干燥制得空心磁性纳米气泡,然后在空心磁性纳米气泡中充入气体。
为了控制形成的磁性纳米气泡的内部空心尺寸,上述步骤c)中控制w/o/w=药物溶液/plga-peg-fa+spio混合溶液/聚乙烯醇水溶液的体积比=0.5~2:5:10~25。
上述步骤b)中还可以利用热分解法制作spio:将fe(acac)3溶解于苄基醚和油酸胺中,将该溶液加热,在氮气保护下脱水,然后以20℃/min的加热速率快速加热至300℃,并在此温度下反应1h,将溶液冷却至室温。加入50毫升乙醇,然后离心,制得疏水性磁性纳米颗粒spio。
上述载药多功能磁性纳米气泡可应用于制备诊断剂和或治疗剂。进一步的,用于诊断成像或成像辅助应用中的化合物和/或药物。
本发明载药多功能磁性纳米气泡,相比传统的载药纳米粒子,具有以下有益效果:
1)内部填充的气体,尤其是氟碳气体,壳膜材料中混合负载的磁性纳米颗粒使制备的磁性纳米气泡即能够作为mr造影剂也可以用作us造影剂,具有双重造影功能。由于壳膜材料采用具有生物相容性和可生物降解性的聚合物材料,混合负载的磁性纳米颗粒表面进行疏水性修饰,使其具有优异的生物相容性和药物负载能力。同时,最外层具有能够与肿瘤细胞膜表面受体特异结合的配体分子,例如fa分子,增强磁性纳米气泡的靶向作用;
2)磁性纳米气泡的us信号和mr造影功能明显增强,并且随着磁性纳米气泡壳膜材料中磁性纳米颗粒加载量的增加而逐渐增加,而磁性纳米颗粒负载为17.6wt%的us信号明显,与壳膜材料中未混合负载磁性纳米颗粒相比,提高了64%以上;磁性纳米气泡中sipo气泡壳中spio的密集聚集,t2弛豫率为109.18mm-1s-1;
3)高效的靶向药物传递性能和药物释放性能:本发明磁性纳米气泡通过叶酸受体介导靶向作用和高聚集超声(fus)触发的药物递送来靶向肿瘤,纳米气泡流体力学尺寸分布为91.7nm至459nm,气泡表面的peg链可延长循环半衰期并可克服单核吞噬系统清除,因此,磁性纳米气泡有望有效地通过肿瘤部位新生血管血管壁间隙(600~800nm)并积聚在肿瘤部位;fus超声产生的剪切力可以拓宽细胞间空间,从而增加间隙运输,声空化可引起局部应力并增强外渗和细胞膜通透性,因此,fus可进一步增强磁性纳米气泡在肿瘤部位的积累。此外,fus触发药物释放可以导致肿瘤中的药物浓度迅速达到致死剂量,从而有效杀死癌细胞。
附图说明
图1为本发明实施例1载药多功能磁性纳米气泡制备方法流程示意图;
图2为本发明实施例1中制备的磁性纳米颗粒spio的透射电子显微镜tem图片;
图3为本发明实施例1中制备的磁性纳米气泡的扫描电子显微镜图片;
图4为本发明实施例1中制备的磁性纳米气泡的透射电子显微镜图片;
图5为本发明实施例1制备的磁性纳米气泡的结构示意图如图2所示,其中1代表fa、2代表peg、3代表plga、4代表dox(抗癌药物)、5代表c3f8气体;
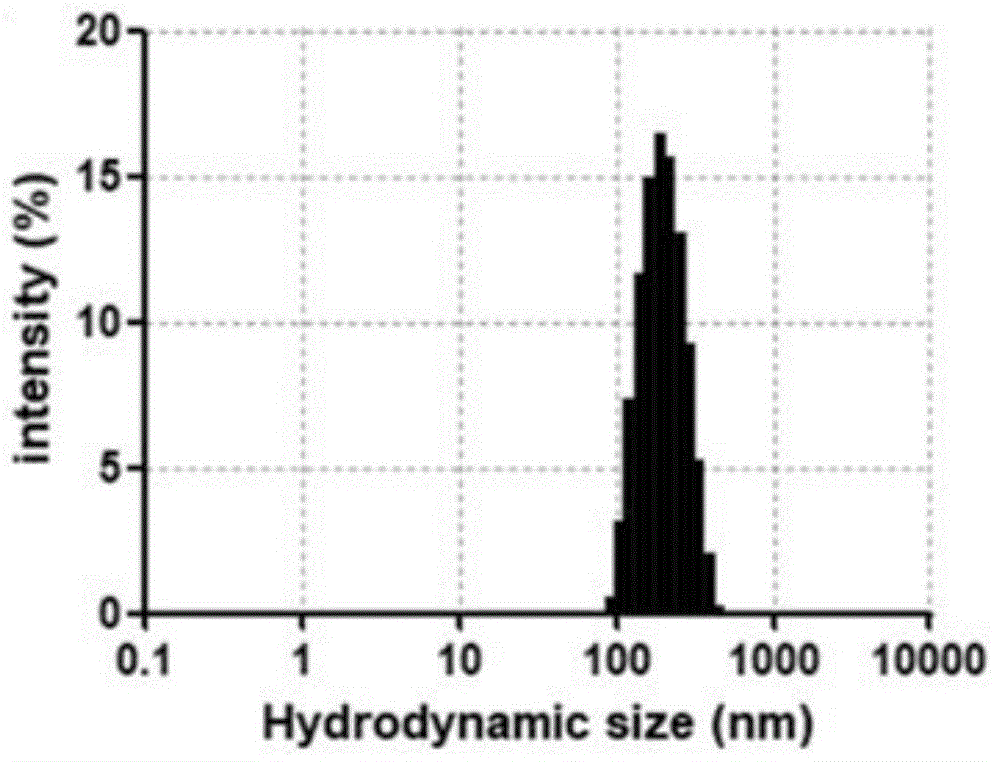
图6为本发明实施例1制备的磁性纳米气泡的尺寸分布图;
图7为本发明试验例1中磁性纳米气泡的超声波造影剂和磁共振造影剂性能评价结果图;
图8为本发明试验例2中fus触发本发明磁性纳米气泡中dox释放效果模拟试验结果图;
图9为本发明试验例2中针对本发明磁性纳米气泡的叶酸fa分子和fus介导的磁性纳米气泡对药物释放和传递效果的增强作用评价结果图;
图10为本发明试验例2中fus触发的磁性纳米气泡的体外抗癌效果评价结果图。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。除特殊说明的之外,各实施例及试验例中所用的设备和试剂均可从商业途径得到。
下述实施例和试验例中采用的原料包括:
氯化铁(ⅱ)、氯化铁(ⅲ)、油酸、1m氢氧化钠溶液、盐酸、4',6-二脒基-2-苯基吲哚(dapi)、3-(4,5-二甲基咪唑-2-基)-2,5-二苯基溴化四氮唑(mtt),聚乙烯醇(pva,mw=30~70kda)、聚乳酸-乙醇酸(plga,摩尔比为50:50,mw=7000~17000)、n-羟基琥珀酰亚胺(nhs)、二环以及碳二亚胺(dcc)、二氯甲烷(dcm)、二甲基亚砜(dmso)、叶酸(fa)购自sigma;聚乙二醇胺(peg-diamine,mw=3400)购自laysanbio,inc。阿霉素(dox)购自北京华丰联合技术有限公司;细胞培养基(dulbecco改良的eagle培养基dmem)、青霉素、链霉素和胎牛血清(fbs)购自gibobrl(美国马里兰州)。所有化学试剂均为分析纯,无需进一步纯化即可使用,所有是溶液均可使用milli-q系统(美国马萨都塞州billerica的millipore)超纯水制备。
实施例1
本实施例制备载药磁性纳米气泡,其工艺流程参见附图1,具体操作步骤为:
a)制备plga-peg-fa高分子聚合物。
首先,用n,n'-二环己基碳二亚胺(dcc)和n-羟基琥珀酰亚胺(nhs)在二氯甲烷溶剂(dcm)中活化聚乳酸-乙醇酸(plga)24小时,然后与聚乙二醇二胺(peg-diamine)反应12小时,plga和peg-diamine高分子摩尔比1:2,两个反应步骤的产物都经过过滤提纯、滴入冰冷的二乙醚中沉淀、在真空下干燥,获得的plga-pe-nh2高分子溶解于二甲亚砜溶液(dmso)中,并在去离子水中透析(mwco:3.5kda)2天,冷冻干燥2天;
用n,n'-二环己基碳二亚胺(dcc)活化叶酸(fa),并逐滴的加入到plga-peg-nh2溶解的二甲亚砜溶液中(摩尔比为:plga-peg-nh2:fa:dcc=1:2:2.5)。在室温、氮气保护下反应12h,然后将该混合溶液在去离子水中透析(mwco:3.5kda)48h,去除未反应的叶酸,获得的plga-peg-fa高分子冷冻干燥2天;制备的plga-peg-fa的分子量为10000~20000g/mol;
b)制备缩水水性超顺磁铁作为磁性纳米颗粒:
用化学共沉淀法合成了疏水性超顺磁铁spio:将10mmol氯化铁(iii)和5mmol氯化铁(ii)溶解于24毫升盐酸水溶液(hcl1m)中,在干燥氮气保护下,将溶液滴加到含有3g油酸的naoh1m水溶液中,在80℃,机械搅拌60分钟,将黑色沉淀物进行磁分离,使用无水乙醇洗涤三次,然后分散在20ml二氯甲烷中。将溶液超生震荡10分钟,然后离心去除未分散的残留物(2000转/分,10分钟),制得spio,如图2所示,通过透射电子显微镜(tem)表征了spio的大小和形态,spio的tem图像呈现出球形形态,相对均匀尺寸范围为4至7nm;
c)制备磁性纳米气泡:
采用水/油/水(w/o/w)双乳液-溶剂蒸发法制备了磁性纳米气泡:通过搅拌将1mlspio二氯甲烷溶液与plga-peg-fa聚合物溶液(2ml二氯甲烷/100mg聚合物)混合,将0.3ml阿霉素(dox)溶液(10mgdox溶解于300ul去离子水)添加到有机相中,并超声乳化1分钟后添加到10ml聚乙烯醇(pva)溶液(5wt%)乳液中,然后在冰浴(icebath)中进一步超声处理5分钟,将所得双乳液稀释于50ml聚乙烯醇溶液(0.5wt%)在室温下机械搅拌12h,蒸发磁性纳米气泡中的残留二氯甲烷;离心后,除去上清液,用去离子水清洗沉淀;离心和洗涤过程重复三次;最后,在清洗后,将磁性纳米气泡冷冻干燥48小时,然后在干燥样品中充满全氟碳气体,并在4℃下保存。
本实施例磁性纳米气泡结构表征:
如图3所示,采用扫描电子显微镜表征本实施例制备的磁性纳米气泡显示出均匀的球形形态,没有聚集;如图4所示,采用透射电子显微镜表征本实施例制备的磁性纳米气泡,与spio的tem图像对比显示磁性纳米气泡中存在可见的黑点的灰色区域,表明磁性纳米气泡中负载有spio;图5为本实施例制备的磁性纳米气泡结构示意图,其中1代表fa、2代表peg、3代表plga、4代表dox(抗癌药物)、5代表c3f8气体;
采用zetasizernanozs90分析仪中通过dls方法测量对磁性纳米气泡的平均直径和尺寸分布,如图6所示为平均流体力学尺寸为208.4±12.58nm,尺寸范围为91.7nm至459nm。
在本发明的其他实施例中在制备载药多功能磁性纳米气泡过程中各原料用量可根据实际需求进行调整,其中控制plga和peg-diamine高分子摩尔比1:1~3,plga-peg-nh2和fa摩尔比为1:2,水/油/水(w/o/w)溶液体积比为0.5~2:5:10~25,以控制制备的磁性纳米气泡的尺寸分布及均匀性,结合实际需要调整负载的药物为dox之外的其他药物控制其负载量,并控制spio的负载量为5~30wt%。
在本发明的其他实施例中,还可以采用热分解方法制备疏水性磁性纳米颗粒,具体方法为:将fe(acac)3(3mmol)溶解于15ml苄基醚和15ml油酸胺中,将该溶液加热到110℃,在氮气保护下脱水1h,然后以20℃/min的加热速率快速加热至300℃,并在此温度下反应1h,将溶液冷却至室温,加入50毫升乙醇,然后离心,制得疏水性磁性纳米颗粒。。
试验例1本发明制备的磁性纳米气泡的超声波造影剂和磁共振造影剂性能评价
试验样品:阳性对照:空气;阴性对照:脱气去离子水;试验组:100mg/ml未负载spio的纳米气泡、200mg/ml未负载spio的纳米气泡、200mg/ml负载5.7wt%spio的磁性纳米气泡、200mg/ml负载12.1wt%spio的磁性纳米气泡、200mg/ml负载17.6wt%spio的磁性纳米气泡、200mg/ml负载25.4wt%spio的磁性纳米气泡、200mg/ml负载31.2wt%spio的磁性纳米气泡;其中纳米气泡和磁性纳米气泡均为按照上述实施例所述制备方法制备而成。
试验方法:将试验样品置于琼脂糖体膜孔中,获取空气、脱气去离子水和纳米气泡或不同spio浓度的磁性纳米气泡的超声图像,带有7.5mhzus传感器超声成像系统(alpinion医疗系统,e-cube-12r)被用作发送器和接收器,使用相同的仪器参数(机械指数,mi=0.1,增益=10db)采集所有超声图像,所有的mr成像研究均在philipsachieva3.0tmri扫描仪上进行,将磁性纳米气泡加入pbs(ph=7.4)稀释至最终铁浓度为0、0.025、0.05、0.1、0.2、0.4、1.2mm,并置于直径1厘米的离心管中,使用以下参数获得t2加权的图像,重复时间72毫秒,回波时间9毫秒,切片厚度为3.0毫米,还测量了感兴趣区域内的mr信号强度。
试验结果:如图7中的图(a)和(b)所示,将空气和脱气去离子水用作阳性和阴性对照,磁性纳米气泡表现出明显的增强对比度的超声信号效果,通过增加磁性纳米气泡的浓度可以提高超声信号强度,此外,通过将spio含量增加到17.6wt%,超声信号被进一步逐渐增强到129(灰度值),当spio含量超过17.6wt%时,由于spio影响了气泡状结构的形成以及减少了全氟化碳气体的封装量,超声信号强度急剧下降,并且由于磁性纳米气泡的高磁性和出色的生物相容性,使其具备优越的t2加权mr成像对比剂功能。t2加权mr成像数据显示,如图7中(c)图,随着铁浓度的增加,磁性纳米气泡可能会削弱mr图像的信号强度。如图7中(d)评估了弛豫率,以评估磁性纳米气泡的mr对比能力,t2弛豫率计算为109.18mm-1s-1,足以进行进一步的动物mr成像。
试验例2磁性纳米气泡靶向传递药物的性能和fus触发下的药物释放性能
试验样品:负载有dox的磁性纳米气泡mf-mnb;未负载dox的磁性纳米气泡puremf-mnb,均按照上述实施例所述方法制备而成。
试验方法及结果:
1)分别取相应的样品,分别分散在5mlpbs溶液(ph=7.4)中,并分别转移至透析袋(mwco:3500da)中,将透析袋分别置于装有50mlpbs的容器中,fus处理3分钟后在室温下150rpm摇动,从每个样品中分别取出1ml处理后的样品,并保存在-20℃进行进一步分析,将1ml新鲜pbs加回容器中以保持恒定体积;使用紫外可见分光光度计分析每个实验组样品中的dox浓度,计算释放dox的累积速率作为时间的函数。并按照上述同样的方法处理对照组样品,不进行fus触发作用对照组,结果如图8所示,
2)通过共聚焦激光扫描显微镜和icp-oes定量分析法评价叶酸(fa)分子和fus介导的磁性纳米气泡对药物释放和传递效果的增强作用:
将4t1细胞以每孔105个细胞的密度(每孔表面积为1.7cm2)的密度接种到培养玻片上,并在37℃孵育24小时。然后,将介质替换为对照组1:游离的dox(doxonly),对照组2:负载dox磁性纳米气泡+阻断fa受体(mf-mnb+fablocking),对照组3:负载dox磁性纳米气泡+不进行fus触发(mf-mnb),实验组:负载dox磁性纳米气泡+fus触发(mf-mnb+fus),将特定组用fus处理5分钟,并在37℃下孵育2小时,用pbs洗涤细胞,用dapi染色细胞核,并用4%甲醛溶液固定及再次漂洗。最后,使用共聚焦激光扫描显微镜观察细胞内荧光信号强度,如图9的(a)图所示。
将2×1044t1细胞接种到48孔板中,孵育过夜以进行细胞附着:部分4t1细胞用高剂量的游离fa预处理4小时以阻断fa受体,然后将细胞与磁性纳米气泡孵育4小时以允许磁性纳米气泡的细胞内专递,并将fus应用于相应的样本3分钟以进一步增强药物的传送和释放,随后,将细胞用冰冷的pbs洗涤三次,将500μl放射免疫沉淀测定裂解和提取缓冲液添加到每个孔中,并孵育30分钟以允许从细胞中提取裂解物,通过icp-ods分析细胞裂解中铁含量,如图9的(b)图所示,分别以阻断fa受体和未fus触发药物释放为对照组,并根据进行的标准牛血清蛋白测定测量细胞裂解物中蛋白质含量。
3)评估fus触发的磁性纳米气泡的细胞裂解效率:通过标准mtt细胞增殖测定法确定的细胞毒性,将4t1乳腺癌细胞以每孔1×104细胞的密度接种到96孔板中,并孵育24小时以进行细胞附着,设置实验组和对照组,其中对照组1:无磁性纳米气泡无fus处理(con),对照组2:未负载药物磁性纳米气泡(puremf-mnb),对照组3:无磁性纳米气泡仅fus处理(fusonly),对照组4:阻断fa受体的负载dox的磁性纳米气泡(mf-mnb+fablocking),对照组5:无fus触发的负载dox的磁性纳米气泡(mf-mnb),对照组6:游离的dox(doxonly),实验组:负载dox的磁性纳米气泡+fus触发(mf-mnb+fus),对照组和实验组分别为将用过的培养基替换为相应的试验样品溶液(dox浓度为10μg/ml)12小时后,将细胞孔置于37℃的样品架上,并通过聚焦超声触发该组3分钟,进一步温育12小时后,除去上清液,然后将孔用pbs洗涤两次,并与含有mtt的dmem一起温育另外4小时,除去mtt溶液,并加入dmso以溶解细胞用于光谱测量,用酶标仪测量570nm处的吸光度。如图10所示。
试验结果显示,使用共聚焦显微镜成像观察了游离dox和负载dox的磁性纳米气泡在4t1细胞中的分布以及fus增强细胞内在化及细胞内药物控释效应,游离dox在细胞核内显示出明显的红色荧光,这可能是因为像dox这样的小分子可以直接扩散到细胞中,磁性纳米气泡产生的dox荧光主要在核周细胞质中观察到,当与带有fa阻断剂的磁性纳米气泡组相比时,磁性纳米气泡处理的组表现出更强的的荧光信号。这些结果表明磁性纳米气泡通过fa受体介导的靶向4t1肿瘤细胞。fus处理后,由于声穿孔效应和fus触发引起的快速药物释放,强烈的红色荧光在细胞质和细胞核中积累;
通过定量细胞内铁的积累,进一步评估了fa受体介导靶向作用和fus处理对磁性纳米气泡细胞吸收的增强作用。以fa受体为靶点,磁性纳米气泡的细胞内化显著增强,带有磁性纳米气泡的4t1细胞中的铁浓度达到178μmol/mg蛋白,而被fa受体阻断剂的4t1细胞中的铁浓度仅为120μmol/mg蛋白,通过fus触发可将细胞摄取进一步增强至202μmol/mg蛋白,归因于肿瘤细胞膜通透性的提高。
通过mtt测定进一步评估各形式的细胞毒性,通过未负载dox的纯磁性纳米气泡或fus处理,细胞活力没有明显变化,磁性纳米气泡具有比具有fa受体阻断作用的磁性纳米气泡明显更高的抗癌作用,并且在24小时内细胞活力进一步降低至18.5%,fus处理归因于细胞吸收增加以及从磁性纳米气泡快速释放dox。这些结果表明,所制造的磁性纳米气泡可以通过fa受体介导的肿瘤细胞靶向和fus处理有效杀死癌细胞。
通过上述试验例的试验结果表明,本发明制备的针对叶酸受体的磁性纳米气泡,用于超声和mr成像造影剂以及fus触发的药物递送,磁性纳米气泡可以稳定地将17.6wt%的spio纳米颗粒捕获到聚合物壳中,表现出出色的生物相容性,以超过64%的效率将药物加载到核中。由于气泡壳中密集聚集的spio纳米粒子提供出色的磁性和增强us信号,磁性纳米气泡表现出了优异的us和mr成像对比剂功能。此外,通过fus触发,在2天之内将近一半的药物释放时间缩短了近3倍,磁性纳米气泡的药物释放增加了22%,通过fa受体靶向和fus处理,细胞摄取提高了100%以上。最后,用mtt法评估了具有fa配体和fus超声处理的磁性纳米气泡的细胞毒性,在24小时内细胞存活率显著降低了18.5%。因此,本发明提供的多功能磁性纳米气泡是一种非常具有前景的纳米药物载体,可用于us和mr成像造影剂和fus触发的药物递送,以及进一步有效的癌症治疗。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!