纳多洛尔缓释注射剂及其制备方法与流程
1.本发明属于治疗高血压和心绞痛的注射剂领域,特别是一种纳多洛尔缓释注射剂。
背景技术:
2.纳多洛尔是一种白色或几乎白色结晶性粉末的化学品,微溶于水,易溶于乙醇。纳多洛尔作为一种心血管药,临床上主要用于治疗高血压、心绞痛、心律失常、甲状腺功能亢进症、偏头痛等病症。近年来,有报道将纳多洛尔替代普萘洛尔,能够有效缓解改善因服用普萘洛尔治疗婴幼儿血管瘤导致的睡眠障碍问题。目前的纳多洛尔药物产品,大多数为片剂,例如普通片剂、包衣片、肠溶片、缓释片等。然而片剂需要用水吞服,服用条件有限制,患者的顺应性不高。
3.注射剂相比于口服剂,不经过消化系统和肝脏而直接注入人体组织,不会受到消化液的破坏和食物的影响,所以计量更准确,吸收更快,药效更迅速。
4.现有的注射剂型中,例如cn107496382a提供了一种复合纳米囊-可注射水凝胶双重载药缓释体系,将包封药物的纳米囊分散在水凝胶中,加入乳化剂,形成水/油/水乳液,作为注射剂能提高药物稳定性,控制药物释放。然而这种方式更适合于水溶性的药物,对于不溶于水或微溶于水的药物,不能起到良好的缓释效果。又例如cn102772362a提供了一种提高生物利用度的氧化石蒜碱组合物及其制剂,先将氧化石蒜碱与油酸形成复合物,然后使用表面活性剂、脂类制备成纳米脂质体注射剂。采用上述方法在应用于纳多洛尔的注射剂时不能获得较好的缓释效果。
技术实现要素:
5.针对以上现有技术的不足,本发明提供了一种纳多洛尔缓释注射剂,具体通过以下技术实现。
6.纳多洛尔缓释注射剂,包括以下组分:纳多洛尔脂质体0.8-1.5wt%、聚卡波非 0.01-0.05wt%、表面活性剂0.05-0.2wt%、水凝胶材料1.8-2.5wt%,剩余为去离子水;
7.所述纳多洛尔脂质体的制备方法为:将粒径为10-50nm的纳多洛尔、乙烯-醋酸乙烯共聚物分别溶解于有机溶剂中,混合后第一次超声处理得到乳液ⅰ,超声处理参数为 40-80w,处理时间20-60s;将乳液ⅰ、油酸、泊洛沙姆加至去离子水中第二次超声处理,超声处理参数为60-100w,处理时间40-100s;然后去除有机溶剂,冷冻干燥得到纳多洛尔脂质体。
8.优选地,包括以下组分:纳多洛尔脂质体1wt%、聚卡波非0.04wt%、表面活性剂0.15wt%、水凝胶材料2.2wt%,剩余为去离子水。
9.优选地,纳多洛尔、乙烯-醋酸乙烯共聚物、油酸和泊洛沙姆的用量比例为 1:2-5:5:3-5。
10.更优选地,纳多洛尔、乙烯-醋酸乙烯共聚物、油酸和泊洛沙姆的用量比例为 1:3:5:4.5。
11.优选地,所述水凝胶材料为海藻酸及其无机盐、聚丙烯酰胺或其衍生物。水凝胶材料可以选用海藻酸、海藻酸盐中的任意一种或同时使用两种,同时还使用聚丙烯酰胺、聚丙烯酰胺衍生物中的任意一种或同时使用两种。
12.更优选地,所述水凝胶材料中,海藻酸及其无机盐、聚丙烯酰胺或其衍生物的用量比例为1:2-4。
13.进一步优选地,所述水凝胶材料中,海藻酸及其无机盐、聚丙烯酰胺或其衍生物的用量比例为1:3.5。
14.本发明还提供了上述纳多洛尔缓释注射剂的制备方法,包括以下步骤:
15.s1、制备纳多洛尔脂质体,将纳多洛尔脂质体、水凝胶材料、表面活性剂、40%重量的去离子水搅拌均匀;
16.s2、取加入聚卡波非和剩余60%重量的去离子水中搅拌均匀;
17.s3、将步骤s1所得溶液倒入步骤s2所得溶液中,搅拌均匀制成注射剂成品。
18.优选地,步骤s1中的搅拌速度为800-1000rpm,搅拌时间30-60min。
19.优选地,步骤s2和s3中的搅拌速度均为100-200rpm,搅拌时间30-60min,步骤s2 中的搅拌温度为40-60℃,步骤s3中的搅拌温度为常温。
20.与现有技术相比,本发明的有益之处在于:本发明提供的纳多洛尔缓释注射剂,采用由乙烯-醋酸乙烯共聚物、油酸形成双层结构的纳多洛尔纳米缓释微粒,局部皮下注射后缓释效果好。
附图说明
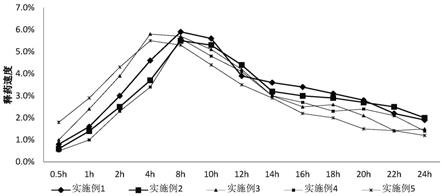
21.图1为实施例1-5制备的纳多洛尔缓释注射剂的释药曲线图;
22.图2为对比例2-4制备的纳多洛尔缓释注射剂的释药曲线图。
具体实施方式
23.下面将对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
24.以下实施例和对比例除非有特殊说明,所用的原料具体为以下几种:泊洛沙姆采用泊洛沙姆188,丙烯酸树脂采用丙烯酸树脂ⅰ号。
25.以下实施例和对比例除非有特殊说明,否则纳多洛尔脂质体的制备方法均为:将粒径为50nm左右的纳多洛尔、乙烯-醋酸乙烯共聚物分别溶解于有机溶剂中,混合后第一次超声处理得到乳液ⅰ,超声处理参数为60w,处理时间40s;将乳液ⅰ、油酸、泊洛沙姆188 加至去离子水中第二次超声处理,超声处理参数为100w,处理时间60s;然后去除有机溶剂,冷冻干燥得到纳多洛尔脂质体。
26.以下实施例和对比例除非有特殊说明,否则纳多洛尔缓释注射剂的制备方法如下:
27.s1、制备纳多洛尔脂质体,将纳多洛尔脂质体、水凝胶材料、表面活性剂(泊洛沙姆 188)、40%重量的去离子水常温搅拌均匀,搅拌速度为1000rpm,搅拌时间30min;
28.s2、取加入聚卡波非和剩余60%重量的去离子水中搅拌均匀,搅拌速度为200rpm,
搅拌时间40min,搅拌温度50℃;
29.s3、将步骤s1所得溶液倒入步骤s2所得溶液中,常温搅拌均匀制成注射剂成品,搅拌速度为100rpm,搅拌时间30min。
30.实施例1
31.本实施例提供的纳多洛尔缓释注射剂,包括以下组分:纳多洛尔脂质体1wt%、聚卡波非0.04wt%、表面活性剂0.15wt%、水凝胶材料2.2wt%,剩余为去离子水;
32.其中,纳多洛尔脂质体在制备时,所用的纳多洛尔、乙烯-醋酸乙烯共聚物、油酸和泊洛沙姆188的用量比例为1:3:5:4.5。
33.实施例2
34.本实施例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,纳多洛尔脂质体在制备时,所用的纳多洛尔、乙烯-醋酸乙烯共聚物、油酸和泊洛沙姆188的用量比例为1:2:5:5。
35.实施例3
36.本实施例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,纳多洛尔脂质体在制备时,所用的纳多洛尔、乙烯-醋酸乙烯共聚物、油酸和泊洛沙姆188的用量比例为1:5:5:3。
37.实施例4
38.本实施例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,所述水凝胶材料中,海藻酸钠、聚丙烯酰胺的用量比例为1:2。
39.实施例5
40.本实施例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,所述水凝胶材料中,海藻酸钠、聚丙烯酰胺的用量比例1:4。
41.对比例1
42.本对比例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,纳多洛尔脂质体的制备方法中未加入油酸,具体为:将粒径为50nm左右的纳多洛尔、乙烯-醋酸乙烯共聚物分别溶解于有机溶剂中,混合后第一次超声处理得到乳液ⅰ,超声处理参数为60w,处理时间40s;将乳液ⅰ、泊洛沙姆188加至去离子水中第二次超声处理,超声处理参数为100w,处理时间60s;然后去除有机溶剂,冷冻干燥得到纳多洛尔脂质体。所用的纳多洛尔、乙烯-醋酸乙烯共聚物和泊洛沙姆的用量比例为1:3:4.5。
43.对比例2
44.本对比例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,纳多洛尔脂质体的制备方法中未加入乙烯-醋酸乙烯共聚物,具体为:将粒径为50nm 左右的纳多洛尔、油酸、泊洛沙姆188加至去离子水中超声处理,超声处理参数为100w,处理时间60s;然后冷冻干燥得到纳多洛尔脂质体。所用的纳多洛尔、油酸和泊洛沙姆的用量比例为1:5:4.5。
45.对比例3
46.本对比例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,所述水凝胶材料全部为海藻酸钠。
47.对比例4
48.本对比例提供的纳多洛尔缓释注射剂,与实施例1所用的组分及用量相同,不同之处在于,所述水凝胶材料全部为聚丙烯酰胺。
49.应用例1:实施例1-5和比较例1-4制备的纳多洛尔缓释注射剂的稳定性
50.将实施例1-5和比较例1-4制备的纳多洛尔缓释注射剂于室温静置1个月,观察期外观变化,结果如下表1。
51.表1实施例1-5和比较例1-4的纳多洛尔缓释注射剂室温静置1个月后的外观
52.组名室温静置1个月后的外观实施例1均匀澄清透明,液面未见分层,稳定实施例2均匀澄清透明,液面未见分层,稳定实施例3均匀澄清透明,液面未见分层,稳定实施例4均匀澄清透明,液面未见分层,稳定实施例5均匀澄清透明,液面未见分层,稳定比较例1澄清透明,有轻微分层,不稳定比较例2均匀澄清透明,液面未见分层,稳定比较例3均匀澄清透明,液面未见分层,稳定比较例4均匀澄清透明,液面未见分层,稳定
53.通过表1的结果表明,采用本发明的技术方案制备的纳多洛尔缓释注射剂样品稳定,对比例1制备的注射剂由于未使用油酸包覆在纳多洛尔表面形成水包油结构,1个月后就出现轻微分层现象,稳定性不好。
54.应用例2:实施例1-5和比较例2-4制备的纳多洛尔缓释注射剂的体外释放试验
55.对实施例1-5和比较例2-4制备的纳多洛尔缓释注射剂进行体外释放试验,通过扩散池做药物释放试验,采用5μm的人造纤维膜作为渗透材料,以25%乙醇溶液作为接收介质,供给室给药量为0.2ml,接收池体积7ml,有效渗透面积为3.14cm2。将扩散池置于恒温水浴槽(37℃
±
0.5℃)中,磁力搅拌器置于恒温水浴槽下,搅拌速度为350r/min。分别于第0.5h、1h、2h、4h、8h、10h、12h、14h、16h、18h、20h、24h,取出5ml接收液,同时补以同体积的空白接收液。将取得的样品进行离心,取上清液,通过液相色谱法分析接收液,以某段时间的释药量占药物总量的百分比,除以这段释药时间得到释药速度。
56.释药速度的具体计算方法为:假设药物的总量为w,0.5h时药物的释放量为w0,1h时药物累积释放量为w1,则0.5h时药物的释放速度为w0/(0.5w),1h时药物的释放速度为 (w1–
w0)/(0.5w)。需要说明的是,w0/(0.5w)中的0.5是30min,即0.5h;(w1–
w0)/(0.5w) 中的0.5是1h
–
0.5h=0.5h。绘制实施例1-5和比较例2-4的纳多洛尔缓释注射剂的释药曲线图,分别如图1、2所示。
57.由图1可以发现,实施例1制备的纳多洛尔缓释注射剂,在给药后释药速度不断提升,大约在第8-10h之间的某个时刻达到释药速度峰值,随后释药速度缓慢下降。实施例2-5 制备的纳多洛尔缓释注射剂也同样出现了释药速度峰值,只不过出现释药速度峰值的时间或早或晚,释药速度峰值峰值比实施例1略低,但与实施例1出现释药速度峰值出现的时间相差不大,不超过2h。
58.由图2可以发现,当(对比例2)纳多洛尔脂质体制备时未加入乙烯-醋酸乙烯共聚物时,释药速度峰值出现的不明显,大约在4h左右有一个略微突出的释药速度峰值,且释药
速度峰值相对较低。当(对比例3)注射剂中,水凝胶材料全部由海藻酸钠组成时,释药速度提升缓慢,其释药速度峰值也不明显,大约在10h左右达到峰值。当水凝胶材料全部由聚丙烯酰胺组成时,在第2h就达到释药速度峰值,然后释药速度快速下降。
59.通过图1、2的实施例1-5和比较例2-4制备的纳多洛尔缓释注射剂的释药速度变化趋势可以获知,纳多洛尔脂质体中,油酸和乙烯-醋酸乙烯共聚物的比例,以及存在与否,对释药速度峰值的出现时间和数值大小都具有一定影响,特别是缺少某一个原料时,会影响纳多洛尔脂质体的稳定性、释药速度。当水凝胶材料中海藻酸钠、聚丙烯酰胺的用量比例变化,或者缺少某一种原料时,会对释药速度峰值出现的时间产生影响,还会一定程度影响释药速度峰值的数值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1