用于使用荧光成像来确定损伤灶深度的系统和方法与流程
用于使用荧光成像来确定损伤灶深度的系统和方法
1.本申请是申请号为201480062665.3的中国专利申请的分案申请,原申请是2014年11月14日提交的pct国际申请pct/us2014/065774于2016年5月16日进入中国国家阶段的申请。
2.相关申请
3.本申请要求于2014年11月14日提交的美国申请序列号14/541,991的权益和优先权,并且要求于2013年11月14日提交的美国临时申请序列号61/904,018的权益和优先权,二者的全部内容通过引用整体并入本文。
技术领域
4.本公开内容总体上涉及将消融能量应用到身体以形成治疗性损伤灶(lesion)的医学过程。具体地,本公开内容涉及用于对损伤灶和组织进行成像以确定损伤灶深度的系统和方法。
背景技术:
5.房颤(atrial fibrillation,af)是世界上最常见的持续性心率失常,其目前影响数百万人。在美国,预计到2050年af会影响一千万人。af与死亡率、发病率的提高相关,会影响生活质量,并且是中风的独立风险因素。罹患af的实质性终生风险加重了疾病的公共卫生负担,其仅在美国就达到超过七十亿美元的年治疗费用。
6.已知患有af的患者中的大部分发作是被从延伸到肺静脉(pv)中的肌袖内产生的局灶性电活动触发的。房颤还可以被上腔静脉或其他心房结构(即心脏的传导系统内的其他心脏组织)内的局灶性活动触发。这些局灶性触发还可以引起由折返电活动(或转子)驱动的房性心动过速,然后其可以分段成作为房颤特征的多个电小波。此外,长期的af可以引起心脏细胞膜中的功能改变,而这些改变进一步使房颤延续。
7.射频消融(radiofrequency ablation,rfa)、激光消融和冷冻消融是由医师用来治疗房颤而使用的基于导管的标测(map)和消融系统的最常见的技术。医师使用导管来引导能量以破坏局灶性触发物或者形成将触发物与心脏的其余传导系统隔离的电隔离线。后一种技术通常被使用在所谓的肺静脉隔离(pvi)中。但是,af消融方法的成功率一直保持相对停滞,据估计该方法后一年复发率高达30%至50%。导管消融之后的复发的最常见原因是pvi线中的一个或更多个间隙(gap)。所述间隙通常是由于无效消融或不完全消融的结果,无效消融或不完全消融在该方法过程中可以暂时阻断电信号,但是会随着时间而愈合并且促进房颤的复发。
8.因此,需要形成并验证适当的消融,减少荧光镜检查时间,并降低心律失常发生率,从而改善效果和降低成本。
技术实现要素:
9.根据本公开内容的一些方面,提供了用于确定消融部位之深度的方法,所述方法
包括:照射具有损伤灶部位的心脏组织;沿着跨过所述损伤灶部位的第一行(line)从经照射心脏组织获得线粒体烟酰胺腺嘌呤二核苷酸氢(nadh)荧光强度;基于所述nadh荧光强度沿着所述第一行来创建所述损伤灶部位之深度的2维(2d)图;以及由所述2d图来确定沿着所述第一行的选定点处所述损伤灶部位的深度,其中较低的nadh荧光强度对应于所述损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
10.在一些实施方案中,所述方法还包括通过消融来在心脏组织中形成损伤灶部位。获得步骤可以包括:检测来自经照射组织的nadh荧光;由所述nadh荧光来创建所述损伤灶部位的数字图像,所述数字图像包含多个像素;以及确定沿着跨过所述损伤灶部位的行之所述多个像素的nadh荧光强度。在一些实施方案中,所述方法还包括:基于来自所述损伤灶部位和健康组织的所述nadh荧光的量来在所述数字图像中区分所述损伤灶部位和所述健康组织;以及基于代表所述健康组织的像素的nadh荧光强度来对所述数字图像进行归一化。
11.在一些实施方案中,检测步骤包括通过约435nm至485nm的带通滤光器(filter)来对所述nadh荧光进行滤光。在一些实施方案中,所述健康组织具有较亮的外观,而所述损伤灶部位具有较暗的外观。创建步骤可以包括沿着跨过所述损伤灶部位的所述行绘制nadh荧光强度,以创建所述损伤灶部位之深度的2d图。
12.在一些实施方案中,所述方法还包括:沿着跨过所述损伤灶部位的第二行从经照射心脏组织获得nadh荧光强度;基于所述nadh荧光强度沿着所述第二行来创建所述损伤灶部位之深度的2d图;以及由沿着所述第一行的2d图和沿着所述第二行的2d图来构建所述损伤灶部位的3维(3d)图像。在一些实施方案中,可以沿着跨过所述损伤灶部位宽度的垂直线多次重复所述获得、创建和确定步骤,所述深度的每个2d图平行于沿着所述损伤灶部位长度的所述第一行;以及整合垂直线上所述损伤灶部位深度的各2d图中的每个,以重建所述损伤灶部位之深度的3d图像。
13.所述确定步骤可以包括应用范围从全黑到全白的像素灰阶。所述方法可以用于分析心外膜组织、心内膜组织、心房组织和心室组织。
14.在一些实施方案中,所述照射步骤包括使用激光器产生的uv光来照射心脏组织,其中激光器产生的uv光的波长可为约300nm至约400nm。
15.根据本公开内容的一些方面,提供了用于对心脏组织进行成像的系统,所述系统包含:照射装置,所述照射装置被配置成照射具有损伤灶部位的组织以激发所述组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);成像装置,所述成像装置被配置成检测来自经照射组织的nadh荧光;以及控制器,所述控制器与所述成像装置通信,编程所述控制器以沿着跨过所述损伤灶部位的第一行从经照射组织获得nadh荧光强度;基于所述nadh荧光强度沿着所述第一行来创建所述损伤灶部位之深度的2维(2d)图;以及由所述2d图来确定沿着所述第一行的选定点处所述损伤灶部位的深度,其中较低的nadh荧光强度对应于所述损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
16.根据本公开内容的一些方面,提供了用于对心脏组织进行成像的系统,其包含:导管,所述导管具有远端区域和近端区域;光源;光纤,所述光纤从所述光源延伸到所述导管的所述远端区域,以照射靠近所述导管远端的具有损伤灶部位的组织,以激发所述组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);图像束(image bundle),所述图像束用于检测
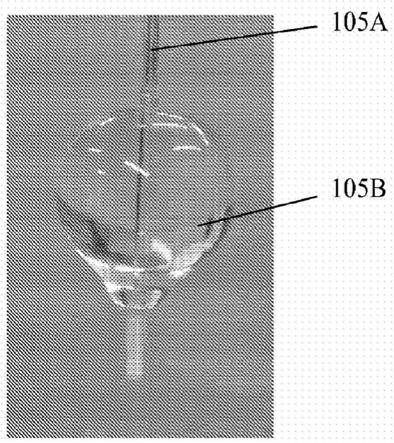
来自经照射组织的nadh荧光;连接至所述图像束的照相机,所述照相机被配置成接收来自所述经照射组织的所述nadh荧光,并且产生经照射组织的数字图像,所述数字图像包含多个像素;以及控制器,所述控制器与所述照相机通信,所述控制器被配置成由所述数字图像来确定沿着跨过所述损伤部位的第一行之所述多个像素的nadh荧光强度;基于所述nadh荧光强度沿着所述第一行来创建所述损伤部位之深度的2d图;以及由所述2d图来确定沿着所述第一行的选定点处所述损伤灶部位的深度,其中较低的nadh荧光强度对应于所述损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
附图说明
17.将参照附图对目前公开的实施方案进行进一步解释,在附图中,贯穿若干视图,相同的结构由相同的数字表示。所示的附图并非一定按比例绘制,而是通常着重于说明目前公开的实施方案的原理。
18.图1a是本公开内容的一种实施方案系统的系统结构图。
19.图1b是本公开内容的一种实施方案系统的框图。
20.图1c是示出了适于与本公开内容的系统和方法一起使用的一个示例性计算机系统的图。
21.图2是根据本公开内容的一个实施方案的专用导管的视图。
22.图3是根据本公开内容的一个方面的充气(inflate)导管球囊(balloon)和稍端(tip)的特写照片。
23.图4a是根据本公开内容的一种方法的流程图。
24.图4b是根据本公开内容的一种方法的流程图。
25.图4c至图4f示出了根据本公开内容的沿着单行进行的深度分析。
26.图4g和图4h示出了根据本公开内容的形式为3d的深度分析,其中通过fnadh对两个消融损伤灶和损伤灶间间隙进行成像。
27.图5a和图5b是健康心脏组织(图5a)和经消融心脏组织(图5b)的发射波长的并列式图;
28.图6a和图6b是白光照射下的心脏损伤灶(图6a)和由于uv光的照射而产生的nadh荧光(图6b)的并列式图像比较。
29.图7a是示出了uv照射下观看的示出损伤灶直径测量的心外膜图像的照片。
30.图7b是图7a中同一损伤灶的直径测量的、但是通过氯化三苯基四氮唑(ttc)染色的照片。
31.图7c是发荧光的损伤灶和经ttc染色的损伤灶之损伤灶尺寸直径测量的相关性的图。
32.图8a是损伤灶深度与nadh荧光的相关性的图。
33.图8b是通过用ttc染色而揭示的两个损伤灶的直径测量的照片。
34.图8c是fnahd可视化损伤灶的直径测量的照片。
35.图8d是图8c的反信号(inverted signal)。
36.图9是将损伤灶深度与反nadh荧光强度相比较的经编译(complie)数据的图。
37.图10是损伤灶深度的3d重建。
38.图11是nadh荧光强度相对于随消融持续时间(时间)而变化的损伤灶深度的图。
39.图12a和图12b分别举例说明了通过冷冻消融形成的损伤灶和损伤灶的3d图。
40.图12c和图12d分别举例说明了通过射频消融形成的损伤灶和损伤灶的3d图。
41.图12e和图12f分别举例说明了三个不同的损伤灶和示出所述损伤灶之对应深度的物理关系的3d图。在3
‑
d重建图像上举例说明了损伤灶间间隙。
42.图13a是通过冷冻探针形成的损伤灶的图像。
43.图13b是图13a之损伤灶的放大。
44.图13c是通过图13a的冷冻探针形成的损伤灶的3d图。
45.图14示出了与通过ttc分析测量的实际损伤灶深度以相反的方式相关的心外膜fnadh强度的图。
46.尽管上述附图示出了目前公开的实施方案,但正如论述中所指出的,还可以考虑其他实施方案。本公开内容通过代表性而非限制性的方式呈现了说明性实施方案。本领域技术人员可以设计出落入当前所公开实施方案之原理的范围和精神内的许多其他修改和实施方案。
具体实施方式
47.本公开内容总体上涉及将射频、激光或冷冻消融能量应用到身体以形成治疗性损伤灶的医学过程。具体地,本公开内容涉及可以使用线粒体烟酰胺腺嘌呤二核苷酸氢(nadh)荧光(fnadh)来对心脏损伤灶和组织进行成像的系统和方法。可以在房颤(af)的治疗过程中使用本系统和方法。具体地,本公开内容涉及用于通过分析nadh荧光强度数据来生成损伤灶深度图以确定损伤灶深度的系统和方法。在一些实施方案中,本系统和方法可以用于确定心脏组织(心外膜组织、心内膜组织、心房组织和心室组织)中损伤灶的深度。但是,当前所公开的方法和系统还可以应用于分析其他组织类型中的损伤灶。可以在消融过程中通过消融来产生待分析的损伤灶。在一些实施方案中,还可以使用本文中所公开的方法和系统来分析通过消融或通过其他手段产生的已有损伤灶。
48.根据本公开内容的一些方面,可以实时地对心脏组织中的内源性nadh荧光(fnadh)进行成像,以鉴定消融的区域和未消融的区域。可以使用fnadh成像来鉴定消融的区域之间的间隙,并且然后可以对间隙进行消融。成像可以在消融过程中进行,并且不需要另外的化学物质,如造影剂(contrast agent)、示踪剂或染料。
49.在一些实施方案中,可以测量荧光的强度并且绘制荧光强度,其中最低荧光(最暗)对应于最深的经消融损伤灶,而最高荧光(最亮)对应于未消融或健康的组织。明和暗两端之间的任何灰度水平通常对应于组织损伤灶深度的程度。当前所公开的系统和方法可以用于基于在对组织进行消融并且使用fnadh系统对组织进行成像之后获得的像素强度来确定损伤灶深度。在一些实施方案中,可以将相关的深度数据整合进向医师提供关于损伤灶几何形状和质量之及时反馈的损伤灶的3d重建。因此,本公开内容通过在进行该过程时向医师提供损伤灶深度信息来解决当今的已知技术和方法的缺乏损伤灶质量反馈的问题。例如,具有深度信息可以用于后续的诊断和治疗。在进行消融过程(具体地肺静脉隔离过程)中,多个目的中的至少一个目的是递送足够深以具有持久结果并且提高手术的成功率的消融损伤灶。在该过程中,最佳的是消融损伤灶没有间隙并且每个损伤灶已经覆盖足够的深
度。这被称为透壁损伤灶(transmural lesion)(其表示不破坏心脏外侧的组织或对心脏造成穿孔),以使得在该过程时使用深度信息从而帮助操作员进行足够深以提供适当的结果和更持久结果的更好的损伤灶。此外,所产生的损伤灶在很大程度上依赖于所使用的消融工具,如rfa(标准或灌注)、冷冻(导管或球囊)以及激光,它们全部都产生不同形状的损伤灶。克服所产生的损伤灶依赖于所使用的消融工具是一个挑战,这使得每个消融工具导致具有不同的深度,其中一些深度比其他深度更深。在进行消融过程中,不存在最小深度数字,其可以取决于若干因素,如正被消融的区域,心房比心室薄或一些其他因素。例如,2mm的深度对于心房组织而言可以是最佳的,但是对于心室组织而言可以是不良的,然而,每个患者将会具有不同厚度的组织并且需要具体的关注。
50.如上面所提到的,高质量且可验证的损伤灶可以是消融过程的成功和避免复发的关键因素中的至少一些关键因素。有质量的损伤灶可以具有足够的深度并且造成从心脏的心内膜表面到心外膜表面的细胞的完全坏死(即透壁),同时使对以外的非心脏结构的损坏最小化。然而,当前所公开的标测系统以及系统和方法的其他方面在由消融产生的细胞损伤的程度以及确实地验证损伤灶的整体性方面提供反馈。因此,通过在进行该过程时向医师提供损伤灶可视化以及损伤灶深度信息,当前所公开的实施方案尤其解决了当今已知技术的缺乏损伤灶质量反馈的问题。
51.参见图1a和图1b,本公开内容的消融可视化系统(ablation visualization system,avs)可以包含:患者体外的光源130a(如uv激光器),和用于将光从光源输送到患者体内的光装置或光输送光纤130b;具有适当的滤光(在需要的情况下)的照相机135a和连接到照相机的图像束135b;以及在其处理器或控制器上具有图像处理软件的具有一个或更多个显示器140a(针对技术人员)和140b(针对医师)的计算机系统140。
52.作为实例,图1c示出了典型的处理结构的图,其可以结合本公开内容的方法和系统来使用。计算机处理装置200可以耦接至显示器212以用于图形输出。处理器202可以是能够执行软件的计算机处理器204。典型的实例可以是计算机处理器(如或处理器)、asic、微处理器等。处理器204可以耦接至内存206,其通常可以是用于存储指令和数据同时处理器204执行的易变(volatile)ram内存。处理器204还可以耦接至存储装置208,其可以是非易变存储介质,如硬盘驱动器、闪存驱动器、磁带驱动器、dvdrom或类似的装置。尽管没有示出,计算机处理装置200通常包括多种形式的输入和输出。i/o可以包括网络适配器、usb适配器、蓝牙无线电设备、鼠标、键盘、触摸板、显示器、触摸屏、led、振动设备、扬声器、麦克风、传感器、或者用于与计算机处理装置200一起使用的任何其它输入或输出装置。处理器204还可以耦接至其他类型的计算机可读介质,包括但不限于能够向处理器(如处理器204)提供计算机可读指令的电子、光学、磁或其他存储或传输装置。多种其他形式的计算机可读介质可以向计算机传输指令或者将指令携带到计算机,包括路由器、专用或公共网络或者有线和无线的其他传输装置或通道。指令可以包括来自任何计算机编程语言(包括例如c、c++、c#、visual basic、java、python、perl和javascript)的代码。
53.程序210可以是包含指令和/或数据的计算机程序或计算机可读代码,并且可以被存储在存储装置208上。指令可以包括来自任何计算机编程语言(包括例如c、c++、c#、visual basic、java、python、perl和javascript)的代码。通常情况下,处理器204可以将程序210的指令和/或数据中的一些或全部指令和/或数据加载到内存206中以用于执行。程序
210可以是任何计算机程序或进程,包括但不限于网页浏览器166、浏览器应用程序164、地址登记进程156、应用程序142或任何其他计算机应用或进程。程序210可以包括多种指令和子程序,在被加载到内存206中并且被处理器204执行时,所述多种指令和子程序使处理器204执行多种操作,这些操作中的一些或全部可以实现本文中所公开的用于管理医疗护理的方法。程序210可以被存储在任何类型的非临时性计算机可读介质(例如但不限于硬盘驱动器、可移动驱动器、cd、dvd或任何其他类型的计算机可读介质)上。
54.有可能的是,光源130a可以包含车(cart)132。在一些实施方案中,系统还可以包含专用导管105a,其包含可充气球囊105b。在一些实施方案中,图像束135b和光输送光纤可以从导管的外部延伸到球囊105b内部的导管的远端区域。可以设想的是可以存在被添加到上面所公开的系统的每个部分的多个组件。系统还可以包含用于导管的导丝105c、ep荧光系统160、可控鞘管(sterable sheath)165a、用于可控鞘管的导丝165b、导引器鞘管套件(introducer sheath kit)165c、球囊加压器(indeflator)170和经中隔套件180。
55.图1b是根据本公开内容的一个示例性系统的框图。avs系统包含外部仪器125,外部仪器125具有光源130a、根据需要进行适当滤光的照相机135a以及具有一个或更多个显示器140a与图像处理软件的计算机系统(未示出)。avs系统包含内部仪器,该内部仪器包含消融装置140、照射装置130b以及成像装置135b,其中内部组件处于与导管105a相关联的内部球囊105b内。应该注意的是,包含导管105a与可充气球囊导管105b的内部仪器耦接至外部仪器125。在一些实施方案中,照射装置130b和成像装置135b可以利用光纤波导以向和从治疗组织传送光。
56.仍参照图1a和图1b,光源130a可以包括作为心肌的照射源的激光器。激光器的输出波长可以在目标荧光团(在该情况下,为nadh)的吸收范围内,以便在健康心肌细胞中诱发荧光。在一些实施方案中,激光器可以是uv激光器。
57.根据图1a和图1b的一些方面,激光器产生的uv光可以提供更多的照射功率,并且其波长可以在可能需要的任何纳米数下纯化。多于一个波长的发射可能存在问题,其中它们可能导致其他分子发射荧光(而不是nadh),并且它们可能会导致在反射范围内的反射注入图像噪声或者更糟,从而压过nadh反射信号。存在可以发射期望照射波段的商用激光器,并且其可以在接近50至200mw或更高的许多功率设置下使用。在一些实施方案中,即时系统(instant system)使用具有可调功率达150mw的激光器。
58.照射源上的波长范围可以由目的解剖结构界定,特别是选择导致最大的nadh荧光而不是仅由略微较长的波长激活之太多胶原蛋白荧光的波长。在一些实施方案中,激光具有300nm至400nm的波长。在一些实施方案中,激光具有330nm至370nm的波长。在一些实施方案中,激光具有330nm至355nm的波长。在一些实施方案中,可以使用355nm,这是因为其邻近nadh激发的峰和并且正好小于胶原蛋白激发。激光器的输出功率可以足够高以产生可恢复的荧光数据,但不能高至引起细胞损伤。
59.仍参照图1a和图1b,可以采用导管105a来执行许多功能,所述功能包括而不限于:血管导航、血液置换、光从光源130a到心肌的传播以及荧光的图像采集。在共同拥有的美国申请no.13/624,902中公开了适当导管的一个实例,该申请的全部内容并入本文。在一些实施方案中,在系统和导管实施方案内收纳或整合消融技术。
60.参照图2和图3,导管105a可包含在或靠近导管105a远端的球囊105b。由于血液吸
收照射和荧光波长,球囊105b可以从心肌表面置换血液。为了这样做,球囊105b可以是可充气和顺应性的(compliant),以很好地定位在解剖结构特别是肺静脉内。用于使球囊105b充气的介质也可以是光学透明的,但出于导航目的理想的是荧光不透明的。合适的充气介质包括但不限于氘(重水)和co2,其满足这两个要求。球囊105b也可以由至少在所关注的心肌照射和荧光二者的波长下光学透明的材料制成。球囊105b可以是由具有最佳拟合成肺静脉和其他结构的最佳可变大小的非顺应性材料制成,或由顺应性材料(如硅酮或尿烷)制成。在一些实施方案中,在330nm至370nm的uv范围内,球囊105b可以是光学透明的。
61.在一些实施方案中,球囊105b对于uv照射而言由330nm至370nm是光学透明的并且对于荧光波长而言由400nm至500nm是光学透明的。用于球囊的合适uv透明材料包括但不限于硅酮和尿烷。
62.仍参照图2和图3,还可以使用导管105a将照射光(例如uv激光和任选白色光)从外部光源有效地输送至球囊105b并且送出球囊105b到心肌。在一些实施方案中,由于石英的uv效率和小的直径,激光输送光纤通常是由石英制成的,可以使用其从uv激光光源输送照射光。
63.还可以使用图2和图3的导管收集和传送从经照射组织到外部照相机的nadh荧光的光(参照图1a和图1b)。在一些实施方案中,这可以经由从导管的远端区域延伸到外部照相机的成像光纤束(参见图1a)来实现。在一些实施方案中,图像束可以包含个体单模光纤中的一个或更多个,其一起保持图像完整性,同时根据需要沿导管至相机和滤光器的长度传输图像。尽管是柔性并且直径小,但是成像束(imaging bundle)可以实现对由球囊覆盖的目标组织区域进行成像的足够视场。
64.照相机可以连接至计算机系统(参见图1a)以用于观看,并且可以具有与nadh荧光对应的波长的高量子效率。一个这样的照相机是andor ixon dv860。可以将435nm至485nm(在一些实施方案中为460nm)的光带通滤光器插入在成像束和照相机之间,以阻挡在nadh荧光发射段之外的光。在一些实施方案中,可以将其他的光带通滤光器插入在成像束和照相机之间,以阻挡在根据被成像的组织的峰荧光而选择的nadh荧光发射段之外的光。
65.在一些实施方案中,由照相机所产生的数字图像被用于执行2d和3d重建。在一些实施方案中,图像束可连接至照相机,所述照相机可以由nadh荧光(fnadh)生成可以在计算机上显示的数字图像。计算机处理器/控制器具有用于形成数字图像之像素的像素强度的数据,所以所述计算机处理器/控制器可以使用2d或3d程序,以生成深度相关性图。在一些实施方案中,nadh荧光可被直接传送到计算机处理器/控制器。
66.参照图4a,举例说明了本公开内容之系统的操作。最初,(步骤410)将导管插入受房颤影响的心脏组织的区域中,如肺静脉/左心房交界处或心脏的另一区域。例如,通过球囊将血液从视场移出。对于房颤消融而言,可以使用在光纤波导周围的透明球囊来置换在肺静脉/左心房交界处的血液。可以通过来自光源和光纤或另一照射装置的紫外光来照射受影响的区域(步骤415)。可以在照射之前或之后,使用消融装置来消融所照射区域中的组织(步骤420)。使用本公开内容的系统,可以采用点至点rf消融或冷冻或激光或其他已知消融程序。通过使稍端跨过导管的中心腔或导管外部来进行消融。在该过程后,可以撤回消融稍端。在一些实施方案中,消融稍端可并入本文所公开的导管中。
67.仍参照图4a,通过成像束和照相机的组合对受照射区域进行成像(步骤425)。在一
些实施方案中,本公开内容的方法依赖于nadh的荧光发射成像,其是烟酰胺腺嘌呤二核苷酸(nad+)的还原形式。nad+是在所有活细胞的有氧代谢氧化还原反应中起重要作用的辅酶。其通过从柠檬酸循环(三羧酸循环)接受电子氧化剂以氧化剂起作用,这发生在线粒体中。通过该过程,因此nad+被还原成nadh。nadh和nad+在细胞的呼吸单元线粒体中最丰富,但也存在于细胞质中。nadh是线粒体中的电子和质子供体,以调节细胞的代谢,并参与许多生物学过程,包括dna修复和转录。
68.通过测量组织的紫外线诱发的荧光,可以了解组织的生化状态。已经针对nadh荧光在监测细胞的代谢活动和细胞死亡中的用途研究了nadh荧光。体外和体内的几个研究调查了使用nadh的荧光强度作为细胞死亡(凋亡或坏死)监测的内在生物标志的潜力。当nadh从损伤细胞的线粒体释放或转化为其氧化形式(nad+)时,其荧光显著下降,从而使其可以非常有用于区别健康组织与损伤的组织。在不可获得氧气时的缺血状态期间,nadh可以累积在细胞中,从而使荧光强度提高。然而,在死细胞的情况下,nadh存在一起消失。下表总结了由于nadh荧光引起的相对强度的不同状态:
[0069][0070][0071]
仍参照图4a,虽然nad+和nadh二者都相当容易地吸收uv光,但nadh是响应uv激发的自体荧光而nad+不是。nadh具有约350nm至360nm的uv激发峰和约460nm的发射峰。在一些实施方案中,本公开内容的方法可以使用约330nm至约370nm的激发波长。因此用适当的仪器,可以在实时测量目的区域内的低氧以及坏死组织时,对发射波长进行成像。此外,可以使用nadh荧光的灰阶渲染比例来实现相对度量。
[0072]
在低氧条件下,氧气水平下降。随后fnadh发射信号的强度可以提高,表明线粒体nadh过量。如果不检测低氧,当受影响的细胞连同其线粒体死亡时,最终会发生信号的全衰减(attenuation)。可以使用nadh水平的高对比度来鉴定末期受损消融组织的周缘。
[0073]
仍参照图4a,为了起始荧光成像,操作者可以布置安装在导管远端部分的球囊。接着,通过来自光源(如uv激光器)的uv光激发nadh。在组织标本中的nadh吸收激发波长的光并且发射更长波长的光。可以收集发射的光并将其传回照相机,并且可以在显示器上产生成像受照射区域的显示(步骤430),其用于利用nadh荧光来鉴定成像区域中的消融和未消
融组织(步骤435)。然后,如果需要消融另外的组织,则可以通过返回到消融步骤来重复该过程。应当认识到,虽然图4a举例说明了顺序进行的步骤;但是这些步骤中的许多步骤可以同时进行或几乎同时进行,或者以与图4a中所示的不同的顺序来进行。例如,消融、成像和显示可以同时发生,并且消融和未消融的组织的鉴定可以在消融组织时发生。
[0074]
由处理器或计算机在计算机系统上执行的应用软件可以向用户提供与医师的接口。主要功能中的一些功能可以包括:激光控制、照相机控制、图像捕获、图像调节(亮度和对比度调整等)、损伤灶鉴定、损伤灶深度分析、过程事件记录以及文件操作(创建、编辑、删除等)。
[0075]
图4b举例说明了该确定损伤灶深度过程的流程图。步骤440公开了从计算机显示器经由应用软件使用nadh荧光来鉴定成像区域中的消融和未消融组织。步骤445公开了鉴定损伤灶特异性的目的图像,以开始损伤灶深度分析。步骤450公开了在目的损伤灶的图像内鉴定健康组织区域。通过一个非限制性实例的方式,参考图6a和图6b,心脏中的nadh的成像荧光可以产生:由于缺乏荧光而具有暗外观的损伤灶部位的生理显示;由于正常荧光而具有亮外观的间隙的生理显示;以及具有在损伤灶部位附近的较亮光环型外观的任何缺血组织的生理显示(参照图6a和图6b)。当鉴定了损伤灶时,其被选择用于损伤灶深度分析。
[0076]
步骤455公开了使用在每个像素观察到的nadh荧光强度与在所鉴定的健康组织中观察到的nadh荧光强度的比来归一化整个图像。步骤460公开了经由从使归一化强度比与损伤灶深度相关的、预先建立的数据集导出的算法来处理所得到的归一化图像数据。可以使用健康组织的荧光与损伤灶组织的荧光的比来计算损伤灶深度。首先,用户在图像内鉴定健康组织的区域。然后,应用软件使用在每个像素观察到的nadh荧光强度与在所鉴定的健康组织中观察到的nadh荧光强度的比来归一化整个图像。然后,经由从使归一化强度比与损伤灶深度相关的、预先建立的数据集导出的算法来处理所得到的归一化图像数据。通过使用患者自身的心肌nadh荧光作为对照,该方法大大减少了患者间绝对nadh荧光变化的影响,以及照射光和成像系统中的损耗和由于镜面反射和漫反射而产生的光强度的变化,以及其他光学非理想特性。
[0077]
步骤465公开了完成跨损伤灶沿单行进行的深度分析。针对损伤灶中一个单一位置由来自单个位置、行或区域的信息的完成深度分析也是可能的。图4c至4f示出了沿单行进行的深度分析。例如,图4c示出了犬心脏已被消融六次的图像。方形包住了单个消融损伤灶。图4d在右上角示出的是从血液灌注的犬心脏的同一区域获得的nadh荧光(fnadh)图像。图4e是沿单行进行并且基于图4d中的数字图像(即由形成数字图像的像素强度)产生的2d深度图。图4f是沿同一行切割的苏木精和伊红染色的犬心脏组织,其示出了损伤灶的实际深度(方形示出了损伤灶的边界),其中,最深区域对应于图4d中的最暗斑和图4e中的最低fnadh。
[0078]
步骤470公开了沿与初始行平行的不同行重复步骤460至470,因此每条行的深度数据编译成损伤灶部位的3d重建模型。跨损伤灶沿单行进行的深度分析过程可以根据需要沿与初始行不同的行重复多次,并且每行的深度数据可被编译成损伤灶部位的3d重建模型。
[0079]
通过非限制性实例的方式,图4g示出了由fnadh成像的两个消融损伤灶和损伤灶间间隙的数字图像。图4h示出了由图4g数字图像中的像素强度进行的3d重建。如上所述,可
以使用2d数据和3d数据二者用于进一步的诊断或治疗。
[0080]
可以测量和绘制由照相机检测到的荧光的强度,其中,最低荧光(最暗)对应于最深损伤灶,而最高荧光(最亮)对应于未消融或健康组织。在亮和暗极值之间的任何灰度水平一般对应于组织损伤灶深度的程度。照相机传感器的灵敏度确定在全黑和全白之间的灰度水平的数量。在这样的应用中几个二进制数是常见的,包括分别与8比特和16比特的分辨率对应的256级和65,536级。在8比特灵敏度的情况下,0将为全黑而255为全白,其中,中间有254个灰度水平。使用该灰阶图像,可以估计适当的深度图。在一些实施方案中,也可以使用24比特分辨率。
[0081]
应注意的是,fnadh成像可以可靠和可重复地预测心脏消融损伤灶直径和深度。fnadh强度的损失与多个rf损伤灶的实际测量直径和深度相关,其中,相关系数分别为大于96%和79%。由于uv照射无法可靠地穿透深度大于2mm之下的心脏组织,因此在损伤灶深度大于2mm处发生相关性丧失是可能的。随着进一步的损伤灶深度,没有进一步的fnadh可以被检测到,并且因此在约2mm损伤灶深度处观察到fnadh信号强度的可重复的平台。如由ct扫描测量的,左心房的通常针对消融的位置处的平均左心房壁厚度为1.85mm。因此,跨rf损伤灶所观察到的fnadh信号强度的最低点和平台用作用于清晰、全或无确定足够损伤灶深度的合理模型。
[0082]
本文所公开的方法、系统和装置可用于多种治疗过程。可以使用本文所公开的方法、系统和装置的示例性过程包括但不限于:用于心脏中的诊断和治疗过程,用于治疗心律失常(如,例如室上性心律失常和心室心律失常),用于治疗房颤,以及肺静脉标测和消融。消融的组织可以是心肌(心外膜或心内膜心肌),但本文公开的方法应该对骨骼肌、肝脏、肾以及具有显著存在丰富nadh线粒体的其他组织具有同样的作用。
[0083]
本发明公开的方法可与二维(2d)至三维(3d)标测方案一起使用。可以将多个2d图像叠加至组织或器官(包括心脏)的3d重建图像上。许多心律失常手术包括在该手术过程中使用患者的特定解剖结构的重建三维图像。使用多种成像形式,包括计算机断层扫描术(ct)、磁共振成像(mri)、超声、以及使用系统如navx和carto的电解剖标测。在所有情况下,三维解剖图像或表面呈现患者特定解剖结构以帮助定位待治疗的组织区域。在所有情况下,能够可视化形成损伤灶的精确位置以及损伤灶缺失(例如,损伤灶集中的“间隙”或断裂)的精确位置,将引导手术以优化治疗结果。2d图像至3d图像的标测允许系统在三维、可旋转、交互式虚拟环境中使用患者的特定解剖结构叠加、空间配准和/或纹理标测组织的单个或多个图像(这可能表明损伤灶的存在或不存在)。
[0084]
在一些实施方案中,本公开内容的系统和方法使得能够将由系统产生的图像配准和/或叠加到使用其他成像形式例如mri图像、计算机断层扫描术(ct)图像、超声图像及其三维重建看到的患者的特定解剖结构上。在一些实施方案中,本公开内容的系统和方法还可以包括将由系统产生的图像配准和/或叠加到使用其他电解剖标测、解剖重建和导航系统(如navx和carto)看到的患者的特定解剖结构上。配准和叠加可以在手术过程期间中实时进行。将nadh图像纹理标测至重建的心内膜表面上使得能够可视化治疗部位。例如,损伤灶的多个nadh快照可以创建整个肺静脉开口或多个肺静脉的完整的全景图像。将传感器放置在导管稍端上可以提供以下信息,该信息使得nadh图像能够组合在一起以创建3d重建图像。
[0085]
下面提供使用本公开内容的系统和方法的实施例。这些实施例仅仅是代表性的并且不应当被用来限制本公开内容的范围。对于本文中所公开的方法和装置而言,存在多种替代设计。因此,所选择的实施例主要是用来证明本文所公开的装置和方法的原理。
[0086]
实施例
[0087]
使用功能上等同的系统进行实验以产生消融损伤灶和损伤灶图像,以开发损伤灶深度分析的方法。下面描述实验设置。
[0088]
nadh荧光系统提供使用峰波长为365nm的led聚光灯(pls
‑
0365
‑
030
‑
07
‑
s,mightexsystems)来照射心外膜表面。在460nm+/
‑
25nm带通过滤发射的光,并且使用装有低放大率透镜的ccd照相机(andor ixon dv860)来成像。对nadh(fnadh)的荧光进行成像,以监测心外膜组织的状态。
[0089]
rfa系统提供使用标准临床rf发生器(boston scientific的ept1000消融系统)来进行rfa。发生器经由4mm冷却的blazer消融导管(boston scientific)电连接至动物以递送损伤灶。在消融时使用接地垫。发生器被设置为温度控制模式。使用浸在液氮中的定做金属探针或通过使用medtronic的freezor max心脏冷冻消融导管来进行冷冻消融。
[0090]
参照图5a和图5b,首先,获得健康心脏组织中的nadh激发和发射光谱的基线数据。图5a和图5b示出了组织激发
‑
发射矩阵。由于nadh的存在,因此健康组织当在330nm至370nm的范围内激发时在450nm至470nm强烈发射。在消融的组织中不存在与nadh相关联的大峰。
[0091]
在图6a和图6b中示出了典型rfa损伤灶的一个实例。左侧的图像是使用白光照射捕获的,而右侧的fnadh图像是使用具有460nm滤光器的uv激发捕获的。
[0092]
所有动物方案由乔治华盛顿大学医学院的动物护理和使用委员会审查和批准,并符合动物研究的指南。
[0093]
离体实验初始使用大鼠(200
‑
300gsprague
‑
dawly)的切除、无血心脏来进行。使用标准程序对动物进行肝素化和麻醉。使用中线切口来打开胸部。然后切除心脏;在恒压下对主动脉进行插管和离体langendorff灌注。将心脏放置在接地垫的顶部上,并且在rfa消融期间将其淹没在37摄氏度的台氏溶液中。或者,将冷冻探针直接施加到心外膜表面。
[0094]
将射频能量施加至切除、无血大鼠心室的心外膜,同时改变温度和持续时间,以产生不同大小的rfa损伤灶。如通过校准的天平来测量2克均匀的接触力。通过改变rf应用的温度(50,60和70摄氏度)和时间(10,20,30,40,50秒)来生成不同大小的损伤灶。在六个不同大鼠心脏标本上生成总共12个rfa损伤灶。
[0095]
损伤灶和组织周围的nadh荧光通过使用mightexprecision led聚光灯以365nm的uv光照射心外膜表面来测量。使用460/25nm的带通滤光器来选择与fnadh对应的光,并使用高灵敏度的电荷耦合装置照相机来成像。另外,邻近于卷尺以明亮光对损伤灶进行成像,以使得能够测量损伤灶的大小。然后,将fnadh图像输入到imagej软件中以测量大小,并分析每个损伤灶的暗度谱。通过将目的线性区域(roi)放置通过每个fnadh成像的消融损伤灶的中心,以在跨损伤灶周边的每个点处测量像素强度来评估暗度谱。然后,使用包含氯化三苯基四氮唑(ttc)的台氏溶液逆行灌注心室组织,以评估组织坏死。切除心外膜损伤灶,以对组织损伤进行肉眼测量和组织学测量。
[0096]
在体内实验中,使用犬开胸模型来进行。动物在一般麻醉的诱导侯经历开胸手术。使用4mm射频消融导管,以多种持续时间和温度给心外膜表面造成多个损伤灶。然后使用
365nm的uv光(mightex precisionled聚光灯)来照射心脏的心外膜表面,以及经由耦接至高量子效率荧光照相机(andor ixon dv860照相机)的460/25nm滤光器而使对应的fnadh通过。在具有卷尺的亮白光下对损伤灶进行成像以测量损伤灶的大小。
[0097]
在大鼠实验之后提供尸体检查,用ttc染色动物心脏。ttc是用于评估急性坏死的标准程序,这取决于脱氢酶和nadh与四唑盐反应以形成甲瓒色素的能力。代谢活跃的组织显现为深红色而坏死组织显现为白色。在ttc染色之后,在先前针对像素强度分析定义的中心线性roi处将损伤灶二等分,以用于测量跨过对应roi的损伤灶深度。以肉眼检查确定并记录了损伤灶形态、宽度、长度和深度。
[0098]
对于犬实验,多个心外膜损伤灶的区段被纵向地二等分并且被提交用于组织学染色(苏木精
‑
伊红)。然后在光学显微术下以40x来对标本进行分析以表征形态改变,用于确定热引起的细胞损伤和坏死的程度。
[0099]
统计学分析包括使用所记录的方法和标准偏差来通过fnadh和ttc染色进行的两个独立的检测仪(reader)测量的损伤灶大小。还获得并记录了通过fnadh和通过ttc染色获得的损伤灶大小的相关系数。
[0100]
结果包括心外膜fnadh首先与损伤灶大小相关。在大鼠模型中,使用fnadh和氯化三苯基四氮唑(ttc)染色通过两个独立的检测仪来递送并测量一共12个心外膜表面损伤灶(参见图7a、图7b及图7c)。图7a中举例说明了典型的fnadh图像,以及图7b中示出了使用ttc染色进行的实际损伤灶直径测量。使用ttc进行的对损伤灶直径的线性测量(顶部图像,7a)与从对应的fnadh图像获得的损伤灶直径(底部图像,7b)相关。图7c示出了损伤灶大小相对于消融递送次数的概括图。对于所有损伤灶大小,心外膜fnadh接近地预测通过ttc染色确定的实际损伤灶直径。nadh和ttc平均直径分别为7.9
±
1.85mm和8.2
±
1.95mm,其中,相关系数为96%。
[0101]
温度和损伤灶递送次数是变化的以在大鼠心脏中的变化深度处获得大量的心外膜表面损伤灶。然后沿损伤灶的中心线多次测量心外膜fnadh的强度。图8a、图8b、图8c及图8d中示出了示例损伤灶组,其中,针对图8c中跨过损伤灶#1的行将fnadh绘制在顶部图(图8a)中。图8b示出了从跨过同一损伤灶的ttc染色的心脏获得的所测量的深度。图8d示出了在图(图8a)中使用的fnadh的反图像。这样做以使得更高强度的反fnadh与所示出的损伤灶深度相关并且具有类似形状。
[0102]
参照图9和图10,将损伤灶深度与反fnadh信号强度进行了比较,在图9中编译并绘制。此外,在50摄氏度下递送损伤灶分别10秒、20秒、30秒、40秒和50秒。在变化的温度下获得了相同比较并且示出了类似的发现(参见图9和图10)。
[0103]
参照图11,使用通过使温度和损伤灶持续时间变化而获得的损伤灶在特定温度下针对不同持续时间获得线性相关系数。图11示出了在60摄氏度下的结果,其中,取决于消融的持续时间,相关系数为0.84至0.97。
[0104]
通过使用跨过损伤灶的仅5条平行的行并且使用3d绘图程序绘制值来聚集来自fnadh各个图的灰阶,从而从犬的心外膜图像获得对损伤灶深度的3d重建。
[0105]
图12a和图12b、图12c和图12d以及图12e和图12f分别示出了对冷冻损伤灶、射频损伤灶以及多个冷冻损伤灶的更高分辨率的3d重建。要注意的是,在显示多个损伤灶的绘图中,损伤灶深度的变化可见。
[0106]
实验结果证实fnadh为心外膜损伤灶大小的准确量度并且为损伤灶深度的预测物。通过沿跨过消融图像的多行重复以上描述的方法并且编译结果可以获得对深度的3d重建(参见图10、图12a、图12b和图12c)。
[0107]
如以上注意到的那样,图13a示出了例如通过使用冷冻消融导管来创建的消融损伤灶的fnadh图像,以及图13b是该消融损伤灶的放大图像。图13c示出了对同一消融损伤灶的3d深度重建相关绘图。主要不同在于图12包括使用rfa创建的一些消融损伤灶,其中,rfa和冷冻损伤灶在3d上具有不同的外观。
[0108]
参照图14,rfa损伤灶可以从具有优良分辨率的可见组织检测并区分出来,这是因为与周围的较健康心肌组织相比,rfa损伤灶表现出非常低的或者不可检测的fnadh。通过fnadh成像的损伤灶直径与通过ttc所测量的损伤灶大小密切地相关(平均nadh和ttc直径分别为7.9
±
1.85mm和8.2
±
1.95mm;相关系数[cc]为96%)。心外膜fnadh的强度以反方式与通过ttc分析所测量的实际损伤灶深度相关。如图14所示,针对损伤灶深度达1.8mm(显著性p<0.0001)的所有rfa变量以超过79%的cc来再现这种关系,在此之外,fnadh信号强度变得饱和并平稳。
[0109]
损伤灶深度与心外膜fnadh的关系用统计学显著性来再现。通过变化的rf持续时间和温度,在大鼠心室的心外膜上生成不同大小的多个损伤灶。对这些多个损伤灶进行损伤灶深度与反fnadh信号强度的分析。fnadh强度的损失与损伤灶深度相关,其中皮尔逊相关系数为78%,并且在直到约2mm的损伤灶深度时有高度显著性(p<0.0001)。在2mm以外,随着fnadh值平稳,该关系失去其显著性。
[0110]
在一些实施方案中,用于对消融组织和未消融组织进行成像的系统包含紫外线(uv)激光器光源;可充气球囊导管,包含uv激光器导向仪(guide)和图像导向仪;耦接至导管的外部荧光照相机;耦接至照相机的、具有显示器的计算机;以及成像软件。
[0111]
在一些实施方案中,导管还包含用于导管导航的导丝端口;和/或消融治疗技术,包括射频电极、激光消融能力(capability)或冷冻消融能力。在一些实施方案中,球囊可以由顺应材料(如硅酮或尿烷)制成;任选地在330nm至370nm的uv范围内透明;或者任选地在430nm至490nm的荧光光范围内透明。
[0112]
在一些实施方案中,估计损伤灶深度的方法可以包括以下步骤:获取并显示组织的烟酰胺腺嘌呤二核苷酸氢(nadh)荧光数据;鉴定图像内的健康组织的区域;使用在图像的每个像素观察到的nadh荧光强度与在所鉴定的健康组织中观察到的nadh荧光强度的比来将整个图像归一化;鉴定消融组织的区域;以及应用用于将所得的经归一化图像与损伤灶深度相关的算法。
[0113]
在一些实施方案中,相关算法使用数据然后使用将经归一化的强度比与损伤灶深度相关的预先建立的数据集。在一些实施方案中,损伤灶深度估计使用患者自身的心肌nadh荧光作为对照。在一些实施方案中,通过使用以下技术中的一种或更多种来进行消融:射频消融、激光消融或冷冻消融。组织可以是心脏组织。在一些实施方案中,沿用户指示的行来进行对所估计的损伤灶深度的截面绘图。在一些实施方案中,通过编译一系列截面图来进行对所估计的损伤灶深度的3d绘图。
[0114]
在一些实施方案中,提供了治疗房颤的方法,所述方法包括:获取并显示心脏组织的特定区域(如肺静脉的孔)中的nadh荧光数据;跨图像分析损伤灶深度;鉴定健康的心脏
组织;鉴定适当的损伤灶;如果存在的话,鉴定不完全的损伤灶;如果存在的话,鉴定缺血区(受伤但未坏死的组织);在需要的地方重新应用消融治疗或者为了填充损伤灶行中的所鉴定的间隙,或者为了完成不完全的损伤灶,或者为了给缺血区搭桥;按照重新获取并显示经修复的组织所需,重复以上步骤;以及对心脏的其他区域(如剩余的肺静脉、左心房的其他部分或者甚至右心房的包括上腔静脉的特定区域)重复以上步骤。
[0115]
在一些实施方案中,用于对消融的心外膜心脏肌肉组织、肺静脉/左心房连结处的未消融间隙、以及损伤灶深度进行成像的、具有近端和远端的导管包含:可充气的透明顺应性或非顺应性球囊,该球囊由充有能够传输光的透明流体的uv透明材料制成,用于将周围的血液置换以允许在远端处对nadh荧光的可视化;紫外线照射装置,其用于在远端处使用可传输uv光的光纤来激发肺静脉和左心房组织的线粒体nadh;微纤维镜,用于在远端处检测来自经照射肺静脉和左心房组织的nadh荧光;耦接至微纤维镜的位于近端处的荧光照相机,用于由所检测到的nadh荧光创建图像,该荧光照相机包含460nm+/
‑
25nm带通滤光器以检测由微纤维镜捕获的来自经照射肺静脉和左心房组织的nadh荧光,其中,所检测到的荧光数据示出由于缺少荧光导致具有暗外观的损伤灶部位的生理学、由于正常荧光导致具有亮外观的间隙的生理学、以及在损伤灶部位周围的具有较亮光环型外观的任何缺血组织的生理学;以及用于通过沿着跨过损伤灶部位长度的行绘制所检测到的荧光强度来确定沿该行的损伤灶部位深度的模块;其中,最低的荧光强度测量值对应于损伤灶部位的最深点,而最高的荧光对应于未消融组织。
[0116]
在一些实施方案中,该模块应用范围从全黑至全白的像素灰阶以沿着行创建损伤灶部位的深度的2d图,其中在假设256(0至255)个灰度水平的情况下,0是全黑并且是最深点,而255是全白并且是最浅点,其中消融组织的深度的2d图是绝对测量值,其中fnadh信号强度被归一化成先前建立的fnadh/深度灰阶值。
[0117]
在一些实施方案中,沿着跨过损伤灶部位之宽度的垂直线多次重复对消融组织的深度的2d图,深度的每个2d图平行于沿着损伤灶长度的行,以及整合垂直线上消融组织的深度的各2d图中的每个,从而重建消融组织的深度的3d图像。
[0118]
在一些实施方案中,导管还包含导丝内腔以插入柔性导丝。照相机可以是具有高量子效率的ccd照相机。在一些实施方案中,微纤维镜是光学成像束。在一些实施方案中,由330nm至370nm以及更具体地处于335nm的激光源来提供uv照射。在一些实施方案中,uv照射纤维稍端覆盖有发散透镜以使uv光折射和分散。
[0119]
在一些实施方案中,用于获取消融的心内膜心脏肌肉组织、肺静脉和左心房连结处的未消融间隙、以及损伤灶深度的实时图像的方法包括:可充气的透明顺应性球囊,该球囊由充有能够传输光的透明流体的uv透明材料制成,用于将周围的血液置换以允许在远端处对nadh荧光的可视化;使用紫外线光进行照射,用于激发肺静脉和左心房组织的线粒体nadh;使用光学成像束检测来自经照射肺静脉和左心房组织的nadh荧光;通过使用460nm带通滤光器来对所检测到的nadh荧光进行滤光以使用荧光照相机创建图像;其中,所检测到的荧光数据示出由于缺少荧光导致具有暗外观的损伤灶部位的生理学、由于正常荧光导致具有亮外观的间隙的生理学、以及在损伤灶部位周围的具有较亮光环型外观的任何缺血组织的生理学;以及用于通过沿着跨过损伤灶部位长度的行绘制所检测到的荧光强度来确定沿该行的损伤灶部位深度的模块;其中,最低的荧光强度测量值对应于损伤灶部位的最深
点,而最高的荧光对应于未消融组织。在一些实施方案中,该模块应用范围从全黑至全白的像素灰阶以沿着行创建损伤灶部位的深度的2d图,其中在假设256(0至255)个灰度水平的情况下,0是全黑并且是最深点,而255是全白并且是最浅点,其中消融组织的深度的2d图是绝对测量值,其中fnadh信号强度被归一化成先前建立的fnadh/深度灰阶值。在一些实施方案中,沿着跨过损伤灶部位宽度的垂直线多次重复消融组织深度的2d图,深度的每个2d图平行于沿着损伤灶长度的行,以及整合垂直线上的消融组织深度的各2d图中的每个,从而重建消融组织的深度的3d图像。在一些实施方案中,在使用射频、冷冻消融或激光导管来使组织消融的同时进行照射、成像和产生。在一些实施方案中,使用耦接至内腔导管稍端的光纤波导来进行照射和成像,所述光纤波导从紫外线光源向被照射的组织输送紫外线光。在一些实施方案中,通过使用射频导管、冷冻消融导管或激光消融导管中的一种来进行消融。
[0120]
在一些实施方案中,系统包含:用于对消融的肺静脉和左心房心脏组织以及未消融间隙进行成像的、具有远端和近端的导管,该导管包含充有透明流体的可充气顺应性或非顺应性球囊,用于将周围的血液置换以允许在远端处对nadh荧光的可视化;紫外线照射装置,用于在远端处照射组织;以及微纤维镜,用于在远端处检测经照射组织;耦接至微纤维镜的位于近端处的、用于创建2d图像的荧光照相机,该荧光照相机包含被配置成使紫外线辐射从微纤维镜捕获的经照射组织通过的滤光器;其中,所检测到的2d图像示出由于缺少荧光导致具有暗外观的损伤灶部位、由于正常荧光导致具有亮外观的间隙、以及在损伤灶部位周围具有较亮光环型外观的任何缺血组织;用于基于所检测到的2d图像在远端处对心脏组织进行消融的消融装置;以及用于通过沿着跨过损伤灶部位长度的行绘制所检测到的荧光强度来确定沿该行的损伤灶部位的深度的模块;其中,最低的荧光强度测量值对应于损伤灶部位的最深点,而最高的荧光对应于未消融组织。在一些实施方案中,该模块应用范围从全黑至全白的像素灰阶以沿着行创建损伤灶部位深度的2d图,其中在假设256(0至255)个灰度水平的情况下,0是全黑并且是最深点,而255是全白并且是最浅点。其中,消融组织的深度的2d图是绝对测量值,其中fnadh信号强度被归一化成先前建立的fnadh/深度灰阶值。在一些实施方案中,沿着跨过损伤灶部位宽度的垂直线多次重复消融组织的深度的2d图,深度的每个2d图平行于沿着损伤灶长度的行,以及整合垂直线上的消融组织深度的各2d图中的每个,从而重建消融组织的深度的3d图像。在一些实施方案中,耦接至外部照相机的显示器示出所检测到的2d图像。在一些实施方案中,消融装置是具有近端和远端的消融导管。在一些实施方案中,消融导管是激光输送导管、射频输送导管或冷冻消融导管。
[0121]
在一些实施方案中,用于对消融的心外膜心脏肌肉组织和未消融间隙进行成像的、具有近端和远端的导管包含:紫外线照射装置,用于激发心外膜心脏肌肉组织的线粒体nadh;纤维镜,其在远端处检测来自经照射心外膜心脏组织的nadh荧光;耦接至纤维镜的位于近端处的荧光照相机,用于由所检测到的nadh荧光来创建图像,该荧光照相机包含460nm的带通滤光器以检测由微纤维镜捕获的nadh荧光;其中,所检测到的2d图像示出由于缺少荧光导致具有暗外观的损伤灶部位、由于正常荧光导致具有亮外观的间隙、以及在损伤灶部位周围的具有较亮光环型外观的任何缺血组织、用于通过沿着跨过损伤灶部位长度的行绘制所检测并测量的荧光强度来确定沿该行的损伤灶部位深度的模块;其中,最低的荧光强度测量值对应于损伤灶部位的最深点,而最高的荧光对应于未消融组织。在一些实施方案中,该模块应用范围从全黑至全白的像素灰阶以沿着行创建损伤灶部位的深度的2d图,
其中在假设256(0至255)个灰度水平的情况下,0是全黑并且是最深点,而255是全白并且是最浅点。其中,消融组织的深度的2d图是绝对测量值,其中fnadh信号强度被归一化成先前建立的fnadh/深度灰阶值。在一些实施方案中,在跨过损伤灶部位宽度的垂直线上重复消融组织的深度的2d图,该2d图平行于沿着损伤灶长度的行,以及整合垂直线上消融组织各深度的每个,从而重建消融组织的深度的3d图像。
[0122]
在一些实施方案中,用于对消融的心外膜心脏肌肉组织和未消融间隙进行成像的、具有近端和远端的导管包含:紫外线照射装置,用于在远端处激发心外膜心脏肌肉组织的线粒体nadh;位于远端处的用于由所检测到的nadh荧光创建图像的荧光照相机,该荧光照相机包含460nm带通滤光器以检测来自经照射心外膜心脏肌肉组织的nadh荧光;其中,所检测到的荧光数据示出由于缺少荧光导致具有暗外观的损伤灶部位的生理学、由于正常荧光导致具有亮外观的间隙的生理学、以及在损伤灶部位周围具有较亮光环型外观的任何缺血组织的生理学;以及用于通过沿着跨过损伤灶部位长度的行绘制所检测和测量的荧光强度来确定沿该行的损伤灶部位深度的模块;其中,最低的荧光强度测量值对应于损伤灶部位的最深点,而最高的荧光对应于未消融组织。在一些实施方案中,该模块应用范围从全黑至全白的像素灰阶以沿着行创建损伤灶部位深度的2d图,其中,在假设256(0至255)个灰度水平的情况下,0是全黑并且是最深点,而255是全白并且是最浅点。其中,消融组织的深度的2d图是绝对测量值,其中fnadh信号强度被归一化成先前建立的fnadh/深度灰阶值。在一些实施方案中,在跨过损伤灶部位宽度的垂直线上重复消融组织的深度的2d图,该2d图平行于沿着损伤灶长度的行,以及整合垂直线上消融组织的各深度中的每个,从而重建消融组织的深度的3d图像。
[0123]
如以上所述,本发明系统和方法提供高质量和可验证的损伤灶,这可以是消融过程的成功和避免复发的至少一方面。质量损伤灶可以具有适当深度并且完全从心脏的心内膜表面至心外膜表面引起细胞坏死(即透壁),同时使远处非心脏结构的损伤最小化。当前公开的系统和方法提供反馈,如达到由消融引起的细胞损伤的程度,并且实际地验证损伤灶的完整性。当前公开的实施方案通过在该过程时向医师提供损伤灶可视化以及损伤灶深度信息来解决缺少损伤灶质量反馈,从而克服已知技术问题中的至少一些。该信息应当证明在以下方面有用:形成和验证适当的损伤灶、减小荧光镜检查时间、以及减小发生心率失常的比率,由此改善结果并减少花费。
[0124]
根据本公开内容的实施方案,系统和方法使用nadh荧光对消融期间的损伤灶和间隙提供实时的直接可视化。当前公开的系统和方法通过检测未存活的消融的心肌和存活心肌之间的荧光反差来起作用。本公开内容在该过程时实时地向医师提供损伤灶深度信息。
[0125]
根据本公开内容的一些方面,所公开的系统和方法可以用于基于在对组织进行消融并且使用fnadh系统对组织进行成像之后获得的像素强度来确定损伤灶深度。可以通过使fnadh系统提供的图像强度与损伤灶深度相关来提供对消融损伤灶深度的评估。这意味着,可以将相关的深度数据整合在损伤灶的3d重建中,从而给医师关于损伤灶几何形状和质量的实时反馈。
[0126]
根据本公开内容的一些方面,提供了用于确定损伤灶部位的深度的方法,所述方法包括:照射具有损伤灶部位的心脏组织;沿着跨过损伤灶部位的第一行从经照射心脏组织获得线粒体烟酰胺腺嘌呤二核苷酸氢(nadh)荧光强度;基于nadh荧光强度沿着第一行来
创建损伤灶部位的深度的2维(2d)图;以及由2d图来确定沿着第一行的选定点处损伤灶部位的深度,其中较低的nadh荧光强度对应于损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
[0127]
在一些实施方案中,所述方法还包括通过消融来在心脏组织中形成损伤灶部位。获得步骤可以包括:检测来自经照射组织的nadh荧光;由nadh荧光来创建损伤灶部位的数字图像,所述数字图像包含多个像素;以及确定沿着跨过损伤灶部位的行之多个像素的nadh荧光强度。在一些实施方案中,所述方法还可以包括基于来自损伤灶部位和健康组织的nadh荧光的量来在数字图像中区分损伤灶部位和健康组织;基于代表健康组织的像素的nadh荧光强度来对数字图像进行归一化。
[0128]
在一些实施方案中,检测步骤包括通过约435nm至485nm的带通滤光器来对nadh荧光进行滤光。在一些实施方案中,健康组织具有更亮的外观,而损伤灶部位具有更暗的外观。创建步骤可以包括绘制沿着跨过损伤灶部位的行的nadh荧光强度,以创建损伤灶部位的深度的2d图。
[0129]
在一些实施方案中,所述方法还包括:沿着跨过损伤灶部位的第二行从经照射心脏组织获得nadh荧光强度;基于nadh荧光强度沿着第二行来创建损伤灶部位的深度的2d图;由沿着第一行的2d图和沿着第二行的2d图来构建损伤灶部位的3维(3d)图像。在一些实施方案中,可以沿着跨过损伤灶部位宽度的垂直线多次重复获得、创建及确定步骤,深度的每个2d图平行于沿着损伤灶部位长度的第一行;以及整合垂直线上损伤灶部位深度的各2d图中的每个,以重建损伤灶部位的深度的3d图像。
[0130]
确定步骤可以包括应用范围从全黑至全白的像素灰阶。所述方法可以用于分析心外膜组织、心内膜组织、心房组织以及心室组织。
[0131]
在一些实施方案中,照射步骤包括使用激光器产生的uv光来照射心脏组织,其中激光器产生的uv光的波长可以为约300nm至约400nm。
[0132]
根据本公开内容的一些方面,提供了用于对心脏组织进行成像的系统,所述系统包含:照射装置,其被配置成照射具有损伤灶部位的组织以激发组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);成像装置,其被配置成检测来自经照射组织的nadh荧光;以及控制器,其与成像装置通信,编译所述控制器以沿着跨过损伤灶部位的第一行从经照射组织获得nadh荧光强度;基于nadh荧光强度沿着第一行来创建损伤灶部位的深度的2维(2d)图;以及由2d图来确定沿着第一行的选定点处的损伤灶部位的深度,其中较低的nadh荧光强度对应于损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
[0133]
根据本公开内容的一些方面,提供了用于对心脏组织进行成像的系统,所述系统包含:具有远端区域和近端区域的导管;光源;从光源延伸到导管远端区域的光纤以照射靠近导管远端的具有损伤灶部位的组织,从而激发所述组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);图像束,其用于检测来自经照射组织的nadh荧光;连接至图像束的照相机,所述照相机被配置成接收来自经照射组织的nadh荧光并且生成经照射组织的数字图像,所述数字图像包含多个像素;以及控制器,其与照相机通信,所述控制器被配置成由数字图像来确定沿着跨过灶部位的第一行之多个像素的nahd荧光强度,基于nadh荧光强度沿着第一行来创建损伤灶部位的深度的2d图,以及根据2d图来确定沿着第一行的选定点处的损伤灶部位的深度,其中较低的nadh荧光强度对应于损伤灶部位中的更大深度,而较高的nadh荧光
强度对应于未消融组织。
[0134]
提供了用于治疗房颤(af)的系统、导管及方法。使用配备有uv照射源和能够传导uv的光纤的球囊导向的导管、耦接至成像束的具有荧光能力的照相机、以及光学带通滤光器检测nadh荧光,对心脏组织中的内源nadh的荧光(fnadh)进行成像以鉴定消融区域和未消融区域。可以使用fnadh成像来鉴定消融区域之间的间隙,然后可以将所述间隙消融。使用fnadh图像的灰阶显示来预测消融的损伤灶的深度,并且可以在不适当宽度的损伤灶处递送附加损伤灶。在消融过程期间可以进行成像,并且不需要额外的化学制品,如造影剂、示踪剂或染料。
[0135]
陈述了前述公开内容仅为了举例说明本公开内容的多种非限制性实施方案,并且并不意在限制。因为对于本领域技术人员而言可以结合本公开内容的精神和实质来对所公开的实施方案进行修改,所以当前公开的实施方案应当被解释为包括在所附权利要求及其等同方案的范围内的一切内容。
[0136]
以下内容对应于母案申请中的原始权利要求书,现作为说明书的一部分并入此处:
[0137]
1.用于确定损伤灶部位之深度的方法,所述方法包括:
[0138]
照射具有损伤灶部位的心脏组织;
[0139]
沿着跨过所述损伤灶部位的第一行从经照射心脏组织获得线粒体烟酰胺腺嘌呤二核苷酸氢(nadh)荧光强度;
[0140]
基于所述nadh荧光强度沿着所述第一行来创建所述损伤灶部位之深度的2维(2d)图;以及
[0141]
由所述2d图来确定沿着所述第一行的选定点处损伤灶部位的深度,其中较低的nadh荧光强度对应于损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
[0142]
2.根据项1所述的方法,其还包括通过消融在心脏组织中形成损伤灶部位。
[0143]
3.根据项1至2中任一项所述的方法,其中所述获得步骤包括:
[0144]
检测来自经照射组织的nadh荧光;
[0145]
由所述nadh荧光来创建所述损伤灶部位的数字图像,所述数字图像包含多个像素;以及
[0146]
确定沿着跨过所述损伤灶部位的所述行之所述多个像素的nadh荧光强度。
[0147]
4.根据项3所述的方法,其还包括:
[0148]
基于来自所述损伤灶部位和健康组织的所述nadh荧光的量来在所述数字图像中区分所述损伤灶部位和所述健康组织;
[0149]
基于代表所述健康组织的像素的nadh荧光强度来对所述数字图像进行归一化。
[0150]
5.根据项1至4中任一项所述的方法,其中所述检测步骤包括通过约435nm至485nm的带通滤光器来对nadh荧光进行滤光。
[0151]
6.根据项4所述的方法,其中所述健康组织具有较亮的外观,而所述损伤灶部分具有较暗的外观。
[0152]
7.根据项1至6中任一项所述的方法,其中所述创建步骤包括沿着跨过所述损伤灶部位的所述行绘制nadh荧光强度,以创建所述损伤灶部位之深度的2d图。
[0153]
8.根据项1至7中任一项所述的方法,其还包括:
[0154]
沿着跨过所述损伤灶部位的第二行从经照射心脏组织获得nadh荧光强度;
[0155]
基于所述nadh荧光强度沿着所述第二行来创建所述损伤灶部位之深度的2d图;以及
[0156]
由沿着所述第一行的2d图和沿着所述第二行的2d图来构建所述损伤灶部位的3维(3d)图像。
[0157]
9.根据项1至8中任一项所述的方法,其还包括:沿着跨过所述损伤灶部位之宽度的垂直线多次重复所述获得、创建和确定步骤,所述深度的每个2d图平行于沿着所述损伤灶部位长度的所述第一行;以及整合垂直线上所述损伤灶部位深度的各2d图中的每个,以重建所述损伤灶部位之深度的3d图像。
[0158]
10.根据项1至9中任一项所述的方法,其中所述确定步骤包括应用范围从全黑到全白的像素灰阶。
[0159]
11.根据项1至10中任一项所述的方法,其中所述心脏组织选自心外膜组织、心内膜组织、心房组织和心室组织。
[0160]
12.根据项1至11中任一项所述的方法,其中所述照射步骤包括使用激光器产生的uv光来照射所述心脏组织。
[0161]
13.根据项12所述的方法,其中所述激光器产生的uv光的波长为约300nm至约400nm。
[0162]
14.用于对心脏组织进行成像的系统,其包含:
[0163]
照射装置,所述照射装置被配置成照射具有损伤灶部位的组织以激发所述组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);
[0164]
成像装置,所述成像装置被配置成检测来自经照射组织的nadh荧光;和
[0165]
控制器,所述控制器与所述成像装置通信,编程所述控制器以沿着跨过所述损伤灶部位的第一行从经照射心脏组织获得nadh荧光强度;基于所述nadh荧光强度沿着所述第一行来创建所述损伤灶部位之深度的2维(2d)图;以及由所述2d图来确定沿着所述第一行的选定点处损伤灶部位的深度,其中较低的nadh荧光强度对应于损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
[0166]
15.根据项14所述的系统,其中所述照射装置是uv激光器。
[0167]
16.根据项14至15中任一项所述的系统,其中所述成像装置包含照相机以及从所述照相机延伸到正被照射的组织的纤维镜。
[0168]
17.根据项14至16中任一项所述的系统,其中所述成像装置还包含设置在所述照相机与所述纤维镜之间的约435nm至485nm的带通滤光器。
[0169]
18.根据项14至17中任一项所述的系统,其中还编程所述控制器以检测来自经照射组织的所述nadh荧光;由所述nadh荧光来创建所述损伤灶部位的数字图像,所述数字图像包含多个像素;以及确定沿着跨过所述损伤灶部位的所述行之所述多个像素的nadh荧光强度。
[0170]
19.根据项14至18中任一项所述的系统,其中还编程所述控制器以沿着跨过所述损伤灶部位的第二行从经照射心脏组织获得nadh荧光强度;基于所述nadh荧光强度沿着所述第二行来创建所述损伤灶部位之深度的2d图;以及由沿着所述第一行的2d图和沿着所述
第二行的2d图来构建所述损伤灶部位的3维(3d)图像。
[0171]
20.根据项14至19中任一项所述的系统,其中还编程所述控制器以沿着跨过所述损伤灶部位之宽度的垂直线多次重复该过程,所述深度的每个2d图平行于沿着所述损伤灶部位长度的所述第一行;以及整合垂直线上所述损伤灶部位深度的各2d图中的每个,以重建所述损伤灶部位之深度的3d图像。
[0172]
21.用于对组织进行成像的系统,其包含:
[0173]
导管,所述导管具有远端区域和近端区域;
[0174]
光源;
[0175]
光纤,所述光纤从所述光源延伸到所述导管的所述远端区域,以照射靠近所述导管远端的具有损伤灶部位的组织,从而激发所述组织中线粒体的烟酰胺腺嘌呤二核苷酸氢(nadh);
[0176]
图像束,所述图像束用于检测来自经照射组织的nadh荧光;
[0177]
照相机,所述照相机连接至所述图像束,所述照相机被配置成接收来自经照射组织的所述nadh荧光,并且产生经照射组织的数字图像,所述数字图像包含多个像素;和
[0178]
控制器,所述控制器与所述照相机通信,所述控制器被配置成由所述数字图像来确定沿着跨过所述损伤灶部位的第一行之所述多个像素的nadh荧光强度;基于所述nadh荧光强度沿着所述第一行来创建所述损伤灶部位之深度的2d图;以及由所述2d图来确定沿着所述第一行的选定点处所述损伤灶部位的深度,其中较低nadh荧光强度对应于所述损伤灶部位中的更大深度,而较高的nadh荧光强度对应于未消融组织。
[0179]
22.根据项21所述的系统,其中还编程所述控制器以沿着跨过所述损伤灶部位的第二行从经照射心脏组织获得nadh荧光强度;基于所述nadh荧光强度沿着所述第二行来创建所述损伤灶部位之深度的2d图;以及由沿着所述第一行的2d图和沿着所述第二行的2d图来构建所述损伤灶部位的3维(3d)图像。
[0180]
23.根据项21或22所述的系统,其中还编程所述控制器以沿着跨过所述损伤灶部位之宽度的垂直线多次重复该过程,所述深度的每个2d图平行于沿着所述损伤灶部位长度的所述第一行;以及整合垂直线上所述损伤灶部位深度的各2d图中的每个,以重建所述损伤灶部位之深度的3d图像。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1