一种评估心血管疾病风险的系统
1.本发明涉及一种评估心脏生物节律或心血管疾病风险的标志物及其用途,以及使用该标志物评估心脏生物节律或心血管疾病风险的装置和系统。
背景技术:
2.人的生理和病理参数受到昼夜节律的严格控制。昼夜节律在心血管系统中存在重要意义,而昼夜节律系统的慢性破坏,例如轮班工作、时差、社交互动、进食方式或昼夜节律障碍,与心血管疾病(cvd)的发生和发展也密切相关。因此,评估个人心血管系统的昼夜节律状态,对于心血管系统的功能评估、疾病风险预测、诊断分析甚至是治疗改善都有积极的意义。
3.目前已经有许多测量方法用于评估个人的昼夜节律状态,例如暗光下褪黑素浓度变化(dim-light melatonin onset,dlmo)和时型问卷等,研究人员也开发出了基于各种生物样本的昼夜节律状态分析方法。但是,dlmo和时型问卷这些方法均不能直接反映心脏系统的昼夜节律。心率是心脏健康的一个重要参数,也是最容易精确测量的,心率的昼夜变化也能够反映心血管系统功能的节律变化。之前已经有研究报道心率的昼夜差异(dipping,杓型)与心血管疾病风险相关,但并没有和生物节律深入关联。
技术实现要素:
4.评估受试者生物节律的标志物及其方法
5.本发明公开了一种用于评估受试者心脏生物节律的标志物,所述标志物为心率低谷相位和夜间心率差异(a)中的至少一种。
6.本发明公开了一种评估受试者心脏生物节律的方法,其中使用心率低谷相位和夜间心率差异(a)中的至少一种标志物确定受试者生物节律。
7.本发明公开了一种标志物在制备用于评估受试者生物节律装置中的用途,其中所述标志物为心率低谷相位和夜间心率差异(a)中的至少一种。
8.在一个具体实施例中,所述心率低谷相位或夜间心率差异(a)通过受试者夜间静息态数据的心率拟合曲线后获得的,其中夜间静息态数据是指除去了夜间静息态数据中睡眠周期、起夜活动等干扰之后的夜间睡眠期间的心率数据。
9.在一个具体实施例中,使用能够收集连续心率的设备诸如holter动态心电监测系统或带心率模块的可穿戴设备,通过数据预处理和数据拟合获得受试者夜间静息态的心率拟合,得到心率低谷相位或夜间心率差异(a),进而反映受试者的心脏生物节律。
10.在一个具体实施例中,所述受试者存在心脏生物节律。
11.在一个具体实施例中,所述评估生物节律的装置包括
12.1)数据获取模块;
13.2)数据预处理模块;
14.3)数据拟合模块,包括
15.i)全局拟合模块;和可选择的
16.ii)局部拟合模块;
17.4)报告模块;
18.其中,所述数据获取模块用于获取受试者的心率数据,包括下载受试者的心率数据和向数据预处理模块输出数据;
19.所述数据预处理模块用于获取静息态数据,包括将受试者的心率数据按天分割确定夜间静息态时间段以及进一步去除波动的峰获得静息态数据;
20.所述全局拟合模块用于获取心率低谷相位和/或夜间心率差异,包括使用三角函数将所述夜间静息态数据拟合为曲线,以获取心率低谷相位,和/或计算夜间心率差异;
21.所述局部拟合模块用于在拟合曲线中获得夜间静息态时间段内的局部峰和局部谷的信息;
22.所述报告模块用于评估受试者心脏生物节律或心血管疾病风险。
23.在一个具体实施例中,所述装置包括可操作地附接到计算设备的输入设备和可穿戴设备中的至少一种。
24.在一个具体实施例中,所述装置包括能够收集连续心率的设备诸如holter动态心电监测系统或带心率模块的可穿戴设备。
25.评估受试者心血管疾病风险的标志物及其方法
26.本发明公开了一种用于评估受试者心血管疾病风险的标志物,所述标志物为心率低谷相位和夜间心率差异(a)的至少一种。
27.本发明公开了一种评估受试者心血管疾病风险的方法,包括以下步骤:
28.1)使用能够收集连续心率的设备诸如holter动态心电监测系统或带心率模块的可穿戴设备收集受试者的连续心率数据,其中心率数据密度常规为每分钟1个数据点;
29.2)获得获取静息态数据时间段:数据预处理,去除夜间静息态数据中睡眠周期、起夜活动等干扰因素造成的波动的峰;使用周期为24小时的三角函数(cos函数)数据拟合获得受试者夜间静息态的心率拟合曲线,在曲线中得到心率低谷相位或计算夜间心率差异a;使用巴特沃兹滤波器(butterworth filter)滤波获取了夜间静息态数据中小的峰谷参数。其中,夜间心率差异a为夜间静态数据拟合的心率曲线的振幅。
30.3)通过心率低谷相位或夜间心率差异a数值进而判断受试者的心血管疾病风险大小。
31.在一个具体实施例中,所述心率低谷相位或夜间心率差异a数值是通过受试者夜间静息态的心率拟合获得的,其中夜间静息态是指除了夜间静息态数据中睡眠周期、起夜活动等干扰之后的夜间睡眠期间。
32.在一个具体实施例中,当心率低谷相位在0到5之间和或夜间心率变化在2.75到26之间时,受试者属于心血管疾病低的风险;当心率低谷相位≤0时,受试者属于心房异常诸如房颤或房扑的高风险;当心率低谷相位≥5时,受试者属于心房异常诸如房颤或房扑的高风险,或属于心室异常诸如室颤和/或室扑的高风险;当夜间心率差异≥26时,受试者属于心房异常和传导阻滞的高风险;当夜间心率差异≤2.75时,受试者属于窦性心动过速和qrs的高风险。其中,所述受试者存在心脏生物节律。
33.在一个具体实施例中,所述受试者为无心脏生物节律或夜间平均心率/白天平均心率≥1时,受试者被评估为心血管疾病的高风险。
34.本发明进一步公开了一种标志物在制备用于评估受试者心血管疾病风险的装置中的用途,其中所述标志物为心率低谷相位和夜间心率差异a的至少一种。
35.在一个具体实施例中,所述评估心血管疾病风险的装置包括
36.1)数据获取模块;
37.2)数据预处理模块;
38.3)数据拟合模块,包括
39.i)全局拟合模块;和可选择的
40.ii)局部拟合模块;
41.4)报告模块;
42.其中,所述数据获取模块用于获取受试者的心率数据,包括下载受试者的心率数据和向数据预处理模块输出数据;
43.所述数据预处理模块用于获取静息态数据,包括将受试者的心率数据按天分割确定夜间静息态时间段以及进一步去除波动的峰获得静息态数据;
44.所述全局拟合模块用于获取心率低谷相位和/或夜间心率差异,包括使用三角函数将所述夜间静息态数据拟合为曲线,以获取心率低谷相位,和/或计算夜间心率差异;
45.所述局部拟合模块用于在拟合曲线中获得夜间静息态时间段内的局部峰和局部谷的信息;
46.报告模块所述报告模块用于按照心率低谷相位或夜间心率差异的值评估受试者心血管疾病风险。
47.在一个具体实施例中,所述装置包括可操作地附接到计算设备的输入设备和可穿戴设备中的至少一种。
48.在一个具体实施例中,所述装置包括能够收集连续心率的设备诸如holter动态心电监测系统或带心率模块的可穿戴设备。
49.装置和系统
50.另一方面,本发明公开了一种评估心脏生物节律或心血管疾病风险的装置,包括:
51.1)数据获取模块;
52.2)数据预处理模块;
53.3)数据拟合模块,包括
54.i)全局拟合模块;和可选择的
55.ii)局部拟合模块;
56.4)报告模块;
57.其中,所述数据获取模块用于获取受试者的心率数据,包括下载受试者的心率数据和向数据预处理模块输出数据;
58.所述数据预处理模块用于获取静息态数据,包括将受试者的心率数据按天分割确定夜间静息态时间段以及进一步去除波动的峰获得静息态数据;
59.所述全局拟合模块用于获取心率低谷相位和/或夜间心率差异,包括使用三角函数将所述夜间静息态数据拟合为曲线,以获取心率低谷相位,和/或计算夜间心率差异;
60.所述局部拟合模块用于在拟合曲线中获得夜间静息态时间段内的局部峰和局部谷的信息;
61.所述报告模块用于评估受试者心脏生物节律或心血管疾病风险。
62.报告模块在一个具体实施例中,所述装置进一步包括数据采集模块,用于采集受试者的24小时以上的连续心率数据,优选所述数据为大约24小时、大于24小时例如36小时、48小时、60小时、72小时、1周、2周、3周、4周、1个月、2个月、3个月、6个月、9个月、12个月的心率数据。
63.在一个具体实施例中,所述装置中使用标志物为心率低谷相位和/或夜间心率差异评估评估心脏生物节律或心血管疾病风险。
64.在一个具体实施例中,使用周期为24小时的cos函数,最小二乘法将夜间静息态数据进行全局拟合,获取心率低谷相位的值。
65.在一个具体实施例中,所述夜间心率差异为夜间静态数据拟合的心率曲线的振幅。
66.在一个具体实施例中,在报告模块中,当心率低谷相位的值在0到5之间和或夜间心率差异的值在2.75到26之间时,受试者被评估为心血管疾病的低风险;当心率低谷相位的值≤0时,受试者被评估为心房异常诸如房颤或房扑的高风险;当心率低谷相位的值≥5时,受试者被评估为心房异常诸如房颤或房扑的高风险,或心室异常诸如室颤或室扑的高风险;当夜间心率差异的值≥26时,受试者被评估为心房异常和传导阻滞的高风险;当夜间心率差异的值≤2.75时,受试者被评估为窦性心动过速和qrs的高风险。所述受试者为存在心脏生物节律。
67.在一个具体实施例中,在报告模块中,所述受试者为无心脏生物节律或夜间平均心率/白天平均心率≥1时,受试者被评估为心血管疾病的高风险。
68.在一个具体实施例中,其中所述装置包括可操作地附接到计算设备的输入设备。
69.在一个具体实施例中,其中所述装置可为可穿戴设备。
70.在一个具体实施例中,其中所述装置进一步包括能够收集连续心率的设备诸如holter动态心电监测系统或带心率模块的可穿戴设备。
71.又一方面,本发明公开了一种评估心脏生物节律或心血管疾病风险的系统,包括如前任一项所述的装置,其中通过拟合心率低谷相位和夜间心率差异中的至少一种,进而评估心脏生物节律或心血管疾病风险。
72.在一个具体实施例中,当心率低谷相位在0到5之间和或夜间心率变化在2.75到26之间时,受试者属于心血管疾病低的风险;当心率低谷相位≤0时,受试者属于心房异常诸如房颤或房扑的高风险;当心率低谷相位≥5时,受试者属于心房异常诸如房颤或房扑的高风险,或属于心室异常诸如室颤和/或室扑的高风险;当夜间心率差异≥26时,受试者属于心房异常和传导阻滞的高风险;当夜间心率差异≤2.75时,受试者属于窦性心动过速和qrs的高风险。
73.另一方面,本发明公开了一种能够收集连续心率的装置用于评估心脏生物节律或心血管疾病风险中的用途。
74.在一个具体实施例中,通过拟合心率低谷相位和夜间心率差异中的至少一种,进而评估心脏生物节律或心血管疾病风险。
75.在一个具体实施例中,所述能够收集连续心率的装置包括holter动态心电监测系统或带心率模块的可穿戴设备。
附图说明
76.图1示出心率分析方法的流程图。
77.图2示出心率分析结果示意图。细线条代表为原始心率曲线;连续粗线条代表滤波后的曲线;虚线为全局cos拟合得到的曲线;黑色六角星为全局拟合曲线最低点;
×
代表局部谷点;*代表局部峰点;两侧加粗线段为入睡和醒来时的心率曲线(用于获取快速上升、下降斜率)。
78.图3示出心率生物节律参数分析结果示意图。灰色点代表原始心率数据,连续灰色曲线代表滤波后的曲线;左侧淡灰色弧形曲线为cos拟合得到的心率低谷曲线;黑色粗线条标示了心率下降和上升曲线;黑色点代表心率最低谷。
79.图4示出心率低谷相位对比时型问卷结果。
80.图5示出心率低谷相位对比dlmo的结果。
81.图6示出holter患者心率节律分组。
82.图7示出极端心率生物节律参数人群cvd风险。
具体实施方式
83.下面将通过具体描述,对本发明作进一步的说明。
84.除非另有限定,本文中所使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解相同的含义。
85.本技术中,单数形式“一个”、“该”包括复数对象,除非上下文另外清楚规定。
86.如本文所用,术语“受试者”包括任何人或非人动物。术语“非人类动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类动物、绵羊、狗、猫、马、牛、鸡、大鼠、小鼠、两栖动物、爬行动物等。除非另有说明,否则术语“患者”或“受试者”可互换使用。在本发明中,优选的受试者是人类。
87.如本文所用,术语“静息态数据”也称为“夜间静息态数据”,是指通过校准时间、数据划分和滤波后,并除去了睡眠周期、起夜活动等干扰数据之后获得的夜间睡眠期间时间段的心率数据。术语“夜间静息态时间段”是指通过校准时间、数据划分和滤波后获得的夜间睡眠状态的时间段。本发明中所述的夜间静息态数据是经过了数据预处理后的数据。
88.如本文所用,术语“心率低谷相位”是指使用夜间静息态数据经过三角函数拟合曲线后,获得的曲线最低谷的时间点,该时间用于反映心脏生物节律。
89.如本文所用,术语“夜间心率差异”是指使用夜间静息态数据经过三角函数拟合曲线后,获得的夜间的心率拟合曲线的振幅。
90.如本文所用,术语“无心脏生物节律”是指使用了jonckheer-terpstra-kendall节律性分析(jtk_cycle)算法来确定的心率数据无节律。
91.如本文所用,术语“可穿戴设备”是指直接穿在身上,或是整合到用户的衣服或配件的一种便携式设备。可穿戴设备可以是一种硬件设备,所述设备可通过软件支持以达到数据交互、云端交互或数据分析的目的。
92.实施例
93.下述实施例中的实验方法,如无特殊说明,均为常规方法。将参照下述非限制性实验实施例进一步理解本发明。
94.实施例1心率分析方法
95.本发明中分析方法使用的是连续记录的心率数据,可以来源于holter动态心电监测系统或带心率模块的可穿戴设备,心率数据密度常规为每分钟1个数据点。
96.具体地,共招募了211名志愿者(72名男性,139名女性)。志愿者需完成晨间-夜间问卷调查(morningness-eveningness questionnaire,meq),然后佩戴智能腕带至少1个月进行数据采集。可穿戴设备从两家独立供应商处购买。智能腕带采集的1分钟频率的心率hr数据在用户授权后通过应用程序接口从厂商云服务器上检索,并存储在本地数据库中。本研究设计符合赫尔辛基宣言,并经苏州大学伦理委员会批准(ecsu-201800098)。
97.由于白天心率数据受运动、工作强度、社交等多种主观因素及外部因素影响,不能客观反映个体当天的生物节律,因此选取夜间静息态的心率数据作为获取节律参数的数据来源。经过预处理去除了夜间静息态数据中睡眠周期、起夜活动等干扰之后使用三角函数拟合获取核心全局参数。此外,还使用巴特沃兹滤波器(butterworth filter)滤波获取了夜间静息态数据中小的峰谷参数。总体流程示意图参见图1,具体包含以下步骤:
98.1)获取静息态数据时间段:
99.1-1)校准时间
100.时间数据是后续处理的基准,考虑到不同软件对时间数据存储的特殊性与差异性,在工作开始之前需对初始时间进行校准。
101.1-2)数据划分
102.以每天14点为分割点,以天为单位,对时间序列数据进行划分。同时,对残缺数据进行筛选。
103.1-3)滤波
104.将每天的心率数据做成曲线图,该曲线是由宏观的生物钟曲线和许多细小的噪声(抖动)叠加形成,即分别由低频成分与高频成分组成。其中低频成分对应的曲线变化缓慢,高频成分对应的曲线变化剧烈。
105.为了研究睡眠阶段的生物钟曲线,需要过滤掉高频噪声,故使用低频滤波器过滤或者大幅度衰减曲线的高频成分,让低频成分通过。此处使用butterworth低通滤波器,得到滤波后的数据。
106.1-4)获取睡眠数据(静息态)
107.a.利用滤波后的数据smooth_filter,计算全天的心率均值b_mean以及全天的心率中位数b_prctile,取两者最小值作为临界值b_inf。
108.b.求睡眠数据起始点:取长度interval(1)=240(单位:分钟),计算时间区间[1:interval(1)]内,有多少点对应的心率小于b_inf,即位于b_inf下方的点的个数,记为count_point。
[0109]
c.若count_point=0,时间区间向右滑动interval(1),对新的时间区间做类似b的操作。
[0110]
若0《count_point《interval(1),向右滑动1单位,对新的时间区间做类似b的操
作。
[0111]
若count_point=interval(1),将对应时间区间的左端点标记为睡眠数据起始点,循环结束。
[0112]
d.求睡眠数据终止点:
[0113]
原理与a相同,改为从右向左判断,
[0114]
e.若count_point=0,时间区间向左滑动interval(1),对新的时间区间重复d的操作。
[0115]
若0《count_point《interval(1),向左滑动1单位,对新的时间区间重复d的操作。
[0116]
若count_point=interval(1),将对应时间区间的右端点标记为睡眠数据终止点,循环结束。
[0117]
针对夜间睡眠时间过短的情况,上述方法可能未能有效获取所需数据,此时,将区间长度由interval(1)=240改为interval(2)=120(单位:分钟),重复相关步骤。
[0118]
f.为了获取更完善的睡眠数据,考虑对两端略微进行延伸。
[0119]
对于左端(起始端),若有延伸余量,则考虑将起始点向左移动continue_len=60(单位:分钟)。若出现溢出,即此时起点超出实际记录范围,则取0《=移动量《continue_len.
[0120]
对于延伸的这段数据,做一阶差分。定义上升数为差分数据中大于零的个数,定义下降数为差分数据中小于零的个数。计算上升数与下降数,若下降数》=2倍的上升数,则认为有必要进行延伸,更改起始点坐标,否则无需延伸,即不必修改坐标。
[0121]
g.对于右端(终止端),若有延伸余量,则考虑将终止点向右移动continue_len=60(单位:分钟)。若出现溢出,即此时终点超出实际记录范围,则取0《=移动量《continue_len.
[0122]
对于延伸的这段数据,做一阶差分,按前述定义计算上升数与下降数,若上升数》=2倍的下降数,则认为有必要进行延伸,更改起始点坐标,否则无需延伸,即不必修改坐标。
[0123]
h.根据由f和g确定的坐标,切分出睡眠数据。
[0124]
2)在静息态时间段内,去除波动的峰(被认为是睡眠周期、起夜活动等干扰因素)进而获得经过预处理后的夜间静息态数据
[0125]
对获取的睡眠数据,因为整个睡眠阶段会包含许多小的睡眠周期,反映在心率曲线上就是许多小的波动,为获得宏观的睡眠静息态数据,使用滑动窗口对数据进行遍历比较,定义出局部波峰波谷的起点/终点并进行删除。
[0126]
3)使用周期为24小时的cos函数,最小二乘法(自适应参数选取)全局拟合获取最低谷相位和心率差异;
[0127]
相位为拟合所得cos曲线最低点所对应的时间(图示黑色六角星横坐标)
[0128]
心率差异计算方法:
[0129]
夜间心率差异=2*(夜间心率均值-cos拟合曲线最低位置的心率)
[0130]
昼夜心率差异=2*(全天心率均值-cos拟合曲线最低位置的心率)
[0131]
4)计算静息与活动两种状态变化时心率的快速下降、上升曲线相关的参数;
[0132]
将睡眠数据三等分,记为左、中、右三部分。
[0133]
利用左段数据求进入睡眠状态时斜率值。取长度interval(3)=50的时间区间,定义统计量“下降得分”,用以判断此时所选的时间区间的质量(即用该区间求斜率的效果)。定义:对区间数据做一阶差分,计算下降数(差分数据中小于零的个数),下降量(差分数据中小于零的值求和然后取绝对值),再以0.3,0.7为权重将两者求和,称为区间的下降得分。遍历左段,寻找得分最高的区间段,寻找此区间左半段的最大值max_info及其所在位置max_place,寻找右半段的最小值min_info及其所在位置。
[0134]
进入睡眠状态的斜率为该时间段内每分钟心率下降的数量(取负)。下降结束时间为入睡时间段最后一个时刻对应的时间,下将结束心率为下降结束时间对应的心率。
[0135]
利用右段数据求醒来阶段的斜率值。取长度interval(3)=50的时间区间,定义“上升得分”,用以判断此时所选的时间区间的质量(即用该区间求斜率的效果)。定义:对区间数据做一阶差分,计算上升数(差分数据中大于零的个数),上升量(差分数据中大于零的值求和),再将两者以0.3,0.7为权重求和,称为区间的上升得分。遍历右段,寻找得分最高的区间段。寻找此区间左半段的最小值min_info及其所在位置min_place,寻找右半段的最大值max_info及其所在位置max_place。醒来阶段的斜率值为该时间段内每分钟心率上升的数量。上升开始时间为醒来时间段第一个时刻对应的时间,上升开始心率为下上升开始时间对应的心率。
[0136]
5)基于巴特沃兹滤波器计算静息态时间段内的多个局部小波动参数(可能与睡眠周期有关)。
[0137]
使用滤波后的睡眠数据计算局部波峰与波谷,将时间区间三等分,计算时间区间左、中、右三部分的心率均值,以及左、右两部分的心率最大或小值。若区间中部的心率均值同时大于左、右两部分的均值,并且中间部分最大值与左半部分最小值的差以及与右半部分最小值的差均大于阈值,则取时间区间内心率最大值为局部峰值点。若区间中部的心率均值同时小于左、右两部分的均值,并且左半部分最大值以及与右半部分最大值与中间部分最小值的差均大于阈值,则取时间区间内心率最小值为局部谷值点。
[0138]
将夜间振幅低于最低5%的情况归为无节律,将夜间相位与人群平均相位相差正负10—14小时的情况归为反相位。这两种情况不再继续判断其他参数。如果没有这两种情况,则输出参数中节律意义明显的6个:夜间相位、夜间心率的振幅、夜间心率的均值、夜间心率快速下降的斜率、夜间心率快速上升的斜率、睡眠对称性指标,将结果输出个客户。
[0139]
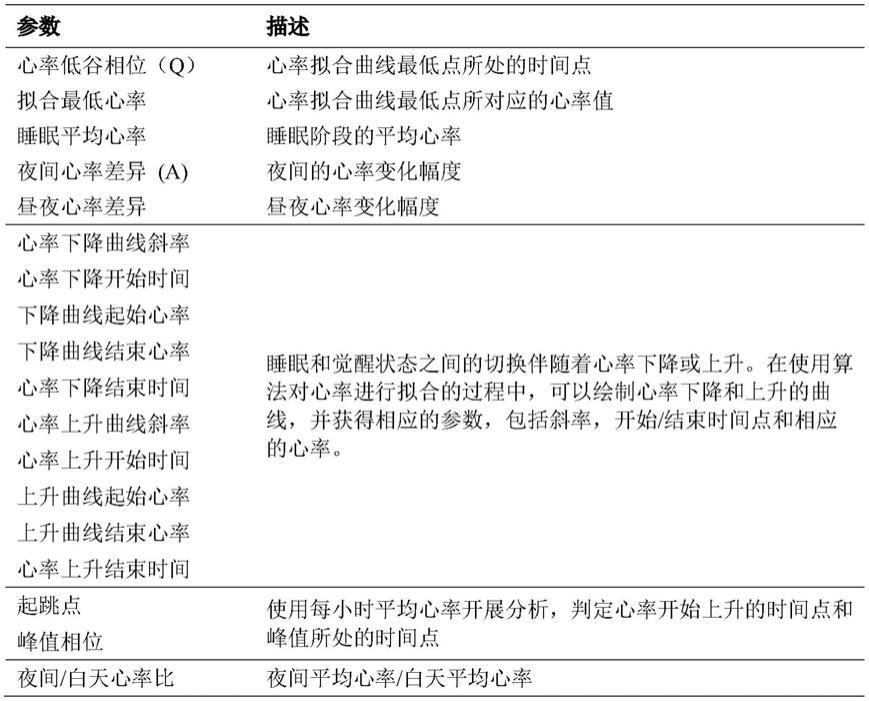
心率曲线的拟合见图2,生物节律参数分析结果示意图见图3,所解析的参数列表见表1,其中最为关键参数是:
[0140]
1)心率低谷相位:生物节律常规定义节律性数据最高峰所对应的时间点为相位(峰值相位),但由于日间心率数据受活动干扰比较大,我们的算法选择使用夜间睡眠期间心率拟合曲线的最低谷对应的时间点来反映心率节律相位,即心率低谷相位。
[0141]
2)夜间心率差异:振幅也是生物节律中的重要参数,常规是拟合曲线最高峰与最低谷之间的差,体现了心率在24小时周期内的振荡强度。由于我们主要针对夜间数据开展分析,所以定义了夜间的心率变化,即夜间心率差异。
[0142]
表1.心率生物节律参数列表
[0143][0144]
实施例2心率生物节律分析结果准确性
[0145]
为证明心率低谷相位可以作为生物节律的标志物,发明人使用了现有技术中生物节律分析常用的成熟工具(早晚时型问卷med和暗光下褪黑素浓度变化dlmo)进行了比对。分析步骤和结果如下:
[0146]
1.心率低谷相位和时型问卷结果比对
[0147]
早晚时型问卷(meq)是一个分析个人时型的成熟工具,我们开展了志愿者实验对比了心率生物节律分析所获得的心率低谷相位和meq时型。根据211名志愿者中获得的结果,心率低谷相位和emq时型呈现良好的相关性(附图4a)。进一步对心率低谷相位值和时型问卷分数(分数越高,时型越晚)开展相关性分析,结果显示两者呈显著的负相关性(附图4b,显著性p《0.0001)。
[0148]
2.心率低谷相位和dlmo结果比对
[0149]
暗光下褪黑素浓度变化(dlmo)被认为是判定个体昼夜节律的一个金标准。我们也开展实验对比了心率生物节律分析所获得的心率低谷相位和dlmo。
[0150]
12名志愿者从18:00至24:00聚集在两个避光室。每隔30分钟采集一次唾液样品,存放在冰箱中,并进行elisa试剂盒(瑞士ibl国际公司)检测。在matlab中用hockey-stick法测定每个人的褪黑素起始时间(danilenko kv,verevkin eg,antyufeev vs,wirz-justice a,cajochen c:the hockey-stick method to estimate evening dim light melatonin onset(dlmo)in humans.chronobiol int 2014,31:349-355.)。
[0151]
根据在9名志愿者中获得的结果,心率低谷相位和dlmo的相关性分析证明两者呈线性相关(图5,相关系数r=0.89,显著性分析p《0.05)。
[0152]
以上这两个方面的对比分析证实了心率低谷相位能够获得准确反应个体的生物节律状态,是良好的标志物。
[0153]
实施例3心率生物节律与心血管疾病相关性
[0154]
为了进一步分析心率生物节律参数与心血管疾病发病率的关系,收集了苏州大学第一附属医院心内科2010年9月至2014年7月期间的11 074份holter历史数据集,覆盖相关患者。然后对holter数据集进行筛选,以保证数据的完整性,并排除使用人工心脏起搏器的患者,从而对时间型进行无偏分析。共有10,095个数据集进行了进一步分析。使用holter软件ecglab(深圳生物医学仪器公司)的定制模块导出1分钟频率的简化hr数据以及诊断结论。本回顾性研究设计得到了医院伦理审查委员会的批准(申请号:2019025)。10,095例临床患者的holter心率数据中,患者的年龄为8至97岁,大多数人群(25%-75%百分位数)介于48至68岁之间。holter数据包含了完整的心电图,我们从中导出了简单心率数据(每分钟1个数据点),使用实施例1记载的方法分析了这些患者心率的生物节律参数。此外,holter数据同时包含了诊断结论,holter数据集包含有经验的心脏病医生根据临床指南(aha/accf/hrs关于心电图标准化和解释的建议)给出的诊断结论。我们也从中提取了与心血管疾病相关的临床指标,并将它们分为7大类共13小类cvd指标(表2)。
[0155]
表2.cvd指标分类
[0156][0157]
我们首先用butterworth滤波器对数据进行过滤去噪。然后采用滑动窗口来自动区分休息期和活动期,通过标记hr下降和上升的斜率来代替固定的白天和晚上。通过与过滤后的hr数据计算出的阈值进行比较,将滑动窗口的第一个时间点,即所有hr都低于阈值的时间点视为夜间期的起点。进行类似的处理来确定夜间的结束。之后,采用最小二乘法对夜间hr数据进行cos函数拟合。自动确定最低拟合hr值和低谷期时间。此外,利用日平均hr值、平均静息hr值和最低拟合hr值可以计算出受试者夜间和整个昼夜周期内的hr夜间和昼夜变化。采用k-means聚类的算法,自动搜索从低稳定状态向高状态转变的起始、时机。第一个活动点t tonset1和第一个时间点t tonset2,其中t tonset2的数据点与前三个点的平均值之差达到一定阈值的时间点在凌晨4点以后是两个候选的发病时间。选取两个候选点中较早的一个作为发病时间。同样,所有的参数都是从基于腕带的hr数据中检索出来的。
[0158]
我们首先分析了心率有无节律与cvd的关系,使用jonckheer-terpstra-kendall节律性分析(jtk_cycle)算法判断心率数据有无节律,根据结果将holter患者分为无节律(32.5%)和有节律(67.5%)两大类,其中有节律组又进一步分为反相位组(夜间平均心率/白天平均心率≥1)和正相位组(图6)。线性回归用于评价相关性,在graphpad prism 8中采用单因素方差分析的bonferroni检验,通过输入心电图数据中cvd指数的基线特征和时型:
心律失常型、反相型和节律型,评价疾病发生与时型之间的关联。所有统计分析中,双侧p值《0.05,认为有统计学意义。使用bonferroni分析,我们发现:与正常节律人群相比,反相位人群的房性事件、室性事件、窦性心动过速、传导阻滞和qrs风险显著升高;而无节律人群的房性事件、窦性心动过缓、传导阻滞和qrs风险显著升高(表3)。
[0159]
为了深入评价心率生物节律参数与cvd指标之间的相关性,我们进行了递进偏相关分析,以确定有节律组人群(包括正相位和反相位)的心率低谷相位(hr trough phase)和夜间变化(nocturnal variation)这两个参数的临界点。我们发现:心率低谷相位在0到5之间(有节律人群的89.7%),夜间心率变化在2.75到26之间(有节律人群的91.9%)的人群cvd指标风险较低。根据临界点确定了正常范围后,使用pearson相关性分析进一步研究了异常范围内人群心率生物节律参数与cvd风险指标的相关性。结果显示:
[0160]
表3.不同心率生物节律人群cvd风险比较
[0161][0162]
统计差异显著性
[0163]
*:p《0.05;**:p《0.01;***:p《0.001;****:p《0.0001
[0164]
在有节律的人群中,极端的心率低谷相位(或)与心房异常事件(房颤、房扑)密切相关(图7a),而心室异常事件(室颤和室扑)仅与心率低谷相位严重延迟相关(图7a)。
[0165]
在反相位人群中,夜间心率变化与心房异常事件和窦性心动过缓的相关性最强(图7b)。
[0166]
在有节律的人群中,夜间心率变化过大(a≥26)与心房事件和传导阻滞密切相关(图7c),而夜间心率变化过小(a≤2.75)则与窦性心动过速和qrs呈明显相关性(图7c)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1