鸟嘌呤核苷的新用途的制作方法
本发明属于药物技术领域,具体涉及鸟嘌呤核苷在制备mapk、nf-κb、stat3抑制剂或治疗哮喘药物中的新用途。
背景技术:
哮喘是最常见的慢性非传染性疾病之一,成人哮喘患病率为4.3%。哮喘患病率逐年上升,据估计,从1990年到2015年,哮喘的患病人数上升至3.582亿,增长了12.6%;2015年有40万人死于哮喘。尽管吸入糖皮质激素(ics)是大多数患者的一线治疗用药,但儿童和成人对ics的依从性极差,并且有一小部分患者对糖皮质激素耐药。因为患者认为,短效β2激动剂(saba)比ics更熟悉和更易接受、更便宜、更安全。因此,中国只有5.6%的哮喘患者接受了常规的ics治疗。然而,根据《全球哮喘防治倡议》(gina)的规定,仅使用saba治疗会增加哮喘恶化和死亡的风险。因此,迫切需要开发更安全,更有效的哮喘治疗药物。
鸟嘌呤核苷(鸟苷)是一种内源性核苷,是合成dna和rna的原料之一。在医药工业上,其主要的用途是作为合成三氮唑核苷、无环鸟苷的中间体。在食品工业上,其作为呈味核苷酸鸟苷酸二钠的主要原料,与肌苷酸二钠混合简称i+g,添加到味精中即为第二代、第三代味精,具有十分广阔的市场。
鸟嘌呤核苷对哮喘的作用及其分子机制目前还未见报道。
技术实现要素:
本发明的目的是针对现有技术中迫切需要开发更安全,更有效的哮喘治疗药物的问题,提供鸟嘌呤核苷用于制备治疗哮喘的药物的用途。
本发明提供鸟嘌呤核苷或其药学上可接受的盐、或其晶型、或其立体异构体、或其光学异构体在制备治疗哮喘的药物中的用途。
优选的,哮喘为吸入性哮喘、感染型哮喘、混合型哮喘、职业性哮喘、慢性哮喘性支气管炎、运动性哮喘或慢性哮喘。
优选的,药物是减轻气道炎症、减轻气道纤维化和/或减轻气道高反应性的药物。
优选的,药物的制品形式为药丸、药水、吸入剂或喷雾剂。
本发明还提供一种治疗哮喘的药物,它是以鸟嘌呤核苷为活性成分,加上药学上可接受的辅料或者辅助性成分制备而成。
优选的,药物的制品形式为药丸、药水、吸入剂或喷雾剂。
本发明还提供鸟嘌呤核苷或其药学上可接受的盐、或其晶型、或其立体异构体、或其光学异构体在制备p38mapk抑制剂、p65nf-κb抑制剂或stat3抑制剂中的用途。
优选的,
p38mapk抑制剂用于治疗恶性肿瘤、炎症或神经系统疾病,优选的,所述p38mapk抑制剂用于治疗口腔癌、口咽癌、鼻咽癌、呼吸系统癌、泌尿生殖系统癌、胃肠癌、中枢神经系统或周围神经系统组织癌、内分泌或神经内分泌癌或造血系统癌、胶质瘤、肉瘤、肿瘤、淋巴瘤、黑色素瘤、纤维瘤、脑膜瘤、脑癌、口咽癌、肾癌、胆道癌、嗜铬细胞瘤、胰岛细胞癌、li-fraumeni肿瘤、甲状腺癌、甲状旁腺癌、垂体瘤、肾上腺肿瘤、成骨肉瘤、i型多发性神经内分泌和ii型肿瘤、乳腺癌、肺癌、头颈癌、前列腺癌、食道癌、气管癌、肝癌、膀胱癌、胃癌、胰腺癌、卵巢癌、子宫癌、宫颈癌、睾丸癌、结肠癌、直肠癌、皮肤癌、关节炎、炎症性肠疾、哮喘、牛皮癣、心肌损伤、中风、阿尔兹海默症、艾滋病、慢性阻塞性肺病、多发性骨髓瘤、骨髓增生异常综合征、急性呼吸窘迫综合症、冠心病、急性冠脉综合征、重度抑郁症、牙痛、动脉粥样硬化或神经性疼痛中的一种或多种的组合;
p65nf-κb抑制剂用于治疗恶性肿瘤、炎症或神经系统疾病,优选的,所述p65nf-κb抑制剂用于治疗白血病、淋巴瘤、多发性骨髓瘤、非小细胞肺癌、鼻咽癌、乳腺癌、结肠癌、胃癌、胰腺癌、膀胱癌、前列腺癌、卵巢癌、肝癌、霍奇金病、甲状腺癌、黑色素瘤、动脉硬化症、骨吸收、心肌肥厚、心脏衰竭、缺血/再灌注、多发性硬化症、肌营养不良、慢性阻塞性肺疾病、全身炎症反应综合症、神经病理学疾病、炎症性肠病疾病、关节炎、哮喘、狼疮、肿瘤发生、病毒感染、糖尿病、阿尔茨海默氏病、艾滋病或抑郁症中的一种或多种的组合;
stat3抑制剂用于治疗恶性肿瘤、皮肤疾病、炎症或自身免疫性疾病,优选的,所述stat3抑制剂用于治疗乳腺癌、卵巢癌、头颈部鳞状细胞癌、前列腺癌、恶性黑色素瘤、多发性骨髓瘤、淋巴瘤、脑瘤、非小细胞肝癌、白血病、银屑病、扁平苔鲜、皮肤肿瘤、基底细胞上皮瘤、湿疹样癌、炎症性肺病、哮喘、慢性肾炎、胃炎、胰腺炎、梗阻性肾病、糖尿病肾小球病、视网膜炎、系统性红斑狼疮、类风湿性关节炎、硬皮病、甲状腺机能元进、青少年糖尿病、多发性硬化症、自发性血小板减少性紫癜、溃疡性结肠炎、自身免疫性肝炎或原发性胆汁性肝硬化中的一种或多种的组合。
本发明还提供一种p38mapk抑制剂,它是以鸟嘌呤核苷为活性成分,加上药学上可接受的辅料或者辅助性成分制备而成。
本发明还提供一种p65nf-κb抑制剂,它是以鸟嘌呤核苷为活性成分,加上药学上可接受的辅料或者辅助性成分制备而成。
本发明还提供一种stat3抑制剂,它是以鸟嘌呤核苷为活性成分,加上药学上可接受的辅料或者辅助性成分制备而成。
“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上za与受体相兼容。
“盐”是将化合物或其立体异构体,与无机和/或有机酸和/或碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。
本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
通过相关实验研究的结果发现:在体外thp-1源性巨噬细胞炎症模型中,鸟嘌呤核苷通过抑制mapk和nf-κb的激活抑制促炎因子il-6的生成。在哮喘小鼠模型中,鸟嘌呤核苷降低了小鼠血浆ova-ige,降低il-4、il-6和il-13的产生,减轻气道高反应性,减轻肺组织细胞浸润、气道炎症和胶原沉积。此外,鸟嘌呤核苷治疗组小鼠肺组织p-p38mapk,p-p65nf-κb,p-iκbα、p-stat3蛋白表达水平明显低于哮喘模型组。
因而,鸟嘌呤核苷能够作为活性成分用于制备哮喘治疗药物,其还可以作为p38mapk抑制剂、p65nf-κb抑制剂、stat3抑制剂,其中,p38mapk抑制剂可以用于治疗恶性肿瘤、炎症或神经系统疾病,因此,本发明还可以作为治疗恶性肿瘤、炎症或神经系统疾病的药物;p65nf-κb抑制剂可以用于治疗恶性肿瘤、炎症或神经系统疾病,因此,本发明还可以作为治疗恶性肿瘤、炎症或神经系统疾病的药物;stat3抑制剂可用于治疗恶性肿瘤、皮肤疾病、炎症或自身免疫性疾病,因此,本发明还可以作为治疗恶性肿瘤、皮肤疾病、炎症或自身免疫性疾病。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
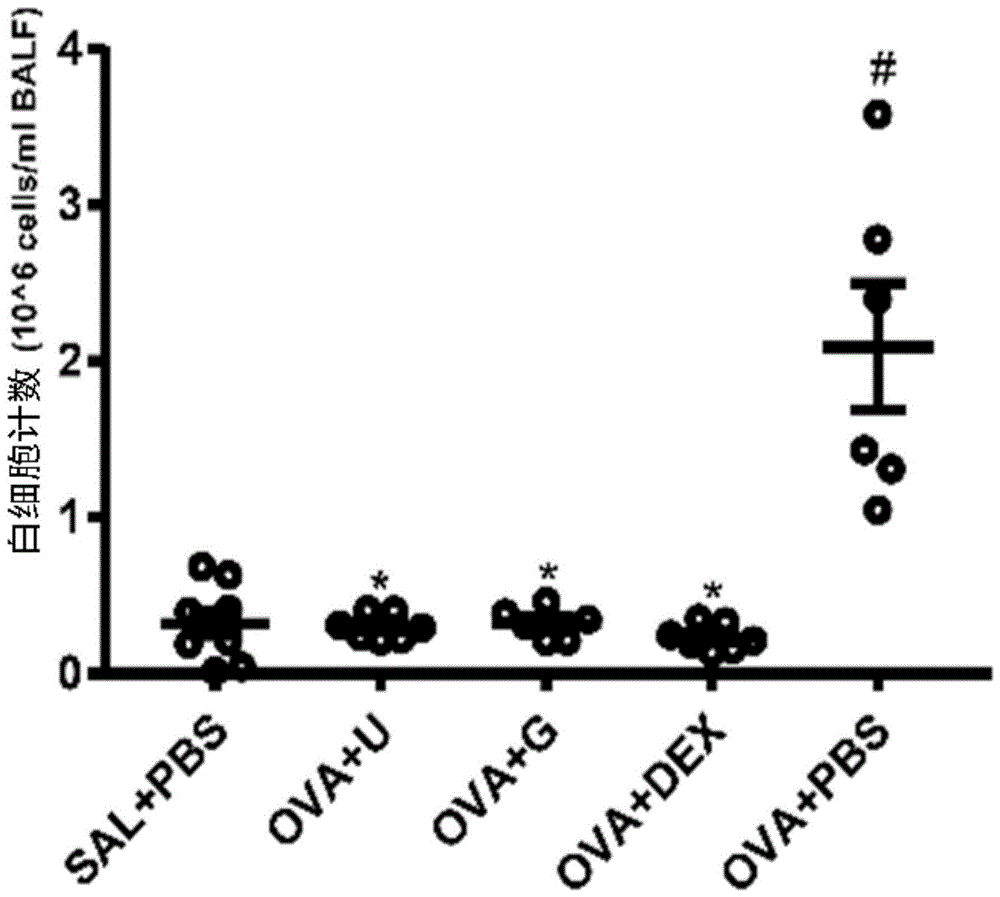
图1为本发明实施例1中鸟嘌呤核苷、尿嘧啶核苷、地塞米松对ova所致哮喘小鼠肺泡灌洗液中总白细胞数目的影响;
图2为本发明实施例1中肺组织的h&e染色;
图3为本发明实施例2中肺组织的masson染色;
图4为本发明实施例3中不同浓度氯化乙酰胆碱激发后各组小鼠的增强呼气间歇值(penh);
图5为本发明实施例4中各组小鼠肺组织il-4、il-6、il-13的表达水平;
图6为本发明实施例5中各组小鼠血浆中ova-ige水平;
图7为本发明实施例6中各组小鼠肺组织中炎症介质的mrna水平;
图8为本发明实施例7中免疫组化方法检测小鼠肺组织p-p38mapk的表达情况;
图9为本发明实施例7中免疫印迹实验检测小鼠肺组织p38mapk的磷酸化、总蛋白的表达水平;
图10为本发明实施例8中免疫印迹实验检测小鼠肺组织nf-κb的磷酸化、总蛋白的表达水平;
图11为本发明实施例8中免疫印迹实验检测小鼠肺组织p-stat3、stat3;p-iκbα、iκbα蛋白表达水平;
图12为本发明实施例9中鸟嘌呤核苷、尿嘧啶核苷对thp-1源性巨噬细胞il-6表达水平的影响;
图13为本发明实施例10中鸟嘌呤核苷、尿嘧啶核苷对thp-1源性巨噬细胞p38mapk蛋白表达水平的影响;
图14为本发明实施例11中鸟嘌呤核苷、尿嘧啶核苷对thp-1源性巨噬细胞蛋白表达水平的影响。
具体实施方式
下面通过具体的实施例对本发明的技术方案做进一步的说明:
实施例1:鸟嘌呤核苷减轻卵清蛋白(ova)所致哮喘小鼠的气道炎症本实施例实验过程如下:
(1)哮喘动物模型的建立
新购的4-6周龄的balb/c雌性小鼠饲养于spf级环境中适应一周后再开展实验。
1)第1、14天,阴性对照组腹腔注射100μl0.9%nacl;除阴性对照组外,其余组每只小鼠腹腔注射100μl含40μg卵清蛋白(ova)和4mg注射铝佐剂的溶液。
2)第24~26天,小鼠超声雾化吸入质量分数1%的ova溶液(pbs溶解)30分钟,阴性对照组吸入雾化pbs缓冲液30分钟。雾化前1h,地塞米松组腹腔注射1mg/kg的地塞米松;尿嘧啶核苷组气管内注射6.1mg/kg的尿嘧啶核苷;鸟嘌呤核苷组腹腔注射6.1mg/kg的鸟嘌呤核苷;
由此得到阴性对照组(sal+pbs)、地塞米松治疗组(ova+dex)、尿嘧啶核苷治疗组(ova+u)、鸟嘌呤核苷治疗组(ova+g)和哮喘模型组(ova+pbs)共五组小鼠。
(2)肺泡灌洗液及总白细胞计数
第27天,进行气道高反应性检测后,腹腔注射水合氯醛麻醉,暴露胸腔,心尖取血后将左侧肺门结扎,分离颈部气管,对右侧肺叶进行灌洗,缓慢推入0.6mlpbs,停留5s后缓缓吸出并重复两次。将收集的肺泡灌洗液4℃,3500rpm离心15min,100μlpbs重悬细胞沉淀,10μl细胞悬液与10μl台盼蓝混合均匀后用
细胞计数实验结果如图1所示:
与阴性对照组相比,哮喘模型组肺泡灌洗液中白细胞数目明显增加(p=0.034);与哮喘模型组相比,鸟嘌呤核苷治疗组(p=0.036)、尿嘧啶核苷治疗组(p=0.034)、地塞米松治疗组(p=0.029)白细胞数目均有所降低,其中地塞米松治疗组更为明显。
(3)h&e染色
为进一步证实鸟嘌呤核苷、尿嘧啶核苷能够减轻ova所致的哮喘小鼠的气道炎症,将左侧肺叶进行病理切片,通过h&e染色,检测细支气管、终末支气管周围细胞浸润情况评价小鼠气道炎症。
第27天,进行气道高反应性检测后,左侧肺叶放入包埋框中,4%多聚甲醛固定,常规脱水包埋,4μm厚度切片,然后按以下步骤进行he染色:
1)脱蜡:二甲苯(i)10min,二甲苯(ii)10min
2)复水:依次浸泡于100%、95%、80%、60%中浸泡5min;双蒸水洗3次,每次3分钟;
3)苏木精染色5min,双蒸水洗3min,1%盐酸-乙醇浸泡10s、流水洗1min,双蒸水洗1min;
4)0.5%伊红染色1min,双蒸水洗30s;
5)脱水:80%乙醇(i)30s、95%乙醇(i)1min、95%乙醇(ii)1min、100%乙醇(i)1min、100%乙醇(ii)1min;
6)透明:二甲苯(i)3min,二甲苯(ii)3min;
7)封片:滴加中性树胶,盖上盖玻片后自然风干。
h&e染色结果如图2(上图:放大50倍,scalebar=200μm;下图:放大400倍,scalebar=25μm)所示,阴性对照小鼠肺组织无明显异常改变,肺泡结构清晰;哮喘模型组支气管及血管周围有大量炎症细胞浸润,部分上皮细胞发生脱落,肺泡壁增厚,部分肺泡塌陷,周围肺泡融合扩张;与对照组相比,治疗组的炎症反应明显减轻。
实施例2:鸟嘌呤核苷减轻卵清蛋白(ova)所致哮喘小鼠的气道纤维化
本实施例采用与实施例1相同的方式建立哮喘动物模型。
然后进行masson染色:
第27天,进行气道高反应性检测后,左侧肺叶放入包埋框中,4%多聚甲醛固定,常规脱水包埋,4μm厚度切片,然后按以下步骤进行染色:
1)脱蜡:二甲苯(i)10min,二甲苯(ii)10min
2)复水:依次浸泡于100%、95%、80%、60%中浸泡5min;双蒸水洗3次,每次3分钟;
3)weigert苏木精染8min;
4)酸性乙醇分化5s,蒸馏水洗1min;
5)masson蓝化液反蓝3min,蒸馏水洗1min;
6)丽春红酸性品红染色液染6min,2%醋酸洗1min;
7)1%磷钼酸溶液1min;
8)苯胺蓝染色液中染2min;
9)脱水:80%乙醇(i)30s、95%乙醇(i)1min、95%乙醇(ii)1min、100%乙醇(i)1min、100%乙醇(ii)1min;
10)透明:二甲苯(i)3min,二甲苯(ii)3min;
11)封片:滴加中性树胶,盖上盖玻片后自然风干。
将各组小鼠的肺组织进行masson染色,胶原纤维被染成蓝色,结果如图3(上图:放大50倍,scalebar=200μm;下图:放大400倍,scalebar=25μm)所示,正常小鼠肺组织仅血管周围有少量胶原纤维,而哮喘模型小鼠肺组织血管及支气管周围胶原纤维表达含量明显增加。而地塞米松治疗组(ova+dex)、尿嘧啶核苷治疗组(ova+u)和鸟嘌呤核苷治疗组(ova+g)中的胶原纤维表达含量明显减少。
实施例3:鸟嘌呤核苷明显减轻哮喘小鼠的气道高反应性
气道高反应性是哮喘的一大病理特征,本实施例用全体积描记系统测定小鼠在不同浓度氯化乙酰胆碱激发后的增强呼气间歇值(penh),具体过程如下:
本实施例采用与实施例1相同的方式建立哮喘动物模型。第27天,将小鼠置于全体积描记系统的体描箱中冷静10分钟,然后依次给予0、12.5、25、50、100mg/ml的氯化乙酰胆碱溶液雾化2min,每次雾化后记录6分钟内的penh值。
结果如图4所示,哮喘模型组小鼠的penh值明显高于阴性对照组;与模型组相比,鸟嘌呤核苷、尿嘧啶核苷、地塞米松治疗组penh值明显降低,地塞米松治疗组最为明显。
实施例4:鸟嘌呤核苷明显降低哮喘小鼠的肺部炎症因子表达
本实施例使用elisa试剂盒,按照说明书要求对样品进行测定。本实施例采用与实施例1相同的方式建立哮喘动物模型。第27天后,检测各组小鼠肺组织中il-4、il-6、il-13的表达水平,结果如图5所示,哮喘小鼠和正常小鼠肺组织中il-4、il-6、il-13的表达均有统计学意义(p<0.05),鸟嘌呤核苷、尿嘧啶核苷、地塞米松治疗后il-4、il-6、il-13水平明显低于哮喘小鼠,且均有统计学意义(p<0.05)。
实施例5:鸟嘌呤核苷明显降低哮喘小鼠的ova-ige表达
本实施例使用elisa试剂盒,按照说明书要求对样品进行测定。本实施例采用与实施例1相同的方式建立哮喘动物模型。第27天后,检测各组小鼠血浆中的ova-ige的表达水平,结果如图6所示,与正常小鼠相比,哮喘小鼠血浆中ova-ige水平明显升高(p<0.05);与哮喘小鼠相比,尿嘧啶核苷治疗组ova-ige水平无明显差别,但鸟嘌呤核苷及地塞米松治疗组能明显降低ova-ige水平。
实施例6:鸟嘌呤核苷降低哮喘小鼠多种炎症介质的基因表达
il-6协同tgf-β通过jak-stat通路调节th17细胞的分化,th17细胞分泌的il-17能诱导气道上皮细胞分泌趋化因子cxcl1、cxcl3、cxcl8,这些趋化因子能招募中性粒细胞聚集到炎症部位;il-13能直接刺激气道上皮细胞黏液基因muc5ac的表达,促进粘液分泌,粘液高分泌是哮喘的病理特征之一,也与气道高反应性相关。因此本实施例通过实时荧光定量pcr方法检测细胞因子il-17,粘液基因muc5ac,趋化因子cxcl1、cxcl3的mrna水平。实时定量荧光pcr的具体测试过程如下:
按照实施例1的方法建立哮喘动物模型。第27天,取各组小鼠右侧肺组织在液氮中研磨后,按以下步骤提取肺组织总rna。
1)加1mltrizol,吹打混匀;
2)加200μl氯仿,剧烈摇晃15s,室温静置3min;
3)将2)中的液体在4℃,12000g的离心力条件下离心10分钟,吸取0.5ml上层含rna的水相于干净1.5mlep管中,加入1.5倍体积(即0.75ml)的75%异丙醇,涡旋混匀,4℃静置30min;
4)将3)中的液体在4℃,12000g条件下离心10分钟,弃上清后加入1ml75%乙醇洗涤,涡旋混匀;
5)将4)中的液体在4℃,7500g条件下离心5min,弃上清,开盖静置5min(挥干乙醇);
6)管中加40μldepc水,混匀后即得rna。
7)测rna浓度。
按以下步骤将rna逆转录成cdna:
1)基因组dna的去除:在无酶的1.5mlep管中加入0.7μg模板rna、4μl4×gdnawipermix,再加rnase-freeddh2o至16μl。移液枪轻轻吹打混匀后在pcr仪中42℃加热2min。
2)逆转录:在上一步的ep管中加入4μl的5×hiscriptiiqrtsupermixii,用移液枪轻轻吹打混匀,在该条件下逆转录反应:温度50℃下进行15min;温度85℃下进行5s。
按以下条件实时荧光定量pcr:
1)反应体系(10μl)组成为:
cdna模板(7ng)2μl;
sybrmixture5μl;
引物f(300nm)0.3μl;
引物r(300nm)0.3μl;
depc水to10μl。
2)反应程序:
95℃反应3min;
95℃反应15s后58.5℃(根据具体引物的tm调整)反应1min,该过程循环进行40次;
58.5℃(根据具体引物的tm调整)反应1min。
3)熔解曲线程序:
95℃进行15s;
60℃进行1min;
95℃进行1s。
根据qpcr得到目的基因的cq值,以rplp2为内参基因获得相应的δcq值,以2-δδcq分析各组目的基因相对于对照组的相对表达倍数。
结果如图7所示,与阴性对照组相比,哮喘模型组小鼠肺组织cxcl1、muc5ac、il-17的mrna水平明显升高(p<0.05);而鸟嘌呤核苷、尿嘧啶核苷、地塞米松治疗组cxcl1、muc5ac、il-17的mrna的表达水平对于哮喘模型组则明显下调(p<0.05)。
实施例7:鸟嘌呤核苷抑制哮喘小鼠p38mapk的激活
p38mapk在哮喘病理进程中起重要作用,调节多种炎症相关的细胞功能,导致气道炎症和气道重塑,因此有研究表明p38mapk抑制剂是治疗哮喘、恢复糖皮质激素敏感性的策略之一。本实施例通过免疫组化检测肺组织p-p38mapk的表达情况,用免疫印迹方法检测肺组织p38mapk及p-p38mapk的表达情况。
免疫组化测试的具体过程如下:
按照实施例1的方法建立哮喘动物模型。第27天,进行气道高反应性检测后,左侧肺叶放入包埋框中,4%多聚甲醛固定,常规脱水包埋,4μm厚度切片,然后按以下步骤进行免疫组化实验:
1)脱蜡及复水:二甲苯浸泡10min,更换新的二甲苯重复一次;依次在100%、95%、80%的乙醇中浸泡5min;
2)抗原修复:水浴加热0.01m的枸橼酸缓冲液至95℃左右,放入切片,加热15min,室温冷却约30min;
3)消除内源性过氧化物酶活性:pbs洗三次,每次3min;在3%的h2o2(ddh2o稀释)溶液中孵育10min;pbs洗3次,每次3min;
4)封闭:5%山羊血清(pbs稀释)封闭1h后甩掉多余血清;
5)一抗孵育:滴加稀释好的一抗(pbs稀释,稀释比例1:50),4℃过夜孵育后室温复温30min,pbs洗三次,每次3min;
6)二抗孵育:滴加二抗,37℃下孵育1h,pbs洗三次,每次3min;
7)显色:滴加dab,镜下观察染色程度,掌握反应时间(约为5min);ddh2o中清洗干净;
8)复染:切片浸没于苏木素中复染2分钟,ddh2o冲洗干净;在1%hcl、99%乙醇溶液中浸泡10s,迅速用ddh2o冲洗干净;
9)脱水:80%乙醇(i)30s、95%乙醇(i)1min、95%乙醇(ii)1min、100%乙醇(i)1min、100%乙醇(ii)1min
10)透明:二甲苯(i)3min,二甲苯(ii)3min
11)封片:滴加中性树胶,盖上盖玻片后自然风干。
免疫印迹测试的具体过程如下:
按照实施例1的方法建立哮喘动物模型。第27天,进行组织蛋白的提取。
(1)蛋白提取及浓度测定
1)组织蛋白提取:右侧肺组织在液氮中研磨至粉末,收集于1.5ml离心管中,加入适量蛋白裂解液冰上裂解30min,超声破碎2次,每次2s,间隔8s。在4℃,13000rpm条件下离心10分钟,收集上清液。
2)蛋白浓度测定:①按50体积的bca试剂a液加1体积的bca试剂的b液配制bca工作液;②用pbs配制浓度为0、0.025、0.05、0.1、0.2、0.3、0.4mg/ml的蛋白标准品,并加到96孔板中,每孔20μl;③将样品稀释10倍,即96孔板中每孔加2μl样品和18μlpbs;④每孔加200μlbca工作液,37℃孵育30分钟,检测在562nm处的吸光度值。
(2)蛋白印迹试验
1)取上一步骤中离心后收集的上清液,加入1/4体积的5×loadingbuffer,涡旋混匀后在100℃金属浴中加热变性5min。按后续步骤进行蛋白印迹试验。
2)凝胶电泳:将凝胶固定于电泳槽中,加入电泳缓冲液,缓慢拔出凝胶中的电泳梳,凝胶甬道中加入蛋白marker、20μg蛋白样品,浓缩胶80v恒压电泳30min,分离胶以120v恒压电泳至蓝色loadingbuffer到达凝胶底部。
3)转膜:将比凝胶略大的pvdf膜(孔径20μm)置于甲醇中活化2min,按照海绵垫-滤纸-凝胶-pvdf膜-滤纸-海绵垫的顺序安装转膜夹,将转膜夹安装于转膜槽内(pvdf膜在正极面,胶在负极面),外槽放置生物冰盒,转膜槽内加入足量的转膜液,在冰水浴中恒流300ma转膜60min。
4)封闭:用tbst将10×快速封闭液稀释至1×封闭液,将pvdf膜置于封闭液中,室温摇床封闭10min。
5)一抗孵育:用碧云天一抗稀释液配置一抗工作液,将封闭后的pvdf膜在tbst中漂洗2次,然后置于一抗工作液中,4℃过夜孵育。
6)二抗孵育:用碧云天二抗稀释液配置二抗工作液,将完成一抗孵育的pvdf膜用tbst洗涤3次,每次5min,然后置于二抗工作液中,室温摇床孵育1h。
7)显影:按1体积的ecla液加1体积的eclb液配置ecl工作液,完成二抗孵育后,将膜用tbst洗3次,每次15min,然后滴加ecl工作液后曝光。
免疫组化结果如图8(上图:放大200倍,scalebar=50μm;下图:放大400倍,scalebar=20μm)所示,与正常对照组相比,哮喘模型组细支气管周围p-p38mapk表达水平明显升高;而鸟嘌呤核苷、尿嘧啶核苷及地塞米松治疗组p-p38mapk表达水平明显比哮喘模型组低。这与免疫印迹实验结果一致如图9所示,表明鸟嘌呤核苷、尿嘧啶核苷、地塞米松可以抑制哮喘小鼠p-38mapk的激活。
实施例8:鸟嘌呤核苷抑制哮喘小鼠nf-κb通路及stat3的激活
nf-κb是一种核转录因子,受到激活后nf-κb与iκbα解离,然后入核,与转录启动子结合,调节多种炎症基因(如il-1、il4、tnf-α、il-13等)的表达,与炎症细胞招募、气道重塑等有关。stat3是一种转录因子,能被多种细胞因子激活如il-6,il-6通过jak/stat3通路促进il-4表达及th17细胞的分化,从而产生更多的炎症介质,加重炎症反应及气道高反应性。本实施例按照实施例7所述的方法,对nf-κb通路关键分子及stat3表达水平进行测试。
结果如图10和图11所示,与阴性对照组相比,哮喘模型组小鼠肺组织p-iκbα表达增加,进而活化nf-κb,p-nf-κb表达明显增加;与哮喘模型组相比,鸟嘌呤核苷、尿嘧啶核苷、地塞米松治疗组p-iκbα、p-nf-κb表达均明显降低。哮喘模型组的p-stat3表达上调,鸟嘌呤核苷、尿嘧啶核苷、地塞米松治疗组p-stat3表达下降,其中鸟嘌呤核苷治疗组更为明显。
实施例9:鸟嘌呤核苷、尿嘧啶核苷降低thp-1源性巨噬细胞il-6的生成
本实施例通过如下方法进行实验:
(1)thp-1细胞培养
将thp-1细胞培养于含10%fbs、1%青链霉素双抗、0.05mmβ-巯基乙醇的rpmi1640培养基中,密切观察细胞状态。当细胞密度生长至80~90×104cell/ml时,将含细胞的培养液收集于离心管中,以条件800rpm,3min离心后,吸去上清液,加入新鲜培养液重悬细胞沉淀,将细胞悬液分装于新的培养皿中,传代时的细胞密度控制在20~40×104cell/ml。细胞冻存时将细胞离心(800rpm,3min)后,用2ml无血清冻存液重悬细胞,轻轻吹打均匀,分装于2只冻存管中,-80℃冰箱中储存,长期储存则转移至液氮中保存。
(2)thp-1细胞的诱导,构建m0、m1型巨噬细胞、不同浓度核苷化合物的干预组。
1)选择状态良好、处于对数生长期的thp-1细胞,离心后弃上清液,加入新鲜培养基重悬细胞后计数。
2)将细胞浓度调整至55×104/ml,同时加入100ng/ml的pma,混合均匀后,接种于6孔板中,每孔2ml。
3)24h后,悬浮单核细胞分化为贴壁巨噬细胞,即m0型巨噬细胞。直接更换为含有100ng/ml的lps、20ng/ml的ifn-γ的新鲜培养基后成为m1型巨噬细胞组。吸去原有培养上清液,同时加入含不同浓度的鸟嘌呤核苷和尿苷的培养基预处理1h后,加入100ng/ml的lps、20ng/ml的ifn-γ成为鸟嘌呤核苷干预组和尿嘧啶核苷干预组。
4)24h后,收集上清及细胞进行后续实验。
(3)采用elisa检测细胞上清中il-6浓度。
结果如图12所示,对照组(ctl组,不加lps/ifn-γ)il-6浓度接近于0,而lps/ifn-γ(thp-1源性巨噬细胞)组细胞il-6合成分泌明显增加;与lps/ifn-γ(thp-1源性巨噬细胞)组相比,鸟嘌呤核苷、尿嘧啶核苷治疗组能明显降低il-6的合成及分泌,且呈浓度依赖性。
实施例10:鸟嘌呤核苷抑制thp-1源性巨噬细胞p38mapk的激活
本实施例的细胞样品的制备与实施例9相同,本实施例采用如下方法提取细胞蛋白:吸去培养上清液后,pbs洗两次,加入适量的蛋白裂解液冰上裂解30min,将裂解液转移至1.5ml离心管中,超声破碎1次,超声1s。4℃,13000rpm,离心10分钟,收集上清液。
然后采用与实施例7相同的方法进行免疫印迹测试,检测p38mapk及p-p38mapk的表达情况。结果如图13所示,与对照组相比,p-p38mapk表达水平明显升高;而鸟嘌呤核苷、尿嘧啶核苷治疗组p-p38mapk表达水平明显比thp-1源性巨噬细胞组低。
实施例11:鸟嘌呤核苷抑制thp-1源性巨噬细胞nf-κb、stat3的激活
本实施例采用与实施例10相同的方法检测p65rela、p-nf-κbp65、stat3、p-stat3及hif-1α的表达情况。结果如图14所示,与对照组相比,p-nf-κbp65、p-stat3、hif-1α表达水平明显升高;而鸟嘌呤核苷、尿嘧啶核苷治疗组p-nf-κbp65、p-stat3、hif-1α蛋白表达水平明显比thp-1源性巨噬细胞组低。
根据实施例1~实施例10可以知道,在ova所致哮喘小鼠模型中,鸟嘌呤核苷能够减轻小鼠气道炎症和气道纤维化,能够明显减轻气道高反应性。鸟嘌呤核苷还能够明显降低哮喘小鼠的肺部炎症因子il-4、il-6和il-13的表达,明显降低哮喘小鼠的ova-ige表达。此外,鸟嘌呤核苷还能够抑制哮喘小鼠p38mapk的激活、nf-κb通路及stat3的激活。对于thp-1源性巨噬细胞,鸟嘌呤核苷能够抑制il-6的生成,能够抑制p38mapk的激活、nf-κb通路及stat3的激活。
综上所述,鸟嘌呤核苷可以减轻小鼠气道炎症和气道纤维化,能够明显减轻气道高反应性,可以用于哮喘治疗,还可以作为p38mapk抑制剂、p65nf-κb抑制剂、stat3抑制剂,而p38mapk抑制剂、p65nf-κb抑制剂、stat3抑制剂可以用于治疗恶性肿瘤、皮肤疾病、炎症、自身免疫性疾病或神经系统疾病,因此鸟嘌呤核苷还可以用于治疗恶性肿瘤、皮肤疾病、炎症、自身免疫性疾病或神经系统疾病。
- 还没有人留言评论。精彩留言会获得点赞!