用于肿瘤放化疗栓塞治疗和影像的多功能微球制剂及其制备方法
1.本发明属于药物制剂领域,具体涉及一种可用于肿瘤的放化疗栓塞治疗和核医学影像的微球制剂及其制备方法。
背景技术:
2.现有技术公开了恶性肿瘤发病率呈逐年上升的趋势,有关统计显示,全球范围内,恶性肿瘤导致的死亡数仅次于心血管疾病。目前,恶性肿瘤的治疗方法主要包括手术切除、放射治疗和化疗。研究显示,多数恶性肿瘤都具有丰富的血管系统,这些血管不仅能为肿瘤的生长提供必要的养分,而且在肿瘤后期的转移中扮演着重要的角色。肿瘤的栓塞治疗是指通过将肿瘤特异性供血血管堵塞,阻断肿瘤的养分供应来达到“饿死”肿瘤的目的。在栓塞治疗时,联合化疗药物或放射性治疗核素可以增加治疗效果。
3.在肿瘤化疗栓塞治疗中常用的栓塞剂有碘油和dc bead
tm
。将化疗药物水溶液和碘油通过来回推打形成稳定的w/o乳剂后,进行肝癌的化疗栓塞治疗能够一定程度延长患者生存期。有关实践显示,碘油栓塞肿瘤血管时间短暂,同时碘油中的化疗药物突释严重,容易造成正常组织的毒性反应。dc bead
tm
作为一种固体栓塞微球克服了碘油在化疗栓塞治疗中的许多缺点。dc bead
tm
能形成永久性栓塞,延长栓塞时间,而且其中所载药物能够缓慢释放,使肿瘤部位维持较高药物浓度的同时还能降低外周血中的药物浓度从而避免了系统毒性的产生。
4.治疗性核素
131
i,半衰期为8天,发射β射线,射线最大能量为0.81mev,最大穿透深度为2mm,是理想的内照射核素,同时还发射γ射线,射线最大能量为364kev,可用于发射型计算机断层扫描影像或单光子发射计算机断层成像。
131
i标记的碘油曾在临床上用于肝癌的内照射放疗栓塞治疗,并取得了一定的治疗效果。但是,由于碘油在肺部沉积,导致其易产生肺部损伤等副反应,从而限制了其在临床上的应用。目前,
131
i标记的碘油产品已被欧洲生产商撤回。
5.虽然化疗栓塞治疗和放疗栓塞治疗都能一定程度上延长癌症患者的生存期,但是治疗效果仍然有限。有临床试验结果显示,化疗栓塞联合外照射治疗后能够进一步延长患者的生存期,但是,外照射造成非肿瘤区域的辐射损伤,对病人产生的副作用大,因此,将栓塞、化疗和内照射放疗三种疗法相结合的疗法有望在提高治疗肿瘤效果的同时减少给药剂量,降低毒副作用。
6.另一方面,针对碘油作为化疗栓塞和放疗栓塞制剂存在的不足,需要设计和制备新型微球制剂,实现对放射性核素碘稳定标记,同时稳定包载化疗药物,并形成对肿瘤血管永久栓塞的作用,以实现栓塞、化疗和内照射放疗三种疗法的协同。同时,可利用放射性核素所发射的γ-射线进行发射型计算机断层扫描影像或单光子发射计算机断层成像,对微球的体内分布进行实时动态监测,实现制剂的诊疗一体化。
7.针对现有技术的基础与现状,本发明拟提供一种集化疗、内照射放疗和栓塞治疗
于一体,同时可用于发射型计算机断层扫描或者单光子发射计算机断层成像的诊疗一体化微球栓塞剂。该种微球制剂能装载多种化疗药物,还能够标记放射性核素碘,标记稳定性高。与化疗栓塞微球或者放疗栓塞微球制剂相比较,本发明公开的化疗、放疗联合栓塞制剂在实现同等的治疗效果的情况下,所需递送的化疗药物和治疗性核素剂量显著降低。
技术实现要素:
8.本发明的目的在于针对现有技术的基础与现状,提供一种可用于肿瘤的放化疗栓塞治疗和影像的多功能微球制剂及其制备方法。该微球以聚乙烯醇衍生物作为骨架材料,与n-丙烯酰氨基酸单体聚合交联固化而成。该种微球可进行放射性核素碘的标记,同时可以吸附化疗药物。该多功能微球制剂可实现对肿瘤的栓塞、放化联合治疗,同时进行发射型计算机断层扫描或者单光子发射计算机断层成像。
9.本发明的微球制剂中所需的聚乙烯醇衍生物单体,其结构简式如下:
[0010][0011]
其中,分子量范围为10kda~1000kda,优选为75kda。聚乙烯醇衍生物单体由n-(2,2-二甲氧基乙基)-2-丙烯酰胺与聚乙烯醇的羟基发生缩醛反应而成,n-(2,2-二甲氧基乙基)-2-丙烯酰胺的取代度范围为0.1%~40%,优选为10%~15%。
[0012]
本发明的微球制剂中加入的n-丙烯酰氨基酸单体,其结构通式如下:
[0013][0014]
其中r是以下结构中一种或几种:
[0015][0016]
优选为n-丙烯酰酪氨酸。
[0017]
本发明涉及的微球制剂中n-丙烯酰氨基酸单体与聚乙烯醇衍生物大分子单体的摩尔比范围为50:1~1000:1,优选为245:1~260:1。
[0018]
本发明提供了所述的微球制剂的制备方法,包括以下步骤:
[0019]
(1)分别配制n-丙烯酰氨基酸单体水溶液、聚乙烯醇衍生物大分子单体水溶液和引发剂硫酸钾水溶液;
[0020]
(2)配制含有乳化剂的油相溶液,其中油相可以是液体石蜡、乙酸丁酯、大豆油或硅油,乳化剂可以是司盘80、司盘60或醋酸丁酸纤维素;
[0021]
(3)将水相溶液逐滴加入到油相中形成乳剂;
[0022]
(4)将含有催化剂n,n,n’,n
’-
四甲基乙二胺水溶液加入到乳剂中,催化聚合交联反应,固化形成微球;
[0023]
(5)微球经洗涤后筛分,收集得到不同粒径范围的微球。
[0024]
其中:
[0025]
步骤(1)中含有n-丙烯酰氨基酸单体溶液的配制步骤为:采用氢氧化钠溶液溶解n-丙烯酰氨基酸,氢氧化钠溶液浓度优选为200~400mg/ml,体积优选为0.1~20ml,并用浓盐酸调ph至中性;n-丙烯酰氨基酸质量,优选为:0.1~20g。
[0026]
步骤(1)中聚乙烯醇衍生物大分子单体溶液浓度,优选为7.5%~20%;使用聚乙烯醇衍生物大分子单体溶液体积,优选为2~200ml。
[0027]
步骤(1)中过硫酸钾溶液浓度,优选为100~200mg/ml;使用过硫酸钾溶液体积,优选为0.05~10ml。
[0028]
步骤(2)中油相可以是液体石蜡,大豆油,硅油,优选为液体石蜡;液体石蜡使用体积,优选为10~1000ml;乳化剂可以是司盘80或者司盘60,优选为司盘80,司盘80使用量优选为0.05~15g。
[0029]
步骤(4)中n,n,n’,n
’-
四甲基乙二胺溶液,使用体积优选为0.2~20ml;浓度优选为5%~15%(v/v)。
[0030]
步骤(4)中催化聚合交联反应温度优选为25~60℃,反应时间优选为2~12h。
[0031]
步骤(5)中洗涤步骤为:依次采用乙酸乙酯、无水乙醇、超纯水洗涤,每种溶剂洗涤两次。
[0032]
步骤(5)中微球筛分后的粒径范围为20~120μm,120~200μm,200~300μm,300~500μm,500~700μm,700~900μm,900~1100μm,1100~1300μm,优选20~120μm。
[0033]
本发明涉及的微球制剂同时可以标记以下放射性核素碘中的一种或几种:碘-123,碘-125,碘-131,优选为碘-131。
[0034]
本发明中,进行放射性核素碘标记步骤如下:
[0035]
(1)将微球混悬于磷酸盐缓冲液中;
[0036]
(2)将放射性核素碘的碘化钠溶液加入到(1)微球混悬液中,混合均匀;
[0037]
(3)将含有氯胺-t的磷酸盐缓冲液加入到(2)混合溶液中,轻轻振摇混匀;
[0038]
(4)将反应液置于25~45℃水浴中反应10~60min;
[0039]
(5)将(4)中微球混悬液经离心洗涤,沉淀即为放射性核素碘标记微球。
[0040]
其中,步骤(1)中磷酸盐缓冲液的ph为7.4,体积优选为0.1~10ml,微球粉末质量优选为5~500mg。
[0041]
步骤(2)中放射性核素碘溶液的活度优选为10~100mci/ml,加入的放射性碘溶液体积优选为0.01~10ml。
[0042]
步骤(3)中氯胺-t溶液加入体积优选为0.01~10ml,氯胺-t溶液浓度优选为1~10mg/ml。
[0043]
步骤(4)中水浴温度优选为25~45℃,标记时间优选为10~60min。
[0044]
本发明涉及的微球制剂经上述放射性碘标记步骤后标记率为81%~99.5%。
[0045]
本发明涉及的微球制剂可以通过离子交换的方式或者吸附的方式装载以下化疗药物中的一种或几种:盐酸阿霉素,表柔比星,柔红霉素,米托蒽醌,伊立替康,拓扑替康,优选为盐酸阿霉素。
[0046]
本发明涉及的微球制剂和标记放射性碘的放射性微球装载化疗药物的步骤如下:
[0047]
(1)将化疗药物溶于超纯水,配成化疗药物溶液;
[0048]
(2)将(1)溶液加入到采用上述方法制备的微球悬液中或者放射性核素碘标记微球悬液中,振荡数次,等待5~30min;
[0049]
(3)将(2)中混合溶液离心后,除去上清,得到载药微球。
[0050]
本发明涉及的微球制剂和标记放射性核素碘的放射性微球经上述步骤进行化疗药物的装载,盐酸阿霉素的载药量为10%~60%,表柔比星的载药量为7%~45%,柔红霉素的载药量为10%~43%,米托蒽醌的载药量为9%~35%,伊立替康的载药量为8%~30%,拓扑替康的载药量为5%~25%。
[0051]
本发明涉及的微球制剂,其单体组成成份还可以包含2-丙烯酰胺-2-甲基丙磺酸单体。其中,加入的n-丙烯酰氨基酸、2-丙烯酰胺-2-甲基丙磺酸与聚乙烯醇衍生物大分子单体三者的摩尔比范围优选为50:50:1~1000:1000:1。
[0052]
本发明所述微球制剂的制备方法如下:
[0053]
(1)配制n-丙烯酰氨基酸溶液;
[0054]
(2)配制2-丙烯酰胺-2-甲基丙磺酸溶液;
[0055]
(3)配制聚乙烯醇衍生物大分子单体溶液;
[0056]
(4)配制过硫酸钾溶液;
[0057]
(5)将步骤(1)、(2)、(3)、(4)中溶液混合均匀,作为水相;
[0058]
(6)将步骤(5)中的水相加入到含有分散剂的油相中,氮气下搅拌;
[0059]
(7)配制n,n,n’,n
’-
四甲基乙二胺溶液;
[0060]
(8)氮气下将步骤(7)中溶液加入到步骤(6)中的混合溶液中,继续反应1~10h;
[0061]
(9)将步骤(8)中反应液经离心后,沉淀经洗涤后分散于超纯水中;
[0062]
(10)将步骤(9)中沉淀溶液经湿法筛分后得到不同粒径范围的微球。
[0063]
步骤(1)中,优选使用200~400mg/ml氢氧化钠溶液溶解n-丙烯酰氨基酸,氢氧化钠溶液体积优选为0.1~20ml,并用浓盐酸调ph至中性;n-丙烯酰氨基酸质量,优选为:0.1~20g。
[0064]
步骤(2)中2-丙烯酰胺-2-甲基丙磺酸质量优选为0.1~20g,使用超纯水溶解,体积优选为0.1~20ml。
[0065]
步骤(3)中聚乙烯醇衍生物大分子单体溶液浓度,优选为10%~21%;使用聚乙烯醇衍生物大分子单体溶液体积,优选为1~200ml。
[0066]
步骤(4)中过硫酸钾溶液浓度,优选为100~200mg/ml;使用过硫酸钾溶液体积,优选为0.05~10ml。
[0067]
步骤(6)中油相,优选为乙酸丁酯。乙酸丁酯使用体积,优选为30~3000ml;分散剂优选为醋酸丁酸纤维素,醋酸丁酸纤维素使用量优选为0.3~30g。
[0068]
步骤(7)中n,n,n’,n
’-
四甲基乙二胺溶液,使用体积优选为0.3~25ml;浓度优选为6%~17%(v/v)。
[0069]
步骤(8)中水浴温度优选为45~65℃。
[0070]
步骤(9)中洗涤顺序优选为:乙酸乙酯、无水乙醇、超纯水,依次洗涤两次。
[0071]
步骤(10)中微球筛分后的粒径范围为20~120μm,120~200μm,200~300μm,300~500μm,500~700μm,700~900μm,900~1100μm,1100~1300μm,优选20~120μm。
[0072]
本发明涉及的微球制剂,其单体组成成份还可以包含n,n
’-
亚甲基双丙烯酰胺,其中,n-丙烯酰氨基酸、n,n
’-
亚甲基双丙烯酰胺与聚乙烯醇衍生物大分子单体三者的摩尔比范围优选为50:5:1~1000:200:1。所述微球制剂的制备方法如下:
[0073]
(1)配制n-丙烯酰氨基酸溶液;
[0074]
(2)配制n,n
’-
亚甲基双丙烯酰胺溶液;
[0075]
(3)配制聚乙烯醇衍生物大分子单体溶液;
[0076]
(4)配制过硫酸钾溶液;
[0077]
(5)将步骤(1)、(2)、(3)、(4)中溶液混合均匀,作为水相;
[0078]
(6)将步骤(5)中的水相加入到含有乳化剂的油相中,氮气下搅拌乳化;
[0079]
(7)配制n,n,n’,n
’-
四甲基乙二胺溶液;
[0080]
(8)氮气下将步骤(7)中溶液加入到步骤(6)中的乳液中,于水浴下继续反应6h~24h;
[0081]
(9)将步骤(8)中乳液经离心后,沉淀经洗涤后分散于超纯水中;
[0082]
(10)将步骤(9)中沉淀溶液经湿法筛分后得到不同粒径范围的微球。
[0083]
步骤(1)中,优选使用200~400mg/ml氢氧化钠溶液溶解n-丙烯酰氨基酸,氢氧化钠溶液体积优选为0.1~20ml,并用浓盐酸调ph至中性;n-丙烯酰氨基酸质量,优选为0.1~20g。
[0084]
步骤(2)中n,n
’-
亚甲基双丙烯酰胺质量优选为0.01~5g,使用超纯水分散,体积优选为0.1~15ml。
[0085]
步骤(3)中聚乙烯醇衍生物大分子单体溶液浓度,优选为7.5%~20%;使用聚乙烯醇衍生物大分子单体溶液体积,优选为1~200ml。
[0086]
步骤(4)中过硫酸钾溶液浓度,优选为100~200mg/ml;使用过硫酸钾溶液体积,优选为0.05~10ml。
[0087]
步骤(6)中油相可以是液体石蜡,大豆油,硅油,优选为液体石蜡;液体石蜡使用体积,优选为10~1000ml;乳化剂可以是司盘80、司盘60,优选为司盘80,司盘80使用量优选为0.05~15g。
[0088]
步骤(7)中n,n,n’,n
’-
四甲基乙二胺溶液,使用体积优选为0.2~20ml;浓度优选为5%~15%(v/v)。
[0089]
步骤(8)中水浴温度优选为30~50℃。
[0090]
步骤(9)中洗涤顺序优选为:乙酸乙酯、无水乙醇、超纯水,依次洗涤两次。
[0091]
步骤(10)中微球筛分后的粒径范围为20~120μm,120~200μm,200~300μm,300~500μm,500~700μm,700~900μm,900~1100μm,1100~1300μm,优选20~120μm。
[0092]
本发明涉及的微球制剂标记放射性核素碘-125或碘-131可用于肝癌、肝转移肿瘤、子宫肌瘤、肾癌或胰腺癌的栓塞、放疗、化疗联合治疗,同时放射性核素碘-131可以进行发射型计算机断层扫描或者单光子发射计算机断层成像。
[0093]
本发明涉及的微球制剂标记放射性核素碘-123,可用于肝癌、肝转移肿瘤、子宫肌瘤、肾癌或胰腺癌的栓塞、化疗联合治疗,同时放射性核素碘-123可以进行发射型计算机断层扫描或者单光子发射计算机断层成像。
附图说明
[0094]
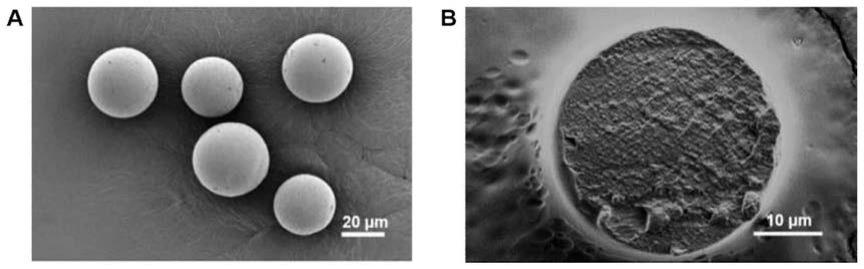
图1.dox-nat-pva微球(a)及其截面(b)的场发射扫描电镜图。
[0095]
图2.dox-nat-pva微球粒径分布图。
[0096]
图3.
131
i-dox-nat-pva微球的放射性薄层扫描图:(a)
131
i-dox-nat-pva微球标记后立即点样,(b)
131
i-dox-nat-pva微球标记完成经离心洗涤后点样,标记率为92.39%
±
1.51%。
[0097]
图4.
131
i-nat-pva微球和
131
i-dox-nat-pva微球在磷酸缓冲液(pbs)和50%胎牛血清(fbs)中的标记稳定性。
[0098]
图5.孵育72h后,dox-nat-pva微球和
131
i-dox-nat-pva微球中dox的ic
50
值的测定与比较(a,b);
131
i-nat-pva微球和
131
i-dox-nat-pva微球中
131
i的ic
50
值的测定与比较(mean
±
sd,n=3,
**
p《0.01)。
[0099]
图6.乏氧下,dox-nat-pva微球和
131
i-dox-nat-pva微球中dox的ic
50
值测定和比较(a,b);
131
i-nat-pva微球和
131
i-dox-nat-pva微球中
131
i的ic
50
值测定和比较(c,d)(mean
±
sd,n=3,
***
p《0.001)。
[0100]
图7.肝动脉栓塞后预定时间点模型大鼠的spect/ct影像图(箭头指示微球位置)。h,小时;d,天。
[0101]
图8.(a)各治疗组中肝癌原位模型大鼠于肝动脉栓塞前(pre)及肝动脉栓塞后1、3、7、14d分别尾静脉注射
18
f-fdg,小动物pet/ct影像监测肿瘤部位
18
f-fdg摄取变化结果(箭头指示肿瘤位置,各治疗组给药剂量如下:control组注射0.2ml生理盐水;nat-pva组注射nat-pva微球悬液0.2ml,含微球0.04ml;
131ilow-nat-pva组注射
131
i-nat-pva微球悬液0.2ml,含微球0.04ml,
131
i 200μci;
131ihigh-nat-pva组注射
131
i-nat-pva微球悬液0.2ml,含微球0.04ml,
131
i 500μci;dox
low-nat-pva组注射dox-nat-pva微球悬液0.2ml,含微球0.04ml,dox 0.5mg;dox
high-nat-pva组注射dox-nat-pva微球悬液0.2ml,含微球0.04ml,dox 2.5mg;
131ilow-dox
low-nat-pva组注射
131
i-dox-nat-pva微球悬液0.2ml,含微球0.04ml,dox 0.5mg,
131
i 200μci);(b)各治疗组肿瘤部位
18
f-fdg最大摄取值(suv
max
)随时间变化曲线(mean
±
sd,n=5,
*
p《0.05,
**
p《0.01,
***
p《0.001);(c)各治疗组经肝动脉栓塞14天后肿瘤的离体照片。d,天。
具体实施方式
[0102]
以下结合实施例、附图对本发明作进一步描述。
[0103]
实施例1
[0104]
称取120mg n-丙烯酰酪氨酸(nat),溶于120μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取40mg n,n
’-
亚甲基双丙烯酰胺超声分散于150μl超纯水中,再加入1.334ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),继续超声溶解。将n-丙烯酰酪氨酸溶液加入到聚乙烯醇衍生物溶液中,混合均匀,并加入87μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.12g司盘80的8ml液体石蜡中,于37℃水浴里,氮气下600rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat-pva微球粉末。
[0105]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记30min。标记结束后,取5μl微球溶液进行放射性纸层析测定微球的标记率。剩余标记的微球经5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止,再取5μl微球溶液进行放射性纸层析测定洗涤后的微球放射化学纯度。
[0106]
制备15mg 131
i-nat-pva微球,用200μl超纯水混悬。称取约7.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0107]
场发射扫描电镜下微球大小均匀,表面圆整(图1)。微球平均粒径51.4
±
3.3μm左右(图2)。经测定,微球载药量和包封率分别为33.25%
±
1.73%和99.76%
±
0.18%。放射性纸层析实验结果显示微球标记率为92.59%
±
1.51%,放射化学纯度为99.46%
±
0.47%(图3)。体外标记稳定性考察中,在31天时仍维持85%以上的放化纯度(图4)。
[0108]
常氧条件下测定了
131
i-dox-nat-pva微球与n1s1大鼠肝癌细胞共孵育72h后dox和
131
i的ic
50
分别为3.74
±
0.240ng/ml和8.15
±
0.521μci/ml,对照组dox-nat-pva微球dox的ic
50
为9.26
±
0.127ng/ml,对照组
131
i-nat-pva微球的
131
i的ic
50
为19.56
±
1.190μci/ml,结果显示
131
i-dox-nat-pva微球中的dox化疗和
131
i放疗具有协同作用,协同指数为0.82(图5)。乏氧条件下,测定了
131
i-dox-nat-pva微球与n1s1细胞共孵育72h后dox和
131
i的ic
50
分别4.20
±
1.14ng/ml和6.68
±
1.25μci/ml,对照组dox-nat-pva微球dox的ic
50
为37.98
±
2.58ng/ml,对照组
131
i-nat-pva微球的
131
i的ic
50
为57.12
±
7.41μci/ml,结果显示
131
i-dox-nat-pva微球中的dox化疗和
131
i放疗具有协同作用,协同指数为0.23(图6)。
[0109]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-nat-pva微球,在小动物spect/ct影像下,能准确的监测微球在模型大鼠体内的分布,并可提供准确的肝肿瘤影像至注射后31天(图7)。静脉注射
18
f-fdg,采用小动物pet/ct影像监测原位荷n1s1肝癌
大鼠肿瘤经不同治疗后的生长情况。结果显示,未经治疗组的大鼠中位数生存期为20天(n=5)。经
131
i-dox-nat-pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为200μci,dox剂量为1.67mg/kg,联合治疗)栓塞治疗14天后,肿瘤组织
18
f-fdg显像为阴性,继续观察至60天未见大鼠死亡(n=5)。经对照组
131
i-nat-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为500μci,高剂量放疗)栓塞治疗14天后,肿瘤组织
18
f-fdg显像为阴性,继续观察至60天未见大鼠死亡(n=5);经对照组
131
i-nat-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为200μci,低剂量放疗)栓塞治疗14天后,肿瘤组织
18
f-fdg显像为肿瘤复发,中位数生存期为24天(n=5)。经对照组dox-nat-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为8.35mg/kg,高剂量化疗)栓塞治疗14天后,肿瘤组织
18
f-fdg显像为阴性,继续观察至60天未见大鼠死亡(n=5);经对照组dox-nat-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.67mg/kg,低剂量化疗)栓塞治疗14天后,肿瘤组织
18
f-fdg显像为肿瘤复发,中位数生存期为23天(n=5)。经对照组nat-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗14天后,肿瘤组织
18
f-fdg显像为肿瘤复发,中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-nat-pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在200μci 131
i和1.67mg/kg dox给药剂量下产生与500μci的放疗栓塞或者8.35mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量(图8)。
[0110]
此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为500μci)栓塞治疗后,大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.35mg/kg)栓塞治疗后,大鼠中位数生存期为22天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.35mg/kg)栓塞治疗后,大鼠中位数生存期为45天(n=5)。
[0111]
实施例2
[0112]
称取150mg n-丙烯酰组氨酸(nah),溶于150μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取35mg n,n
’-
亚甲基双丙烯酰胺超声分散于150μl超纯水中,再加入1.334ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),继续超声溶解。将n-丙烯酰组氨酸溶液加入到聚乙烯醇衍生物溶液中,混合均匀,并加入100μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.12g司盘80的8ml液体石蜡中,于40℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后分别依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nah-pva微球粉末。
[0113]
称取微球10mg,混悬于100μl 0.01m ph 7.4 pbs中。取20μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入15μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记35min。标记结束后,测定微球的标记率为90.13%
±
3.11%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为99.75%
±
1.63%。
[0114]
制备15mg 131
i-nah-pva微球,用200μl超纯水混悬。称取约5.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0115]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径54.9
±
5.7μm左右。经测定,微球载药量和包封率分别为25.39%
±
2.37%和94.23%
±
0.35%。体外标记稳定性考察中,在31天时仍维持80%以上的放化纯度。
[0116]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-nah-pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为220μci,dox剂量为1.82mg/kg)栓塞治疗后60天内未见大鼠死亡(n=5)。经对照组
131
i-nah-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为650μci,高剂量放疗)栓塞治疗后60天内未见大鼠死亡(n=5);经对照组dox-nah-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为8.65mg/kg,高剂量化疗)栓塞治疗后60天内未见大鼠死亡(n=5)。经对照组
131
i-nah-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为220μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-nah-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.82mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组nah-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-nah-pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在220μci 131
i和1.82mg/kg dox给药剂量下产生与650μci的放疗栓塞或者8.65mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为650μci)栓塞治疗后大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.65mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.65mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0117]
实施例3
[0118]
称取150mg n-丙烯酰色氨酸(natp),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取45mg n,n
’-
亚甲基双丙烯酰胺超声分散于200μl超纯水中,再加入1.334ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),继续超声溶解。将n-丙烯酰色氨酸溶液加入到聚乙烯醇衍生物溶液中,混合均匀,并加入95μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.12g司盘80的8ml液体石蜡中,于45℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后分别依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的natp-pva微球粉末。
[0119]
称取微球15mg,混悬于100μl 0.01m ph 7.4 pbs中。取20μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入20μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记40min。标记结束后,测定微球的标记率为89.24%
±
1.27%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止,测定下层微球的放射化学纯度为99.64%
±
1.42%。
[0120]
制备25mg 131
i-natp-pva微球,用200μl超纯水混悬。称取约12mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0121]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径45.29
±
5.9μm左右。经测定,微球载药量和包封率分别为30.13%
±
1.73%和92.76%
±
0.18%。体外标记稳定性考察中,在31天时仍维持80%以上的放化纯度。
[0122]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-natp-pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为252μci,dox剂量为1.89mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为642μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-natp-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为9.25mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为252μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-natp-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.89mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组natp-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-natp-pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在252μci 131
i和1.89mg/kg dox给药剂量下产生与642μci的放疗栓塞或者9.25mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为642μci)栓塞治疗后后大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为9.25mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为9.25mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0123]
实施例4
[0124]
称取170mg n-丙烯酰酪氨酸(nat),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取150mg 2-丙烯酰胺-2-甲基丙磺酸,超声溶解于200μl超纯水中。将n-丙烯酰酪氨酸溶液和2-丙烯酰胺-2-甲基丙磺酸溶液加入到5ml 15%聚乙烯醇衍生物(聚乙烯醇分子量:67kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%)溶液中,混合均匀,并加入60μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.3g醋酸丁酸纤维素的30ml乙酸丁酯中,于55℃水浴里,氮气氛下1000rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌4h。反应结束后,反应液经5000rpm离心5min,除去上清,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat-amps-pva微球粉末。
[0125]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取5μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入5μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记30min。标记结束后,测得微球的标记率为85.41%
±
2.54%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为99.27%
±
0.62%。
[0126]
制备15mg 131
i-nat-amps-pva微球,用200μl超纯水混悬。称取约15mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0127]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径49.3
±
6.5μm左右。经测定,微球载药量和包封率分别为40.13%
±
2.72%和80.2%
±
0.38%。体外标记稳定性考察中,在31天时仍维持82%以上的放化纯度。
[0128]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-nat-amps-pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为282μci,dox剂量为2.41mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nat-amps-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为629μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-nat-amps-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为9.42mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nat-amps-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为282μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-nat-amps-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为2.41mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组nat-amps-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-nat-amps-pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在282μci 131
i和2.41mg/kg dox给药剂量下产生与629μci的放疗栓塞或者9.42mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为629μci)栓塞治疗后大鼠中位数生存期为22天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为9.42mg/kg)栓塞治疗后大鼠中位数生存期为23天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为9.42mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0129]
实施例5
[0130]
称取190mg n-丙烯酰组氨酸(nah),溶于190μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取150mg 2-丙烯酰胺-2-甲基丙磺酸,超声溶解于500μl超纯水中。将n-丙烯酰组氨酸溶液和2-丙烯酰胺-2-甲基丙磺酸溶液加入到5ml 15%聚乙烯醇衍生物(聚乙烯醇分子量:67kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%)溶液中,混合均匀,并加入80μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.3g醋酸丁酸纤维素的30ml乙酸丁酯中,于55℃水浴里,氮气氛下1000rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌5h。反应结束后,反应液经5000rpm离心5min,除去上清,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网
10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌5h。反应结束后,反应液经5000rpm离心5min,除去上清,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的natp-amps-pva微球粉末。
[0137]
称取微球15mg,混悬于100μl 0.01m ph 7.4 pbs中。取25μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入20μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记40min。标记结束后测得微球的标记率为85.62%
±
3.72%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为99.62%
±
1.92%。
[0138]
制备25mg 131
i-natp-amps-pva微球粉末,用200μl超纯水混悬。称取约30mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0139]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径53.58
±
3.94μm左右。经测定,微球载药量和包封率分别为51.4%
±
4.23%和83.76%
±
3.62%。体外标记稳定性考察中,在31天时仍维持85%以上的放化纯度。
[0140]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-natp-amps-pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为282μci,dox剂量为2.41mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp-amps-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为629μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-natp-amps-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为9.42mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp-amps-pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为282μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-natp-amps-pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为2.41mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组natp-amps-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-natp-amps-pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在282μci 131
i和2.41mg/kg dox给药剂量下产生与629μci的放疗栓塞或者9.42mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为629μci)栓塞治疗后大鼠中位数生存期为22天(n=5);;经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为9.42mg/kg)栓塞治疗后大鼠中位数生存期为22天(n=5);。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为9.42mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0141]
实施例7
[0142]
称取170mg n-丙烯酰酪氨酸(nat),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。加入到2ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),混合均匀,并加入100μl 150mg/ml过硫酸钾溶
液,混合均匀后加入到含0.15g司盘80的10ml液体石蜡中,于55℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 20%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌4h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat/pva微球粉末。
[0143]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记30min。标记结束后,测得微球的标记率为94.37%
±
1.71%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为99.68%
±
1.29%。
[0144]
制备15mg 131
i-nat/pva微球,用200μl超纯水混悬。称取约7.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0145]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径55.3
±
6.3μm左右。经测定,微球载药量和包封率分别为32.51%
±
2.52%和97.51%
±
1.63%。体外标记稳定性考察中,在31天时仍维持81%以上的放化纯度。
[0146]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-nat/pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为240μci,dox剂量为1.74mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nat/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为540μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-nat/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为8.73mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nat/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为240μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-nat/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.74mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组nat/pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-nat/pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在240μci 131
i和1.74mg/kg dox给药剂量下产生与540μci的放疗栓塞或者8.73mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为540μci)栓塞治疗后大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.73mg/kg)栓塞治疗后大鼠中位数生存期为22天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.73mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0147]
实施例8
[0148]
称取200mg n-丙烯酰组氨酸(nah),溶于200μl 400mg/ml氢氧化钠溶液中,用浓盐
酸调ph至中性。加入到2.5ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),混合均匀,并加入150μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.15g司盘80的10ml液体石蜡中,于40℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入250μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后分别依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nah/pva微球粉末。
[0149]
称取微球10mg,混悬于100μl 0.01m ph 7.4 pbs中。取20μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入15μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记35min。标记结束后,测得微球的标记率为92.13%
±
2.03%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为95.89%
±
2.43%。
[0150]
制备15mg 131
i-nah/pva微球,用200μl超纯水混悬。称取约6.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0151]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径57.7
±
2.7μm左右。经测定,微球载药量和包封率分别为25.39%
±
2.37%和84.23%
±
3.41%。体外标记稳定性考察中,在31天时仍维持80%以上的放化纯度。
[0152]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-nah/pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为245μci,dox剂量为1.96mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nah/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为635μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-nah/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为9.25mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-nah/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为245μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-nah/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.96mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组nah/pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-nah/pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在245μci 131
i和1.96mg/kg dox给药剂量下产生与635μci的放疗栓塞或者9.25mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为635μci)栓塞治疗后大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为9.25mg/kg)栓塞治疗后大鼠中位数生存期为22天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为9.25mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0153]
实施例9
[0154]
称取250mg n-丙烯酰色氨酸(natp),溶于250μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。加入到3ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%)中,混合均匀,并加入145μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.20g司盘80的15ml液体石蜡中,于45℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入300μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后分别依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的natp/pva微球粉末。
[0155]
称取微球20mg,混悬于100μl 0.01m ph 7.4 pbs中。取15μl 10mci/ml na
131
i溶液加入到微球混悬液中,混合均匀后,加入20μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记30min。标记结束后,测得微球的标记率为86.24%
±
1.82%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为96.58%
±
1.63%。
[0156]
制备15mg 131
i-natp/pva微球,用200μl超纯水混悬。称取约5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0157]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径49.29
±
2.9μm左右。经测定,微球载药量和包封率分别为20.43%
±
1.73%和81.72%
±
2.31%。体外标记稳定性考察中,在31天时仍维持85%以上的放化纯度。
[0158]
体内动物实验结果表明,原位荷n1s1肝癌大鼠经肝动脉注射
131
i-dox-natp/pva微球(微球剂量为0.14ml/kg,
131
i放射剂量为270μci,dox剂量为1.95mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为650μci,高剂量放疗)栓塞治疗后60天未见大鼠死亡(n=5);经对照组dox-natp/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为8.90mg/kg,高剂量化疗)栓塞治疗后60天未见大鼠死亡(n=5)。经对照组
131
i-natp/pva放疗栓塞微球(微球剂量为0.14ml/kg,
131
i放射剂量为270μci,低剂量放疗)栓塞治疗后大鼠中位生存期为23天(n=5);经对照组dox-natp/pva化疗栓塞微球(微球剂量为0.14ml/kg,dox剂量为1.95mg/kg,低剂量化疗)栓塞治疗后大鼠中位生存期为22天(n=5);经对照组natp/pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。这一结果证实,
131
i-dox-natp/pva微球具有很好的体内放化疗协同治疗肿瘤的效果,在270μci 131
i和1.95mg/kg dox给药剂量下产生与650μci的放疗栓塞或者8.90mg/kg的化疗栓塞同等的治疗效果,显著降低放疗和化疗的给药剂量。此外,经
131
i-碘油(碘油剂量为0.67ml/kg,
131
i放射剂量为650μci)栓塞治疗后大鼠中位数生存期为21天(n=5);经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.90mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球
剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.90mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。这一结果证实,
131
i-dox-natp/pva微球具有很好的体内协同治疗肿瘤的效果,可以降低放疗和化疗的给药剂量。
[0159]
实施例10
[0160]
称取120mg n-丙烯酰酪氨酸(nat),溶于120μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取40mg n,n
’-
亚甲基双丙烯酰胺超声分散于150μl超纯水中,再加入1.334ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),继续超声溶解。将n-丙烯酰酪氨酸溶液加入到聚乙烯醇衍生物溶液中,混合均匀,并加入87μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.12g司盘80的8ml液体石蜡中,于37℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat-pva微球粉末。
[0161]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
123
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记35min。标记结束后,测得微球的标记率为94.59%
±
1.31%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为96.62%
±
2.92%。
[0162]
制备15mg 123
i-nat-pva微球,用200μl超纯水混悬。称取约7.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0163]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径51.2
±
2.5μm左右。经测定,微球载药量和包封率分别为31.35%
±
2.42%和98.16%
±
0.41%。体外标记稳定性考察中,在31天时仍维持83%以上的放化纯度。
[0164]
体内动物实验结果表明,在小动物spect/ct影像下,能准确的监测
123
i-dox-nat-pva微球在模型大鼠体内的分布。原位荷n1s1肝癌大鼠经肝动脉注射
123
i-dox-nat-pva微球(微球剂量为0.14ml/kg,dox剂量为8.61mg/kg)栓塞治疗后60天内未见大鼠死亡(n=5);经对照组nat-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。此外,经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.61mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.61mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0165]
实施例11
[0166]
称取170mg n-丙烯酰酪氨酸(nat),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取150mg 2-丙烯酰胺-2-甲基丙磺酸,超声溶解于200μl超纯水中。将n-丙烯酰酪氨酸溶液和2-丙烯酰胺-2-甲基丙磺酸溶液加入到5ml 15%聚乙烯醇衍生物(聚乙
烯醇分子量:67kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%)溶液中,混合均匀,并加入60μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.3g醋酸丁酸纤维素的30ml乙酸丁酯中,于55℃水浴里,氮气氛下1000rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌4h。反应结束后,反应液经5000rpm离心5min,除去上清,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat-amps-pva微球粉末。
[0167]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取5μl 10mci/ml na
123
i溶液加入到微球混悬液中,混合均匀后,加入5μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记30min。标记结束后,测得微球的标记率为85.82%
±
1.63%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为96.53%
±
2.14%。
[0168]
制备15mg 123
i-nat-amps-pva微球,用200μl超纯水混悬。称取约15mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0169]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径52.7
±
3.5μm左右。经测定,微球载药量和包封率分别为45.43%
±
2.61%和90.86%
±
1.29%。体外标记稳定性考察中,在31天时仍维持84%以上的放化纯度。
[0170]
体内动物实验结果表明,在小动物spect/ct影像下,能准确的监测
123
i-dox-nat-amps-pva微球在模型大鼠体内的分布。原位荷n1s1肝癌大鼠经肝动脉注射
123
i-dox-nat-amps-pva微球(微球剂量为0.14ml/kg,dox剂量为9.21mg/kg)栓塞治疗后60天未见大鼠死亡(n=5);经对照组nat-amps-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。此外,经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为9.21mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为9.21mg/kg)栓塞治疗后,大鼠中位数生存期为46天(n=5)。
[0171]
实施例12
[0172]
称取170mg n-丙烯酰酪氨酸(nat),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。加入到2ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),混合均匀,并加入100μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.15g司盘80的10ml液体石蜡中,于55℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 20%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌4h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat/pva微球粉末。
[0173]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
123
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入40℃水浴中,标记35min。标记结束后,测得微球的标记率为95.39%
±
0.62%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为99.52%
±
2.53%。
[0174]
制备15mg 123
i-nat/pva微球粉末,用200μl超纯水混悬。称取约7.5mg的盐酸阿霉素,溶于200μl超纯水。将阿霉素溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约15min后,上清颜色不再变化,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0175]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径54.4
±
3.4μm左右。经测定,微球载药量和包封率分别为33.26%
±
3.31%和96.26%
±
2.37%。体外标记稳定性考察中,在31天时仍维持83%以上的放化纯度。
[0176]
体内动物实验结果表明,在小动物spect/ct影像下,能准确的监测
123
i-nat/pva微球在模型大鼠体内的分布。原位荷n1s1肝癌大鼠经肝动脉注射
123
i-dox-nat/pva微球(微球剂量为0.14ml/kg,dox剂量为8.97mg/kg)栓塞治疗后60天未见大鼠死亡(n=5);经对照组nat/pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。此外,经碘油-dox乳剂(碘油剂量为0.67ml/kg,dox剂量为8.97mg/kg)栓塞治疗后大鼠中位数生存期为22天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,dox剂量为8.97mg/kg)栓塞治疗后,肿大鼠中位数生存期为45天(n=5)。
[0177]
实施例13
[0178]
称取120mg n-丙烯酰酪氨酸(nat),溶于120μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。称取40mg n,n
’-
亚甲基双丙烯酰胺超声分散于150μl超纯水中,再加入1.334ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),继续超声溶解。将n-丙烯酰酪氨酸溶液加入到聚乙烯醇衍生物溶液中,混合均匀,并加入87μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.12g司盘80的8ml液体石蜡中,于37℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 10%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌12h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat-pva微球粉末。
[0179]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
125
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记30min。标记结束后,测得微球的标记率为90.41%
±
2.61%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度,为98.96%
±
2.51%。
[0180]
制备15mg 125
i-nat-pva微球粉末,用200μl超纯水混悬。称取约7.5mg的伊立替康,
pva微球(微球剂量为0.14ml/kg,iri剂量为29.77mg/kg)栓塞治疗后60天未见大鼠死亡(n=5);经对照组nat-amps-pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。此外,经碘油-iri乳剂(碘油剂量为0.67ml/kg,iri剂量为29.77mg/kg)栓塞治疗后大鼠中位数生存期为21天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,iri剂量为29.77mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。
[0189]
实施例15
[0190]
称取170mg n-丙烯酰酪氨酸(nat),溶于170μl 400mg/ml氢氧化钠溶液中,用浓盐酸调ph至中性。加入到2ml 7.5%聚乙烯醇衍生物(聚乙烯醇分子量:75kda,n-(2,2-二甲氧基乙基)-2-丙烯酰胺取代度:12%~13%),混合均匀,并加入100μl 150mg/ml过硫酸钾溶液,混合均匀后加入到含0.15g司盘80的10ml液体石蜡中,于55℃水浴里,氮气氛下600rpm搅拌乳化10min,随后逐滴加入200μl 20%(v/v)的n,n,n’,n
’-
四甲基乙二胺水溶液。反应液置于氮气下继续搅拌4h。反应结束后,反应液经5000rpm离心5min,除去液体石蜡,下层沉淀依次经乙酸乙酯、无水乙醇、超纯水,洗涤两次。随后用少量超纯水将沉淀分散后依次过70μm和40μm滤网进行筛分,滤除70μm滤网截留部分和40μm筛网滤过部分。收集40~70μm筛网之间的沉淀,继续用丙酮脱水离心2次后,于真空干燥箱中室温干燥过夜得干燥的nat/pva微球粉末。
[0191]
称取微球5mg,混悬于100μl 0.01m ph 7.4 pbs中。取10μl 10mci/ml na
125
i溶液加入到微球混悬液中,混合均匀后,加入10μl 10mg/ml氯胺-t pbs溶液,轻轻振摇混匀后,将微球悬液放入37℃水浴中,标记45min。标记结束后,测得微球的标记率为92.02%
±
3.98%。剩余微球标记液中加入1ml超纯水,5000rpm离心5min,除去上清,下层沉淀继续加入超纯水洗涤至上清中检测不出放射性为止。测得下层微球的放射化学纯度为98.22%
±
3.81%。
[0192]
制备15mg 125
i-nat/pva微球粉末,用200μl超纯水混悬。称取约7.5mg的伊立替康,溶于200μl超纯水。将伊立替康溶液加入到微球混悬液中,轻轻震荡混悬,使两者充分混合。随后静置,每间隔5min震荡一次,约35min后,5000rpm离心5min,收集上清。沉淀继续用超纯水重复洗涤三次。
[0193]
场发射扫描电镜下微球大小均匀,表面圆整。微球平均粒径53.0
±
2.5μm左右。经测定,微球载药量和包封率分别为19.03%
±
2.31%和58.81%
±
4.81%。体外标记稳定性考察中,在31天时仍维持80%以上的放化纯度。
[0194]
体内动物实验中,在小动物spect/ct影像下,能准确的监测
125
i-iri-nat/pva微球在模型大鼠体内的分布。原位荷n1s1肝癌大鼠经肝动脉注射
125
i-iri-nat/pva微球(微球剂量为0.14ml/kg,iri剂量为35.8mg/kg)栓塞治疗后60天未见大鼠死亡(n=5);经对照组nat/pva微球(微球剂量为0.14ml/kg)单一栓塞治疗后大鼠中位数生存期为22天(n=5)。此外,经碘油-iri乳剂(碘油剂量为0.67ml/kg,iri剂量为35.8mg/kg)栓塞治疗后大鼠中位数生存期为22天(n=5)。经dc bead
tm
化疗栓塞微球(微球剂量为0.18ml/kg,粒径为75-150μm,iri剂量为35.8mg/kg)栓塞治疗后60天未见大鼠死亡(n=5)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1