心房颤动(AF)的局灶性起源位置的自动识别的制作方法
相关申请的交叉引用
本专利申请涉及于同一日期提交的名称为“errorestimationoflocalactivationtimes(lat)measuredbymultipleelectrodecatheter”、代理人案卷号为1002-1729.1的美国专利申请,该专利申请的公开内容以引用方式并入本文。
本发明整体涉及电生理标测,并且具体地涉及心脏电生理标测。
背景技术:
用于标测心脏组织的电生理(ep)特性的侵入式心脏技术先前在专利文献中已有提出。例如,美国专利申请公布2017/0042449描述了一种使用多电极导管对心脏基质进行局部ep表征的系统和方法。该系统从多个电极中选择至少一个电极簇,以从对应于电描记图信号的加权部分的信息内容推导来自至少一个电极簇的至少一个与取向无关的信号。该系统为用户或过程显示或输出与导管取向无关的电生理信息。
又如,美国专利申请公布2015/0366476描述了一种用于标测心脏的电活动的系统和方法。该系统可包括具有多个电极的导管轴。系统的处理器能够从多个电极中的至少一个电极收集一组信号。该组信号可在一段时间内收集。处理器还能够由该组信号计算至少一个传播矢量,由所述至少一个传播矢量生成数据集,生成数据集的统计分布,并且生成统计分布的视觉表示,诸如角度的圆形直方图。细胞波阵面传播的方向(例如传播角度)和速度可通过将由相邻电极感测到的激活时间与正被确定传播矢量的目标电极进行比较来确定。
美国专利申请公布2017/0202470描述了一种用于识别局灶性起源的系统和方法。该方法可包括经由传感器检测随时间推移的心电图(ecg)信号,经由所述传感器中的一个传感器检测到的每个ecg信号具有在心脏中的位置并指示心脏的电活动,每个信号包括至少r波和s波;创建r-s标测图,该r-s标测图包括所述ecg信号中的每个ecg信号的r与s之比,所述r与s之比包括r波的绝对量值与s波的绝对量值之比;对于ecg信号中的每个ecg信号,识别局部激活时间(lat);并且将r-s标测图上的ecg信号的r与s之比与所识别的lat相关联,并且使用该相关性识别局灶性起源。
美国专利申请公布2017/0281031描述了电解剖标测法,该电解剖标测法通过以下步骤来执行:将多电极探头插入活体受检者的心脏中;记录来自心脏中相应位置处的电极的并发电描记图;界定电描记图中的相应激活时间间隔;由激活时间间隔生成电传播波标测图;通过调整电描记图的激活时间间隔内的局部激活时间,使波的相干性最大化;以及报告所调整的局部激活时间。
美国专利申请公布2004/0243012描述了一种用于识别和定位在窦性节律期间的受检者心脏中的内曲回路峡部的方法和系统。该方法可包括:(a)经由电极接收在窦性节律期间的来自心脏的电描记图信号,(b)基于电描记图信号来产生标测图,(c)基于标测图来确定心脏中的内曲回路峡部的位置,以及(d)显示内曲回路峡部的位置。
技术实现要素:
本发明的实施方案提供了一种方法,该方法包括经由心脏中的多个电极接收采集的集合,其中每次采集包括通过电极测量的一组电生理(ep)信号。对于采集中的每次采集,估计相对于一组ep信号所源自的电极的相应波达方向(doa)和相应距离。汇总这些采集,以形成作为所估计的doa和距离的函数的采集的统计分布。使用统计测试,根据预定义的一致性标准检查采集的统计分布是否一致。如果发现采集的统计分布是一致的,则由统计分布推导生成了所接收的ep信号的致心律失常活动的局灶性起源在心脏中的估计位置。将局灶性起源的估计位置叠加在心脏的至少一部分的解剖标测图上。
在一些示例性实施方案中,对于给定采集,估计doa和距离包括从给定采集中的一组ep信号提取相应的一组相对波达时间,并且使用所提取的相对波达时间估计doa和距离。
在一些示例性实施方案中,汇总采集包括根据从每次采集提取的相应的一组相对波达时间对采集进行预过滤,并且在采集的统计分布中仅包括预过滤的采集。
在一个示例性实施方案中,根据所提取的一组相对波达时间对采集进行预过滤包括以下步骤:(a)使用所估计的doa和距离,对于每次采集,计算将由源于所估计的doa和距离处的局灶性起源的ep波得到的所建模的一组相对波达时间,以及(b)对于每次采集,通过应用预定义的几何测试来确定所提取的一组相对波达时间和所建模的一组相对波达时间之间的相似度。
在一些示例性实施方案中,估计相似度包括计算两组之间的余弦相似性几何测试。在其它实施方案中,估计相似度包括计算每个相对波达时间的估计误差并且将估计误差与给定阈值进行比较。
在一个示例性实施方案中,该方法还包括使用所建模的一组相对波达时间,调整ep信号上的注释的时间值,ep信号的电压-时间斜率小于预指定的斜率。
在另一个示例性实施方案中,对采集进行预过滤包括丢弃被确定为具有相异的多组波达时间的一次或多次采集。
在一些示例性实施方案中,推导估计位置包括将曲线拟合到统计分布,并且找到作为所估计的doa和距离的函数的曲线的最大值。
在一些示例性实施方案中,估计doa和距离包括使成本函数最小化。在其它示例性实施方案中,使成本函数最小化包括使加权成本函数最小化。在另外的实施方案中,使成本函数最小化包括通过在每次迭代中移除具有最大估计误差的ep信号值来迭代地使成本函数最小化。
在一个示例性实施方案中,推导所估计的位置包括对统计分布应用k均值分析,在解剖结构上投影估计位置,并且选择具有小于给定值的投影距离的位置。
根据本发明的一个示例性实施方案,还提供了一种包括接口和处理器的系统。接口被配置为接收由心脏中的多个电极采集的采集的集合,其中每次采集包括一组电生理(ep)信号。处理器被配置为(a)对于采集中的每次采集,估计相对于一组ep信号所源自的电极的相应波达方向(doa)和相应距离,(b)汇总采集,以形成作为所估计的doa和距离的函数的采集的统计分布,(c)使用统计测试,根据预定义的一致性标准检查采集的统计分布是否一致,(d)如果发现采集的统计分布是一致的,则由统计分布推导生成了所接收的ep信号的致心律失常活动的局灶性起源在心脏中的估计位置,以及(e)将局灶性起源的估计位置叠加在心脏的至少一部分的解剖标测图上。
本发明的另一个示例性实施方案提供了一种方法,该方法包括经由心脏中的多个电极接收采集的集合,其中每次采集包括通过电极测量的一组电生理(ep)信号。对于采集中的至少一些采集,估计相对于所述一组ep信号所源自的电极的相应波达方向(doa)和相应距离。基于所估计的doa和距离,估计ep信号中的至少一个ep信号中的定时误差。调整ep信号的时序以拟合所估计的doa和距离并校正误差。使用一组ep信号(包括所调整的ep信号)生成心脏的至少一部分的ep标测图。
在一些示例性实施方案中,生成ep标测图包括生成局部激活时间(lat)标测图。
在一些示例性实施方案中,估计doa和距离包括推导使成本函数最小化的doa和距离。
在一个示例性实施方案中,调整ep信号的时序包括:(a)选择ep信号中的初始注释,(b)基于所估计的doa和距离确定对应于初始注释的经校正的注释,以及(c)在确认经校正的注释满足预定义条件时,调整ep信号的时序。
在另一个示例性实施方案中,确认经校正的注释满足预定义条件包括确认经校正的注释落入ep信号中的相邻峰之间的下降。在又一个示例性实施方案中,确认经校正的注释满足预定义条件包括确认经校正的注释和初始注释位于ep信号的相同单调递减区段上。
在一些示例性实施方案中,确认经校正的注释满足预定义条件包括确认经校正的注释和初始注释位于ep信号的相同单调区段上,并且该区段的斜率低于预定义的阈值斜率。
根据本发明的一个示例性实施方案,还提供了一种包括接口和处理器的系统。接口被配置为接收由心脏中的多个电极采集的采集的集合,其中每次采集包括一组电生理(ep)信号。处理器被配置为:(a)对于采集中的至少一些采集,估计相对于一组ep信号所源自的电极的相应波达方向(doa)和相应距离,(b)基于所估计的doa和距离,估计ep信号中的至少一个ep信号的定时误差,(c)调整ep信号的时序以拟合所估计的doa和距离并校正误差,以及(d)使用所述一组ep信号(包括所调整的ep信号)生成心脏的至少一部分的ep标测图。
附图说明
结合附图,通过以下对本发明的实施方案的详细描述,将更全面地理解本发明,其中:
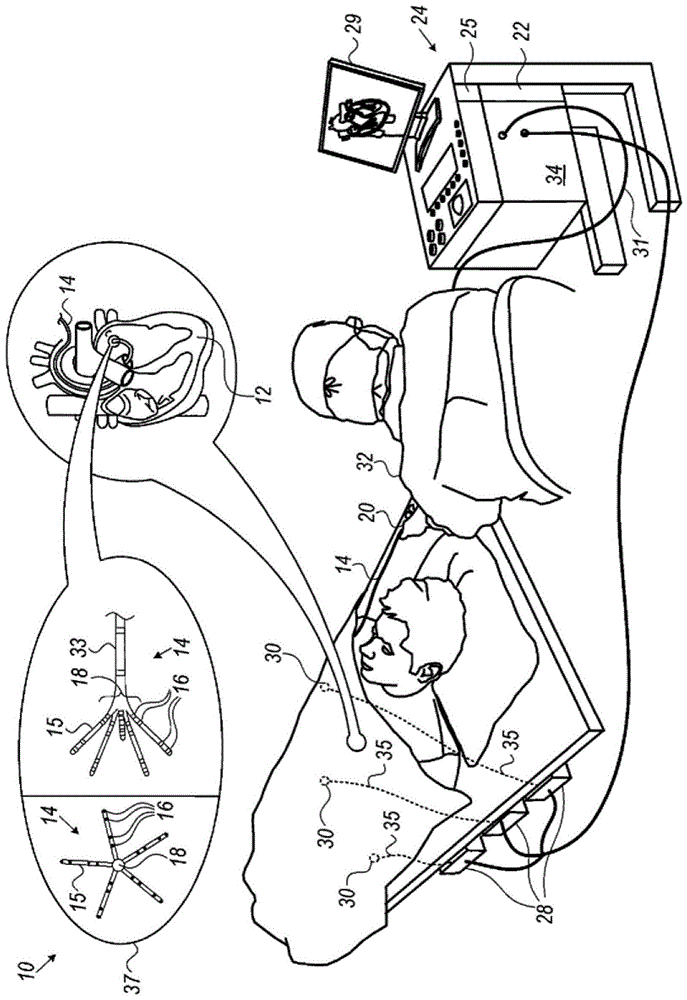
图1为根据本发明的示例性实施方案的电生理(ep)标测系统的示意性图解;
图2为示意性地示出根据本发明的示例性实施方案的用于自动识别心律失常的局灶性起源的位置的方法的流程图;
图3a和图3b为示出根据本发明的示例性实施方案的由图1的系统采集的ep信号的曲线图的两个图;
图4a和图4b为示出根据本发明的示例性实施方案的分别使用图3a和图3b的曲线图的ep信号提取并建模的相对波达时间的图;
图5为示意性地示出根据本发明的示例性实施方案的用于沿循图4a和图4b的步骤推导波达方向(doa)和距离的方法的流程图;
图6为示意性地示出根据本发明的另一个示例性实施方案的用于由局灶性起源推导波达方向(doa)的方法的流程图;
图7a至图7c分别为根据本发明的示例性实施方案的(a)示出由图1的系统采集的单极性ep信号的曲线图的图,(b)导管的位置,以及(c)示出所提取的ep值的相应估计误差的等时标测图;
图8a和8b分别为根据本发明的示例性实施方案的示出由图1的系统采集的单极性ep信号的曲线图的图和示出所提取的ep值的相应估计误差的等时标测图;
图9a和图9b分别为根据本发明的示例性实施方案的示出包含高于给定阈值的估计误差的单极性ep信号的曲线图的图,以及局灶性起源在x-y空间中的初始估计位置;
图10为示出根据本发明的示例性实施方案的迭代doa模型的九次迭代中图9b的局灶性起源的估计位置的曲线图;
图11a和图11b为根据本发明的示例性实施方案的波达方向(doa)和与局灶性起源的距离的直方图;并且
图12为示出根据本发明的示例性实施方案的通过k均值聚类模型分析的doa集群的图。
具体实施方式
概述
就局灶类型的心律失常而言,异常电生理(ep)波脉冲从心脏中的异位病灶异常传播。由于触发异常ep波的局部异常心脏组织,或者因为形成导致现有ep波错误传播的小折返路径的局部异常心脏组织,可能发生局灶类型的心律失常。在一些患者中,可消融局部致心律失常组织以消除局灶类型的心律失常。因此,识别局灶类型的致心律失常组织的位置在临床上可能是有价值的。
下文所述的本发明的示例性实施方案提供了用于自动识别心脏中局灶性致心律失常活动的位置的ep标测系统和方法。除此之外或另选地,一些示例性实施方案提供了用于估计所测量的ep值的注释误差并且根据其原因校正注释误差的方法。在一些示例性实施方案中,基于包括经校正的注释的一组注释,处理器生成心脏的至少一部分的ep标测图(例如,lat标测图)。
ep标测系统使用多电极导管,诸如
在一些示例性实施方案中,处理器随后对于每次采集估计相对于所采集的一组ep信号源自的电极的波达方向(doa)和距离rdoa。处理器集合采集以形成作为所估计的doa和距离的函数的采集的统计分布(例如,直方图,或x-y空间中的集群标测图),并且使用统计测试检查采集的统计分布是否一致。
根据预定义的一致性标准检查恒定性。相关一致性测试的示例包括但不限于恒定性估计器或置信区间的使用。又如,如果标测图中的一个或多个集群各自包含至少给定百分比(例如,10%)的数据点,则x-y空间中的集群标测图可以是一致的,如下所述。
如果发现采集的统计分布是一致的,则处理器由统计分布推导生成了所接收的ep信号的致心律失常活动的局灶性起源在心脏中的估计位置。最后,处理器将局灶性起源的估计位置叠加在心脏的至少一部分的解剖标测图上。
在一些示例性实施方案中,为了估计doa和距离,处理器利用ep波阵面的波达时间注释每个ep信号,在下文中也称为初始注释。处理器从初始注释的一组信号(即,从给定采集)提取相应的一组相对波达时间。使用几何模型,处理器分析所提取的一组相对时间以指示所考虑的ep波的性质,如下所述。该模型假设每次采集与在采集ep信号的区域上具有恒定速度的单个行进的宽ep波阵面独特地相关。
在一些示例性实施方案中,当汇总采集时,处理器对采集进行预过滤并且在采集的统计分布中仅包括预过滤的采集。处理器通过应用以下步骤对采集进行预过滤:(a)使用所估计的doa和距离,对于每次采集计算将由源于局灶性起源处的ep波得到的一组建模的相对波达时间,该局灶性起源相对于导管具有所估计的doa和距离,以及(b)对于每次采集,应用测试以确定所提取的一组相对波达时间和所建模的一组相对波达时间的相似度,并且丢弃生成相异的多组时序的任何采集。相关测试的示例包括几何相似性测试,以及估计误差(在下文中也称为定时误差)与给定阈值的比较。
在一些示例性实施方案中,几何相似性测试包括在所提取的一组相对波达时间与所建模的一组相对波达时间之间应用余弦相似性几何测试。相似度可在零(表示完全相异性)与一(表示完全相似性)之间的范围内。在一个另选的示例性实施方案中,使用最小二乘法作为几何测试。
异常ep波可能不一定具有局灶性起源性质,这可通过相似性检查来指示。在一个示例性实施方案中,无论ep波的性质如何,即局灶性或异常,所推导的建模相对时间可用于调整未明确定义的初始注释的时间值,即,其中波阵面的电压-时间斜率小于预指定的斜率。所调整的注释在下文中也称为经校正的注释。
通常,处理器利用包含特定算法的软件进行编程,该算法使处理器能够执行上文列出的处理器相关步骤和功能中的每一者。
本发明所公开的用于自动识别心脏中致心律失常活动的局灶性起源的技术可改善基于导管的相关心律失常治疗的临床结果。
系统描述
图1为根据本发明的示例性实施方案的电生理(ep)标测系统10的示意性图解。系统10包括导管14,该导管由医师32穿过患者的血管系统插入心脏12的腔室或血管结构中。医师32使导管的远侧末端18例如在ep标测目标位点处与心脏壁接触。导管14通常包括柄部20,该柄部具有合适的控制器,使得医师32能够按照ep标测所需的那样对导管14的远侧端部进行操纵、定位和取向。
导管14是多电极导管,诸如插图37中所示的前述
导管14联接到控制台24,该控制台使医师32能够观察和调节导管14的功能。为了辅助医师32,导管14的远侧部分可包含各种传感器,诸如向位于控制台24中的处理器22提供位置、方向和取向信号的接触力传感器(未示出)和磁性传感器33。处理器22可履行如下所述的若干处理功能。具体地,可以使电信号经由缆线31从位于导管14的远侧末端18处或附近的电极16,在心脏12和控制台24之间来回传送。可通过缆线31和电极16将起搏信号和其它控制信号从控制台24传送至心脏12。
控制台24包括由处理器22驱动的监视器29。电接口34中的信号处理电路通常接收、放大、过滤并数字化来自导管14的信号,包括由上述传感器和多个感测电极16生成的信号。由控制台24和定位系统接收并使用数字化信号,以计算导管14的位置和取向,并且如下文进一步详细描述地分析来自电极16的ep信号。
在本发明所公开的规程期间,跟踪电极16的相应位置。跟踪可例如使用由biosense-webster生产的
在一些示例性实施方案中,除了acl跟踪子系统之外或代替acl跟踪子系统,系统10包括磁定位跟踪子系统,该磁定位跟踪子系统通过使用场生成线圈28在预定义工作空间中生成磁场并感测导管处的这些场来确定导管14的远侧端部处的磁性传感器33的位置和取向。由于电极16在臂15上具有已知位置并且彼此之间具有已知关系,因此一旦导管14在心脏中被磁性跟踪,电极16中的每个电极在心脏中的位置就变得已知。合适的磁定位跟踪子系统在美国专利7,756,576和7,536,218中有所描述,所述专利被转让给本专利申请的受让人并且其公开内容以引用方式并入本文。
基于来自具有跟踪位置的电极16的ep信号,可根据美国专利6,226,542、6,301,496和6,892,091中公开的方法制备电激活标测图,所述专利被转让给本专利申请的受让人并且其公开内容以引用方式并入本文。
处理器22利用存储于存储器25中的软件来操作系统10。例如,软件可以电子形式通过网络下载到处理器22,或者另选地或除此之外,该软件可被提供和/或存储在非临时性有形介质诸如磁存储器、光学存储器或电子存储器上。具体地,处理器22运行如本文所公开的包括在图2中的专用算法,该专用算法使得处理器22能够执行所公开的步骤,如下文进一步所述。
图1所示的示例性例证完全是为了概念清晰而选择的。也可采用其它类型的感测几何结构,诸如篮状导管或
心房颤动(af)的局灶性起源位置的自动识别
图2为示意性地示出根据本发明的示例性实施方案的用于自动识别心律失常的局灶性起源的位置的方法的流程图。根据所呈现的实施方案,该算法执行从医师32在导管插入步骤100处将具有多个感测电极16的导管14插入患者的心脏12中开始的过程。
接着,在ep信号采集步骤102处,系统10接收来自电极16的多组ep信号的采集的集合,医师32将该电极与心脏组织接触。在本发明所公开的实施方案中的一些实施方案所使用的三十秒的典型诊断间隔中,系统收集100次至200次的采集,包括ecg片段,每个ecg片段各自具有100毫秒-200毫秒的典型持续时间。在一些示例性实施方案中,30秒窗口的自动分段由处理器22执行,以产生100毫秒-200毫秒的片段,每个片段对应于传播通过心房的单个激活。
接着,在doa推导步骤104处,处理器22由每次采集推导假定局灶性起源的doa和距离的估计值。然后,在预过滤步骤106处,处理器22对每次采集进行预过滤以丢弃不适于包括在后续统计分析中的采集。在一些示例性实施方案中,处理器22通过比较所提取的ep值与所建模的ep值之间的估计相对时间误差来对采集进行预过滤。该阶段可包括尝试进一步处理,诸如包括迭代计算以改善doa估计,从而减小估计误差,如下所述。
在其它示例性实施方案中,处理器通过运行所建模的ep值和所提取的ep值的一致性的几何测试(例如,运行余弦相似性测试)来对采集进行预过滤。
无论哪种方式,在汇总步骤108处,处理器22汇总经确认的doa和距离值。接着,在统计分析步骤110处,处理器22运行统计测试以找到doa和距离(即,候选局灶位置)的一个或多个候选者(如果存在的话)。
在投影验证步骤112处,处理器通过在解剖结构上投影位置来确认候选位置中的哪个是否为有效位置。
此外,在直接验证步骤114处,处理器确认在验证位置处采集到下述至少最小数量的局灶指示ecg信号的验证候选位置。
最后,在局灶性起源呈现步骤116处,处理器22将致心律失常激活的局灶性起源的一个或多个识别位置叠加到心脏12的至少一部分的解剖标测图上。
图2所示的示例性流程图完全是为了概念清晰而选择的。上文简要描述的步骤的更多细节和具体实施方案将在下文中给出,包括在图5和图6的流程图中。
通过第一方法推导和确认波达方向(doa)和距离
图3a和图3b为示出根据本发明的示例性实施方案的由图1的系统采集的ep信号的曲线图42的两个图。例如,通过图1的ep标测系统使用导管14采集所示的ep信号。这两次采集是多次采集的一部分,编号介于几十和几百之间。这样的集合可包括在导管的不同心脏内放置处获取的采集和/或在相同放置期间获取的重复采集。使用跟踪系统,多个电极中的每个电极具有在心脏中的位置。
该曲线图示出了ep波“撞击”导管14的二十个电极中的每个电极的初始注释时间44。注释通过本领域已知的方法进行,诸如美国专利8,700,136中所述,该专利被转让给本专利申请的受让人并且其公开内容以引用方式并入本文。
在图3a中,ep波首先撞击电极“13”和“14”,然后撞击电极“15”和“7”,以此类推。在图3b中,ep波首先撞击电极“5”和“6”,然后撞击电极“7”和“8”,以此类推。
如图3a和图3b所示,ep信号的初始注解的电压-时间斜率中的一些电压-时间斜率是未明确定义的,即,是浅的(例如,在图3b的曲线图10和11中)。在一个示例性实施方案中,本发明所公开的技术通过推导经校正的注释来提高此类注释的准确性,如下面图7a、图8a和图9a所示,即使该技术未识别出致心律失常活动的局灶性起源。在一个示例性实施方案中,使用下面推导的基于导管14的已知几何形状的建模时间调整未明确定义的初始注释的时间值,即,其中图3a和图3b所示的电压-时间斜率比预指定的斜率小。
图3a和图3b以举例的方式提供。如果使用具有多个电极的另一个导管,诸如篮状导管或lasso导管,则采集的大小(例如,一组中的曲线图数量)和注释时间将反映给定导管的几何形状,同时由本发明所公开的技术类似地使用。
图4a和图4b为示出根据本发明的实施方案的分别使用图3a和图3b的曲线图的ep信号提取并建模的相对波达时间的图。处理器22将通过执行下述步骤根据相应的所提取的一组相对波达时间对采集进行预过滤。
图4a和图4b中的提取时间66分别通过处理器22计算图3a和图3b的初始注释时间44之间的时间差值来推导。图4a和图4b中的相应的建模相对时间68随后由处理器22使用经校正的注释时间(未示出,如下所述)推导。
图4a和图4b的上部中的色标48通过对导管14的所描绘的二十个电极16中的每个电极进行颜色编码来对相对波达时间进行编码。图4a和图4b的上部还示出了在电极采集ep信号的两种情况下电极16的跟踪位置(在pentaray导管14的示意性限定的臂15上)。使用例如前述acl跟踪技术跟踪每个电极16在3d空间中的位置。x-y-z轴(z未示出)属于固定的参考轴系统,诸如应用acl方法的位置跟踪系统20。
基于所提取的相对波达时间66,处理器22以几何方式(例如,如箭头40a和40b所示)估计ep波看起来源自的假定局灶性起源50,如由连接箭头40a和40b从导管14的远侧末端18起源的共同位置的线60所示的距离进一步标记。
图4a和图4b的下部在同一曲线图上示出了所提取的一组相对波达时间66和相应的所建模的一组相对波达时间68。相对波达时间66通过处理器22由实际ep波“撞击”电极的初始注释时间推导。假设模拟ep波源自相对于电极16具有所估计的doa和距离的局灶性起源50处,通过处理器22使用所估计的doa55和距离60来计算建模时间68。
在一个示例性实施方案中,只有在从采集推导的余弦相似性时序匹配超过0.9的值时,处理器才确定指示局灶性起源的采集。可使用除余弦相似性之外的几何测试(例如,量度),所述几何测试检查所提取的组和所建模的组的相似程度,诸如汉明距离。
处理器使用以下余弦相似性方程估计每次采集的每对此类组(在本文中被标记为矢量sex和smd)相似的程度:
方程1
其中计算两个有序组的归一化内积的余弦相似性可给出介于-1和1之间的任何值。实际上,余弦相似性尤其被用于正空间,其中结果被限定在[0,1)内。例如,值1对应于完全相似性,而值零或任何负值指示完全相异性。在一个示例性实施方案中,如果所计算的余弦相似性给出高于预指定的最小值(诸如高于0.9)的值,则处理器确定这些组是相似的。
处理器22对由采集的集合推导的所有组运行相似性检查,并且丢弃具有低于预指定的最小值(例如,<0.9)的余弦相似性的采集。
接着,处理器22仅针对成功通过余弦相似性测试的采集使用方程2和3计算被定义为矢量(r50-r18)的相位的波达方向(doa)55以及信号组所源自的距离60:
方程2doa=phase〖(r50-r18〗)
方程3距离=||r50-r18||,
其中r50和r18分别为假定局灶性起源50和导管14的远侧末端18的矢量坐标。在一些实施方案中,当将系统坐标从3d转换为2d时,r18将为零矢量,因为导管的中心被置于xy空间的原点处。
图5为示意性地示出根据本发明的示例性实施方案的用于沿循图4a和图4b的步骤推导波达方向(doa)和距离的方法的流程图。该过程开始于在相对时间提取步骤200处处理器22从初始注释的ep信号提取相对波达时间66。
接着,在doa和距离估计步骤202处,基于ep信号由(a)具有宽波阵面(b)以恒定速度传播的单个ep波生成的假设,并且基于导管14的已知几何形状,处理器22推导ep波的doa55和距离60的每个采集估计值。
接着,在相对时间建模步骤204处,基于估计的doa55和距离60的值,处理器22计算将生成步骤106中的具有试验性doa和的距离的局灶波的相对时间。然后,在相似性检查步骤206处,处理器22例如通过使用余弦相似性测试来检查所提取的一组相对时间和所建模的一组相对时间的相似程度。
如果发现这些组相异,则在采集丢弃步骤208处,处理器22将不良doa和距离值存储或丢弃为非指示性的。在汇总步骤210处,处理器22将具有被发现相似的所提取和所建模的相对时间组的所有采集(即,通过预过滤)汇总成作为doa和距离的函数的单独分布(例如,汇总成下面图11a和图11b的直方图70和72)。如下面的图11a和图11b所示,如果在直方图中视为存在,则对汇总的doa和距离进行统计分析,以找到局灶性起源的位置。
图5所示的示例性流程图完全是为了概念清晰而选择的。通常可执行附加步骤,诸如医师32初始解剖标测心脏12的相关部分(例如,使用快速解剖标测(fam)规程)以获得解剖标测图。标准可随所用的统计工具的类型而变化。在一个示例性实施方案中,被丢弃的建模时序组仍然可用于调整未明确定义的相应初始注释时间,如下文在“lat改善”下所述。
通过第二方法推导和确认波达方向(doa)和距离
图6为示意性地示出根据本发明的另一个示例性实施方案的用于由局灶性起源推导波达方向(doa)的方法的流程图。
图6所示的过程开始于处理器22在相对时间提取步骤300处从初始注释的ep信号提取相对波达时间66。接着,在投影检查步骤304处,算法通过检查将导管投影(即,投影步骤302)到2d空间中是否有效来检查是否应用3d或2d加权doa模型估计,如下所述。
接着,根据投影步骤304是被发现为无效步骤还是有效步骤,处理器22分别在3d建模步骤306处运行3d加权doa发现模型,或者在2d建模步骤308处运行2d加权doa发现模型。
在估计误差步骤310处,使用3d或2d模型,处理器22随后检查所建模的相对时间和所提取的相对时间之间的估计误差是否低于给定阈值。
如果估计误差在给定阈值内,则在lat改善步骤312处,处理器22应用lat改善计算以使doa估计更准确。lat改善在下文进一步描述。
在另一方面,如果估计误差高于给定阈值,则在doa迭代估计步骤314处,处理器22运行doa迭代模型。
在后续估计误差步骤316处,处理器22随后检查使用迭代模型重新计算的估计误差是否低于给定阈值。如果不是,则在采集丢弃步骤318处,处理器22将不良doa和距离值存储或丢弃为非指示性的。然而,如果迭代模型成功,则处理器22对结果应用lat改善步骤312。
在任一种方式中,在汇总步骤320处,通过处理器22汇总成功预过滤的doa和距离的经lat改善的估计值。如下所示,如果统计模型认为存在病灶性起源,则对所汇总的doa值进行统计分析,以找到病灶性起源的一个或多个位置。
在一个示例性实施方案中,图6中描述的用于推导doa和方向的本发明所公开的方法利用3d空间中的成本函数,如图7a至图7c所述。
图7a至图7c分别为根据本发明的示例性实施方案的(a)示出由图1的系统采集的单极性ep信号的曲线图的图,(b)导管14的位置,以及(c)示出所提取的ep值的相应估计误差550的等时标测图。具体地,图7b示出了导管14的远侧末端18在x-y空间中的位置,以及导管在左心房340的解剖结构上的实际位置338。
估计误差550(即,定时误差550)示于图7a、图8a和图9a中,作为初始注释与经校正的注释之间的时间差值。
图7a示出了一组单极性信号330,其中包含使用下述成本函数模型推导的所测量的和初始注释的局部激活时间332(ti-圆形)和对应的估计局部激活时间334(
将基于成本函数的doa模型应用于每次采集,所述采集包括一组至少10个局部心房激活ti、i电极的局部心房激活时间,i=1,...,m10≤m≤n,其中n为导管的有效电极的数量,例如,对于
方程4
在方程4中,
方程5
图7b的上图描绘了所得的估计的局灶性活动。在图7b中,色标(与图4a和图4b中的色标48相同)通过对导管14的所描绘的二十个电极16中的每个电极进行颜色编码来编码相对波达时间。图7b还示出了在电极采集ep信号的两种单独情况下电极16的跟踪位置(在pentaray导管14的示意性限定的臂15上)。使用例如前述acl跟踪技术跟踪每个电极16在3d空间中的位置。x-y-z轴(z未示出)属于固定的参考轴系统,诸如应用acl方法的位置跟踪系统20。
最后,还示出了成本函数模型推导的doa55和一组信号330所源自的距离60。
图7c(等时标测图)示出了所分析的ep波从圆形线344内的局灶性起源位置336传播,所述圆形线表示根据图7c的右侧中的色条以毫秒为单位的波达时间。圆形350表示电极的位置,圆形内的数字表示以毫秒为单位的图7a的成本函数推导的各个(即,每个电极)估计误差550。
lat改善
在本发明的一些示例性实施方案中,处理器通过选择ep信号中的初始注释,基于所估计的doa和距离确定对应于初始注释的经校正的注释并且在确认经校正的注释满足预定义条件时调整ep信号的时序,从而调整ep信号的初始注释的时间,如下所述。
处理器22通过以下方式推导(例如,计算)估计误差550:(a)使用使位置和传导速度集合最小化的成本函数θ=(x0,y0,z0,to,v)以及电极的测量位置来计算冲击时间
在一个实施方案中,如果满足预定义条件1至3中的一个,则用
1.在碎裂信号(未示出)或双电势lat(诸如图9a中电极15的ep信号的值333)内发现
2.
3.ti和
继续描述另一个主题,该主题描述了成本函数的简化具体实施。
在一些示例性实施方案中,可应用2d空间中的成本函数。在2d模型中,导管被投影到表面上;这通过获取具有最高特征值的两个特征矢量来执行。如果由两个特征矢量保留的能量大于95%,则模型假设从3d空间到表面的投影是有效的,并且该组方程更简单,θ=(x0,y0,t0,v),而不具有z维度。
在一些示例性实施方案中,包括使用加权成本函数来估计doa的另选doa估计步骤由算法使用,并且描述于图8a和图8b中。
图8a和8b分别为根据本发明的示例性实施方案的示出由图1的系统采集的单极性ep信号440的曲线图的图和示出所提取的ep值的相应估计误差的等时标测图。下述加权成本函数doa模型背后的主要概念是“急剧”激活比浅激活更“可靠”,其中急剧程度水平基于ti处的单极性信号的dv/dt来限定。每个ti基于其dv/dt映射到0至1之间的权重wi。在图8a中,靠近每个圆形的数字表示斜率的权重。
还应当注意,在图8a中,一些ep信号包括最早的s波模式,诸如在由电极e19和e20(一起448)感测到的信号444中。此类负斜率模式(不具有在ep波接近电极时先上升的信号振幅)指示远离电极传播的异常局灶性ep波。该状况指示导管14“正好在目标上”,其中所述电极中的一些电极在心律失常的局灶性起源附近(例如,距离60小于臂15的长度)。
如图8b所示,使用加权成本函数推导的局灶性起源的估计位置446至少部分地被电极16的测量位置围绕。
用于2d成本函数模型的一组方程(即,不具有z依赖性的方程5)中所需的交替如下:
方程6
在一些示例性实施方案中,如果相对时间的估计误差高于给定阈值,则应用迭代doa估计过程并在图9a和图9b、图10以及图11a和图11b中进行描述。
图9a和图9b分别为根据本发明的实施方案的示出具有高于给定阈值的估计误差550的单极性ep信号的曲线图的图,以及局灶性起源在x-y空间中的相应初始估计位置560。此外,一些ep值存在于双电势lat内(诸如图9a中的电极15的ep信号的经校正的注释值333)。另外,一些ep值(所测量的值和所估计的值)存在于单极性负偏转的起点与终点之间(诸如在图9a中的电极16的ep信号的负偏转555内)。
如图9b所示,位置560非常靠近导管的远侧末端的位置,然而鉴于上述观察,该位置可能是错误的。
在一个示例性实施方案中,如果平均估计误差高于给定阈值(例如,7毫秒),则处理器22运行迭代计算以估计doa。图9a中的平均估计误差为12.4毫秒。在每次迭代中,从doa估计中移除具有最高估计误差的局部激活时间。只要有超过十个的有效局部激活时间值,就重复该过程。
图10为示出根据本发明的示例性实施方案的迭代doa模型的九次迭代中图9b的局灶性起源560的估计位置的曲线图。在零迭代和第一迭代中,病灶性起源位置560几乎与导管的远侧末端18的位置重合,然而,从第二迭代到第9迭代,局灶性活动的位置移位并且最终被置于(570)电极“1”附近。在图10中,整圆表示用于doa估计的有效电极,而环形圆表示无效电极。环形电极旁边的标记“迭代x”告知在迭代x时从doa估计中消除了特定电极。无效片段的百分比是对该受检者的af的“复杂性”的良好量度。
在零迭代和第9迭代之间,最大估计误差从大约25毫秒降至小于5毫秒。在方程4中同样用作成本的估计值的传导速度cv从大于100mm/msec下降至最小值0.5mm/msec。
本发明所公开的迭代模型用于处理具有噪声波形的采集或具有多于一个朝向导管传播的波的情况。
第一统计测试方法和第二统计测试方法
典型采集的持续时间为100毫秒-200毫秒。典型的记录具有30秒的单极性信号,因此包含大约120次-200次采集。存储来自大约120次-200次采集的所有有效doa估计值,随后将其汇总,直到所有采集都被处理,然后将统计方法应用于有效doa估计值的数据库。
第一统计方法
如上文所指出和本部分所述,处理器22将汇总的doa和距离值放在直方图中并对直方图进行统计分析。在一个示例性实施方案中,处理器被配置为通过将曲线拟合到直方图并找到作为所估计的doa和距离的函数的曲线的最大值来从直方图推导估计的位置。
图11a和图11b分别为根据本发明的实施方案的波达方向(doa)的直方图70a和70b以及与局灶性起源的距离的直方图72a和72b。如图所示,doa分布由每个doa值的采集次数组成,并且距离分布由每个距离值的采集次数组成。通常,处理器22由通过预过滤阶段的数十次至数百次采集范围内的数量编译(即,汇总)直方图70a和70b以及直方图72a和72b,诸如图2所示并且在图3中进行了分析。
使用统计测试,处理器22首先检查如图11a和图11b的doa直方图中的示例所示的doa分布是否产生一致的doa值。一致性测试工具的示例包括但不限于恒定性估计器和置信区间的使用。
如果例如通过指示两个或更多个亲和性不同的doa值的分布发现doa不一致,则处理器22结束本发明所公开的局灶性起源识别过程。在一个实施方案中,处理器22向用户呈现该过程未识别致心律失常活动的局灶性起源的通知。
如果处理器22由作为doa的函数的采集分布推导出一致的doa值,则处理器22根据分布最佳地估计doa和与所考虑的局灶性起源的距离。然后,处理器22使用最佳估计的doa和距离来识别生成所接收的ep信号的心脏12中致心律失常活动的局灶性起源的位置。
如图11a所示,通过图11a的直方图70a分析的临床病例的最普遍doa值落在0.85π的doa附近。由直方图72a指示的相应的最常见距离为约300mm。因此,处理器22可针对该患者以相对于x轴0.85π的角度识别在距远侧末端18的位置约300mm的距离处的局灶性心律失常的位置的出射度。
图11b示出了通过图11b的直方图70b分析的临床病例的最普遍doa值落在0.5π的doa附近。由直方图72b指示的相应的最常见距离为约300mm。因此,处理器22可针对该患者以相对于x轴0.5π的角度识别在距远侧末端18的位置约300mm的距离处的局灶性心律失常的位置的出射度。
第二统计方法
图12为示出根据本发明的实施方案的通过k均值聚类模型分析的doa集群的图。处理器22将k均值聚类模型应用于通过预过滤并在x-y空间中汇总的一组doa值。
在图12中,圆形表示来自包括在单个记录会话中的多次采集的lat值的采集的doa估计值。在所示的记录结果中,存在“解释”数据的两个doa集群。在记录中,第一集群80(在(-3.7mm,-0.2mm)处的红色圆形)包含80.5%的doa,并且第二集群88包含19.5%的doa。
如果可将主要集群中的一个(多于10%的doa区段)的估计位置投影到解剖结构,即从估计位置诸如估计位置84到解剖结构的距离小于给定值例如6mm(可配置),则识别出病灶性起源。如图12所示,从k均值聚类估计位置84到解剖结构位置90的距离(由箭头85的长度给出)为约3mm,远低于6mm上限。因此,位置90由本发明所公开的技术验证为病灶性起源。
如果我们发现位于距局灶6mm半径内的电极中的最早s波模式的至少10个指示(可配置),则也可以验证病灶性起源。重要的是需注意,基于焦点检测的doa可表现在解剖结构上的位置中,而无需将导管置于局灶性活动的区域中,因此验证过程是任选的。
虽然本文描述的实施方案主要涉及心脏应用,但本文描述的方法和系统也可以用于其它应用,诸如神经病学中。本发明所公开的方法也可应用于涉及局灶性活动的时空“线索”的任何数据集中,并且需要处理器找到该局灶性活动,例如以使用eeg/meg对癫痫患者进行局灶性估计。
因此应当理解,上面描述的实施方案以举例的方式被引用,并且本发明不限于上文特定示出和描述的内容。相反,本发明的范围包括上文描述的各种特征的组合和子组合以及它们的变型和修改,本领域的技术人员在阅读上述描述时将会想到该变型和修改,并且该变型和修改并未在现有技术中公开。以引用方式并入本专利申请的文献被视为本申请的整体部分,不同的是如果这些并入的文献中限定的任何术语与本说明书中明确或隐含地给出的定义相冲突,则应仅考虑本说明书中的定义。
- 还没有人留言评论。精彩留言会获得点赞!