G-四链体特异结合试剂在制备抗新冠病毒的药物中的应用的制作方法
本发明属于新冠病毒药物设计领域,具体涉及一种g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用。
背景技术:
新冠肺炎(covid-19)是由冠状病毒sars-cov-2引起的,截至目前仍然没有有效的药物。因此,寻找针对当前疫情的特定药物和新的治疗方法迫在眉睫。
到目前为止,临床药物的开发主要集中在病毒蛋白酶及其靶向抑制剂上。例如remdesivir(瑞德西韦)是一种核苷类似物,具有抗病毒活性,其治疗covid-19的临床试验正在进行中。另外,几种候选疫苗的临床试验也正在进行中。因此,新的抗病毒策略仍然是迫切需要的。迄今为止,尚未报道针对sars-cov-2rna二级结构的小分子药物治疗案例。
g-四链体(g4)是由g-quartet层叠而形成的四链dna或rna结构,是最重要的非典型核酸二级结构之一,因其独特的构象和生物学意义而受到广泛关注。高通量测序数据显示,人类基因组中可能存在超过700,000个潜在的g-四链体形成序列。g-四链体因其重要的基因功能而被认为是很有前途的治疗靶点。一些g-四链体特异性结合化合物已经被用于癌症治疗的临床试验,例如cx-3543甚至已经进入ii期,用于治疗多种类型的癌症。除了人类之外,一些细菌和病毒中也存在rnag-四链体,包括人类免疫缺陷病毒(hiv)、单纯疱疹病毒(hsv)、人类乳头瘤病毒(hpv)、埃博拉病毒(ebv)和丙型肝炎病毒(hcv)。g-四链体结构形成被认为是调控病毒生命周期的关键元素。更有趣的是,一些g-四链体特异性化合物通过靶向g-四链体结构,显示出强大的抗病毒活性。所以,g-四链体特异性靶向化合物可作为抗病毒药物的候选药物。因此,如果sars-cov-2的基因组中存在rnag-四链体,它们将成为g-四链体特异性靶向化合物新靶点,进而展示抗病毒活性,为抗covid-19新型药物设计提供思路。
技术实现要素:
本发明的目的是提供一种g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用,本发明首先发现了sars-cov-2中存在新型rnag-四链体结构,并证明该结构是抗covid-19病毒药物的潜在靶点,进而使用g-四链体特异结合试剂稳定这种结构,能显著降低n蛋白水平。因为n蛋白在病毒组装和复制中发挥关键作用,可以利用g-四链体特异结合试剂抑制sars-cov-2病毒组装和复制。
为了实现上述目的,本发明的技术方案具体如下:
本发明提供一种g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用。
在上述技术方案中,优选的是:所述g-四链体特异结合试剂为pdp,其结构式如下:
在上述技术方案中,优选的是:所述g-四链体特异结合试剂为tmpyp4,其结构式如下:
本发明首先通过使用多种生物物理技术和分子生物学分析,发现sars-cov-2中的富g序列(该序列位于sars-cov-2核衣壳磷酸化蛋白n编码序列区域)可以在活细胞中折叠成稳定的单分子rna四链体结构,我们命名为rg4。
rg4g-四链体可以被g-四链体特异结合试剂(例如小分子pdp或者tmpyp4)稳定,并调控rg4g-四链体的生物功能。例如,在hela细胞中,加入pdp可以稳定这种结构,并显著降低n蛋白水平。因为n蛋白在病毒组装和复制中发挥关键作用,可以利用g-四链体特异结合试剂抑制sars-cov-2病毒组装和复制。因此,sars-cov-2中的rnag4结构可成为开发抗covid-19抗病毒药物的新靶点。进而本发明提供了一种g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用。
本发明的有益效果是:
本发明的g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用,本发明首先发现了sars-cov-2中存在新型rnag-四链体结构,并证明该结构是抗covid-19病毒药物的潜在靶点,进而使用g-四链体特异结合试剂稳定这种结构,能显著降低n蛋白水平。因为n蛋白在病毒组装和复制中发挥关键作用,可以利用g-四链体特异结合试剂抑制sars-cov-2病毒组装和复制。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细说明。
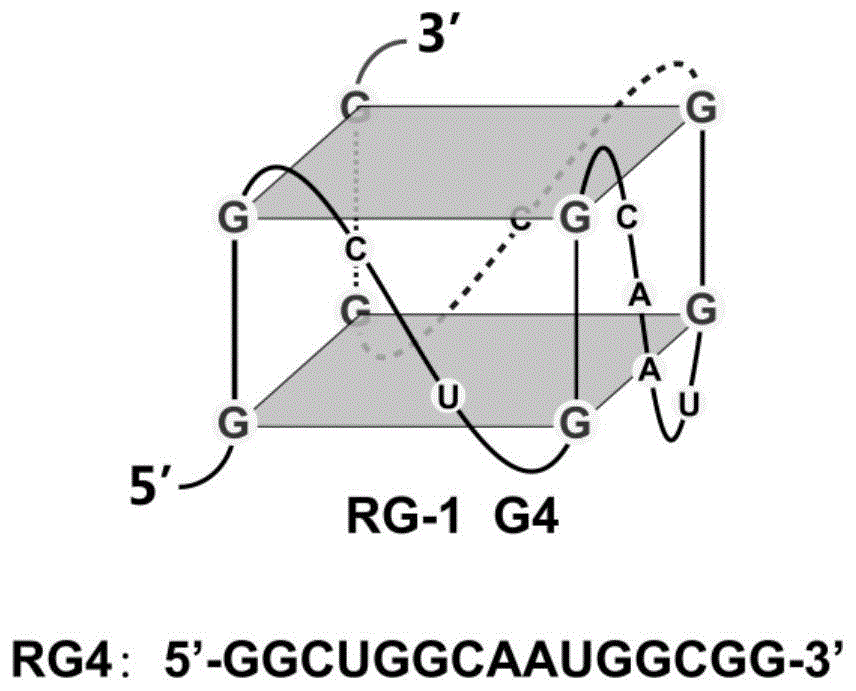
图1是rg4g-四链体的结构示意图;
图2是rg4g-四链体和rg4-突变序列的凝胶电泳图;
图3是rg4g-四链体的600hz核磁共振谱图;
图4是rg4g-四链体和rg4-突变序列的圆二色谱图;
图5是g-四联体特异结合试剂pdp的结构图,以及在pdp存在下rg4g-四链体的热溶解曲线图;
图6是rg4g-四链体在细胞内形成以及pdp对结构形成的影响图;
图7是pdp通过靶向rg4g-四链体抑制egfp报告基因的表达水平图;
图8是pdp通过结合rg4g-四链体抑制n蛋白的表达水平图。
图9为本发明参照文献合成的pdp的核磁氢谱图。
图10为本发明参照文献合成的pdp的核磁碳谱图。
图11为g-四联体特异结合试剂tmpyp4的结构图,以及在tmpyp4存在下rg4g-四链体的热溶解曲线图。
图12为g-四联体特异结合试剂tmpyp4通过结合rg4g-四链体抑制n蛋白的表达水平图。
具体实施方式
本发明的发明思想为:本发明发现sars-cov-2中存在新型rnag-四链体结构,并证明该结构是抗covid-19病毒药物的潜在靶点。进而使用g-四链体特异结合试剂稳定这种结构,能显著降低n蛋白水平。因为n蛋白在病毒组装和复制中发挥关键作用,可以利用g-四链体特异结合试剂抑制sars-cov-2病毒组装和复制。
本发明首先通过使用多种生物物理技术和分子生物学分析,发现sars-cov-2中的富g序列(该序列位于sars-cov-2核衣壳磷酸化蛋白n编码序列区域)可以在活细胞中折叠成稳定的单分子rna四链体结构,我们命名为rg4。
rg4g-四链体可以被g-四链体特异结合试剂(例如小分子pdp或者tmpyp4)稳定,并调控rg4g-四链体的生物功能。例如,在hela细胞中,加入pdp可以稳定这种结构,并显著降低n蛋白水平。因为n蛋白在病毒组装和复制中发挥关键作用,可以利用g-四链体特异结合试剂抑制sars-cov-2病毒组装和复制。因此,sars-cov-2中的rnag4结构可成为开发抗covid-19抗病毒药物的新靶点。进而本发明提供了一种g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用。
所述的g-四链体特异结合试剂优选为:pdp或者tmpyp4,
其中:pdp的结构式如下:
本发明所述pdp参照文献:s.müller,s.kumari,r.rodriguez,s.balasubramanian.nat.chem.,2010,2,1095–1098合成,并对合成的pdp进行表征,其核磁谱图参见图9和图10,由图9和图10可知本发明成功合成了pdp。
tmpyp4的结构式如下:
tmpyp4购买于sigma-aldrich西格玛奥德里奇(上海)贸易有限公司。
本发明首先证明rg4g-四链体结构的形成
1、rna序列的合成
rg4序列:5’-ggcuggcaauggcgg-3’;
rg4-突变序列:5’-gacugacaaugacga-3’;
荧光rg4序列:5’-cy5-aggcuggcaauggcgg-3’;
荧光rg4-突变序列:5’-cy5-agacugacaaugacga-3’;
上述序列均从生工生物工程(上海)股份有限公司购买。其中rg4g-四链体的示意结构图如图1所示。
2.凝胶电泳实验证明rg4g-四链体结构形成
为验证rg4g-四链体结构的形成,本发明进行了聚丙烯酰胺凝胶电泳实验,如图2所示。本发明选取rg4-突变作为对照,因为rg4-突变是无结构的单链rna。与rg4相比,可以观察到突变序列rg4-突变形成了相对应的延迟条带,表明单链的rg4-突变的迁移速度明显慢于形成紧致单分子g-四链体结构的rg4。该结果证明rg4g-四链体结构形成。
3.核磁共振实验证明rg4g-四链体结构形成
本发明进一步采用1h核磁共振(600hznmr)对rg4g-四链体结构进行验证。在10-12ppm的化学位移是g-四链体结构的hoogsteen氢键的特征位置,被认为是g-四链体结构形成的标志。如图3所示,很明显,rg4的1hnmr波谱在该区域显示出明显的亚胺质子峰。该结果证明rg4g-四链体结构形成。
4.圆二色谱实验证明rg4g-四链体结构形成
本发明进一步采用圆二色谱(cd)实验对rg4g-四链体结构进行验证。如图4所示,cd光谱显示,rg4在263.5nm处呈现正波峰,在240nm处出现负波峰,这两处峰正是平行架构g-四链体结构的典型cd特征峰。该结果证明rg4形成典型的平行g-四链体拓扑结构。
为了进一步理解本发明的技术方案,下面结合实施例对本发明做进一步详细的描述。
实施例1:pdp增强rg4g-四链体的稳定性。
本发明使用了一种常用的g-四链体特异性结合小分子pdp(图6a)考察小分子稳定剂对rg4g-四链体热稳定性的影响。圆二色谱热熔解曲线显示,在10mmtris-hcl,100mmkcl,ph=7.2的条件下,rg4g-四链体(1微摩)自身的稳定性为57.1度(图6b)。在加入小分子pdp(1.5微摩)后,rg4g-四链体的热变性温度增至72.1度,热稳定性增加15度。说明pdp能够识别rg4g-四链体并有效增加g-四链体的热稳定性。
实施例2:rg4g-四链体在细胞内形成以及pdp对g-四链体结构形成的影响。
将荧光cy5标记的rg4(rg4-cy5)或突变序列(rg4-突变-cy5)rna转染到海拉(hela)细胞中,利用商业化的g-四链体抗体(bg4)进行检测。如图5a和b中所示,合并图中的黄色区域表明rg4-cy5和bg4抗体共定位良好。相比之下,rg4-突变-cy5和bg4共定位极差。此外,rg4-cy5与bg4的共定位可以被rg4-cy5靶向反义寡核苷酸抑制,因为它们会杂交成双链结构。这些实验表明,rg4可以在活细胞中形成g-四链体结构。另外,在pdp存在条件在,该g-四链体在细胞中可以被pdp调控。在4微摩pdp处理24小时后,rg4-cy5和bg4抗体共定位效果明显增强,但对rg4-突变-cy5没有影响。该实验表明rg4g-四链体在细胞内能够形成,并且pdp可有效增加g-四链体的形成。
实施例3:pdp通过靶向rg4形成的四链体抑制egfp报告基因的表达
建立了增强绿色荧光蛋白(egfp)报告基因系统,以研究活细胞中rg4的形成是否会抑制mrna的翻译。首先,合成了含有rg4的全长n蛋白的dna序列,并将其克隆到plv-egfp慢病毒载体上。然后通过plv-egfp慢病毒载体包装病毒并利用其感染hela细胞系,获得稳定表达n-egfp融合蛋白的细胞系。将1.25×105个稳定表达n-egfp融合蛋白的hela细胞接种到6孔培养板中,分别加入dmso(对照组)和pdp(实验组),使pdp的终浓度为4μm。24小时后,分别利用激光共聚焦显微镜和流式细胞仪观测egfp的绿色荧光强度。如图7a和b所示,pdp处理组的绿色荧光强度显著弱于dmso处理组,说明pdp通过靶向rg4形成的g-四链体抑制egfp报告基因的表达。
实施例4:pdp通过诱导rg4g-四链体形成抑制n蛋白的表达水平
首先,分别合成了含有rg4野生型和rg4-突变体的全长n蛋白的dna序列,并将其克隆到pcag-flag表达载体上。进一步,将1.25×105个hela细胞接种到6孔培养板中,待细胞贴壁后,分别利用脂质体2000转染2微克pcag-flag-n-rg-1野生型载体和pcag-flag-n-rg-1突变型载体,24小时后,分别加入dmso(对照组)和pdp(实验组),使pdp的终浓度为1、2、4微摩。待12小时后,收集细胞,利用ripa蛋白裂解液裂解蛋白进行免疫印迹实验。如图8所示,与dmso处理组相比,pdp处理组的含有rg4野生型的n蛋白的表达水平随着pdp浓度的增加逐渐降低,而不影响有rg4-突变型的n蛋白的表达水平,说明pdp通过诱导rg-1g4形成抑制n蛋白的表达水平。
实施例5
参照实施例2和4,将其中的pdp替换为tmpyp4(图11a),分别获得tmpyp4在tmpyp4存在下rg4g-四链体的热溶解曲线(图11b),及tmpyp4通过结合rg4g-四链体抑制n蛋白的表达水平图12。
如图11所示,圆二色谱热熔解曲线显示,在10mmtris-hcl,100mmkcl,ph=7.2的条件下,rg4g-四链体(1微摩)在加入小分子tmpyp4(1.5微摩)后,rg4g-四链体的热稳定性增加14度。说明tmpyp4能够有效增加g-四链体的热稳定性。
另外,tmpyp4可通过结合rg4g-四链体抑制n蛋白的表达水平。我们将1.25×105个hela细胞接种到6孔培养板中,然后分别转染2微克pcag-flag-n-rg-1野生型载体和pcag-flag-n-rg-1突变型载体。处理24小时后,分别加入dmso(对照组)和tmpyp4(实验组),使tmpyp4的终浓度为1、2、4微摩。孵育12小时后,进行免疫印迹实验。如图12所示,与dmso处理组相比,tmpyp4处理组的含有rg4野生型的n蛋白的表达水平随着tmpyp4浓度的增加逐渐降低,而不影响有rg4-突变型的n蛋白的表达水平。表明tmpyp4通过诱导rg-1g4形成抑制n蛋白的表达水平。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
序列表
<110>中国科学院长春应用化学研究所
<120>g-四链体特异结合试剂在制备抗新冠病毒的药物中的应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>15
<212>rna
<213>人工序列(ribonucleicacid)
<400>1
ggcuggcaauggcgg15
<210>2
<211>15
<212>rna
<213>人工序列(ribonucleicacid)
<400>2
gacugacaaugacga15
<210>3
<211>16
<212>rna
<213>人工序列(ribonucleicacid)
<400>3
aggcuggcaauggcgg16
<210>4
<211>16
<212>rna
<213>人工序列(ribonucleicacid)
<400>4
agacugacaaugacga16
- 还没有人留言评论。精彩留言会获得点赞!