一种人造大麻二酚乳糜的制备方法及其应用与流程
[0001]
本发明涉及一种人造乳糜,特别是一种人造大麻二酚乳糜的制备方法和应用,属于食品、保健品和生物医药技术领域。
背景技术:
[0002]
大麻已经在世界各地种植了几个世纪,用于药用、工业和娱乐用途。汉麻属于木兰纲(magnoliopsida)荨麻目(urticales)大麻科(cannabinaceae)大麻属(cannabis)大麻种(cannabis sativa l.)一年生草本植物。包括delta-9四氢大麻酚(thc)和大麻二酚(cbd)。thc是主要的精神活性化合物,而cbd是一种非精神活性药物,可以有效地治疗癫痫和其他神经精神病疾病。因此,越来越多的cbd产品在世界范围内得到了推广。商业cbd产品主要由工业紫花苜蓿或大麻制成,其中含有少量或无thc,是大麻中的非成瘾性成分。目前国外有十几种相关制剂正在进行临床研究,具有非常好的应用前景。
[0003]
大麻二酚属于脂溶性物质并且极易氧化,大麻二酚不溶于水,因而限制了大麻二酚的应用领域,直接使用会降低其生物利用度,不能充分发挥其功效。如何提高大麻二酚的生物利用度是本领域科技人员重点研究的项目之一。据研究,cbd的生物利用度各不相同,与给药途径和方式有很大关系
[1,2]
。cbd的口服生物利用度为估计为6%,尽管该领域的数据非常缺乏
[3]
。由于cbd的油水分配系数为log p 6.3
[4]
,它通常作为油或酒精制剂供应软胶囊、液体溶液、舌下滴剂或口腔粘膜喷雾剂
[5]
。研究检查人类等摩尔浓度的cbd和thc的口腔和口腔黏膜给药表现出高水平个体间/个体内变异性
[6-7]
。一种提高口服生物利用度的潜在方法是在服用cbd的同时服用高脂肪/高热量膳食
[8]
。这已经在健康受试者中得到了证实,与禁食相比生物利用度大约增加有四倍,成人难治性癫痫患者曲线下面积(auc)和cmax分别增加了4倍和14倍状态与禁食相比
[9-11]
。这可能是由于胶束和乳糜微粒所致为淋巴转运提供更多的药物
[12,13]
。
[0004]
目前,口服和口腔黏膜给药的油悬浮液受到青睐;(悬浮在芝麻油和乙醇中)以油溶液口服,sativex(悬浮在无水乙醇、丙烯中、乙二醇和薄荷油)作为口腔黏膜喷雾剂。然而一项研究表明,在中链甘油三酯(mct)油中cbd是完全溶解的,不会产生任何脂质氧化产物,表明cbd在mct油基质中比在橄榄油或大麻籽油中更被不易氧化降解。
[0005]
人类食用脂肪被消化的过程是首先在小肠中胆汁的作用下,被乳化成乳糜(脂肪微粒),然后经小肠吸收,在体内分解、转化、利用。文献报道的乳糜的粒径在80-500nm,化学组成为,80-95%的甘油三酯(植物油)、6-9%的磷脂、2-7%的胆固醇、0.8-2.5%的蛋白质。乳糜是外源性甘油三酯(脂肪)吸收和转运的载体。乳糜在小肠中肠液和胰液的作用下,被分解成甘油和脂肪酸。所谓的人造乳糜,其作为一种有效的递药体系,就是在去掉乳糜中与递药无关紧要的蛋白,模仿和保持乳糜了的其他化学组成,最大限度的重构乳糜的结构和形态。利用人造乳糜就可以使得脂溶性物质在水中可溶、有效的被人体吸收并且极大提高生物利用度。目前,未见有人造大麻二酚乳糜的相关报道。
技术实现要素:
[0006]
针对上述存在的问题,本发明提供了一种人造大麻二酚乳糜及其制备方法,通过简化剔除天然乳糜成分中所含的蛋白,模仿制备了人为仿造乳糜。人造乳糜采用磷脂和其他助乳化剂包裹植物油,达成将含有大麻二酚的植物油制备成水包油的乳液。该发明制备的水溶性人造大麻二酚乳糜能够保持大麻二酚的稳定性,并赋予该制剂乳糜的特性,增加有效吸收,提高大麻二酚的水溶性及生物利用度,充分发挥大麻二酚的生理功效。此外制备的人造大麻二酚乳糜采用的化学组份都是营养价值极高的高端食品原料,没有副作用,还具有抗焦虑、抗失眠、抗衰老、抗炎、调节机体免疫力等保健功效。
[0007]
本发明目的提供一种含大麻二酚的人造乳糜制剂,以重量百分比计,包括以下有效组分:
[0008][0009]
其中,所述磷脂乳化剂为:大豆磷脂、蛋黄磷脂、大豆卵磷脂、蛋黄卵磷脂、合成卵磷脂中的一种或几种,亦可以是几种不同磷脂以任意比例的混合物。
[0010]
其中,所述单脂肪酸甘油酯助乳化剂为:天然植物油水解的单脂肪酸甘油酯、天然动物油水解的单脂肪酸甘油酯、人工合成的碳链在6-22并且含有1-2个不饱和双键的单脂肪酸甘油酯,这些单脂肪酸甘油酯中的一种或几种,或者几种不同单脂肪酸甘油酯以任意比例的混合物。
[0011]
其中,所述双脂肪酸甘油酯助乳化剂为:天然植物油水解的双脂肪酸甘油酯、天然动物油水解的双脂肪酸甘油酯、人工合成的每一个碳链在6-22并且含有1-2个不饱和双键的双脂肪酸甘油酯,这些双脂肪酸甘油酯中的一种或几种,或者几种不同双脂肪酸甘油酯以任意比例的混合物。
[0012]
其中,所述大麻二酚其thc含量低于0.3%,属于非成瘾性活性物质。
[0013]
其中,所述液态油相为:中链油、大豆油、菜籽油、葵花籽油、松子油、芝麻油、棕榈油、橄榄油、棉花仔油、花生油中的一种或几种,且可以使混合物并且几种的质量比是任意的。
[0014]
最优选的,本发明人造乳糜制剂,包括以下成分:
[0015]
名称重量比(%)卵磷脂2.0
胆固醇0.05单脂肪酸甘油酯0.8双脂肪酸甘油酯0.2大麻二酚5.0棕榈酸维生素e0.01中链油20
[0016]
本发明的药物组合物可以制备成任何可药用的剂型。包括:口服制剂和注射制剂。优选的,本发明的药用剂型选自:片剂、胶囊剂、颗粒剂、糖浆剂、粉针剂、注射剂。
[0017]
在制备成粉剂、片剂、可分散粉剂、胶囊、扁囊剂、栓剂和软膏形式的固体或半固体药物制剂时,可使用固体载体。可使用的固体载体优选为选自稀释剂、调味剂、增溶剂、润滑剂、悬浮剂、粘合剂、膨胀剂等中的一种或多种物质,或可为包封物质。在粉状制剂中,在载体中含有5~70%的微粒化活性成分。适宜的固体载体包括碳酸镁、硬脂酸镁、滑石粉、蔗糖、乳糖、果胶、糊精、淀粉、明胶、甲基纤维素、羧甲基纤维素钠、低沸点蜡、可可脂等。由于它们易于给药,片剂,粉剂、扁囊剂和胶囊等代表最有利的口服固体制剂。
[0018]
本发明的另一个目的在于提供人造乳糜制剂的制备方法。
[0019]
本发明所述的制备方法,包括以下步骤:
[0020]
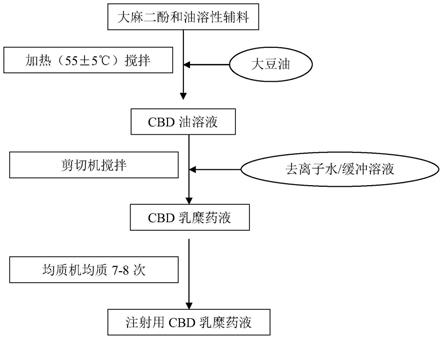
处方量磷脂乳化剂,胆固醇或胆酸,单/双脂肪酸甘油酯助乳化剂,大麻二酚,和v
e
加入液态油中,加热搅拌使之完全溶解。将大麻二酚缓慢的加入用剪切机高速搅拌的纯净水/注射用水缓冲溶液中,在氮气保护的条件下继续搅拌,即得人造大麻二酚乳糜溶液。
[0021]
作为口服产品,可以加入矫味剂、增稠剂(或者稀释剂)、色素、防腐剂,灌装并灭菌。
[0022]
作为注射产品,将人造大麻二酚乳糜溶液经高压均质机均质7-8次,压力为100mpa,得到粒径范围在180nm-300nm的人造大麻二酚乳糜溶液。用注射用水缓冲溶液稀释、定容。氮气保护下灌装,使用旋转高压水浴灭菌,灭菌温度为121℃,15分钟,即得最终产品。最终产品应该是均匀的白色乳状溶液,没有沉淀,分层现象。该产品装瓶后应在2℃-15℃和辟光条件下贮藏。
[0023]
本发明模仿和再现了乳糜的组成、结构形态、巧妙利用了乳糜的体内易吸收的特点,本发明在保持了简化乳糜的基本构成的前提下,于乳滴的油相内核包裹了大麻二酚。本发明将大麻二酚溶于油相,经过初乳化、均质、灭菌,制备成人造大麻二酚乳糜。人造大麻二酚乳糜可以将cbd包裹在乳糜内核,即解决了cbd的水溶性,又保证了cbd的化学稳定性。该发明制备的人造cbd乳糜在用作口服时,可以增加cbd的吸收、显著提高了cbd的生物利用度。在用作注射剂时,解决了cbd的水溶性制剂难题,人造cbd乳糜没有血管刺激、没有严重的副作用,为拓宽cbd的给药方式和应用领域提供了有效的技术支撑。
附图说明
[0024]
图1是本发明的制备工艺流程图。
[0025]
图2是胃肠道稳定性实验图。
[0026]
图3是人造乳糜提高大麻二酚生物利用度实验结果图。
具体实施方式
[0027]
以下依照本发明的技术方案所完成的实施例对本发明作进一步的详细说明,本发明并不局限于这些实施例。
[0028]
实施例1:人造大麻二酚乳糜产品中含0.5%大麻二酚。
[0029]
人造大麻二酚乳糜处方:
[0030][0031][0032]
处方量卵磷脂,胆固醇,单/双脂肪酸甘油酯,大麻二酚,和v
e
在氮气保护下,加入200ml中链油中,加热(65℃)搅拌使之完全溶解。将大麻二酚油溶液缓慢的加入用剪切机高速搅拌(3000r/min)的大约700ml纯净水/注射用水缓冲溶液中,在氮气保护的条件下继续搅拌30min,即得人造大麻二酚乳糜初乳溶液。将人造大麻二酚乳糜初乳溶液经高压均质机均质7次,压力为100mpa,均质过程温度50-65℃,得到粒径范围在290nm
±
70nm的人造大麻二酚乳糜溶液。用注射用水缓冲溶液稀释、调整ph 6.8,定容。氮气保护下灌装,灌装时间5小时,使用旋转高压水浴灭菌,灭菌温度为121℃,15分钟,即得最终产品。最终产品应该是均匀的白色乳状溶液,没有沉淀,分层现象。该产品装瓶后应在2℃-15℃和辟光条件下贮藏。
[0033]
实施例2:人造大麻二酚乳糜产品中含5%大麻二酚。
[0034]
人造大麻二酚乳糜处方:
[0035][0036][0037]
制备方法同实施例1。
[0038]
实施例3:人造大麻二酚乳糜产品中含10%大麻二酚。
[0039]
人造大麻二酚乳糜处方:
[0040]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.12.0大麻二酚10100棕榈酸维生素e0.010.1中链油20200
[0041]
制备方法实施例第二部分:制备大麻二酚人造乳糜各包材处方用量范围
[0042]
本发明对所列人造大麻二酚乳糜各包材的用量范围进行了验证。在本发明的工艺和条件下,保持大麻二酚50g的用量固定不变,中链油用量200ml(20%),维生素e用量在0.5%的含量,验证了卵磷脂的用量在0.5-10%,胆固醇用量在0.1-0.5%,单脂肪酸甘油酯用量在0.1-3%,双脂肪酸甘油酯0.1-1%的范围内的任一用量都可以制成稳定的最终产品。
[0043]
实施例4:人造大麻二酚乳糜产品中最低卵磷脂0.5%,其他组分都保持在最佳配方状态。
[0044]
人造大麻二酚乳糜处方:
[0045][0046][0047]
实施例5:在此验证卵磷脂用量处于中间值的配方和制备(磷脂5%),其他组分都保持在最佳配方状态。
[0048]
人造大麻二酚乳糜处方:
[0049]
名称重量比(%)投料量(g)卵磷脂550胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0050]
实施例6:在此验证卵磷脂最高用量的配方和制备(磷脂10%),其他组分都保持在最佳配方状态。。
[0051]
人造大麻二酚乳糜处方:
[0052]
名称重量比(%)投料量(g)卵磷脂10100胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0053]
实施例7:在此验证单脂肪酸甘油酯在最低值的配方和制备(0.1%),其他组分都保持在最佳配方状态。
[0054]
人造大麻二酚乳糜处方:
[0055]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.11.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0056]
实施例8:在此验证单脂肪酸甘油酯在最高值的配方和制备(3%),其他组分都保持在最佳配方状态。
[0057]
人造大麻二酚乳糜处方:
[0058]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯3.030双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0059]
实施例9:在此验证双脂肪酸甘油酯在最低值的配方和制备(0.1%),其他组分都保持在最佳配方状态。
[0060]
人造大麻二酚乳糜处方:
[0061]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.11.0大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0062]
实施例10:在此验证双脂肪酸甘油酯在最高值的配方和制备(0.5%),其他组分都保持在最佳配方状态。
[0063]
人造大麻二酚乳糜处方:
[0064]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.55
大麻二酚550棕榈酸维生素e0.010.1中链油20200
[0065]
制备方法实施例第三部分:不同体积植物油和不同植物油
[0066]
对本发明所列各种不同体积的植物油和不同种类的植物油进行了验证。在本发明的工艺和条件下都保证可以制成稳定的人造大麻二酚乳糜制剂。
[0067]
实施例11:在此验证最小体积植物油的配方和制备(5%),其他组分都保持在最佳配方状态。
[0068]
人造大麻二酚乳糜处方:
[0069]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油550
[0070]
实施例12:在此验证在植物油最大体积的配方和制备(25%),其他组分都保持在最佳配方状态。
[0071]
药物脂质体处方:
[0072]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1中链油25250
[0073]
实施例13:在此验证花生油作为溶剂的配方和制备(20%),其他组分都保持在最佳配方状态。
[0074]
人造大麻二酚乳糜处方:
[0075]
[0076][0077]
实施例14:在此验证采用橄榄油作为溶剂的配方和制备(20%),其他组分都保持在最佳配方状态。
[0078]
人造大麻二酚乳糜处方:
[0079]
名称重量比(%)投料量(g)卵磷脂2.020胆固醇0.050.5单脂肪酸甘油酯0.88.0双脂肪酸甘油酯0.22.0大麻二酚550棕榈酸维生素e0.010.1精制橄榄油20200
[0080]
三、人造大麻二酚乳糜稳定性研究
[0081]
1、检测方法
[0082]
高效液相色谱法:色谱柱c18柱(3.9mm
×
300mm
×
10μm);流动相:甲醇-水(80:20);检测波长:210nm;流速:1ml/min;进样量:20μl。
[0083]
蒸发光散射检测器法:色谱柱色谱柱c18柱(3.9mm
×
300mm
×
10μm);流动相:甲醇-水(80:20);流速:1ml/min;漂移管温度:76℃,载气流速:3l/min;进样量:20μl
[0084]
2、检测指标:
[0085]
取前述实施例2、5、11的人造大麻二酚乳糜样品,以普通吐温包裹大麻二酚溶液为对照品。超速离心,外观检测(浑浊、颜色、分层、漂油、沉淀、絮状)。
[0086][0087]
3、稳定性研究
[0088]
影响因素试验:高温:60
±
2℃;光照4500
±
500lx;冻融-10℃~-20℃,2天;40℃
±
2℃,融化;考察时间高温光照10天,冻融试验为四个循环。
[0089]
加速试验:30℃
±
2℃,6个月
[0090]
各项指标均符合标准规定,三个样品稳定性良好。
[0091]
[0092][0093]
胃肠道稳定性:取样品2、5各1ml分别加入到2ml模拟胃液、肠液中,涡旋混匀1分钟,然后置于水浴摇床中37℃孵育,分别在模拟胃液中孵育0、0.5、1、2、4小时和模拟肠液中孵育0、1、2、4、6、8小时时间点取样200μl,将上述样品加入5倍冰甲醇终止反应,涡旋混匀1分钟,取样适量,1.2
×
104r.min-1
冷冻离心(4℃)10分钟,取上清液,进样分析。按照胃肠道稳定性试验方法,以0小时样品的峰面积为100%计算,经过4小时孵育后,模拟胃液中cbd的剩余百分率为96.92%,经过在模拟肠液中8小时孵育发现cbd剩余百分率为95.98%,可知,在模拟胃液4小时和8小时模拟肠液中cbd药物含量在90%-110%,变化不大,粒径大小变化也不大,表明样品基本不受分散介质影响,能保持稳定状态。见图2。
[0094]
4、人造乳糜提高大麻二酚药效的研究
[0095]
醋酸扭体法
[0096]
实验方法
[0097]
清洁级小鼠,雌雄各半,体重20
±
2克。雌雄50只,随机分为5组,雌雄各5只,合并雌雄,分笼饲养,每组各10只,模型组:0.5毫升生理盐水灌胃;阳性组:乳糜组、cbd高剂量组、中剂量组、低剂量组每天灌胃一次,灌胃1周,灌胃体积根据小鼠实际体重以及剂量计算,灌胃前称重,最后一次灌胃后2小时,根据小鼠体重0.2毫升/10克的剂量,腹腔注射0.9%冰醋酸溶液,10分钟后计算扭体次数,共计20分钟。
[0098]
抑制百分率=(模型组小鼠扭体次数-阳性组或给药组扭体次数)/模型组小鼠扭体次数
×
100%
[0099]
统计学方法:运用统计软件计量资料以x(
±
s)表示,采用单因素方差分析。阳性组、高剂量组、中剂量组扭体次数与模型组比较,差异有显著性或非常显著性意义p<0.05,p<0.01,高剂量组与阳性组之间无差异p<0.05.表明高中剂量对小鼠镇痛有作用,且镇痛作用呈现一定量效关系,药物剂量越大,镇痛作用越强。
[0100]
各组对小鼠扭体次数比较
[0101][0102]
5、人造乳糜提高大麻二酚生物利用度的研究
[0103]
spf级sd大鼠(平均体重250克,雌雄各半,干净恒温净化通风动物房饲养,自由进食饮水,温度25
±
2℃,相对湿度50%-70%。大鼠禁食过夜(约12小时)。异氟醚吸入麻醉,取大鼠左股动脉血液取样。制备胆瘘模型。
[0104]
cbd吐温制剂:用维生素e醋酸酯溶解cbd粉末(30mg),在乙醇中用磁力轻轻搅拌搅拌10分钟。搅拌混合物加入吐温-20后,在室温下搅拌10分钟(23
±
5℃)保持10分钟,然后添加蒸馏水。制剂保存在4℃,在给药前用蒸馏水稀释3倍。
[0105]
配方:
[0106]
cbd乳糜溶液样品2(100mg/kg/2.5ml)或cbd吐温制剂(50mg/kg/5ml)灌胃给药,比
buccal mucosa and to investigate the pharmacokinetics of cbme per oral in healthy male and female volunteers(gwpk0112).j.cannabis ther.2003,3,79
–
120
[0117]
[8]itin,c.;domb,a.j.;ho_man,a.a meta-opinion:cannabinoids delivered to oral mucosa by a spray forsystemic absorption are rather ingested into gastro-intestinal tract:the influences of fed/fasting states.expert opin.drug deliv.2019,16,1031
–
1035.
[0118]
[9]birnbaum,a.k.;karanam,a.;marino,s.e.;barkley,c.m.;remmel,r.p.;roslawski,m.;gramling-aden,m.;leppik,i.e.food e_ect on pharmacokinetics of cannabidiol oral capsules in adult patients with refractoryepilepsy.epilepsia 2019,60,1586
–
1592.
[0119]
[10]stott,c.g.;white,l.;wright,s.;wilbraham,d.;guy,g.w.a phase i study to assess the e_ect of food on the single dose bioavailability of the thc/cbd oromucosal spray.eur.j.clin.pharmacol.2013,69,825
–
834.
[0120]
[11]taylor,l.;gidal,b.;blakey,g.;tayo,b.;morrison,g.a phase i,randomized,double-blind,placebo-controlled,single ascending dose,multiple dose,and food e_ect trial of the safety,tolerabilityand pharmacokinetics of highly purified cannabidiol in healthy subjects.cns drugs 2018,32,1053
–
1067.
[0121]
[12]porter,c.j.h.;trevaskis,n.l.;charman,w.n.lipids and lipid-based formulations:optimizing the oral delivery of lipophilic drugs.nat.rev.drug discov.2007,6,231
–
248.
[0122]
[13]zgair,a.;wong,j.c.m.;lee,j.b.;mistry,j.;sivak,o.;wasan,k.m.;hennig,i.m.;barrett,d.a.;constantinescu,c.s.;fischer,p.m.;et al.dietary fats and pharmaceutical lipid excipients increase systemic exposure to orally administered cannabis and cannabis-based medicines.am.j.transl.res.2016,8,3448
–
3459.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1