具有疏水性侧链的稳定化细胞穿膜肽及制备方法与应用与流程
[0001]
本发明属于生物医药领域,尤其是涉及一种具有疏水性侧链的稳定化细胞穿膜肽及制备方法与应用。
背景技术:
[0002]
药物分子进入细胞发挥作用会受到各种生理屏障的阻碍作用。对于那些分子量较小、疏水性较强的药物而言,可以以被动扩散方式进入到细胞内部。然而对于那些分子量较大、较为亲水性的大分子药物而言,要想克服细胞膜屏障作用进而发挥其生物学活性功能是一件急需解决的难题。对于这一问题科研人员目前开发了例如电穿孔、显微注射、构建病毒载体系统、基于脂质体的载体系统等多种策略来对大分子药物进行跨膜递送。但以上这些方法通常存在较高生物毒性、较低递送效率、和生物利用度低以及较差的特异性等问题。
[0003]
与上述递送策略相比,细胞穿透肽(cell-penetrating peptides,cpps)可以在极低毒性条件下高效的将多种难通过生物膜的活性大分子药物递送至细胞内。cpps通常含有5-30个氨基酸序列,它不仅自身可以克服生物膜屏障并且可以将偶联的活性物质一起带入细胞内部。其最初的定义为蛋白质转导结构域,特征由较多的碱性氨基酸组成从而在正常生理环境下显示出正电性。由于cpps是由多种天然氨基酸组成,这些氨基酸是生物体中蛋白质的基本结构单元,因此cpps具有生物降解能力良好、生物相容性较高、免疫原性较低的优点,此外它们能够在体内和体外以特别低的浓度穿过细胞膜且不会对细胞膜产生损伤。
[0004]
尽管cpps具有多种优势,但是其不具有细胞选择性,以及容易在体内代谢从而导致生物利用度低下等问题严重限制了它在生物体内的实际应用。此外,制约目前广泛应用的细胞穿透肽的生物体内应用的另一个最重要问题是它们多为线性结构,容易被体内的蛋白酶代谢失去原有结构,从而失去生物活性功能。因此,寻找结构更稳定且穿透能力更强的细胞穿透肽具有重要意义。
技术实现要素:
[0005]
本发明解决了现有细胞穿透肽的代谢稳定性差及细胞穿透能力不高的技术问题。
[0006]
按照本发明的第一方面,提供了一种具有疏水性侧链的稳定化细胞穿膜肽,该稳定化细胞穿膜肽包含穿膜肽基肽和疏水性侧链,穿膜肽基肽为富含精氨酸的细胞穿透肽;所述疏水性侧链包含疏水性小分子,所述稳定化细胞穿膜肽为通过在所述穿膜肽基肽的序列中引入两个天然的半胱氨酸,利用半胱氨酸的烷基化/芳基化反应与所述疏水性小分子交联获得的具有环化侧链的环肽。
[0007]
优选地,所述疏水性小分子选自全氟苯、1,3-二(溴甲基)苯、十氟联苯和4,4'-双(溴甲基)联苯中的任意一种。
[0008]
优选地,所述穿膜肽基肽选自r8衍生物或tat衍生物,r8衍生物的结构如下所示:
[0009][0010]
tat衍生物的结构如下所示:
[0011][0012]
其中,r为可接枝的生物荧光小分子或药物小分子。
[0013]
优选地,所述稳定化细胞穿膜肽为同手性序列环肽。
[0014]
优选地,所述稳定化细胞穿膜肽为左旋序列环肽。
[0015]
优选地,所述环化侧链的环化位置为穿膜肽基肽的i+4或i+7位置,其中,i是多肽链中任意氨基酸残基位置。
[0016]
优选地,所述稳定化细胞穿膜肽的结构如下所示:
[0017][0018]
或
[0019][0020]
其中r为可接枝的生物荧光小分子或药物小分子。
[0021]
按照本发明的另一方面,提供了一种具有疏水性侧链的稳定化细胞穿膜肽的制备方法,包含以下步骤:
[0022]
(1):线性多肽环化
[0023]
将树脂用有机溶剂溶胀后,除去有机溶剂,然后向反应管中加入混合溶液选择性地除去cys或trt保护基,直至溶液中的黄色消失后用有机溶剂轮流清洗多次,再将适量的疏水性小分子与n,n-二异丙基乙胺溶解在dmf中,混合均匀后加入反应管中反应4小时,其中,混合溶液由以下体积比的组分组成:2%三氟乙酸、3%三异丙基硅烷和95%二氯甲烷;
[0024]
(2):fitc标记
[0025]
多肽环化后在脱保护液中除去保护基团,洗涤,再将适量的fitc和n,n-二异丙基乙胺完全溶解于n,n-二甲基甲酰胺中,将fitc溶液与多肽置于ep管中在摇床上摇晃过夜反应,将反应过后的树脂用溶剂轮流清洗多次,直至未反应的fitc完全除去,用甲醇收缩树脂,氮气吹干;
[0026]
(3):从树脂上切下多肽
[0027]
在室温下,使用合适的混合溶液与树脂一起摇晃4小时,将多肽从树脂上切下,用
氮气流吹去部分溶液,加入冷乙醚超声处理,离心沉淀,然后弃去乙醚并重复多次,底部沉淀在室温下自然干燥得到粗肽;
[0028]
(4):多肽纯化
[0029]
将粗肽溶解在溶剂中,并利用液相色谱纯化粗肽,通过lc-ms确定目标多肽的位置后收集目标产物,收集到的纯肽冷冻干燥之后冷冻保存。
[0030]
按照本发明的另一方面,提供了所述的具有疏水性侧链的稳定化细胞穿膜肽在制备药物载体方面的应用。
[0031]
按照本发明的另一方面,提供了所述的具有疏水性侧链的稳定化细胞穿膜肽在肿瘤治疗方面的应用。
[0032]
总体而言,通过本发明所构思的以上技术方案与现有技术相比,主要具备以下的有益效果:
[0033]
(1)采用固相多肽合成技术构建线性多肽链,分别利用全氟苯、十氟联苯、1,3-二(溴甲基)苯和4,4'-双(溴甲基)联苯对不同线性多肽进行烷基化或芳基化构建了不同具有疏水性环化侧链的环肽,合成方法简单高效,显著提高了细胞穿膜肽的代谢稳定性。
[0034]
(2)通过fcm和fm检测b16f10细胞对于线性cpps与具有疏水性侧链的环化cpps的摄取情况,验证了环化cpps的穿透能力大于线性cpps,氨基酸的构向以及侧链的亲疏水性均会影响cpps的穿透能力,且4,4'-双(溴甲基)联苯环化构建的sr8-4和stat-4表现出最强的细胞穿透能力和较快的穿透速度。
[0035]
(3)transwell模型实验以及细胞球穿透实验证明sr8-4、stat-4比r8、tat有更强的跨细胞穿透能力,活体肿瘤组织的穿透实验表明在实体瘤中sr8-4、stat-4比r8、tat具有更强的细胞结合及穿透能力。
附图说明
[0036]
图1为线性细胞穿膜肽和具有疏水性侧链的稳定化细胞穿膜肽的合成路线图。
[0037]
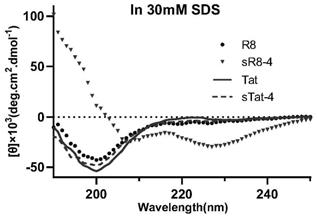
图2为代表性细胞穿透肽在sds溶液中的圆二色谱图。
[0038]
图3为代表性细胞穿膜肽的血清稳定性统计图。
[0039]
图4为b16f10细胞对r8系列多肽摄取的流式柱状图。
[0040]
图5为b16f10细胞对tat系列多肽摄取的流式柱状图。
[0041]
图6多肽跨细胞穿透的荧光定量分析结果图。
[0042]
图7为多肽与4t1多细胞球共孵育后的激光共聚焦成像图,标尺为50μm。
具体实施方式
[0043]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
[0044]
实施例1
[0045]
由于α-螺旋每上升一圈包含3.6个氨基酸残基,对应环化位置需要在i+4,i+7。为了探究疏水性强弱对于cpps的穿透能力的影响,以r8和tat衍生物序列为基础,通过不同亲
疏水性的小分子对多肽进行环化,使用疏水性弱的全氟苯及1,3-二(溴甲基)苯在i+4位置环化,疏水性强的十氟联苯及4,4'-双(溴甲基)联苯在i+7位置进行环化。同时,为了了解氨基酸构象对cpps的穿透能力的影响,设计了手性相同(l)序列以及不同手性(l、d)交替环肽。构建了12条具有疏水性侧链的稳定化细胞穿透环肽的试验例,分别命名为sr8-1、sr8-2、sr8-3、sr8-4、sr8-5、sr8-6以及stat-1、stat-2、stat-3、stat-4、stat-5、stat-6,以基础线性细胞穿膜肽r8和tat衍生物作为对比例,各多肽编号、序列、化学式汇总如表1所示。
[0046]
表1各多肽编号、序列及化学式
[0047][0048][0049]
实施例2
[0050]
以r8、sr8-1、sr8-2、sr8-3、sr8-4、sr8-5、sr8-6的合成路线为示例,合成路线如说明书附图1所示,tat、stat-1、stat-2、stat-3、stat-4、stat-5、stat-6的合成方法与之相同。
[0051]
具体制备过程如下:
[0052]
1、环化方法
[0053]
十氟联苯及4,4'-双(溴甲基)联苯环化方法:将200mg(rcrrrrrrcr、rcrrrrrrcr、grkcrrqrrrc和grkcrrqrrrc)树脂用dcm溶胀10分钟,除去dcm,向反应管中加入混合溶液(2%tfa/3%tis/95%dcm,v/v/v)选择地除去cys(trt)保护基,每次2分钟,直至溶液中的黄色消失后用dcm和dmf轮流清洗多次。将1.2eq.的十氟联苯或4,4'-双(溴甲基)联苯与2.4eq.的dipea溶解在dmf中,混合均匀后加入反应管中反应4小时。
[0054]
全氟苯及1,3-二(溴甲基)苯环化方法:将200mg(rrcrrrcrrr和grckrrcrrr)树脂用dcm溶胀10min,除去dcm,向反应管中加入混合溶液(3%tfa/5%tis/92%dcm,v/v/v)选择地除去cys(trt)保护基,每次2分钟,用dcm和dmf轮流清洗多次。将2eq.的全氟苯或1,3-二(溴甲基)苯与4eq.的dipea溶解在dmf中,混合均匀后加入反应管中反应4小时。
[0055]
2、fitc标记
[0056]
多肽环化后在脱保护液(50%吗啡啉/50%dmf,v/v)中除去fmoc保护基团,洗涤。将2eq.的fitc和4eq.的dipea完全溶解于dmf中,将fitc溶液与多肽置于ep管中在摇床上摇晃过夜反应。将反应过后的树脂用dmf、dcm轮流清洗多次,直至未反应的fitc完全除去,用甲醇收缩树脂,氮气吹干。
[0057]
3、从树脂上切下多肽
[0058]
在室温下,使用tfa/水/tis(9.5/0.25/0.25,v/v/v)的混合溶液与树脂一起摇晃4小时,将多肽从树脂上切下。用氮气流吹去tfa,加入冷乙醚超声处理,离心沉淀,然后弃去乙醚并重复3次,底部沉淀在室温下自然干燥得到粗肽。
[0059]
4、多肽纯化
[0060]
将粗肽溶解在混合溶液(ch3cn/h2o,1:9,v/v)中,并通过c18半制备柱(agilent eclipse xdb-c18,9.4
×
250mm,5μm,流速4ml/min)纯化粗肽。通过lc-ms确定目标多肽的位置后收集目标产物,收集到的纯肽冷冻干燥之后冷冻保存。纯化条件:40分钟内以3ml/min的流速将溶剂b(溶剂a:含有1
‰
(v/v)tfa的水,溶剂b:acn)从15%升至45%的梯度系统,检测220nm和254nm处紫外信号。
[0061]
实施例3
[0062]
利用反相hplc保留时间对所合成的cpps亲疏水性做比较,将冻干的多肽溶解于水溶液中通过反相hplc(agilent poroshell 120 ec-c18:4.6
×
150mm,4μm,流速1.0ml/min)检测每条多肽的出峰时间,从而判断多肽的疏水性,出峰时间越晚的多肽疏水性越强。实验条件:30分钟内以1.0ml/min的流速将溶剂b(溶剂a:水中的1
‰
(v/v)tfa,溶剂b:acn)从10%升至80%的梯度系统,检测220nm和254nm处紫外信号。
[0063]
检测包含线性多肽在内的14条cpps在反相hplc上的保留时间如表2和表3所示,结果表明,环化cpps与对应的线性cpps相比,保留时间均增加,证明环化cpps的疏水性有所提高。亲疏水不同的小分子以及不同氨基酸构象都会对保留时间有影响,线性多肽的保留时间最短。
[0064]
表2 r8及稳定化多肽的保留时间
[0065][0066]
表3 tat及稳定化多肽的保留时间
[0067][0068]
实施例4
[0069]
环化可以有效约束多肽构象,而多肽构象被认为对其穿透能力有重要影响,多肽可以形成α-螺旋和β-折叠等多种二级结构,在此利用圆二色谱考察了代表性稳定化细胞穿透肽的二级结构,将r8、sr8-4、tat、stat-4四条多肽分别溶解在30mm的十二烷基硫酸钠(sds)中。室温下通过jasco j-810收集圆二色谱数据,检测条件如下:步长分辨率为0.5nm,速度为20nm/s,累积10次,响应时间为1s,带宽为1nm,路径长度为10mm,所有圆二色谱均转换为平均残基摩尔椭圆度。
[0070]
获得的代表性细胞穿透肽在sds溶液中的圆二色谱图如图2所示,sr8-4在208nm和227nm处分别出现负峰,190nm附近具有正峰,这是非常典型的α-螺旋构象的特征,cpps的螺旋结构或者在细胞膜上形成螺旋结构都可以增强多肽与脂质双分子层相互作用从而促进cpps的细胞穿透。
[0071]
实施例5
[0072]
将r8、sr8-4、tat和stat-4与fbs共孵育来判断其血清稳定性。
[0073]
将多肽与fbs的水溶液中在37℃下孵育0小时、1小时、2小时和4小时后分别进行取样,每个样品取10μl,用150μl溶液(12%三氯乙酸溶于h2o/ch3cn(v/v,1:3))稀释,取三个平行样。将稀释液在4℃冷藏1小时,然后4℃,12000r/mim下离心15分钟。收集上清液,并通过反相hplc(agilent zorbax sb-aq:4.6
×
250mm,5μm,流速1.0ml/min,494nm)分析未被降解的多肽。分析条件是在25分钟内溶剂b从10%升至90%的梯度洗脱(溶剂a:含有1
‰
tfa(v/v)的水,溶剂b:乙腈(acn))。
[0074]
计算1小时、2小时、4小时的峰面积与0小时的比例以获得对应时间未被降解多肽
的百分比,得到的结果如说明书附图3所示,结果发现r8在1小时后仅剩余71.9%未被降解,而sr8-4有97.1%未被降解;共孵育4小时后r8有49.0%未被降解,sr8-4有77.3%未被降解。在1小时内58.2%的tat被蛋白酶水解,而stat-4仅仅被降解了10.4%。以上数据证明,具有疏水性侧链的环化cpps的胰蛋白酶稳定性大于线性cpps。
[0075]
实施例6
[0076]
为了探究cpps的细胞穿透能力,通过流式细胞术分析cpps与小鼠黑色素瘤细胞b16f10共孵育后的胞内荧光量。将b16f10细胞以均匀接种在12孔板中孵育24小时,除去培养基,pbs清洗。将细胞与3μm的fitc标记多肽在不含fbs的培养基中共孵育1小时,除去含多肽培养基,胰蛋白酶消化细胞3分钟,离心收集细胞,将细胞悬浮于pbs中并加入台盼蓝与细胞孵育3分钟,然后通过fcm对细胞内荧光进行定量分析,以线性肽r8和tat作为对照,计算其他环状cpps的相对平均荧光值,以此判断cpps的穿透能力强弱。
[0077]
结合获得的柱状图数据附图4-5可知,在b16f10细胞上的所有环肽都比线性肽具有更高的细胞穿透能力,且同手性序列环肽穿透能力都大于异手性交替环肽。荧光定量分析显示sr8-3和sr8-4的荧光强度显著高于r8。stat-3和stat-4的荧光强度显著高于tat。
[0078]
实施例7
[0079]
为了证明环化增强了cpps的细胞间穿透能力,实验中建立transwell模型以模拟内皮细胞到肿瘤细胞以及肿瘤细胞至肿瘤细胞的穿透。将人脐静脉内皮细胞huvec接种在transwell小室中模拟肿瘤组织处的内皮细胞,底部接种b16f10细胞以模拟浅层肿瘤细胞。
[0080]
具体过程如下:将huvec细胞接种在12孔transwell小室中,b16f10细胞均匀接种在盖玻片上,将盖玻片放入12孔板中孵育24小时。除去培养基,在无fbs的培养基中,将小室中的细胞与浓度为10μm的cpps孵育1小时。除去含有cpps的培养基,并将细胞用pbs洗涤。添加新鲜的无fbs的培养基,将小室与底部爬片上的b16f10细胞共同孵育2小时后固定爬片上的b16f10细胞,并用dapi染色通过荧光显微镜观察并对获得的荧光图片进行定量分析如图6所示,可以看出,sr8-4、stat-4的荧光强度分别是r8、tat的2.43和2.08倍,表明了环状cpps从上层细胞穿透到下层细胞的量大于线性cpps,证明环状cpps的细胞间穿透能力强于线性cpps。
[0081]
实施例8
[0082]
本实施例进一步为研究环状cpps是否能够克服实体瘤存在高细胞密度和间质液压力以及低氧张力的障碍到达更深层的细胞,以反映其穿透能力的强弱,为此我们培养了肿瘤细胞球来评估cpps的穿透能力。
[0083]
具体过程如下:将1%琼脂糖(w/v)溶液经高压灭菌,将其每孔1ml分配到12孔板中,在室温下凝固。将4t1细胞接种在琼脂糖表面,孵育4-7天,以形成肿瘤球体模型。将适量多肽与肿瘤球在无fbs的培养基中于37℃共孵育12小时。之后,将肿瘤球用pbs洗涤并固定,然后在clsm下观察多肽的穿透深度并拍照,拍照时激光强度,曝光时间均保持一致,获得如说明书附图7所示的激光共聚焦显微图。结合图片可知,r8在40μm的深度在细胞球中心位置观察不到荧光,与r8相比较sr8-4在相同的深度的荧光强度都大于r8,tat组在40μm处就难以观察到绿色荧光,而stat-4在40μm处绿色荧光分布在整个细胞球内部。结果表明含有疏水性侧链的cpps自身具有更强的穿透能力,可以克服多细胞球生理障碍穿透到更深层的细胞中。
[0084]
综上,本发明所筛选出的sr8-4、stat-4具有比目前广泛应用的细胞穿透肽具有更强的穿透能力和代谢稳定性,实现对肿瘤组织的深层穿透,同时也可以作为药物载体携载药物分子或者作为荧光探针载体分子作为新型工具分子进一步应用于药物递送领域。
[0085]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1