具有NMN和/或NADH结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用的制作方法
具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用
技术领域
[0001]
本发明涉及生物医药及化学技术领域,特别涉及一种具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用。
背景技术:
[0002]
结核病是结核分枝杆菌感染人体后产生的疾病,由于结核分枝杆菌感染人体后会在人体内存在数月或者数年,导致结核病的传播范围广、感染性强、致死率高,使其成为最严重的疾病之一。根据世界卫生组织2018年结核病年度报告中显示,全球新发现结核病患者约1000万人,其中90%为成年人,因结核病死亡的患者高达130万人,其中包括艾滋病的结核病合并感染的患者,结核病潜伏感染者则高达17亿。虽然随着医疗水平的提高结核病新发病及死亡率有所下降,但其仍然是引起人类死亡的第10大传染性疾病,面对结核病越来越严重的情况,治疗和控制结核病已刻不容缓。
[0003]
相关技术中,多药耐药和广泛药耐药成为制约抗菌药物临床使用的关键因素,抗结核药物亦如此。目前,临床上抗结核病的大部分药物已经使用约半个世纪,结核分枝杆菌已对部分药物耐药。结核病的新药研发过程去不够理想,存在研发周期长,新药副作用大的问题。
[0004]
因此,研发一种高效、低毒的抗结核药物迫在眉睫。
技术实现要素:
[0005]
本发明的主要目的是提出一种具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用,旨在解决传统抑制剂毒性高的技术问题。
[0006]
为实现上述目的,本发明提出一种具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用。
[0007]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制备抑制结核分枝杆菌生长的制剂中的应用。
[0008]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制备抑制哺乳动物细胞内结核分枝杆菌增殖的制剂中的应用。
[0009]
可选地,所述哺乳动物细胞为巨噬细胞。
[0010]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制剂中的浓度为1~20mmol/l。
[0011]
可选地,所述结核分枝杆菌为牛型结核分枝杆菌。
[0012]
本发明还提供了一种治疗和/或预防因结核分枝杆菌感染引起的疾病的药物,所述药物的有效成分包括具有nmn和/或nadh结构的化合物和/或其可药用盐。
[0013]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制剂中的浓度为1~20mmol/l。
[0014]
可选地,所述药物的药剂型为乳剂、油剂、粉剂、水剂、透皮吸收剂、悬浮剂、片剂、颗粒剂、粘膜吸收剂、栓剂或胶囊剂中的一种。
[0015]
本发明还提供一种如上所述的具有nmn和/或nadh结构的化合物和/或其可药用盐在制备治疗和/或预防因结核分枝杆菌感染引起的疾病的药物中的应用。
[0016]
相较于现有技术,本发明取得了以下有益效果:
[0017]
本发明技术方案中,通过在结核分枝杆菌抑制剂中加入具有nmn和/或nadh结构的化合物和/或其可药用盐,以解决传统结核分枝杆菌抑制剂毒性大的问题。
附图说明
[0018]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
[0019]
图1为本发明一实施例中nmn抑制巨噬细胞内结核分枝杆菌的数据统计图;
[0020]
图2为本发明一实施例中nadh抑制巨噬细胞内结核分枝杆菌的数据统计图;
[0021]
图3至图5为本发明一实施例中nmn和/或nadh结构的化合物对结核分枝杆菌的抑制结果统计图;
[0022]
图6至图8为本发明一实施例中nmn和/或nadh结构的化合物的细胞毒性检测结果图。
[0023]
本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
[0024]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0025]
参见图1至图8,本发明提出一种具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用。
[0026]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制备抑制结核分枝杆菌生长的制剂中的应用。
[0027]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制备抑制哺乳动物细胞内结核分枝杆菌增殖的制剂中的应用。
[0028]
可选地,所述哺乳动物细胞为巨噬细胞。例如但不限于,所述巨噬细胞为thp-1细胞来源的巨噬细胞。
[0029]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制剂中的浓度为1~20mmol/l。
[0030]
可选地,所述结核分枝杆菌为牛型结核分枝杆菌。例如但不限于,所述牛型结核分枝杆菌为牛型结核分枝杆菌bcg 1173p2。
[0031]
本发明还提供了一种治疗和/或预防因结核分枝杆菌感染引起的疾病的药物,所
述药物的有效成分包括具有nmn和/或nadh结构的化合物和/或其可药用盐。
[0032]
可选地,所述具有nmn和/或nadh结构的化合物及其可药用盐在制剂中的浓度为1~20mmol/l。
[0033]
可选地,所述药物的药剂型为乳剂、油剂、粉剂、水剂、透皮吸收剂、悬浮剂、片剂、颗粒剂、粘膜吸收剂、栓剂或胶囊剂中的一种。
[0034]
本发明还提供一种如上所述的具有nmn和/或nadh结构的化合物和/或其可药用盐在制备治疗和/或预防因结核分枝杆菌感染引起的疾病的药物中的应用。
[0035]
为进一步阐述说明本发明提供的具有nmn和/或nadh结构的化合物及其可药用盐在制备结核分枝杆菌抑制剂中的应用的效果,选用以下实施例组进行详细阐述。应当理解,下列实施例组仅用于说明本发明中结核分枝杆菌抑制剂的效果,并不限制本发明。
[0036]
需要说明的是,下述实施例中所使用的的试验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、器材等,如无特殊说明,均可从商业途径获得。下述实施例中的牛型结核分枝杆菌bcg 1173p2菌株中携带有puv3583c-gfp质粒,能够表达绿色荧光蛋白(gfp)。下述实施例中的thp-1细胞:atcc编号为tib-202。
[0037]
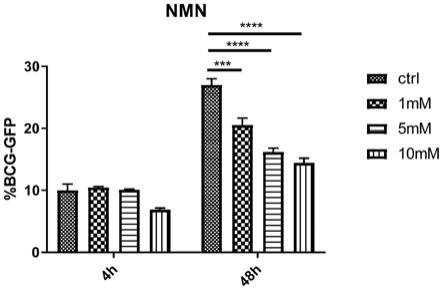
实施例1 nmn对巨噬细胞内结核分枝杆菌的抑制实验
[0038]
1、实验操作:
[0039]
1.1获取巨噬细胞:将thp-1细胞以5*10
5
个/ml的细胞浓度接种于96孔板中,每孔100ul,以100ng/ml佛波酯(pma)分化24h后细胞贴壁,得到thp-1细胞来源的巨噬细胞;
[0040]
1.2共孵育:采用牛型结核分枝杆菌bcg 1173p2侵染上述获得的thp-1细胞来源的巨噬细胞,获得感染有结核分枝杆菌的巨噬细胞体系;洗涤感染有结核分枝杆菌的巨噬细胞体系胞外的牛型结核分枝杆菌bcg 1173p2,并加入含10%(体积分数)胎牛血清的1640培养基培养;分别加入1mm、5mm、10mm的nmn(终浓度),同时设置空白对照组,共孵育48h;
[0041]
1.3荧光强度的检测:分别取共孵育4h、48h时的培养样品,检测巨噬细胞中的gfp荧光强度,得到如图1所示的结果;其中,每个时间点设置4个复孔。
[0042]
2、结果分析:孵育4h时,nmn的各个给药浓度与对照组相比,没有较明显的抑制作用;孵育48h后,nmn的各个给药浓度对巨噬细胞内的结核分枝杆菌有明显的抑制作用。其中,当nmn的给药浓度为5mm时,对巨噬细胞内的结核分枝杆菌的抑制作用最为明显。
[0043]
实施例2 nadh对巨噬细胞内结核分枝杆菌的抑制实验
[0044]
1、实验操作:
[0045]
1.1获取巨噬细胞:将thp-1细胞以5*10
5
个/ml的细胞浓度接种于96孔板中,每孔100ul,以100ng/ml佛波酯(pma)分化24h后细胞贴壁,得到thp-1细胞来源的巨噬细胞;
[0046]
1.2共孵育:采用牛型结核分枝杆菌bcg 1173p2侵染上述获得的thp-1细胞来源的巨噬细胞,获得感染有结核分枝杆菌的巨噬细胞体系;洗涤感染有结核分枝杆菌的巨噬细胞体系胞外的牛型结核分枝杆菌bcg 1173p2,并加入含10%(体积分数)胎牛血清的1640培养基培养;分别加入1mm、5mm、10mm的nadh(终浓度),同时设置空白对照组,共孵育48h;
[0047]
1.3荧光强度的检测:分别取共孵育4h、48h时的培养样品,检测巨噬细胞中的gfp荧光强度,得到如图2所示的结果;其中,每个时间点设置4个复孔。
[0048]
2、结果分析:孵育4h时,nadh的各个给药浓度与对照组相比,没有较明显的抑制作用;孵育48h后,nadh的各个给药浓度对巨噬细胞内的结核分枝杆菌有明显的抑制作用。其
中,当nadh的给药浓度为10mm时,对巨噬细胞内的结核分枝杆菌的抑制作用最为明显。
[0049]
实施例3 nmn对结核分枝杆菌的抑制实验
[0050]
1、实验操作:将牛型结核分枝杆菌bcg 1173p2调整菌液浓度至od600的读数值为0.05,接种于96孔板,每孔99ul。然后分别加入1mm、5mm、10mm的nmn(终浓度)的供试药的浓度梯度稀释液1.0ul,37℃共孵育48h;同时设置阳性对照利福平组(即孵育体系中有牛型结核分枝杆菌bcg1173p2,但是没有加入试供药,而是加入利福平)。并在4h、8h处取样检测培养体系中的gfp荧光强度,得到如图3所示的结果;其中,每个时间点设置4个复孔。
[0051]
2、结果分析:孵育4h时,nmn的各个给药浓度与对照组相比,没有较明显的抑制作用;孵育8h后,nmn的各个给药浓度对结核分枝杆菌有明显的抑制作用。其中,当nmn的给药浓度为10mm时,对结核分枝杆菌的抑制作用最为明显。
[0052]
实施例4 nadh对结核分枝杆菌的抑制试验
[0053]
1、实验操作:将牛型结核分枝杆菌bcg 1173p2调整菌液浓度至od600的读数值为0.05,接种于96孔板,每孔99ul。然后分别加入1mm、5mm、10mm的nadh(终浓度)的供试药的浓度梯度稀释液1.0ul,37℃共孵育48h;同时设置阳性对照利福平组(即孵育体系中有牛型结核分枝杆菌bcg1173p2,但是没有加入试供药,而是加入利福平)。并在4h、8h处取样检测培养体系中的gfp荧光强度,得到如图4所示的结果;其中,每个时间点设置4个复孔。
[0054]
2、结果分析:孵育4h时,nadh的各个给药浓度与对照组相比,没有较明显的抑制作用;孵育8h后,nadh的各个给药浓度对结核分枝杆菌有明显的抑制作用。其中,当nadh的给药浓度为10mm时,对结核分枝杆菌的抑制作用最为明显。
[0055]
实施例5 nmn和nadh的组合物对结核分枝杆菌的抑制试验
[0056]
1、实验操作:将牛型结核分枝杆菌bcg 1173p2调整菌液浓度至od600的读数值为0.05,接种于96孔板,每孔99ul。然后分别加入如表1所示的nmn和nadh的组合物(终浓度)的供试药的浓度梯度稀释液1.0ul,37℃共孵育48h;同时设置阳性对照利福平组(即孵育体系中有牛型结核分枝杆菌bcg 1173p2,但是没有加入试供药,而是加入利福平)。并在4h、8h处取样检测培养体系中的gfp荧光强度,得到如图5所示的结果;其中,每个时间点设置4个复孔。
[0057]
表1 nmn和nadh的组合成分表
[0058]
序号nmn/mmnadh/mm11125531010
[0059]
2、结果分析:孵育4h时,nmn和nadh的组合物的各个给药浓度与对照组相比,没有较明显的抑制作用;孵育8h后,nmn和nadh的组合物的各个给药浓度对结核分枝杆菌有明显的抑制作用。其中,当nadh的给药浓度为5mm时,对结核分枝杆菌的抑制作用最为明显。
[0060]
实施例6 nmn的细胞毒性测试
[0061]
1、实验操作:(需要说明的是,本实施例选用nmn作为对巨噬细胞的细胞毒性测试的试供药)
[0062]
1.1获取巨噬细胞:将thp-1细胞以5*10
5
个/ml的细胞浓度接种于96孔板中,每孔100ul,以100ng/ml佛波酯(pma)分化24h后细胞贴壁,得到thp-1细胞来源的巨噬细胞;
[0063]
1.2孵育:分别加入1mm、5mm、10mm、20mm、40mm的不同浓度nmn(该浓度为nmn在体系中的终浓度),与上述获得的thp-1细胞来源的巨噬细胞孵育44h;
[0064]
1.3吸光度检测:在上述孵育了44h的巨噬细胞中加入5mg/ml mtt溶液10ul/孔,4h后加入dmso溶液100ul/孔、振荡器震荡10min,于波长570nm处检测吸光度,以得到细胞存活率,如图6所示;其中,每孔设置3个复孔。
[0065]
2、结果分析:由图6可知,nmn试供药在1~40mm的剂量范围内对thp-1细胞来源的巨噬细胞没有显示细胞毒性。
[0066]
实施例7 nadh的细胞毒性测试
[0067]
1、实验操作:(需要说明的是,本实施例选用nmn作为对巨噬细胞的细胞毒性测试的试供药)
[0068]
1.1获取巨噬细胞:将thp-1细胞以5*10
5
个/ml的细胞浓度接种于96孔板中,每孔100ul,以100ng/ml佛波酯(pma)分化24h后细胞贴壁,得到thp-1细胞来源的巨噬细胞;
[0069]
1.2孵育:分别加入1mm、5mm、10mm、20mm、40mm的不同浓度nadh(该浓度为nadh在体系中的终浓度),与上述获得的thp-1细胞来源的巨噬细胞孵育44h;
[0070]
1.3吸光度检测:在上述孵育了44h的巨噬细胞中加入5mg/ml mtt溶液10ul/孔,4h后加入dmso溶液100ul/孔、振荡器震荡10min,于波长570nm处检测吸光度,以得到细胞存活率,如图7所示;其中,每孔设置3个复孔。
[0071]
2、结果分析:由图7可知,nadh试供药在1~40mm的剂量范围内对thp-1细胞来源的巨噬细胞没有显示细胞毒性。
[0072]
实施例8 nmn和nadh的组合物的细胞毒性测试
[0073]
1、实验操作:(需要说明的是,本实施例选用nmn作为对巨噬细胞的细胞毒性测试的试供药)
[0074]
1.1获取巨噬细胞:将thp-1细胞以5*10
5
个/ml的细胞浓度接种于96孔板中,每孔100ul,以100ng/ml佛波酯(pma)分化24h后细胞贴壁,得到thp-1细胞来源的巨噬细胞;
[0075]
1.2孵育:分别加入如表2所示的不同浓度nmn和nadh的组合物(该浓度为nmn和nadh的组合物在体系中的终浓度),与上述获得的thp-1细胞来源的巨噬细胞孵育44h;
[0076]
1.3吸光度检测:在上述孵育了44h的巨噬细胞中加入5mg/ml mtt溶液10ul/孔,4h后加入dmso溶液100ul/孔、振荡器震荡10min,于波长570nm处检测吸光度,以得到细胞存活率,如图8所示;其中,每孔设置3个复孔。
[0077]
表2 nmn和nadh的组合成分表
[0078][0079][0080]
2、结果分析:由图8可知,nmn和nadh的组合物的试供药在1~40mm的剂量范围内对
thp-1细胞来源的巨噬细胞没有显示细胞毒性。
[0081]
以上所述仅为本发明的可选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1