治疗金黄色葡萄球菌相关疾病的方法与流程
治疗金黄色葡萄球菌相关疾病的方法
发明背景
发明领域
[0001]
本发明提供了使用抗金黄色葡萄球菌α-毒素(抗at)抗体预防和/或治疗金黄色葡萄球菌相关菌血症和脓毒症的方法,以及预防和/或治疗免疫功能不全患者的金黄色葡萄球菌相关肺炎的方法。
背景技术:
[0002]
金黄色葡萄球菌(s.aureus)是引起全世界死亡率和发病率的主导原因,引起从轻度皮肤和软组织感染到如心内膜炎、骨髓炎及坏死性肺炎等严重侵袭性疾病的一系列不同的感染(洛维fd(lowy fd),《新英格兰医学杂志》(n engl j med),339(8):520-32(1998);凯尔文(klevens)等人,《美国医学会杂志》(jama)298(15):1763-71(2007))。金黄色葡萄球菌通常被分类为甲氧西林抗性(mrsa)或甲氧西林敏感性(mssa)的。若干报导已经显示,金黄色葡萄球菌感染会引起严重结果,不管耐药性状况如何(佛勒(fowler)等人,《内科学文献》(arch intern med.)163(17):2066-72(2003);德卡拉克(de kraker)等人,《科学公共图书馆-医学》(plos med.)十月;8(10):e1001104(2011))。
[0003]
抗生素是治疗金黄色葡萄球菌疾病的医疗标准。尽管引入了针对金黄色葡萄球菌的新抗生素,但新耐药机制的出现需要新的方法来预防或治疗金黄色葡萄球菌疾病。在抗生素时代之前,向感染患者被动给予免疫血清在临床上被用于治疗细菌感染(科勒(keller)和斯蒂姆(stiehm),《临床微生物学评论》(clin microbiol rev)13(4):602-14(2000))。当今,使用类似的方法来治疗一些毒素介导的细菌疾病(例如肉毒中毒、白喉、破伤风)(科勒和斯蒂姆,《临床微生物学评论》13(4):602-14(2000);艾侬(arnon)等人,《新英格兰医学杂志》(n.engl.j.med.)354:462-471(2006))。已经通过比较at表达缺陷型金黄色葡萄球菌菌株与同基因的野生型亲本菌株显示,金黄色葡萄球菌α毒素(at)是若干金黄色葡萄球菌疾病模型(例如皮肤坏死、肺炎、脓毒症、心内膜炎及乳腺炎)中的关键毒力决定因素(在众多其他细胞外因素之中)(布拉穆雷(bramley)等人,《感染与免疫》(infect immun.)57(8):2489-94(1989);拜耳(bayer)等人,《感染与免疫》65:4652-4660(1997);科诺德(kernodle)等人,《感染与免疫》65:179-184(1997);布贝克瓦登伯格(bubeck wardenburg)等人,《感染与免疫》75(2):1040-4(2007);布贝克瓦登伯格等人,《实验医学杂志》(j exp med.)205(2):287-94(2008);小林(kobayashi)等人,《传染病杂志》(j infect dis.)204(6):937-41(2011))。
[0004]
at是90%的金黄色葡萄球菌菌株产生的溶细胞性33kda成孔毒素,并且被视为主要毒力因素。它是以单体形式分泌并且结合靶细胞膜上的特异性受体adam-10(维尔克(wilke)和布贝克瓦登伯格,《美国国家科学院院刊》(pnas)107(30):13473-8(2010);坏岛(inoshima)等人,《自然
·
医学》(nat med)17(10):1310-4(2011))。at低聚合成七聚体前体孔并且进行构象变化,从而引起跨膜β-桶蛋白形成,并且随后引起细胞溶解(巴卡迪
(bhakdi)和特拉努姆-延森(tranum-jensen),1991;宋(song)等人,1996)。血小板以及上皮、内皮和免疫细胞(例如淋巴细胞和巨噬细胞)易受at溶解影响,表明该毒素对组织损害和免疫逃避具有直接影响(巴卡迪和特拉努姆-延森,《微生物学评论》(microbiol rev.)55(4):733-51(1991);拉吉尔(ragle)和布贝克瓦登伯格,《感染与免疫》77(7):2712-8(2009);特卡奇克(tkaczyk)等人,《临床免疫学与疫苗》(clin vaccine immunol)19(3):377-85(2012))。还已经证实,at在亚溶解浓度下发挥重要的细胞毒性作用(格里明格尔(grimminger)等人,《免疫学杂志》(j immunol.)159(4):1909-16(1997);维尔克和布贝克瓦登伯格,《美国国家科学院院刊》107(30):13473-8(2010);坏岛等人,《自然
·
医学》17(10):1310-4(2011))。at在巨噬细胞膜上结合并进行低聚合使nlrp3炎性体活化,由此连同其他葡萄球菌病原体相关分子模式(pamp)一起诱导il-1β分泌并促进细胞死亡(克拉文(craven)等人,《公共科学图书馆
·
综合》(plos one)4(10)(2009);科拜耳(kebaier)等人,《传染病杂志》(j infect dis)205(5):807-17(2012))。促炎性细胞因子表达(例如il-1β)增加是急性肺损伤的标志(古德曼(goodman)等人,《细胞因子与生长因子评论》(cytokine growth factor rev)14(6):523-35(2003))。
[0005]
at在亚溶解浓度下还使adam-10介导的存在于细胞-细胞粘附接触中的e-钙粘素的蛋白水解活化,导致上皮完整性的破坏并且促成肺炎以及皮肤和软组织感染中所见的上皮损害(坏岛等人,《自然
·
医学》17(10):1310-4(2011);马瑞斯基(maretzky)等人,《美国国家科学院院刊》102(26):9182-7(2005);坏岛等人,《皮肤病学研究杂志》(j invest dermatol.)132(5):1513-6(2012))。at通过直接和间接活性发挥其细胞毒性作用,从而建立有助于细菌生长和侵袭性疾病的环境。因此,at的靶向抑制可以预防或限制金黄色葡萄球菌相关疾病。这一假说得到了其他研究的支持,这些研究证实,在鼠类感染模型中,在针对at进行主动或被动免疫之后金黄色葡萄球菌疾病的严重程度降低(门择斯(menzies)和科诺德,《感染与免疫》64(5):1839-41(1996);布贝克瓦登伯格等人,《实验医学杂志》(j exp med.)205(2):287-94(2008);拉吉尔和布贝克瓦登伯格,《感染与免疫》77(7):2712-8(2009);肯尼迪(kennedy)等人,《传染病杂志》202(7):1050-8(2010);特卡奇克等人,《临床免疫学与疫苗》19(3):377-85(2012))。
[0006]
具有fc变体区域的抗at抗体和其亲本抗体lc10是人类高亲和力抗at mab(先前披露于美国临时申请号61/440,581和国际申请号pct/us 2012/024201(以wo 2012/109205公布)中,各案的内容通过引用结合于此)以及特卡奇克等人,《临床免疫学与疫苗》19(3):377(2012)中。
[0007]
菌血症和脓毒性休克造成了大部分的金黄色葡萄球菌侵袭性疾病(凯尔文等人,《美国医学会杂志》(jama)298(15):1763-71(2007))。已提出at在金黄色葡萄球菌脓毒症期间是重要的毒力因素,并且在脓毒症期间引起内皮损害(鲍尔斯(powers)等人,《传染病杂志》206(3):352-6(2012))。at与其受体在内皮细胞上相互作用,从而通过引导细胞溶解或活化adam-10介导的内皮紧密连接的蛋白水解来允许毒素介导血管损害(同上)。两种机制都将增加血管渗透性(细菌性脓毒症的标志)。
[0008]
尽管如美国临时申请号61/440,581和国际申请号pct/us 2012/024201中所描述,已显示用抗at单克隆抗体进行被动免疫使得鼠类葡萄球菌肺炎模型的存活率显著增加,但尚不了解抗at抗体在增加患有金黄色葡萄球菌相关疾病的免疫功能不全哺乳动物的存活
率方面是否有效。这是了解作为免疫功能不全的个体,特别是患有嗜中性粒细胞减少症的那些有增加的金黄色葡萄球菌感染风险的关键部分(安德鲁斯(andrews)和沙利文(sullivan),《临床微生物学评论》(clin microbiol rev)16(4):597-621(2003);鲍马(bouma)等人,《英国血液学杂志》(br j br haematol.)151(4):312-26(2010))。
[0009]
本发明首次提供了抗at抗体在预防脓毒症和免疫功能不全性肺炎方面有效的例证。发明概述
[0010]
在此提供了用于预防或降低哺乳动物受试者的金黄色葡萄球菌相关脓毒症的严重程度的方法,这些方法包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。还提供了降低哺乳动物受试者的血流或心脏中的金黄色葡萄球菌细菌负荷的方法,这些方法包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。还提供了减少哺乳动物受试者体内的金黄色葡萄球菌细菌凝集和/或血栓栓塞病变形成的方法,这些方法包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。还提供了预防或降低免疫功能不全的哺乳动物受试者的金黄色葡萄球菌相关肺炎的严重程度的方法,这些方法包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。
[0011]
在此所描述的不同方法中,该受试者的血流或心脏中的金黄色葡萄球菌细菌负荷适当地降低,并且在另外的实施例中,该受试者体内金黄色葡萄球菌细菌凝集和/或血栓栓塞病变形成减少。
[0012]
在此所描述的不同方法中的哺乳动物受试者宜为人类。
[0013]
在不同方法中,该分离的抗at抗体或其抗原结合片段是选自下组,该组由以下各项组成:fv、fab、fab'及f(ab')2。在其他实施例中,该抗体是全长抗体。在又另外的实施例中,该抗体包含fc变体区域。
[0014]
在此所描述的不同方法的实施例中,该分离的抗体或其抗原结合片段免疫特异性地结合到金黄色葡萄球菌α毒素多肽并且包括:(a)包含seq id no:7、10、13或69的氨基酸序列的vh cdr1;(b)包含seq id no:8、11、14、17、70或75的氨基酸序列的vh cdr2;(c)包含seq id no:9、12、15、18、16、65、66、67、71、72、76或78的氨基酸序列的vh cdr3;(d)包含seq id no:1或4的的氨基酸序列vl cdr1;(e)包含seq id no:2、5、73或77的氨基酸序列的vl cdr2;以及(f)包含seq id no:3、6、64、68或74的氨基酸序列的vl cdr3。
[0015]
在多个实施例中,用于在此所描述的不同方法中的vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2以及vl cdr3对应于seq id no:7、8、9、1、2及3;seq id no:10、11、12、1、2及3;seq id no:13、14、15、4、5及6;seq id no:7、17、18、1、2及3;seq id no:7、8、16、1、2及64;seq id no:7、8、65、1、2及64;seq id no:7、8、66、1、2及64;seq id no:7、8、67、1、2及68;seq id no:7、8、67、1、2及64;seq id no:7、8、78、1、2及64;seq id no:7、8、65、1、2及68;seq id no:69、70、71、1、2及68;seq id no:7、8、72、1、73及74;seq id no:69、75、71、1、2及68;seq id no:69、75、76、1、2及68;seq id no:69、75、76、1、77及74;seq id no:69、70、
71、1、77及74的氨基酸序列。
[0016]
在另外的实施例中,该分离的抗体或其抗原结合片段包含重链可变结构域,该结构域与seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的氨基酸序列具有至少90%的一致性,并且(iii)包含轻链可变结构域,该结构域与seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列具有至少90%的一致性。适合地,该分离的抗体或其抗原结合片段包含了具有seq id no 20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的重链可变结构域,以及具有seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的轻链可变结构域。
[0017]
在此所描述的不同方法的另外的实施例中,该vh和vl对应于seq id no:20和19;seq id no;22和21;seq id no:24和23;seq id no:26和25;seq id no:28和27;seq id no:41和42;seq id no:43和44;seq id no:45和46;seq id no:47和48;seq id no:47和48;seq id no:49和50;seq id no:51和52;seq id no:51和52;seq id no:53和54;seq id no:55和56;seq id no:57和58;seq id no:59和60;seq id no:61和58;seq id no:62和58;seq id no:62和63;seq id no:79和63的氨基酸序列。
[0018]
在这些不同方法的又另外的实施例中,该分离的抗体或其抗原结合片段包含了具有fc变体结构域的抗at抗体,其中该抗体包含了对应于seq id no:80的vh-igg1-yte和/或对应于seq id no:81的vl-κ。附图简要说明
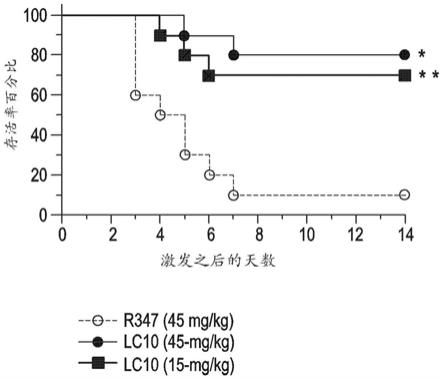
[0019]
图1.lc10预防改善了iv致死性激发模型的存活率。在用sf8300(3
×
108cfu)进行iv激发之前24小时,用lc10(45和15mg/kg)或同型对照物(r347,45mg/kg)对小鼠(每组10只)进行被动免疫。监测存活率,持续14天。数据代表4次独立实验。用对数秩(马特尔-考克斯(martel-cox))测试评估统计显著性:*p值=0.0005;**p值=0.0043。
[0020]
图2.lc10预防减少心脏中的细菌负荷。在以sf8300(2.98e8cfu)进行iv激发之前24小时,用lc10(45和15mg/kg)或同型对照物(r347,45mg/kg)对小鼠进行被动免疫。感染后十四小时,从感染的动物收集心脏并且进行处理以用于cfu计数。用不成对2尾学生t检验(student's t-test)进行统计分析:*p值=0.0028;**p值=0.0082。
[0021]
图3.lc10预防减少葡萄球菌菌血症。在以sf8300(3
×
108cfu)进行iv激发之前24小时,用lc10(45和15mg/kg)或同型对照物(r347,45mg/kg)对小鼠进行被动免疫。在感染后的不同时间点,通过心脏穿刺来收集血液并且涂布用于cfu计数。用学生t检验进行统计分析。如果*p<0.05,那么认为数据相对于r347存在统计学差异。
[0022]
图4.总体和分类白细胞计数。在第0天和第3天,对c57bl6/j小鼠给予6个不同剂量的cpm(mg/kg)。在第0天、第1天、第4天及第6天,取得每组每个时间点5只小鼠的血液样品。使用sysmex自动血液学分析器对总体和分类白细胞计数(嗜中性粒细胞、淋巴细胞)进行分析。
[0023]
图5.细菌剂量滴定。在第二剂cpm(第4天)之后24小时,用50μl对数期的细菌悬浮液(剂量范围从1
×
107到2
×
108cfu)in激发五只免疫功能不全的小鼠。观察动物的存活率,持续7天时间。
[0024]
图6.lc10增加免疫功能不全的动物的存活率。在用50μl的细菌悬浮液sf8300(5
×
107cfu)进行in感染之前24小时,向注射cpm的动物给予lc10(45或15mg/kg)或r347(45mg/
kg)。监测动物的存活率,持续5天。使用对数秩检验测定统计显著性并且*指示相对于用r347处理的动物存在统计学差异(p<0.0001)。
[0025]
图7.总体和分类白细胞计数。在第-4天和第-1天,对应地给予c57bl/6小鼠2种剂量的cpm(150mg/kg和100mg/kg)。在第-4天、第-3天、第-1天、第0天、第2天及第3天,从5只小鼠收集血液样品。使用sysmex自动血液学分析器测定总体和分类白细胞计数(嗜中性粒细胞、淋巴细胞)。发明详细说明
[0026]
术语“多肽”、“肽”、“蛋白质”及“蛋白质片段”在此可互换地使用,指的是氨基酸残基形成的聚合物。这些术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是相应天然存在的氨基酸的人造化学模拟剂,并且适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。
[0027]
术语“氨基酸”是指天然存在和合成的氨基酸,以及类似于天然存在的氨基酸起作用的氨基酸类似物和氨基酸模拟物。
[0028]
如在此所使用,“重组”包括提及这样蛋白质,该蛋白质是使用天然状态不具有能够表达该蛋白质的dna的内源拷贝的细胞所产生。由于这些细胞已经通过引入适当的分离的核酸序列进行遗传变化,故它们产生重组蛋白。
[0029]
如在此所使用,“抗体”和“免疫球蛋白”在最广泛意义上是可互换地使用的,并且包括单克隆抗体(例如全长或完整单克隆抗体)、多克隆抗体、多价抗体、多特异性抗体(例如双特异性抗体,只要它们展现出期望的生物活性)以及抗原结合片段,如在此所描述。天然抗体和免疫球蛋白通常是约150,000道尔顿的杂四聚体糖蛋白,由两条一致轻(l)链和两条一致重(h)链构成。每条轻链通过一个共价二硫键连接到重链,而在不同免疫球蛋白同型的重链之间的二硫键数目不同。每条重链和轻链还具有规则间隔的链内二硫桥键。每条重链在一端处具有可变结构域(v
h
),紧接着是多个恒定结构域。每条轻链在一端处具有可变结构域(v
l
)并且在其另一端处具有恒定结构域。术语“恒定”和“可变”是在功能上使用的。
[0030]
轻链的恒定结构域与重链的第一个恒定结构域对准,并且轻链的可变结构域与重链的可变结构域对准。相信特定氨基酸残基形成了轻链与重链可变结构域之间的界面(科西亚(clothia)等人,《分子生物学杂志》(j.mol.biol.)186,651-66(1985));诺瓦特尼(novotny)和哈伯(haber),《美国国家科学院院刊》(proc.natl.acad.sci.usa)82,4592-4596(1985))。基于重链组成,定义了五个人类免疫球蛋白种类,并且被命名为igg、igm、iga、ige及igd。igg类和iga类抗体被进一步分成几个子类,即igg1、igg2、igg3及igg4,以及iga1和iga2。igg、iga及igd抗体中的重链具有三个恒定区结构域,这些结构域指定为ch1、ch2及ch3,并且igm和ige抗体中的重链具有四个恒定区结构域ch1、ch2、ch3及ch4。因此,重链具有一个可变区和三个或四个恒定区。免疫球蛋白结构和功能评述于例如哈洛(harlow)等人编,《抗体技术实验指南》(antibodies:a laboratory manual),第14章,冷泉港实验室(cold spring harbor laboratory),冷泉港(1988)中。
[0031]
提到的“v
h”或“vh”是指免疫球蛋白重链可变区,包括fv、scfv、dsfv或fab。
[0032]
提到的“v
l”或“vl”是指免疫球蛋白轻链可变区,包括fv、scfv、dsfv或fab。
[0033]
术语“抗原结合片段”是指完整抗体的一部分并且是指完整抗体的抗原决定可变区。抗原结合片段的实例包括但不限于fab、fab'、f(ab')2、fv和单链fv片段、线性抗体、单
链抗体以及由抗原结合片段形成的多特异性抗体。
[0034]
术语“单链fv”或“scfv”是指这样的抗体,其中传统的双链抗体的重链和轻链的可变结构域已经接合形成一条链。术语包括由一个轻链可变结构域(v
l
)或其部分和一个重链可变结构域(v
h
)或其部分组成的结合分子,其中每条可变结构域(或其部分)都来源于相同或不同抗体。scfv分子典型地包含了插入v
h
结构域与v
l
结构域之间的scfv连接子。本领域中已知scfv分子并且描述于例如以下各项中:美国专利号5,892,019;胡(ho)等人,《基因》(gene)77:51-59(1989);伯德(bird)等人,《科学》(science)242:423-426(1988);潘托拉诺(pantoliano)等人,《生物化学》(biochemistry)30:10117-10125(1991);米伦尼克(milenic)等人,《癌症研究》(cancer research)51:6363-6371(1991);塔肯恩(takkinen)等人,《蛋白质工程》(protein engineering)4:837-841(1991),全部通过引用以其全文结合于此。抗金黄色葡萄球菌α毒素抗体和抗原结合片段
[0035]
如在此所用的抗金黄色葡萄球菌α毒素(又称抗金黄色葡萄球菌at或抗at)抗体或其抗原结合片段免疫特异性地结合到对该α毒素蛋白、肽、亚基、片段、部分、低聚物或其任何组合具有特异性的一个或多个表位,并且一般不特异性结合到其他多肽。术语“低聚物”或“α毒素低聚物”是指α毒素单体(例如2个单体、3个单体、4个单体、5个单体、6个单体或7个单体)缔合形成功能性孔(例如7个α毒素单体)。表位可以包含至少一个抗体结合区,该结合区包含α毒素蛋白的至少一部分。如在此所使用,术语“表位”是指能够结合到抗体的蛋白质决定子。表位一般包括如氨基酸和/或糖侧链等分子的化学活性表面基团,并且一般具有特定的三维结构特征,以及特定的化学特征(例如电荷、极性、碱性、酸性、疏水性等等)。构象和非构象表位的区别在于,在变性溶剂存在下,与前者的结合丧失但与后者的结合不丧失。在一些实施例中,识别的表位干扰活性七聚体的形成(例如,抑制α毒素单体低聚合为活性七聚体复合体)。
[0036]
在某些实施例中,表位包含涉及α毒素七聚体复合体形成的α毒素蛋白的至少一部分。指定的表位可以包含α毒素蛋白的连续氨基酸中的至少3个氨基酸残基乃至整个指定部分中的至少一个氨基酸序列的任何组合。在一些实施例中,表位是α毒素蛋白的连续氨基酸中的至少4个氨基酸残基、至少5个氨基酸残基、至少6个氨基酸残基、至少7个氨基酸残基、至少8个氨基酸残基、至少9个氨基酸残基、至少10个氨基酸残基、至少11个氨基酸残基、至少12个氨基酸残基、至少13个氨基酸残基、至少14个氨基酸残基或至少15个氨基酸残基乃至整个指定部分。在某些其他实施例中,表位包含1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个连续或非连续氨基酸残基。在另外的实施例中,包含在表位之内的氨基酸残基涉及α毒素七聚体复合体形成。
[0037]
因此,在具体实施例中,分离/纯化的抗α毒素抗体和抗原结合片段免疫特异性地结合到包含根据seq id no:39的氨基酸序列的分子和/或包含根据seq id no:40的氨基酸序列的分子。在某些实施例中,抗α毒素抗体和抗原结合片段还结合来自不同物种的α毒素同源物或直系同源物,或者结合到seq id no:39的氨基酸序列的变体,其中在35位处的组氨酸被亮氨酸置换或被对应于本领域的普通技术人员已知的h35突变的其他氨基酸置换。可变区
[0038]
在某些实施例中,抗α毒素抗体或抗原结合片段是从亲本抗体制备的。在一些实施
例中,抗α毒素抗体或抗原结合片段被包含在亲本抗体中。如在此所使用,术语“亲本抗体”是指由用于制备在此定义的变体或衍生物的氨基酸序列编码的抗体。亲本多肽可以包含天然抗体序列(即,天然存在的,包括天然存在的等位基因变体)或天然存在序列的具有事先存在的氨基酸序列修饰(如其他插入、缺失和/或取代)的抗体序列。亲本抗体可以是人类化抗体或人类抗体。在具体实施例中,抗α毒素抗体和抗原结合片段是亲本抗体的变体。如在此所使用,术语“变体”是指借助在亲本抗体序列中添加、缺失和/或取代一个或多个氨基酸残基而在氨基酸序列上不同于“亲本”抗α毒素抗体或抗原结合片段氨基酸序列的抗α毒素抗体或抗原结合片段。
[0039]
抗体的抗原结合部分包含抗体中保留了特异性结合到抗原(例如α毒素)的能力的一个或多个片段。已经显示,抗体的抗原结合功能可以由全长抗体的片段(即,抗原结合片段)进行。抗体的“抗原结合部分”内所涵盖的“抗原结合片段”的实例包括(i)fab片段,由vl、vh、cl及ch1结构域组成的单价片段;(ii)f(ab')2片段,包含在铰链区由二硫桥键连接的两个fab片段的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单一臂的vl和vh结构域组成的fv片段;(v)dab片段,由vh结构域组成;及(vi)分离的互补决定区(cdr)。尽管fv片段的两个结构域vl和vh常常是由独立基因编码,但它们可以使用重组方法,通过合成连接子接合,该连接子使其能够制备成单一蛋白质链形式,其中vl和vh区域配对形成单价分子(称为单链fv(scfv))。此类单链抗体也涵盖在术语“抗体”和抗体的“抗原结合片段”内。这些抗原结合片段可以使用已知技术获得,并且可以按与完整抗体相同的方式针对结合活性对这些片段进行筛选。抗原结合片段可以通过重组dna技术,或通过完整免疫球蛋白的酶促或化学裂解来产生。
[0040]
本发明的抗α毒素抗体和抗原结合片段包含至少一个抗原结合结构域。在一些实施例中,抗α毒素抗体或抗原结合片段包含了含seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61、或62的氨基酸序列的vh。在某些实施例中,抗α毒素抗体或抗原结合片段包含了含seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列的vl。在又另一个实施例中,抗α毒素抗体或抗原结合片段包含了含seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61、或62的氨基酸序列的vh以及含seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列的vl。有关如在此呈现的vh和vl序列的表示,参见表7,这些vh和vl序列能以形成抗α毒素抗体或抗原结合片段的任何组合存在,或者以形成本发明的mab的组合存在。在一些实施例中,vh选自seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62。在不同实施例中,vl选自seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63。某些vh和vl核苷酸序列呈现于表8中。
[0041]
在一些实施例中,分离的抗体或其抗原结合片段包含vh和vl,其中该vh和vl具有由以下各项表示的氨基酸序列:seq id no:20和19;seq id no;22和21;seq id no:24和23;seq id no:26和25;seq id no:28和27;seq id no:41和42;seq id no:43和44;seq id no:45和46;seq id no:47和48;seq id no:47和48;seq id no:49和50;seq id no:51和52;seq id no:51和52;seq id no:53和54;seq id no:55和56;seq id no:57和58;seq id no:59和60;seq id no:61和58;seq id no:62和58;seq id no:62和63;seq id no:79和63。
[0042]
表1-7提供了用于在此呈现的抗体和抗原结合片段的某些实施例的重链可变区(vh)、轻链可变区(vl)以及互补决定区(cdr)。在某些实施例中,抗α毒素抗体和抗原结合片段包含了与表7中披露的vh和/或vl序列中的至少一个具有给定百分比一致性的vh和/或vl。如在此所使用,术语“序列一致性百分比(%)”,还包括“同源性”,被定义为在对准序列并且(必要时)引入空位以获得最大的序列一致性百分比,并且不将任何保守取代视为序列一致性的部分之后,在候选序列中的氨基酸残基或核苷酸与参考序列(如亲本抗体序列)中的氨基酸残基或核苷酸一致的百分比。除了手动比对外,可以借助于本领域已知的局部同源性算法或借助于使用这些算法的计算机程序(威斯康星州麦迪逊市(madison,wisconsin),科学驱动路575号(575science drive),遗传学计算机集团(genetics computer group)的威斯康星遗传学软件包(wisconsin genetics software package)中的gap、bestfit、fasta、blast p、blast n以及tfasta)来产生供比较的序列的最佳比对。
[0043]
在具体实施例中,抗体或抗原结合片段免疫特异性地结合到α毒素,并且包含重链可变结构域,该重链可变结构域包含与seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的氨基酸序列的至少90%的一致性,并且包含轻链可变结构域,该轻链可变结构域包含与seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列的至少90%的一致性,其中该抗体具有抑制一个或多个α毒素单体彼此结合的活性(例如,抑制低聚合)。互补决定区
[0044]
当可变结构域(vh和vl)包含抗原结合区时,变异性不是通过抗体的可变结构域均匀分布的。它被集中在轻链(vl或vk)和重链(vh)可变结构域两者中的称为互补决定区(cdr)的区段中。可变结构域的更高保守性的部分称为构架区(fr)。天然重链和轻链的可变结构域各自包含由三个cdr连接的四个fr,这四个fr大体上采用β-片层构型,这三个cdr形成连接β-片层结构的环并且在一些情况下形成β-片层结构的一部分。每条链中的cdr由fr紧密靠近地保持在一起,与来自另一条链的cdr促成了抗体的抗原结合位点的形成(参见卡巴特(kabat)等人,上文)。重链的三个cdr被指定为vh-cdr1、vh cdr2及vh-cdr-3,而轻链的三个cdr被指定为vl-cdr1、vl-cdr2及vl-cdr3。在此使用卡巴特编号系统。因而,vh-cdr1在大致氨基酸31处(即,在第一个半胱氨酸残基之后大致9个残基处)开始,包括大致5-7个氨基酸,并且在下一个丝氨酸残基处结束。vh-cdr2在cdr-h1末端之后的第十五个残基处开始,包括大致16-19个氨基酸,并且在下一个甘氨酸残基处结束。vh-cdr3在vh-cdr2末端之后大致第十三个氨基酸残基处开始;包括大致13-15个氨基酸;并且在序列m-d-v处结束。vl-cdr1在大致残基24处(即,在半胱氨酸残基之后)开始;包括大致10-15个残基;并且以序列y-v-s结束。vl-cdr2在vl-cdr1末端之后大致第十六个残基处开始,并且包括大致7个残基。vl-cdr3在vh-cdr2末端之后大致第三十三个残基处开始;包括大致7-11个残基,并且在序列t-i-l处结束。应注意,cdr在抗体间变化极大(并且通过定义将无法展现与卡巴特共同序列的同源性)。
[0045]
本发明的抗α毒素抗体和抗原结合片段包含至少一个抗原结合结构域,该结构域包括至少一个互补决定区(cdr1、cdr2或cdr3)。在一些实施例中,抗α毒素抗体或抗原结合片段包含vh,该vh包括至少一个vh cdr(例如,cdr-h1、cdr-h2或cdr-h3)。在某些实施例中,抗α毒素抗体或抗原结合片段包含vl,该vl包括至少一个vl cdr(例如,cdr-l1、cdr-l2或
cdr-l3)。
[0046]
在一些实施例中,免疫特异性地结合到金黄色葡萄球菌α毒素多肽的分离的抗体或其抗原结合片段包括:(a)vh cdr1,该vh cdr1包含与seq id no:7、10、13或69一致的氨基酸序列,或相对于它们包含1、2或3个氨基酸残基取代;(b)vh cdr2,该vh cdr2包含与seq id no:8、11、14、17、70或75一致的氨基酸序列或相对于它们包含1、2或3个氨基酸残基取代;以及(c)vh cdr3,该vh cdr3包含与seq id no:9、12、15、18、16、65、66、67、71、72、76或78一致的氨基酸序列或相对于它们包含1、2或3个氨基酸残基取代。
[0047]
在特定实施例中,分离的抗体或其抗原结合片段包含vh cdr1、vh cdr2及vh cdr3,它们包含与以下各项一致的氨基酸序列,或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:seq id no:7、8及9;seq id no:10、11及12;seq id no:13、14及15;seq id no:7、17及18;seq id no:7、8及16;seq id no:7、8及65;seq id no:7、8及66;seq id no 7、8及67;seq id no:7、8及78;seq id no:69、70及71;seq id no:7、8及72;seq id no:69、75及71;seq id no:69、75及76;或seq id no:69、70及71。
[0048]
在一些实施例中,免疫特异性地结合到金黄色葡萄球菌α毒素多肽的分离的抗体或其抗原结合片段包括:(a)vl cdr1,该vl cdr1包含与seq id no:1或4一致的氨基酸序列或相对于它们包含1、2或3个氨基酸残基取代;(b)vl cdr2,该vl cdr2包含与seq id no:2、5、73或77一致的氨基酸序列或相对于它们包含1、2或3个氨基酸残基取代;以及(c)vl cdr3,该vl cdr3包含与seq id no:3、6、64、68或74一致的氨基酸序列或相对于它们包含1、2或3个氨基酸残基取代。
[0049]
在特定实施例中,分离的抗体或其抗原结合片段包含vl cdr1、vl cdr2及vl cdr3,它们包含与以下各项一致的氨基酸序列,或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:seq id no:1、2及3;seq id no:4、5及6;seq id no:1、2及64;seq id no:1、2及68;seq id no:1、73及74;或seq id no:1、77及74。
[0050]
在一些实施例中,免疫特异性地结合到金黄色葡萄球菌α毒素多肽的分离的抗体或其抗原结合片段包含vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2及vl cdr3,它们包含与以下各项一致的氨基酸序列,或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:(a)vh cdr1,该vh cdr1包含seq id no:7、10、13或69的氨基酸序列;(b)vh cdr2,该vh cdr2包含seq id no:8、11、14、17、70或75的氨基酸序列;(c)vh cdr3,该vh cdr3包含seq id no:9、12、15、18、16、65、66、67、71、72、76或78的氨基酸序列;(d)vl cdr1,该vl cdr1包含seq id no:1或4的氨基酸序列;(e)vl cdr2,该vl cdr2包含seq id no:2、5、73或77的氨基酸序列;以及(f)vl cdr3,该vl cdr3包含seq id no:3、6、64、68或74的氨基酸序列。
[0051]
在特定实施例中,分离的抗体或其抗原结合片段包含vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2及vl cdr3,它们包含与以下各项一致的氨基酸序列或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:seq id no:7、8、9、1、2及3;seq id no:10、11、12、1、2及3;seq id no:13、14、15、4、5及6;seq id no:7、17、18、1、2及3;seq id no:7、8、16、1、2及64;seq id no:7、8、65、1、2及64;seq id no:7、8、66、1、2及64;seq id no:7、8、67、1、2及68;seq id no:7、8、67、1、2及64;seq id no:7、8、78、1、2及64;seq id no:7、8、65、1、2及68;seq id no:69、70、71、1、2及68;seq id no:7、8、72、1、73及74;seq id no:69、
75、71、1、2及68;seq id no:69、75、76、1、2及68;seq id no:69、75、76、1、77及74;seq id no:69、70、71、1、77及74,
[0052]
在一些实施例中,提供了以下组合物,该组合物包含分离的抗体或其抗原结合片段,该分离的抗体或其抗原结合片段(i)包括了包含三个cdr的vh链结构域及包含三个cdr的vl链结构域;并且(ii)免疫特异性地结合到金黄色葡萄球菌α毒素多肽,其中该vh链结构域的三个cdr包括(a)包含seq id no:7、10、13或69的氨基酸序列的vh cdr1;(b)包含seq id no:8、11、14、17、70或75的氨基酸序列的vh cdr2;以及(c)包含seq id no:9、12、15、18、16、65、66、67、71、72、76或78的氨基酸序列的vh cdr3。在特定实施例中,vh cdr1、vh cdr2及vh cdr3对应于seq id no:7、8及9;seq id no:10、11及12;seq id no:13、14及15;seq id no:7、17及18;seq id no:7、8及16;seq id no:7、8及65;seq id no:7、8及66;seq id no 7、8及67;seq id no:7、8及78;seq id no:69、70及71;seq id no:7、8及72;seq id no:69、75及71;seq id no:69、75及76;或seq id no:69、70及71。
[0053]
在某些实施例中,还提供了以下组合物,该组合物包含分离的抗体或其抗原结合片段,该分离的抗体或其抗原结合片段(i)包括了包含三个cdr的vh链结构域及包含三个cdr的vl链结构域;并且(ii)免疫特异性地结合到金黄色葡萄球菌α毒素多肽,其中该vl链结构域的三个cdr包括(a)包含seq id no:1或4的氨基酸序列的vl cdr1;(b)包含seq id no:2、5、73或77的氨基酸序列的vl cdr2;以及(c)包含seq id no:3、6、64、68或74的氨基酸序列的vl cdr3。在特定实施例中,vl cdr1、vl cdr2及vl cdr3对应于seq id no:1、2及3;seq id no:4、5及6;seq id no:1、2及64;seq id no:1、2及68;seq id no:1、73及74;或seq id no:1、77及74。
[0054]
在一些实施例中,免疫特异性地结合到金黄色葡萄球菌α毒素多肽的分离的抗体或其抗原结合片段包含vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2及vl cdr3,它们包含与以下各项一致的氨基酸序列,或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:(a)vh cdr1,该vh cdr1包含seq id no:7、10、13或69的氨基酸序列;(b)vh cdr2,该vh cdr2包含seq id no:8、11、14、17、70或75的氨基酸序列;(c)vh cdr3,该vh cdr3包含seq id no:9、12、15、18、16、65、66、67、71、72、76或78的氨基酸序列;(d)vl cdr1,该vl cdr1包含seq id no:1或4的氨基酸序列;(e)vl cdr2,该vl cdr2包含seq id no:2、5、73或77的氨基酸序列;以及(f)vl cdr3,该vl cdr3包含seq id no:3、6、64、68或74的氨基酸序列。
[0055]
在特定实施例中,分离的抗体或其抗原结合片段包含vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2及vl cdr3,它们包含与以下各项一致的氨基酸序列或相对于以下各项在每个cdr中包含1、2或3个氨基酸残基取代:seq id no:7、8、9、1、2及3;seq id no:10、11、12、1、2及3;seq id no:13、14、15、4、5及6;seq id no:7、17、18、1、2及3;seq id no:7、8、16、1、2及64;seq id no:7、8、65、1、2及64;seq id no:7、8、66、1、2及64;seq id no:7、8、67、1、2及68;seq id no:7、8、67、1、2及64;seq id no:7、8、78、1、2及64;seq id no:7、8、65、1、2及68;seq id no:69、70、71、1、2及68;seq id no:7、8、72、1、73及74;seq id no:69、75、71、1、2及68;seq id no:69、75、76、1、2及68;seq id no:69、75、76、1、77及74;seq id no:69、70、71、1、77及74,
[0056]
在一些实施例中,提供了以下组合物,该组合物包含分离的抗体或其抗原结合片
段,该分离的抗体或其抗原结合片段(i)包括了包含三个cdr的vh链结构域及包含三个cdr的vl链结构域;并且(ii)免疫特异性地结合到金黄色葡萄球菌α毒素多肽,其中该vh链结构域的三个cdr包括(a)包含seq id no:7、10、13或69的氨基酸序列的vh cdr1;(b)包含seq id no:8、11、14、17、70或75的氨基酸序列的vh cdr2;以及(c)包含seq id no:9、12、15、18、16、65、66、67、71、72、76或78的氨基酸序列的vh cdr3。在特定实施例中,vh cdr1、vh cdr2及vh cdr3对应于seq id no:7、8及9;seq id no:10、11及12;seq id no:13、14及15;seq id no:7、17及18;seq id no:7、8及16;seq id no:7、8及65;seq id no:7、8及66;seq id no 7、8及67;seq id no:7、8及78;seq id no:69、70及71;seq id no:7、8及72;seq id no:69、75及71;seq id no:69、75及76;或seq id no:69、70及71。
[0057]
在一些实施例中还提供了包括分离的抗体或其抗原结合片段的组合物,该分离的抗体或其抗原结合片段(i)免疫特异性地结合到金黄色葡萄球菌α毒素多肽;(ii)包含重链可变结构域,该结构域与seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的氨基酸序列包含至少90%的一致性;并且(iii)包含轻链可变结构域,该结构域与seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列包含至少90%的一致性。
[0058]
在一些实施例中,分离的抗体或其抗原结合片段包括具有seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的重链可变结构域,以及具有seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的轻链可变结构域。
[0059]
在特定实施例中,分离的抗体或其抗原结合片段包含vh和vl,其中该vh和vl各自与以下vh和vl氨基酸序列一致或各自与以下vh和vl氨基酸序列具有至少90%、95%或98%的一致性:seq id no:20和19;seq id no;22和21;seq id no:24和23;seq id no:26和25;seq id no:28和27;seq id no:41和42;seq id no:43和44;seq id no:45和46;seq id no:47和48;seq id no:47和48;seq id no:49和50;seq id no:51和52;seq id no:51和52;seq id no:53和54;seq id no:55和56;seq id no:57和58;seq id no:59和60;seq id no:61和58;seq id no:62和58;seq id no:62和63;seq id no:79和63。变体fc区
[0060]
本发明还包括了本发明的结合成员,并且具体地说,具有修饰的igg恒定结构域的本发明的抗体。具有多种功能特征(如在血清中的长半衰期和介导不同的效应子功能的能力)的人igg类别的抗体被用于本发明的某些实施例中(《单克隆抗体:原理与应用》(monoclonal antibodies:principles and applications),威利-利斯公司(wiley-liss,inc.),第1章(1995))。人igg类抗体被进一步分成以下4个亚类:igg1、igg2、igg3以及igg4。迄今为止,已经针对作为igg类抗体的效应子功能的adcc和cdc进行了大量的研究,并且据报道,在人igg类的抗体中,igg1亚类在人体内具有最高的adcc活性和cdc活性(《化学免疫学》(chemical immunology),65,88(1997))。
[0061]“抗体依赖性细胞介导的细胞毒性”和“adcc”是指这样的细胞介导的反应,其中非特异性细胞毒性细胞(例如,自然杀伤(nk)细胞、嗜中性粒细胞以及巨噬细胞)识别靶细胞上的结合抗体并且随后导致该靶细胞溶解。在一个实施例中,此类细胞是人类细胞。虽然不希望受任何具体的作用机制限制,但介导adcc的这些细胞毒性细胞一般表达fc受体(fcr)。用于介导adcc的原代细胞(nk细胞)表达fcγriii,而单核细胞表达fcγri、fcγrii、fcγ
riii和/或fcγriv。造血细胞上fcr的表达概述于雷弗克(ravetch)和肯尼特(kinet),《免疫学年鉴》(annu.rev.immunol.),9:457-92(1991)中。为了评估分子的adcc活性,可以进行体外adcc测定,如描述于美国专利号5,500,362或5,821,337中的测定。用于此类测定的有用效应细胞包括外周血单核细胞(pbmc)和自然杀伤(nk)细胞。作为替代方案,或另外地,可以在体内,例如在动物模型中,如克莱因斯(clynes)等人,《美国国家科学院院刊》(美国),95:652-656(1998)中披露的模型,评估所关注分子的adcc活性。
[0062]“补体依赖性细胞毒性”或“cdc”是指在补体存在下分子起始补体活化并溶解靶的能力。补体活化途径是通过补体系统的第一组分(c1q)结合到与同源抗原复合的分子(例如,抗体)起始。为了评估补体活化,可以进行cdc测定,例如,如加扎诺-桑托罗(gazzano-santaro)等人,《免疫学方法杂志》(j.immunol.methods),202:163(1996))中所描述。
[0063]
人igg1子类抗体的adcc活性和cdc活性的表达一般涉及抗体的fc区结合到存在于效应细胞(如杀伤细胞、自然杀伤细胞或活化的巨噬细胞)表面上的针对抗体的受体(下文称为“fcγr”)。不同的补体组分可以被结合。关于结合,已经提出,抗体铰链区和c区的第二结构域(以下称为“cγ2结构域”)中的若干氨基酸残基很重要(《欧洲免疫学杂志》(eur.j.immunol.),23,1098(1993);《免疫学》(immunology),86,319(1995);《化学免疫学》(chemical immunology),65,88(1997))并且cγ2结构域中的糖链(《化学免疫学》,65,88(1997))也很重要。
[0064]“效应细胞”是表达一种或多种fcr并且执行效应子功能的白细胞。这些细胞至少表达fcγri、fcγrii、fcγriii和/或fcγriv,并且执行adcc效应子功能。介导adcc的人白细胞的实例包括外周血单核细胞(pbmc)、自然杀伤(nk)细胞、单核细胞、细胞毒性t细胞以及嗜中性粒细胞。
[0065]
术语“fc受体”或“fcr”被用来描述结合到抗体fc区的受体。在一个实施例中,该fcr是天然序列人fcr。此外,在某些实施例中,fcr是结合igg抗体的一种fcr(γ受体),并且包括fcγri、fcγrii、fcγriii及fcγriv亚类的受体,包括等位基因变体以及这些受体的替代性剪接形式。fcγrii受体包括fcγriia(“活化受体”)和fcγriib(“抑制受体”),两者具有主要在其胞质结构域方面不同的类似氨基酸序列。活化受体fcγriia在其胞质结构域中含有基于免疫受体酪氨酸的活化基序(itam)。抑制受体fcγriib在其胞质结构域中含有基于免疫受体酪氨酸的抑制基序(itim)。(参见达伦《免疫学年鉴》,15:203-234(1997))。fcr评述于雷弗克和肯尼特,《免疫学年鉴》,9:457-92(1991);卡博尔(capel)等人,《免疫方法》(immunomethods),4:25-34(1994);以及德哈斯(de haas)等人,《实验室与临床医学杂志》(j.lab.clin.med.),126:330-41(1995)中。其他fcr,包括将来鉴别的fcr,都涵盖于在此的术语“fcr”中。该术语还包括新生儿受体fcrn,该受体负责将母本igg转移到胎儿(盖耶(guyer)等人,《免疫学》(immunol.),117:587(1976)以及金姆(kim)等人,《免疫学杂志》,24:249(1994))。
[0066]
在某些实施例中,抗α毒素抗体或抗原结合片段包含改变的fc区(在此也被称为“变体fc区”),其中已经在fc区作出一种或多种改变以便改变抗体的功能特性和/或药物动力学特性。这样的改变可以导致clq结合以及补体依赖性细胞毒性(cdc)或者fcγr与igg的结合减少或增加。本发明技术涵盖在此所描述的具有变体fc区的抗体,其中已经作出变化以便改变效应子功能,从而提供期望的作用。因此,在一些实施例中,抗α毒素抗体或抗原结
合片段包含变体fc区(即,如下所论述的已经改变的fc区)。在此的包含变体fc区的抗α毒素抗体和抗原结合片段在此处还被称为“fc变体抗体”。如在此所使用,天然是指未修饰的亲本序列,并且包含天然fc区的抗体在此被称为“天然fc抗体”。在一些实施例中,如与天然fc区相比较,变体fc区展现出类似的诱导效应子功能的水平。在某些实施例中,如与天然fc相比较,变体fc区展现出更高的效应子功能诱导作用。在某些实施例中,如与天然fc相比较,变体fc区展现出更低的效应子功能诱导作用。在此详述了变体fc区的一些具体实施例。用于测量效应子功能的方法是本领域中已知的。
[0067]
可以通过fc区的变化来改变抗体的效应子功能,这些变化包括但不限于,氨基酸取代、氨基酸添加、氨基酸缺失以及对于fc氨基酸的翻译后修饰(例如,糖基化)的变化。以下描述的方法可以用于改变如在此所描述的分离的抗体或抗原结合片段的效应子功能,产生具有某些有利于预防或治疗特定金黄色葡萄球菌相关疾病或病况的特性的抗体或抗原结合片段。
[0068]
在一些实施例中,制备出对于fc配体(例如fc受体,c1q)的结合特性相对于天然fc抗体已经改变的fc变体抗体。结合特性的实例包括但不限于,结合特异性、平衡解离常数(k
d
)、解离和缔合速率(对应地是koff和kon)、结合亲和力和/或亲合力。在本领域已知的是,平衡解离常数(k
d
)被定义为koff/kon。在某些方面,相对于具有高k
d
的抗体,具有低k
d
的包含fc变体区的抗体可能是更希望的。然而,在一些情况下,与k
d
值相比,kon或koff的值可能更有意义。可以确定的是哪个动力学参数对于给定抗体应用是更重要的。
[0069]
在一些实施例中,如与天然fc抗体相比较,fc变体抗体对于一种或多种fc受体展现出改变的结合亲和力,这些fc受体包含但不限于,fcrn;fcγri(cd64),包括同工型fcγria、fcγrib及fcγric;fcγrii(cd32,包括同工型fcγriia、fcγriib及fcγriic);以及fcγriii(cd16,包括同工型fcγriiia和fcγriiib)。
[0070]
在某些实施例中,相对于天然fc抗体,fc变体抗体具有增强的与一种或多种fc配体的结合。在某些实施例中,fc变体抗体展现出增加或降低的对fc配体的亲和力,该亲和力比天然fc抗体所展现的对于fc配体的亲和力高或低至少2倍,或至少3倍,或至少5倍,或至少7倍,或至少10倍,或至少20倍,或至少30倍,或至少40倍,或至少50倍,或至少60倍,或至少70倍,或至少80倍,或至少90倍,或至少100倍,或至少200倍,或是在2倍与10倍之间,或在5倍与50倍之间,或在25倍与100倍之间,或在75倍与200倍之间,或在100倍与200倍之间。在不同实施例中,fc变体抗体展现的对fc配体的亲和力比天然fc抗体所展现的对fc配体的亲和力高或低至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%、至少20%、至少10%、或至少5%。在某些实施例中,fc变体抗体具有增加的对fc配体的亲和力。fc变体抗体有时可以具有降低的对fc配体的亲和力。
[0071]
在一些实施例中,fc变体抗体具有增强的与fc受体fcγriiia的结合。在一些实施例中,fc变体抗体具有增强的与fc受体fcγriib的结合。在某些实施例中,fc变体抗体具有增强的与fc受体fcγriiia和fcγriib两者的结合。在某些实施例中,与天然fc抗体相比较,具有增强的与fcγriiia的结合的fc变体抗体不会伴随结合fcγriib受体的增加。在某些实施例中,fc变体抗体具有降低的与fc受体fcγriiia的结合。fc变体抗体有时可以具有降低的与fc受体fcγriib的结合。在不同的实施例中,展现出改变的对fcγriiia和/或fcγriib的亲和力的fc变体抗体具有增强的与fc受体fcrn的结合。在一些实施例中,相对于
天然fc抗体,展现出改变的对fcγriiia和/或fcγriib的亲和力的fc变体抗体具有改变的与c1q的结合。
[0072]
在某些实施例中,fc变体抗体展现的对fcγriiia受体的亲和力比天然fc抗体所展现的对fcγriiia受体的亲和力高或低至少2倍,或至少3倍,或至少5倍,或至少7倍,或至少10倍,或至少20倍,或至少30倍,或至少40倍,或至少50倍,或至少60倍,或至少70倍,或至少80倍,或至少90倍,或至少100倍,或至少200倍,或在2倍与10倍之间,或在5倍与50倍之间,或在25倍与100倍之间,或在75倍与200倍之间,或在100倍与200倍之间。在不同实施例中,fc变体抗体展现的对fcγriiia配体的亲和力比天然fc抗体所展现的对fcγriiia配体的亲和力高或低至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%、至少20%、至少10%、或至少5%。
[0073]
在某些实施例中,fc变体抗体展现的对fcγriib受体的亲和力比天然fc抗体所展现的对fcγriib受体的亲和力高或低至少2倍,或至少3倍,或至少5倍,或至少7倍,或至少10倍,或至少20倍,或至少30倍,或至少40倍,或至少50倍,或至少60倍,或至少70倍,或至少80倍,或至少90倍,或至少100倍,或至少200倍,或在2倍与10倍之间,或在5倍与50倍之间,或在25倍与100倍之间,或在75倍与200倍之间,或在100倍与200倍之间。在某些实施例中,fc变体抗体展现的对fcγriib配体的亲和力比天然fc抗体所展现的对fcγriib配体的亲和力高或低至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%、至少20%、至少10%、或至少5%。
[0074]
在一些实施例中,相对于天然fc抗体,fc变体抗体展现出增加或降低的对c1q的亲和力。在一些实施例中,fc变体抗体展现的对c1q受体的亲和力比天然fc抗体所展现的对c1q受体的亲和力高或低至少2倍,或至少3倍,或至少5倍,或至少7倍,或至少10倍,或至少20倍,或至少30倍,或至少40倍,或至少50倍,或至少60倍,或至少70倍,或至少80倍,或至少90倍,或至少100倍,或至少200倍,或在2倍与10倍之间,或在5倍与50倍之间,或在25倍与100倍之间,或在75倍与200倍之间,或在100倍与200倍之间。在某些实施例中,fc变体抗体展现的对c1q的亲和力比天然fc抗体所展现的对c1q的亲和力高或低至少90%、至少80%、至少70%、至少60%、至少50%、至少40%、至少30%、至少20%、至少10%、或至少5%。在不同实施例中,展现出改变的对ciq的亲和力的fc变体抗体具有增强的与fc受体fcrn的结合。在又另一个具体实施例中,相对于天然fc抗体,展现出改变的对c1q的亲和力的fc变体抗体具有改变的对fcγriiia和/或fcγriib的结合。
[0075]
期望的是,通过用于确定一种或多种fcγr介导的效应细胞功能的体外功能测定来表征fc变体抗体。在某些实施例中,fc变体抗体具有类似的结合特性,并且效应细胞如在基于体外的测定中那样在体内模型(如在此描述和披露的那些)中起作用。本发明技术不排除在基于体外的测定中未展现出期望的表型但在体内展现出期望的表型的fc变体抗体。
[0076]
可以通过增加fc区对fcrn的结合亲和力来增加包含fc区的蛋白质的血清半衰期。如在此所使用,术语“抗体半衰期”意思指抗体的药物动力学特性,它是抗体分子在它们给予之后的平均存活时间的量度。抗体半衰期可以表示为从患者(或其他哺乳动物)的身体或其特定区室(例如,如在血清中测量的,即循环半衰期),或在其他组织中消除50%已知量的免疫球蛋白所需要的时间。从一种免疫球蛋白或免疫球蛋白类别到另一种免疫球蛋白或免疫球蛋白类别,半衰期可以不同。一般来说,抗体半衰期的增加导致循环中所给予的抗体的
平均停留时间(mrt)增加。
[0077]
半衰期的增加允许减少给予患者的药物的量以及减小给药频率。半衰期的增加也可以是有益的,例如用于预防金黄色葡萄球菌相关疾病或病况,并且还用于预防患者一出院就经常发生的感染复发。为了增加抗体的血清半衰期,如在本领域已知的,可以将补救受体结合表位结合到抗体(尤其是抗原结合片段)中。如在此所使用,术语“补救受体结合表位”是指引起igg分子的体内血清半衰期的增加的igg分子(例如,igg1、igg2、igg3、或igg4)的fc区的表位。具有增加的半衰期的抗体还可以通过修饰被鉴别为涉及fc与fcrn受体之间的相互作用的氨基酸残基而产生。此外,抗α毒素抗体或抗原结合片段的半衰期可以通过用本领域广泛利用的技术结合至peg或白蛋白而增加。在一些实施例中,包含抗α毒素抗体的fc变体区的抗体与包含天然fc区的抗体相比具有增加约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约60%、约65%、约70%、约80%、约85%、约90%、约95%、约100%、约125%、约150%或更多的半衰期。在一些实施例中,包含fc变体区的抗体与包含天然fc区的抗体相比具有增加约2倍、约3倍、约4倍、约5倍、约10倍、约20倍、约50倍或更多,或在2倍与10倍之间,或在5倍与25倍之间,或在15倍与50倍之间的半衰期。
[0078]
在一些实施例中,在此呈现的技术提供了fc变体,其中fc区包含在一个或多个选自下组的位置处的修饰(例如,氨基酸取代、氨基酸插入、氨基酸缺失),该组由以下各项组成:如通过如在卡巴特中阐述的eu索引来编号的234、235、236、237、238、239、240、241、243、244、245、247、251、252、254、255、256、262、263、264、265、266、267、268、269、279、280、284、292、296、297、298、299、305、313、316、325、326、327、328、329、330、331、332、333、334、339、341、343、370、373、378、392、416、419、421、440及443。任选地,fc区可以在本领域已知的另外的和/或替代的位置处包含非天然存在的氨基酸残基。
[0079]
在某些实施例中,在此提供的是fc变体,其中fc区包含至少一个选自下组的取代,该组由以下各项组成:如通过在卡巴特中阐述的eu索引来编号的234d、234e、234n、234q、234t、234h、234y、234i、234v、234f、235a、235d、235r、235w、235p、235s、235n、235q、235t、235h、235y、235i、235v、235f、236e、239d、239e、239n、239q、239f、239t、239h、239y、240i、240a、240t、240m、241w、241l、241y、241e、241r、243w、243l 243y、243r、243q、244h、245a、247l、247v、247g、251f、252y、254t、255l、256e、256m、262i、262a、262t、262e、263i、263a、263t、263m、264l、264i、264w、264t、264r、264f、264m、264y、264e、265g、265n、265q、265y、265f、265v、265i、265l、265h、265t、266i、266a、266t、266m、267q、267l、268e、269h、269y、269f、269r、270e、280a、284m、292p、292l、296e、296q、296d、296n、296s、296t、296l、296i、296h、269g、297s、297d、297e、298h、298i、298t、298f、299i、299l、299a、299s、299v、299h、299f、299e、305i、313f、316d、325q、325l、325i、325d、325e、325a、325t、325v、325h、327g、327w、327n、327l、328s、328m、328d、328e、328n、328q、328f、328i、328v、328t、328h、328a、329f、329h、329q、330k、330g、330t、330c、330l、330y、330v、330i、330f、330r、330h、331g、331a、331l、331m、331f、331w、331k、331q、331e、331s、331v、331i、331c、331y、331h、331r、331n、331d、331t、332d、332s、332w、332f、332e、332n、332q、332t、332h、332y、332a、339t、370e、370n、378d、392t、396l、416g、419h、421k、440y及434w。任选地,fc区可以包含本领域已知的另外的和/或替代的非天然存在的氨基酸残基。
[0080]
在不同实施例中,在此提供的是fc变体抗体,其中fc区包含在一个或多个选自下
组的位置处的至少一种修饰(例如氨基酸取代、氨基酸插入、氨基酸缺失),该组由234、235及331组成。在一些实施例中,非天然存在的氨基酸选自由234f、235f、235y及331s组成的组。在此提供的是fc变体,其中fc区包含在选自由239、330及332组成的组的一个或多个位置处的至少一种非天然存在的氨基酸。一些实施例中,非天然存在的氨基酸选自由239d、330l及332e组成的组。
[0081]
在一些实施例中,在此提供的是fc变体抗体,其中fc区包含在选自由252、254及256组成的组的一个或多个位置处的至少一种非天然存在的氨基酸。在某些实施例中,非天然存在的氨基酸选自由252y、254t及256e组成的组,如在美国专利号7.083,784中所描述,其内容通过引用以其全文结合在此。
[0082]
在某些实施例中,由igg抗体引起的效应子功能强烈取决于连接到蛋白质fc区的碳水化合物部分。因此,可以改变fc区的糖基化以增加或降低效应子功能。因此,在一些实施例中,在此提供的抗α毒素抗体和抗原结合片段的fc区包含改变的氨基酸残基糖基化。在某些实施例中,改变的氨基酸残基糖基化导致效应子功能降低。在某些实施例中,改变的氨基酸残基糖基化导致效应子功能增强。在一些实施例中,fc区具有减少的岩藻糖基化。在某些实施例中,fc区是无岩藻糖基化(afucosylated)的。
[0083]
在一些实施例中,在此的fc变体可以与如在本领域已知的其他已知的fc变体组合。可以引入fc结构域的其他修饰和/或取代和/或添加和/或缺失。在特定实施例中,具有fc变体结构域的本发明的抗at抗体包含对应于seq id no:80的vh-igg1-yte和/或对应于seq id no:81的vl-κ。抗金黄色葡萄球菌at抗体的代表性序列表1:mab 2a3.1、10a7.5、12b8.19及25e9.1的vl cdr序列seq id no:说明序列seq id no:1vl cdr1rasqsisswlaseq id no:2vl cdr2kasslesseq id no:3vl cdr3qqynsywt表2:mab 28f6.1的vl cdr序列cdr序列表3:mab 2a3.1的vh cdr序列seq id no:说明序列seq id no:7vh cdr1sydmhseq id no:8vh cdr2gigtagdtyypgsvkgseq id no:9vh cdr3dnysstggyygmdv表4:mab 10a7.5和12b8.19的vh cdr序列seq id no:说明序列
seq id no:10vh cdr1rydmhseq id no:11vh cdr2vigtdgdtyypgsvkgseq id no:12vh cdr3drysssnhyngmdv表5:mab 28f6.1的vh cdr序列seq id no:说明序列seq id no:13mab 28f6.1 vh cdr1syamtseq id no:14mab 28f6.1 vh cdr2visgsggstyyadsvkgseq id no:15mab 28f6.1 vh cdr3dgrqvedyyyyygmdv表6:mab 25e9.1的vh cdr序列seq id no:说明序列seq id no:7mab 25e9.1 vh cdr1sydmhseq id no:17mab 25e9.1 vh cdr2vidtagdtyypgsvkgseq id no:18mab 25e9.1 vh cdr3drysgnfhyngmdv表7:抗α毒素mab的vl和vh氨基酸序列
表8:抗α毒素mab的vl和vh核苷酸序列
表9:α毒素vl和vh cdr汇总表说明seq id nosvl cdr 11、4vl cdr 22、5、73、77vl cdr 33、6、64、68、74vh cdr 17、10、13、69vh cdr 28、11、14、17、70、75vh cdr 39、12、15、18、16、65、66、67、71、72、76、78表10:α毒素氨基酸序列表11:具有fc变体区域的抗α毒素mab的vl和vh氨基酸序列
包含抗at抗体及其抗原结合片段的药物配制物
[0100]
还提供了包含如在此所描述的抗α毒素抗体或其抗原结合片段以及载体的药物配制物。此类配制物可以按通篇所描述的不同方法容易地给予。在一些实施例中,该配制物包含药学上可接受的载体。
[0101]
如在此所使用,包含抗α毒素抗体或其抗原结合片段的药物配制物被称为该技术的配制物。术语“药学上可接受的载体”意思指不干扰活性成分的生物活性的有效性的一种或多种无毒材料。这类制剂常规地可以含有盐、缓冲剂、防腐剂、相容的载体以及任选地其他治疗剂。此类药学上可接受的制剂常规地还可以含有适合给予人的相容固体或液体填充剂、稀释剂或包封物质。术语“载体”表示天然的或合成的有机或无机成分,活性成分与该载体组合以促进应用。药物组合物的组分还能够与在此所描述的抗体和抗原结合片段并且与彼此以一定方式混合,该方式使得不存在会实质性地减损期望的药物功效的相互作用。
[0102]
如在此所描述的药物组合物可以调配用于特定剂量。可以调整剂量方案以提供最佳的期望反应。举例来说,如由治疗情况的紧急状态所指示的,可以给予单次推注,可以随着时间给予若干分次剂量,或可以按比例地减少或增加剂量。尤其有利的是以剂量单位形式配制肠胃外组合物,以便于剂量的给予和均匀性。如在此所使用的剂量单位形式是指适合作为单一剂量用于有待治疗的受试者物理不连续的单元;每个单元含有预定量的活性化合物(即抗体或抗原结合片段),该量经计算以结合所需的药物载体产生期望的治疗效果。剂量单位形式的规格是由以下各项指示并且直接取决于以下各项:(a)抗α毒素抗体或抗原结合片段的独特特征以及有待获得的具体治疗效果,以及(b)在混配这种抗α毒素抗体或抗
原结合片段以治疗个体的敏感性的领域中的固有局限性。
[0103]
本发明技术的治疗组合物可以被配制用于特定的给药途经,如口服、经鼻、经肺、局部(包括颊内和舌下)、经直肠、经阴道和/或肠胃外给药。这些配制物可以合宜地呈现为单位剂型,并且可以通过药学领域已知的任何方法来制备。可以与载体材料组合以制造单一剂型的活性成分(即,抗体或抗原结合片段)的量将取决于所治疗的受试者以及特定的给药模式而变化。可以与载体材料组合以制造生单一剂型的活性成分的量一般将是产生治疗效果的组合物的量。金黄色葡萄球菌相关疾病的治疗
[0104]
本发明还提供了使用抗金黄色葡萄球菌α-毒素(抗at)抗体和其抗原结合片段预防和/或治疗金黄色葡萄球菌相关疾病和病况(包括例如菌血症和脓毒症)的方法。还提供了使用抗金黄色葡萄球菌α-毒素(抗at)抗体和其抗原结合片段预防和/或治疗免疫功能不全患者的金黄色葡萄球菌相关疾病和病况(包括例如肺炎)的方法。
[0105]
通篇描述的抗at抗体或其抗原结合片段中任一种,以及此类抗体的突变体、变体及衍生物都可以用于在此所描述的不同方法中。尽管在此描述了用于所提供的不同方法和实例中的示例性抗at抗体和其抗原结合片段,但应理解的是,本领域中已知的任何抗at抗体或其抗原结合片段,并且特别是在此所描述并且披露于公布的国际专利申请号wo 2012/109285(其披露内容通过引用以其全文结合在此)中的那些都可以用于不同方法中。
[0106]
当金黄色葡萄球菌细菌进入哺乳动物的血流(包括人类)中时,发生菌血症,又称为血中毒。持久性发热是菌血症的一个病征。细菌可以行进到身体内较深的位置,从而产生影响内脏(如脑、心脏、肺、骨及肌肉)或以手术方式植入的装置(如人造关节或心脏起搏器)的感染。金黄色葡萄球菌脓毒症的一个标志是细菌凝集和血栓栓塞病变形成,这是以心脏中细菌集落形成单位(cfu)测量的(麦克道(mcadow)等人,2011)。
[0107]
在实施例中,提供了用于预防哺乳动物受试者的金黄色葡萄球菌相关脓毒症或降低哺乳动物受试者的金黄色葡萄球菌相关脓毒症的严重程度的方法。此类方法适合地包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段,包括在此所描述或本领域中已知的其他分离的抗金黄色葡萄球菌α毒素(抗at)抗体或抗原结合片段。
[0108]
预防哺乳动物受试者的金黄色葡萄球菌相关脓毒症的方法适合地包括在感染事件之前,向该受试者给予有效量的分离的抗at抗体或其抗原结合片段。如在此所使用,“感染事件”是指受试者被暴露于或能被暴露于金黄色葡萄球菌感染的事件。示例性感染事件包括但不限于,身体任何部分,包括头、口腔、手、臂、腿、躯干、内脏(例如心脏、脑、肠道、肾脏、胃、肺、肝、脾、胰腺等)、骨、皮肤的手术。手术引起了能容易地感染金黄色葡萄球菌的病症,如开放式手术伤口和器官。另外的感染事件包括身体任何部分的提供开放式伤口或以其他方式使金黄色葡萄球菌感染可以进入体内而接近血流的外伤。另外的感染事件包括输血、注射药物或者不合法或合法药物、针刺、纹身针、插入和维持静脉内(iv)管、插入和维持手术引流管,以及皮肤破损,例如褥疮(褥疮溃疡)部位。
[0109]
在这些方法提供对金黄色葡萄球菌相关脓毒症的预防的实施例中,抗at抗体或其抗原结合片段适合在感染事件之前至少1小时给予。举例来说,在手术(感染事件)之前至少1小时。适合地,抗at抗体或其抗原结合片段是在感染事件之前至少6小时、至少12小时、至
少18小时、至少24小时、至少30小时、至少36小时、至少42小时、至少48小时或更长时间给予。在实施例中,抗at抗体或其抗原结合片段适合地在感染事件之前约6小时到约36小时、约6小时到约36小时、约12小时到约36小时、约12小时到约24小时、约24小时到约36小时、约20小时到约30小时、约20小时到约28小时、约22小时到约26小时,或约12小时、约13小时、约14小时、约15小时、约16小时、约17小时、约18小时、约19小时、约20小时、约21小时、约22小时、约23小时、约24小时、约25小时、约26小时、约27小时、约28小时、约29小时、或约30小时、或约31小时、或约32小时、或约33小时、或约34小时、或约35小时、或约36小时给予。
[0110]
如在此所使用,金黄色葡萄球菌相关脓毒症的“预防”是指降低受试者在感染事件时患上金黄色葡萄球菌相关脓毒症的风险。适合地,受试者患上金黄色葡萄球菌相关脓毒症的风险相较于在感染事件之前未给予抗at抗体或抗原结合片段的受试者降低至少30%。更适合地,,相较于在感染事件之前未给予抗at抗体或抗原结合片段的受试者,风险降低至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或风险完全消除。
[0111]
在用于降低哺乳动物受试者的金黄色葡萄球菌相关脓毒症的严重程度的方法中,此类方法适合地包括向展现出金黄色葡萄球菌相关脓毒症的症状的受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。此类症状可以包括例如发冷、意识模糊或谵妄、发热或低体温(体温过低)、因低血压而头晕、心跳加快、摇晃、皮肤皮疹及温热的皮肤。
[0112]
如在此所使用,“降低严重程度”当结合脓毒症使用时是指减少已经患上金黄色葡萄球菌相关脓毒症的受试者正在展现的症状。适合地,相较于也已经患上金黄色葡萄球菌相关脓毒症的受试者正在展现的症状,但该受试者未给予抗at抗体或其抗原结合片段,这些症状有至少30%减少。更适合地,相较于在感染事件之前未给予抗at抗体或其抗原结合片段的受试者,症状减少至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或症状完全消除(即,该受试者的感染和脓毒症被治愈)。
[0113]
如在此所使用,术语“治疗着(treat)”、“治疗了(treating)”或“治疗(treatment)”可以指治疗性治疗和预防性或预防性措施,其中目的是预防或减慢(减轻)不希望的生理变化或病症,如疾病的发展。有益的或期望的临床结果包括但不限于,症状的缓解、疾病程度的减轻、疾病状态稳定(即,未恶化)、疾病进展延缓或减慢、疾病状态改善或缓和。“治疗”还可以指存活期相较于未接受治疗时的预期存活期延长。需要治疗的那些包括已患有病况或病症的那些以及易于患上病况或病症的那些或打算预防病况或病症的那些。
[0114]
可以按在此所描述的不同方法给予抗at抗体或其抗原结合片段的适合受试者是哺乳动物,如例如人类、狗、猫、灵长类动物、牛、绵羊、马、猪等。
[0115]
在此所描述的抗体或其抗原结合片段可以按适合剂量和给药方案给予,并且此类剂量和给药方案可以取决于疾病或病况。“有效剂量”可以通过确定剂量给药方案是否产生治疗效果或治疗终点(例如预防)来鉴别。抗体或其抗原结合片段给药可以根据期望的作用和其他临床考量而以单次给药或隔开的多次给药提供。
[0116]
可以通过在此所描述的不同方法中的任一种向所述受试者给予抗at抗体或其抗原结合片段的示例性方法包括但不限于,静脉内(iv)、瘤内(it)、病灶内(il)、雾化、经皮、内窥镜、局部、肌内(im)、皮内(id)、眼内(io)、腹膜内(ip)、透皮(td)、鼻内(in)、脑内(ic)、器官内(例如肝内)、缓释植入物,或皮下给药,或经由使用渗透泵或机械泵给药。
[0117]
在另外的实施例中,提供了降低哺乳动物受试者的血流或心脏中的金黄色葡萄球菌细菌负荷的方法。此类方法适合地包括向该受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。
[0118]
哺乳动物受试者的血流或心脏中的细菌负荷适合地经由本领域中已知的用以测定血流或心脏中细菌(适合地金黄色葡萄球菌细菌集落)的量的方法进行测量。举例来说,适合地通过将来自生物体的样品接种于琼脂板上,孵育该板,并且接着对该板上集落形成单位(cfu)的数量进行定量来测量细菌负荷。此类方法是本领域中众所周知的。还可以利用另外的用于测定细菌负荷的适合方法。收集的样品适合地来自血液样品、来自一般采集的生物体,或确切地说来自特定器官。
[0119]
适合地,相较于也已经感染金黄色葡萄球菌的受试者但受试者未给予抗at抗体或其抗原结合片段,感染金黄色葡萄球菌的受试者的细菌负荷(即,通过集落形成单位测量的细菌的量)在用抗at抗体或其抗原结合片段治疗的受试者中减少至少30%。更适合地,,相较于未给予抗at抗体或抗原结合片段的受试者,细菌的量减少至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或细菌负荷完全消除。
[0120]
适合地,抗at抗体或其抗原结合片段是在诊断感染金黄色葡萄球菌之后尽快给予,例如在数小时或数天内给予。打算给予的抗at抗体或抗原结合片段的持续时间和量易于由本领域普通技术人员确定。
[0121]
还提供了减少哺乳动物受试者体内金黄色葡萄球菌细菌凝集和/或血栓栓塞病变形成的方法。此类方法适合地包括向所述受试者给予有效量的分离的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段,包括在此所描述或另外本领域中已知的抗金黄色葡萄球菌α毒素(抗at)抗体或其抗原结合片段。
[0122]
如在此所描述,减少金黄色葡萄球菌细菌凝集的方法是指金黄色葡萄球菌细菌当接触血液和/或在器官中时降低这些细菌之间结块的量。测量细菌凝集的示例性方法是本领域中已知的,包括例如,如麦克道等人,《科学公共图书馆-病原体》7:e1002307(2011)中所描述,其披露内容通过引用以其全文结合于此。适合地,在此提供的方法还减少了受试者的血流和/或器官中血栓栓塞病变形成。测量血栓栓塞病变形成的方法是本领域中已知的并且包括例如磁共振成像(mri)、计算机断层摄影(ct)或计算机轴向断层摄影(cat)扫描或其他适合的成像方法。
[0123]
相较于也已经感染金黄色葡萄球菌的受试者,但该受试者未给予抗at抗体或其抗原结合片段,减少哺乳动物受试者体内金黄色葡萄球菌细菌凝集和/或血栓栓塞病变形成的方法适合地使细菌凝集和/或血栓栓塞病变形成在用抗-at抗体或其抗原结合片段治疗的受试者中减少至少30%。更适合地,相较于未给予抗at抗体或其抗原结合片段的受试者,细菌凝集和/或血栓栓塞病变形成减少至少40%、至少50%、至少60%、至少70%、至少80%、至少90%,或细菌凝集和/或血栓栓塞病变形成完全消除。
[0124]
适合地,预防哺乳动物受试者的金黄色葡萄球菌相关脓毒症或降低哺乳动物受试者的金黄色葡萄球菌相关脓毒症的严重程度的方法还使该受试者的血流或心脏中的细菌负荷降低。在其他实施例中,预防哺乳动物受试者的金黄色葡萄球菌相关脓毒症或降低哺乳动物受试者的金黄色葡萄球菌相关脓毒症的严重程度的方法还使该受试者体内细菌凝集和/或血栓栓塞病变形成减少。
cdr3;(d)包含seq id no:1或4的氨基酸序列的vl cdr1;(e)包含seq id no:2、5、73或77的氨基酸序列的vl cdr2;以及(f)包含seq id no:3、6、64、68或74的氨基酸序列的vl cdr3。此外,也可以利用此类抗体或抗原结合片段的突变体、变体及衍生物,以及与所述氨基酸序列展现至少90%一致性的抗体或其抗原结合片段。
[0134]
在另外的实施例中,在此所描述的不同方法利用了分离的抗体或其抗原结合片段,这些抗体或其抗原结合片段包含cdr,包括vh cdr1、vh cdr2、vh cdr3、vl cdr1、vl cdr2及vl cdr3,它们对应于seq id no:7、8、9、1、2及3;seq id no:10、11、12、1、2及3;seq id no:13、14、15、4、5及6;seq id no:7、17、18、1、2及3;seq id no:7、8、16、1、2及64;seq id no:7、8、65、1、2及64;seq id no:7、8、66、1、2及64;seq id no:7、8、67、1、2及68;seq id no:7、8、67、1、2及64;seq id no:7、8、78、1、2及64;seq id no:7、8、65、1、2及68;seq id no:69、70、71、1、2及68;seq id no:7、8、72、1、73及74;seq id no:69、75、71、1、2及68;seq id no:69、75、76、1、2及68;seq id no:69、75、76、1、77及74;seq id no:69、70、71、1、77及74的氨基酸序列
[0135]
在实施例中,在此所描述的不同方法中利用的分离的抗at抗体或其抗原结合片段包含重链可变结构域,该结构域与seq id no:20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的氨基酸序列具有至少90%的一致性;并且包含轻链可变结构域,该结构域与seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的氨基酸序列具有至少90%的一致性。
[0136]
在此所描述的方法的又另外的实施例中,所利用的分离的抗at抗体或其抗原结合片段包含了具有seq id no 20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61或62的重链可变结构域,以及具有seq id no:19、21、23、25、27、42、44、46、48、50、52、54、56、58、60或63的轻链可变结构域。
[0137]
在另外的实施例中,在此所描述的方法利用了抗at抗体或其抗原结合片段,这些抗体或其抗原结合片段具有vh和vl,他们对应于seq id no:20和19;seq id no:22和21;seq id no:24和23;seq id no:26和25;seq id no:28和27;seq id no:41和42;seq id no:43和44;seq id no:45和46;seq id no:47和48;seq id no:47和48;seq id no:49和50;seq id no:51和52;seq id no:51和52;seq id no:53和54;seq id no:55和56;seq id no:57和58;seq id no:59和60;seq id no:61和58;seq id no:62和58;seq id no:62和63;seq id no:79和63的氨基酸序列。
[0138]
在适合实施例中,分离的抗at抗体包含了具有fc变体结构域的分离的抗at抗体,其中该抗体包含对应于seq id no:80的vh-igg1-yte和/或对应于seq id no:81的vl-κ。实例实例1:脓毒症模型的建立制备细菌激发剂量
[0139]
金黄色葡萄球菌sf8300(usa300)是由比哈迪厄普(binh diep)(加利福尼亚大学旧金山分校(university california san francisco))提供。在250rpm振荡下,在37℃下于50ml胰酶大豆培养液(tsb)中培养细菌过夜。从过夜培养物中取出十毫升添加到1l的新
鲜tsb中并且在振荡下,使细菌在37℃生长到在600nm下的光学密度(od600)是0.8。通过在4℃下以8000rpm离心15分钟来回收细菌,并且在磷酸盐缓冲生理盐水(pbs)中洗涤。通过离心来收集细菌并且将其再悬浮于含10%甘油的pbs中,达到约2
×
10
10
cfu/ml的最终细菌储备液浓度。小鼠激发和存活
[0140]
向数组十只8-9周龄的雌性balb/c小鼠腹膜内(ip)注射在500μl pbs中的指定浓度的lc10或r347(45mg/kg)。随后在24小时之后,用200μl的细菌悬浮液(在ph 7.2的pbs中由冷冻的储备液稀释的5
×
107cfu)于尾静脉中经静脉内(iv)激发动物。激发后监测小鼠的存活,持续14天。用对数秩检验评估统计分析:r347(对照物)对比lc10(抗at ab)免疫的动物。心脏中的细菌负荷
[0141]
感染后14小时,用co2对受感染的小鼠实施安乐死。取出心脏,在溶解基质a管中于1ml冷pbs中进行均质化,并且将其涂布于tsa板上用于细菌计数。用不成对双尾学生t检验分析心脏组织中的细菌负荷以对r347与lc10 mab之间进行逐对比较。如果p<0.05,那么认为数据是显著的。血液中的细菌负荷
[0142]
在感染后8、24、48、72及144小时,用co2对动物实施安乐死。通过心脏穿刺收集血液,并且立即将100μl涂布于tsb板上用于cfu计数。用不成对学生t检验分析数据。如果p<0.05,那么认为lc10与r347 mab之间的值存在统计差异。实例2:抗at抗体对于脓毒症的预防作用
[0143]
为了确定抗at抗体介导的at抑制是否会影响脓毒症的发展,在用金黄色葡萄球菌sf8300(usa300)iv激发之前24小时,用lc10(45和15mg/kg)或同型对照物(r347,45mg/kg)对数组10只小鼠进行被动免疫,并且监测存活率,持续14天。lc10预防使存活率显著增加,表明at在全身金黄色葡萄球菌疾病中起到关键作用并且用lc10对其进行抑制会保护动物免于死亡(图1)。
[0144]
金黄色葡萄球菌脓毒症的标志是细菌凝集和血栓栓塞病变形成,它是以心脏中的细菌cfu测量的(麦克道等人,2011)。为了确定lc10预防是否减小心脏中的细菌负荷,在用sf8300 iv感染之前24小时,用lc10(15和45mg/kg)或r347(45mg/kg)对小鼠进行被动免疫。感染后十四小时,对动物实施安乐死并且处理其心脏用于cfu计数。相对于接受r347对照物的小鼠,用lc10被动免疫的小鼠展现出心脏cfu的显著减少(图2)。
[0145]
同时在iv感染后24到72小时,评估lc10预防对血液中细菌计数的影响。对于r347治疗的小鼠,在72小时内感染小鼠的血流中的细菌计数保持在约103cfu。然而,在所测试的所有时间点,lc10预防使细菌负荷减小,并且在72小时的时候,具有2个数量级的最大减小(图3)。这些结果表明,at对于脓毒症的发展很重要,并且用lc10抑制at使血流和心脏中的细菌cfu减少,并在用致死剂量的金黄色葡萄球菌iv激发之后,促进存活。实例3.免疫功能不全肺炎模型的建立
[0146]
免疫功能不全的个体,特别是患有嗜中性粒细胞减少症的那些有增加的金黄色葡萄球菌感染的风险(安德鲁斯和沙利文,2003;鲍马等人,2010)。为了研究抗at抗体用于预防免疫功能不全个体的金黄色葡萄球菌肺炎的效力,开发并利用了免疫功能不全鼠类肺炎
模型。为了模拟免疫功能不全个体群的感染,通过给予环磷酰胺(已知会耗乏小鼠的白细胞,包括嗜中性粒细胞、淋巴细胞及血小板的烷化剂)来使小鼠嗜中性粒细胞减少(祖鲁阿加(zuluaga)等人,2006)。
[0147]
进行实验以确定使c57bl/6小鼠的循环免疫细胞降低>90%所需的最佳环磷酰胺(cpm)给药方案。将cpm粉末溶解于无菌注射用水中,达到20mg/ml的最终浓度。在第0天和第3天,通过腹膜内注射,用不同的cpm给药方案治疗数组20只小鼠。在第0天、第1天、第4天及第6天处死数组5只动物,并且通过心脏穿刺将血液收集到vacutainer edta管中。随后,使用sysmex自动血液学分析器获得分类白细胞(wbc)计数(嗜中性粒细胞、淋巴细胞)。小鼠肺炎模型制备细菌激发剂量
[0148]
在250rpm振荡下,在37℃下于50ml胰酶大豆培养液(tsb)中培养金黄色葡萄球菌sf8300过夜。将十毫升过夜培养物添加到1l的新鲜tsb中并且在振荡下,使细菌在37℃生长到在600nm下的光学密度(od600)是0.8。通过在4℃下以8000rpm离心15分钟来回收细菌,并且在磷酸盐缓冲生理盐水(pbs)中洗涤。再次通过离心收集细菌,并且将其再悬浮于含10%甘油的pbs中,达到2
×
10
10
cfu ml的最终细菌储备液浓度。免疫功能不全小鼠肺炎模型
[0149]
起初,在激发剂量滴定实验中鉴别免疫功能不全小鼠的最小致死金黄色葡萄球菌剂量。第二次cpm剂量之后二十四小时,用异氟烷对免疫功能不全小鼠进行麻醉,随后将50μl的金黄色葡萄球菌悬浮液(1
×
107到2
×
108cfu)接种于左鼻孔和右鼻孔中。将动物以仰卧放入笼子中以供恢复,并且在7天时间内观察致死率。实例4.抗葡萄球菌at抗体对于嗜中性粒细胞减少性肺炎的预防作用抗at mab在免疫功能不全肺炎模型中的功效研究
[0150]
本实验中使用了30只动物,随机分成3个组。在感染之前4天和1天,给予动物cpm。在用金黄色葡萄球菌sf8300(5
×
107)进行鼻内(in)激发之前24小时(第-1天),每组还给予lc10(45或15mg/kg)或r347(45mg/kg),并且观察存活,长达7天。使用对数秩检验测定统计显著性。免疫缺陷的验证
[0151]
进行实验以确定使总wbc计数(包括嗜中性粒细胞)减少90%的最佳cpm剂量方案。在第0天和第3天,用6种不同的cpm剂量方案处理数组20只小鼠。在第0天、第1天、第4天及第6天,从每个剂量组的5只小鼠收集血液样品,并且使用sysmex血液学分析器进行总体和分类wbc计数。在第4天和第6天,第6组中的动物(第1次cpm剂量是150mg/kg;第2次cpm剂量是100mg/kg[cpm150/100])的总体wbc相对于未处理的动物展现出90%的减少。在这一组中,在第4天和第6天,嗜中性粒细胞和淋巴细胞有90%减少(图4)。在第7天,白细胞开始恢复。这些结果与先前报道的那些相符(祖鲁阿加等人,2006)。因此,选择cpm 150/100剂量来评价lc10在免疫功能不全动物中的预防作用。确定免疫功能不全肺炎模型中的细菌激发剂量
[0152]
为了确定免疫功能不全动物中的最小致死性激发剂量,在5只小鼠的数组中通过in激发对金黄色葡萄球菌sf8300进行滴定(从2
×
108到1
×
107cfu)。观察致死率,持续7天(图5)。最低致死剂量是5
×
107cfu并且选择作为测试lc10预防作用的剂量。
lc10使免疫功能不全肺炎动物的存活率增加
[0153]
为了解在免疫功能不全小鼠中lc10预防作用的影响,在用50μl的细菌悬浮液(sf8300,5
×
107cfu)进行in激发之前24小时,给予注射cpm的动物lc10(45或15mg/kg)或45mg/kg的r347,并且如以上所描述,观察致死率。
[0154]
用45或15mg/kg lc10进行被动免疫使存活率相对于r347对照物显著增加(p<0.0001)(图6)。为了确定在这一研究中动物是免疫功能不全的,在第-4天、第-3天、第1天、第0天、第2天及第3天,从5只未感染小鼠的数组中收集血液样品。进行总体和分类wbc计数,并且在第-4天与第-2天之间,这些动物的总体wbc以及嗜中性粒细胞和淋巴细胞存在90%减少。在第0-2天,这些动物展现出重度嗜中性粒细胞减少症(≤10个嗜中性粒细胞/μl血液)(图7)。因此,用lc10进行预防可以降低金黄色葡萄球菌嗜中性粒细胞减少性小鼠肺炎模型的疾病严重程度。结论
[0155]
使用环磷酰胺开发金黄色葡萄球菌免疫功能不全小鼠肺炎模型,使循环白细胞(包括嗜中性粒细胞和淋巴细胞)减少>90%。小鼠展现重度嗜中性粒细胞减少症,具有≤10个嗜中性粒细胞/μl血液。用lc10进行预防使金黄色葡萄球菌嗜中性粒细胞减少性小鼠肺炎模型的存活率显著改善。这些结果表明,在通过给予环磷酰胺而呈现嗜中性粒细胞减少症的小鼠感染金黄色葡萄球菌之前24小时,用lc10进行被动免疫使存活率显著改善。因此,此证实,抗at抗体可以预防免疫功能不全患者的疾病。
[0156]
本申请中的所有文献、专利、杂志文章及其他材料都特此通过引用结合。
[0157]
尽管已经结合本发明的若干实施例,参照附图完整地描述本发明,但应理解的是,不同变化和修改对于本领域的技术人员可以是显而易见的。应理解,此类变化和修改都包括在如所附权利要求书所界定的本发明的范围内,除非它们背离该范围。
相关技术
网友询问留言
已有1条留言
-
 0访客 来自[中国] 2021年03月09日 09:54请问这个专利是什么时候下来的呢?
0访客 来自[中国] 2021年03月09日 09:54请问这个专利是什么时候下来的呢?
1