重组蛋白hID2在制备治疗结肠炎药物中的应用的制作方法
重组蛋白hid2在制备治疗结肠炎药物中的应用
技术领域
[0001]
本发明涉及生物制药领域,具体涉及一种重组人id2(inhibitor of dna binding 2)蛋白,其通过构建人id2基因重组质粒并在大肠杆菌中高效表达而制备,用于制备治疗溃疡性结肠炎的药物。
技术背景
[0002]
溃疡性结肠炎(ulcerative colitis,uc),是一种原因未明的慢性非特异性肠道疾病,病变主要位于结肠的黏膜层,常累及直肠和远端结肠,也可遍及整个结肠,呈连续性弥散性分布。该病见于任何年龄,以25-40岁较为多见,除少数患者起病急骤外,大多数患者起病缓慢,且病情轻重不一。腹痛、腹泻、黏液便及脓血便、里急后重为主要临床症状,组织病理学表现为黏膜下水肿、炎细胞浸润、杯状细胞减少以及隐窝数量减少,内镜下结肠呈糜烂、溃疡等炎症表现,且部分患者伴有肠外表现,如眼睛、关节、肝脏和皮肤的损伤。根据国内外流行病学统计数据显示,uc的发病率和患病率呈逐年上升的趋势,且具有癌变趋势,给患者带来了极大的身体和精神负担,也给家庭和社会带来了极大的经济负担,被世界卫生组织(who)列为现代难治病之一。
[0003]
现有针对溃疡性结肠炎的主要治疗药物包括:(1)氨基水杨酸类,如水杨酸偶氮磺胺吡啶,是治疗uc的经典药物,对于uc的缓解率达80%以上,但恶心、呕吐、头痛、食欲不振等不良反应发生率较高;(2)糖皮质激素,对于抑制uc急性活动性炎症有效,但糖皮质激素易引起肥胖,药物价格较高,患者难以长期维持治疗;(3)免疫抑制剂,易发生免疫相关不良反应,且部分患者对现有的药物不产生应答,其实际应用受到一定的限制;(4)英夫利昔单抗,作为被美国食品药物管理局(fda)批准用于治疗肠炎的第一个生物大分子蛋白治疗药物,其有一定的临床疗效,但输血反应、感染、恶性肿瘤、自身免疫性疾病等不良反应的发生风险也随之提高。目前尚没有理想的治疗肠炎的药物。因此,开发具有良好效果且安全性较高的治疗肠炎的新型药物具有十分重要的意义。
[0004]
分化抑制因子2(inhibitor of dna binding 2,id2)作为id蛋白家族成员之一(id1-id4),属于螺旋-环-螺旋(helix-loop-helix,hlh)转录因子家族,编码基因定位于2p25染色体上,由两个高度保守性的α螺旋和两螺旋之间保守性差的袢环区段构成,通过螺旋结构上疏水基团的相互作用与其他hlh转录因子结合成四螺旋束的同二聚体或异二聚体,实现对dna结合和转录的调节功能。有研究报道,id2在促进细胞增殖、抑制细胞分化,血管生成和肿瘤发生等方面有多种重要的生物学作用,但id2在溃疡性结肠炎中的作用还未有相关报道。
技术实现要素:
[0005]
发明人一直致力于研究溃疡性结肠炎的发病机理和治疗药物,发现重组蛋白hid2能够明显的降低由dss诱导的溃疡性肠炎模型中小鼠的发病程度,无不良反应和副作用。
[0006]
本发明人进行的试验表明,通过构建人id2基因重组质粒并在大肠杆菌中高效表
达制备的重组蛋白hid2能够显著减少疾病小鼠的体重下降百分率、降低疾病活动指数、减轻结肠组织病理损伤,同时也能显著降低促炎细胞因子的产生以及促进黏蛋白-2(muc2)的表达,无不良反应和副作用。提示重组蛋白hid2能够作为治疗或者缓解溃疡性结肠炎的药物,为临床治疗溃疡性结肠炎提供新的选择。
[0007]
本发明提供一种通过构建人id2基因重组质粒并在大肠杆菌高效表达制备的重组蛋白hid2在制备治疗肠炎药物中的应用。
[0008]
本发明通过试验直接证明了重组蛋白hid2在溃疡性结肠炎方面的有效性,该效果同样可以扩展至对一般的肠炎也具有治疗作用。
[0009]
根据试验结果表明,重组蛋白hid2在所述治疗肠炎引起的腹痛、腹泻、便血、里急后重方面有作用,可以起到治疗或缓解的作用。
[0010]
本发明中的重组蛋白hid2通过腹腔注射方法给药,给药剂量5mg/kg。
附图说明:
[0011]
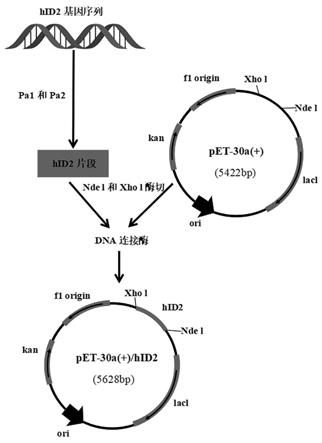
图1:重组表达质粒pet-30a(+)/hid2的构建流程图;
[0012]
图2:重组蛋白hid2表达产物的sds-page(a)和western-blot(b)分析;
[0013]
图3:重组蛋白hid2鉴定的二级质谱图;
[0014]
图4:重组蛋白hid2治疗溃疡性结肠炎时小鼠体重随时间的变化趋势;
[0015]
图5:重组蛋白hid2治疗溃疡性结肠炎时小鼠疾病活动指数随时间的变化趋势;
[0016]
图6:重组蛋白hid2治疗溃疡性结肠炎时小鼠结肠长度的变化;
[0017]
图7:重组蛋白hid2治疗溃疡性结肠炎时小鼠外周血中白细胞的数量变化;
[0018]
图8:重组蛋白hid2治疗溃疡性结肠炎时小鼠结肠he染色(a)及病理评分(b);
[0019]
图9:重组蛋白hid2治疗溃疡性结肠炎时小鼠结肠组织黏蛋白muc2 mrna的表达水平;
[0020]
图10:重组蛋白hid2治疗溃疡性结肠炎时小鼠结肠组织炎性细胞因子mrna的表达水平;
[0021]
注:图4-图10中各组间均有显著性差异(
*
p<0.05,
**
p<0.01,
***
p<0.001)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。
具体实施方式
[0022]
为了使本发明的目的、技术方案及优点更加清楚明白,以下实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。下述实施例中的实验方法若无特殊说明,均为常规方法。下述实施例中的所用的试剂材料等,如无特殊说明,均为市售购买。
[0023]
1.1重组蛋白hid2的制备
[0024]
1.1.1重组表达质粒pet-id2的构建
[0025]
大肠杆菌菌种e.coli.dh5α和大肠杆菌表达质粒pet-30a(+)为本实验室保存的invitrogen公司的产品。pcr引物购自上海英骏生物技术有限公司,分别引入相应的酶切位点。
[0026]
人id2基因5’引物(pa1和pa2):
[0027]
pa1:5
’-
gggaattccatatgaaagccttcagtcccgt-3’(下划线为nde i酶切位点);
[0028]
pa2:5
’-
ccgctcgaggccacacagtgctttgctgt-3’(下划线为xho i酶切位点);
[0029]
以人id2基因序列为模板,pa1为5’端引物,pa2为3’端引物,进行pcr扩增,获得有不同酶切位点的id2基因片段。pcr反应体系为:94℃预变性5分钟,然后94℃变性2分钟,60℃退火30秒,72℃延伸40秒,进行30个循环的扩增反应,最后72℃延伸10分钟。
[0030]
pcr产物经琼脂糖凝胶电泳后利用博大泰克公司的dna片段玻璃奶回收试剂盒切胶纯化回收,然后进行nde i/xho i双酶切,释放出具有不同粘末端的hid2片段,然后与采用ndei/xho i双酶切的载体pet30a(+)进行连接构建重组质粒(质粒构建流程见图1)。重组蛋白hid2的基因编码序列为426bp,由142个氨基酸组成,分子量为15.6kda。将构建的重组质粒16℃连结过夜后转化大肠杆菌dh5α,筛选出重组克隆质粒,进行酶切鉴定并送上海英骏生物技术有限公司测序。通过abi 377检测结果表明,重组质粒pet30a(+)/hid2的酶切结果和测序结果与预期完全一致。在id2基因3’端引入xho i酶切位点,恰好可以利用质粒pet-30a(+)多克隆位点3’端6个连续的组氨酸标签肽(his
6-tag)的密码子,使得表达蛋白的c’末端融合有his
6-tag,便于纯化和鉴定。
[0031]
1.1.2重组质粒的转化和外源重组蛋白hid2在大肠杆菌bl21(de3)中的诱导表达
[0032]
本发明使用的大肠杆菌bl21(de3)为novagen公司产品。以构建好的重组质粒pet30a(+)/hid2转化大肠杆菌bl21(de3),得到重组转化菌。挑取单克隆接种到含有50μg/ml卡那霉素的lb培养基中,37℃培养过夜,次日以1:20接种,37℃培养到od
600
为0.7时,向培养基中加入终浓度为0.2mm的异丙基-β-d-硫代半乳糖苷(iptg),诱导培养3小时,离心收集菌体。
[0033]
1.1.3重组蛋白hid2的大量表达
[0034]
将转化后的重组表达菌株接种至含有200ml lb培养基中(含有卡那霉素50ug/ml),37度过夜培养后,以1:20的比率转接至以下培养液中(kh2po
4 3g/l,na2hpo4·
12h2o 17.1g/l,nacl 0.5g/l,(nh4)2so
4 1g/l,mgso
4 0.2g/l,蛋白胨12g/l,酵母提取物6g/l,葡萄糖2.5g/l,卡那霉素50μg/ml),37度培养4个小时后(od值约为1.5-2.0),加入0.2mm的iptg诱导3h,5000g离心10分钟收集菌体。
[0035]
1.1.4重组蛋白hid2的纯化和复性
[0036]
1.1.4.1样品的预处理
[0037]
1.每100ml培养体积用40ml 1
×
binding buffer(5mm imidazole,0.5m nacl,20mm tris-hcl ph 7.9)重悬菌体。
[0038]
2.超声波处理以彻底重悬沉淀和剪切dna。
[0039]
3.8000g离心15min收集包涵体和细胞碎片蛋白,其它蛋白留在上清液中。
[0040]
4.弃去上清,每100ml培养体积用20ml 1
×
binding buffer(含2m尿素和0.05%曲拉通x-100))重悬沉淀。重复步骤3。
[0041]
5.最后的离心产物弃上清,每100ml培养体积所得沉淀用5ml含6m尿素的1
×
binding buffer重悬。
[0042]
6.冰浴1h完全溶解蛋白。16,000g离心30min以除去不可溶物质,0.45μm滤膜过滤后用于亲和柱层析纯化。
[0043]
1.1.4.2亲和层析柱的预处理
[0044]
将his-bind树脂装柱,依次用3体积的无菌去离子水,5体积的1
×
charge buffer(50mm niso4),3体积的1
×
binding buffer(含6m尿素)洗涤,以填充和平衡层析柱。
[0045]
1.1.4.3样品的纯化
[0046]
1.当binding buffer渗入柱床顶部时,上样。
[0047]
2.用10倍柱床体积的binding buffer(含6m尿素)洗涤层析柱。
[0048]
3.用6倍体积的含6m尿素的washing buffer(60mm imidazole,0.5m nacl,20mm tris-hcl ph 7.9)洗涤层析柱。
[0049]
4.用6倍体积的1
×
elute buffer(250mm imidazole,0.5m nacl,20mm tris-hcl,6m urea ph 8.0)洗脱结合蛋白。
[0050]
1.1.4.4分步透析法对纯化后的重组蛋白hid2进行复性
[0051]
1.将可溶和纯化的重组蛋白hid2用含6m尿素的1
×
binding buffer稀释至15μm,加入2-mercaptoethanol至终浓度为10mm,室温放置30min。
[0052]
2.将还原后的蛋白用至少50倍样品体积的透析液i(50mm tris-hcl ph
[0053]
8.0,1mm edta,200mm nacl,6m尿素)透析过夜,以除去还原剂。
[0054]
3.用尿素浓度依次递减且与透析液i同样组分的缓冲液将样品进行分步透析,尿素浓度依次为3m、2m、1m、0.5m、0m。在尿素浓度为1m的阶段加入750μm的氧化型谷胱甘肽(gssg)和400mm的l-arginine。每次均于4℃透析过夜。
[0055]
4.将最后一步透析所得样品再用50倍体积pbs进行透析,每12h更换一次透析液,共两次。
[0056]
5.将透析后的样品以10,000g,4℃离心30min,收集上清。
[0057]
1.1.5重组蛋白hid2的浓缩及定量
[0058]
1.1.5.1蛋白的浓缩
[0059]
将复性的样品加入超滤离心管centriplus-ym或ultrafree-mc membranes(millipore公司,截留分子量为5000da)中,以5000g离心浓缩蛋白至适宜浓度。
[0060]
1.1.5.2蛋白的定量
[0061]
采用pierce公司的bca protein assay reagent kit进行定量,具体操作见试剂盒说明书。最后将得到重组蛋白hid2,置于-80℃保存。
[0062]
1.1.6重组蛋白hid2的sds-page分析和western-blot分析
[0063]
1.1.6.1 sds-page分析
[0064]
1.配制15%分离胶和5%的浓缩胶,灌制胶板。
[0065]
2.将样品与适量上样缓冲液混合,沸水浴加热5min以变性蛋白。
[0066]
3.取10μl变性样品上样,在tris-甘氨酸电泳缓冲液系统中进行电泳,80v恒压至指示剂进入分离胶后加压至120v进行电泳。
[0067]
4.待溴酚蓝接近分离胶底部时,结束电泳。
[0068]
5.进行考马斯亮蓝染色,结果如图2(a)(m:蛋白分子标准;1、2和3:纯化重组蛋白hid2经浓缩后的三个重复电泳泳道;4、5和6:纯化重组蛋白hid2经浓缩后的三个重复免疫印迹),并将如图2(a)中两个条带命名为d-1、d-2,切胶后装于有去离子水的5ml离心管内,送至上海中科新生命生物科技有限公司进行重组蛋白hid2的鉴定,二级质谱结果表明d-1和d-2两个条带有相同的肽段序列(knslsdhslgisr),经与肽段数据库对比表明d-1是重组
蛋白hid2,d-2可能为重组蛋白hid2的二聚体,如图3所示(a:条带d-1肽段为knslsdhslgisr的二级质谱图;b:条带d-2肽段为knslsdhslgisr的二级质谱图)。
[0069]
1.1.6.2 western-blot检测
[0070]
1.将电泳后的凝胶转移至去离子水中略微漂洗。
[0071]
2.切一张适宜大小的pvdf膜及与膜同样大的滤纸六张。将膜先置于甲醇中3min,再浸入水中2min,最后将膜、滤纸和胶浸入转移缓冲液(39mm甘氨酸,48mm tris碱,0.037%的sds,20%的甲醇)中30min。
[0072]
3.用浸有去离子水的滤纸将石墨电极板擦一遍。
[0073]
4.在阳极石墨板上逐张叠放三张滤纸,精确对齐,不留气泡。
[0074]
5.将pvdf膜置于滤纸上,对齐,不留气泡。
[0075]
6.把凝胶放在膜上,对齐,不留气泡。
[0076]
7.把最后三张滤纸依次叠放在凝胶上,同样精确对齐,不留气泡。
[0077]
8.用滤纸吸干周围多余的液体,装上阴极。
[0078]
9.电泳条件:80v,30分钟;120v,1个小时。
[0079]
10.电转条件:200ma,转膜时间约为1小时。
[0080]
11.电转结束后,取下pvdf膜,将膜置于tbs(50mm tris,150mm nacl)中浸一下,放入装有封闭液(含5%脱脂奶粉的tbs)的烧杯中,室温摇动封闭过夜。
[0081]
12.封闭后的膜用tbst(tbs中加入0.05%tween-20)洗涤,10min/次,洗涤3次。
[0082]
13.将膜置于杂交袋中,加入适量1%bsa-tbs稀释的id2单抗(1:1000),购自cell signaling technology公司(货号:3431s),4℃摇床孵育过夜。
[0083]
14.tbst溶液10min/次,洗涤3次。
[0084]
15.将膜转至杂交袋,加入1%bsa-tbs稀释的hrp标记的羊抗兔igg抗体(1:5000),于室温摇床孵育2个小时。
[0085]
16.tbst洗5次后凝胶成像系统分析,结果如图2(b)(m:蛋白分子标准;1、2和3:纯化重组蛋白hid2经浓缩后的三个重复电泳泳道;4、5和6:纯化重组蛋白hid2经浓缩后的三个重复免疫印迹)。
[0086]
1.2溃疡性结肠炎动物模型的构建
[0087]
溃疡性结肠炎模型由葡聚糖硫酸钠(dextran sulfate sodium,dss)诱导。取8周龄spf级雌性c57bl/6j小鼠随机分为健康对照组(con),溃疡性结肠炎疾病模型组(dss),重组蛋白hid2治疗组(dss+id2),每组5只小鼠。在实验开始前小鼠进行适应性饲养一周;dss组、dss+id2组小鼠从第0天开始自由饮用含有2.5%dss的灭菌水,至第7天后换饮灭菌水;dss+id2组小鼠于第3、5、7天进行重组蛋白hid2腹腔注射,实验开始每天测量小鼠体重,观察小鼠粪便性状、是否便血。
[0088]
1.3重组蛋白hid2对溃疡性结肠炎的治疗作用
[0089]
通过测定小鼠体重、小鼠疾病活动指数、小鼠结肠病理变化、小鼠结肠组织炎性相关细胞因子表达和小鼠结肠黏蛋白muc2 mrna表达,确定重组蛋白hid2在制备治疗溃疡性结肠炎药物中的作用。
[0090]
1.3.1重组蛋白hid2对溃疡性结肠炎小鼠体重的影响
[0091]
从实验开始每日记录小鼠体重,直至实验结束,实验周期为8天。实验结果如图4所
示,con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。各组间小鼠体重具有显著性的差异(con vs dss,***p<0.001;dss vs dss+id2,**p<0.01)。dss造模后小鼠体重持续下降,而腹腔注射重组蛋白hid2的小鼠体重明显下降较少,这说明重组蛋白hid2可以有效降低溃疡性结肠炎小鼠体重下降的程度。dss+id2组小鼠体重较con组相比无明显下降,且con组和dss+id2组小鼠体重相近,说明重组蛋白hid2对小鼠无毒副作用。
[0092]
1.3.2重组蛋白hid2对溃疡性结肠炎小鼠疾病活动指数的影响
[0093]
从实验开始每日记录小鼠体重变化,观察小鼠粪便性状、是否便血,计算疾病活动指数(disease activity index,dai)。本发明应用贝索公司的便隐血(ob)试剂盒检测粪便隐血情况,若肉眼可见粪便上出现明血则直接断定为显性出血。小鼠的体重下降百分率:体重不变或升高为0,体重下降1-5%为1分,体重下降5-10%为2分,体重下降10-15%为3分,体重下降大于15%为4分;大便黏稠度:正常为0,松散粪便为2分,腹泻为4分;大便出血:正常不出血为0分,隐血阳性为2分,显性出血为4分。小鼠体重下降程度评分如表1所示,各组小鼠每天体重变化是小组中小鼠体重变化评分的平均值。
[0094]
表1各组小鼠体重下降程度评分(n=5)
[0095][0096]
注:不同符号“*”,“#”分别表示不同病理指标各组间(con vs.dss;dss vs.dss+id2)的显著性差异(p<0.05)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。
[0097]
小鼠粪便性状如表2所示,各组评分是小组中小鼠粪便性状评分的平均值。
[0098]
表2各组小鼠粪便性状评分(n=5)
[0099][0100]
注:不同符号“*”,“#”分别表示不同病理指标各组间(con vs.dss;dss vs.dss+id2)的显著性差异(p<0.05)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。
[0101]
小鼠粪便出血情况如表3所示,各组小鼠粪便出血评分是小组中小鼠粪便出血评分的平均值。
[0102]
表3各组小鼠便血情况评分(n=5)
[0103][0104]
注:不同符号“*”,“#”分别表示不同病理指标各组间(con vs.dss;dss vs.dss+id2)的显著性差异(p<0.05)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。
[0105]
疾病活动指数将三项结果的总分除以3即得到dai值,即dai=(体重指数+粪便性状+出血情况)/3。dai结果如图5所示,dss组小鼠疾病活动指数不断升高,而dss+id2组小鼠疾病活动指数也有所升高,但明显升高幅度小于dss组,各组间小鼠间疾病活动指数具有显著性的差异(con vs dss;dss vs dss+id2,***p<0.001)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。说明重组蛋白hid2可以有效降低小鼠疾病活动指数。
[0106]
1.3.3重组蛋白hid2对溃疡性结肠炎小鼠结肠长度的影响
[0107]
第8天实验结束时牺牲小鼠,取结肠并用尺子测量长度。各组结肠长度如图6所示,dss组小鼠结肠明显变短,而dss+id2组小鼠结肠长度和con组基本一致,各组间小鼠体重具有显著性的差异(con vs dss;dss vs dss+id2,*p<0.05,**p<0.01)。说明重组蛋白hid2可以增加疾病中结肠的长度。
[0108]
1.3.4重组蛋白hid2治疗溃疡性结肠炎时小鼠外周血中白细胞的数量变化
[0109]
第8天实验结束时牺牲小鼠,眼眶取血至加有edta抗凝剂的1.5ml离心管中,颠倒混匀,测量各组小鼠外周血中白细胞的变化,结果如图7所示,dss组小鼠外周血中中性粒细胞较con组明显增多,淋巴细胞减少,而dss+id2组中性粒细胞降低,淋巴细胞增多,各组间小鼠体重具有显著性的差异(con vs dss;dss vs dss+id2,*p<0.05,**p<0.01,***p<0.001)。说明重组蛋白hid2可以减少外周血中炎性细胞的数量。
[0110]
1.3.5重组蛋白hid2对溃疡性结肠炎小鼠结肠病理变化的影响
[0111]
第8天实验结束时牺牲小鼠,打开腹腔取结肠远端靠近直肠位置约1cm结肠放入4%的多聚甲醛中固定,之后石蜡包埋,he染色观察小鼠结肠病理变化,并进行病理评分。病理评分标准按照johansson mev,gustafsson jk,holm
é
n-larsson j,et al.bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis.gut.2014;63(2):281-291.提出的标准,各项具体的评分结果见表4。
[0112]
表4各组小鼠病理评分各项参数得分(n=5)
[0113][0114]
注:不同符号“*”,“#”分别表示不同病理指标各组间(con vs.dss;dss vs.dss+id2)的显著性差异(p<0.05)。con为健康对照组,dss为溃疡性结肠炎疾病模型组,dss+id2为治疗组。
[0115]
结肠病理结果如图8(a)所示,dss组小鼠结肠腺体排列紊乱甚至消失,大量炎细胞浸润,杯状细胞减少,黏膜下水肿;而经重组蛋白hid2治疗后能显著改善上述症状。如图8(b)所示,dss组小鼠结肠组织病理评分明显升高,而dss+id2组小鼠结肠组织病理评分显著降低。各组间小鼠具有显著性的差异(con vs dss;dss vs dss+id2,***p<0.001)。说明重组蛋白hid2可以显著降低小鼠结肠组织病理评分,可以用于制备预防小鼠结肠炎的药物。
[0116]
1.3.6重组蛋白hid2对溃疡性结肠炎小鼠结肠组织黏蛋白muc2 mrna表达的影响
[0117]
黏蛋白muc2是肠道黏液层的主要成分,覆盖于肠上皮细胞顶端,主要由杯状细胞分泌,可以润滑和保护肠黏膜上皮,在抵御肠内致病菌及有害物质入侵方面发挥着重要功能。
[0118]
实验结束后,第8天牺牲小鼠,取结肠组织提取rna,取结肠组织,利用trizol法抽提结肠组织总rna,用反转录试剂盒将组织rna反转录为cdna,然后用step one plus实时荧光定量pcr仪进行real-time pcr扩增。扩增步骤为预变性95℃30s,一个循环;95℃5s,60℃30s,40个循环。以gapdh作为内参,扩增完成后采用log2(2-δδct
)值表示各组黏蛋白muc2 mrna的相对表达水平,引物序列见表5。
[0119]
结果如图9所示,dss组小鼠结肠组织中黏蛋白muc2基因mrna丰度的减少,dss+id2组小鼠结肠组织中muc2 mrna的表达显著增加。各组间小鼠具有显著性的差异(con vs dss;dss vs dss+id2,*p<0.05,**p<0.01)。说明重组蛋白hid2可增加muc2 mrna的表达,从分子生物学的角度说明重组蛋白hid2可以用于制备治疗溃疡性结肠炎的药物。
[0120]
1.3.7重组蛋白hid2对溃疡性结肠炎小鼠结肠组织炎性相关细胞因子表达的影响
[0121]
实验结束后,第8天牺牲小鼠,取结肠组织,利用trizol法抽提结肠组织总rna,用反转录试剂盒将组织rna反转录为cdna,然后用step one plus实时荧光定量pcr仪进行real-time pcr扩增。扩增步骤为预变性95℃30s,一个循环;95℃5s,60℃30s,40个循环。以gapdh作为内参,扩增完成后采用log2(2-δδct
)值表示各组促炎细胞因子tnf-α、il-1β、il-6mrna的相对表达水平。引物序列见表5。
[0122]
结果如图10所示,dss组小鼠结肠组织中促炎因子tnf-α、il-1β、il-6mrna表达量增多;dss+id2组小鼠促炎因子tnf-α、il-1β、il-6mrna表达量下降。各组间小鼠具有显著性的差异(con vs dss;dss vs dss+id2,*p<0.05,**p<0.01)。说明经重组蛋白hid2处理可以使促炎细胞因子表达量下降,从分子生物学角度证明重组蛋白hid2可以用于治疗溃疡性
结肠炎的药物。
[0123]
表5 tnf-α、il-6、muc2及内参gapdh引物序列
[0124]
基因前引物序列(5
’-3’
)后引物序列(5
’-3’
)tnf-αccctcacactcagatcatcttctgctacgacgtgggctacagil-6tagtccttcctaccccaattccttggtccttagccactccttcmuc2gcctggctctaatatggatactgcttgtgaggtgggil-1βgcaactgttcctgaactcaactatcttttggggtccgtcaactgapdhtctggaaagctgtggggtgatgccagtgagcttcccgttcag
[0125]
从上述结果分析得出,小鼠在患上溃疡性结肠炎的过程中,重组蛋白hid2干预可以有效降低体重下降的程度,显著减缓小鼠的疾病活动指数的上升,显著降低小鼠结肠组织病理评分,使促炎细胞因子tnf-α、il-1β、il-6mrna表达量下降,显著增加muc2 mrna的表达,因此认为重组蛋白hid2可应用于制备治疗溃疡性结肠炎的药物。
[0126]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1