纳米酶成分和治疗方法与流程
纳米酶成分和治疗方法
背景技术:
1.帕金森氏病(pd)是第二大最常见的神经退行性疾病,其特征是路易体(lb)中的α-突触核蛋白(α-syn)异常聚集和积累[1,2]。尽管一些α-syn突变与家族性pd相关[3,4],但大多数病例是散发性病理,病因不明[5]。
[0002]
开发治疗帕金森氏病和其他神经系统疾病的新疗法具有重要的意义。
技术实现要素:
[0003]
在一方面,本发明提供了可以抑制α-突触核蛋白细胞间传播的成分和方法。
[0004]
特别地,在一个实施方案中,本发明提供了治疗患有α-突触核蛋白病或对之易感的哺乳动物(比如人类)的方法,所述方法包括向哺乳动物施用有效计量的一种或多种金属纳米酶。
[0005]
在另一个实施方案中,本发明提供了用于治疗或减缓发病一种蛋白质病的方法,所述方法包括向有此需要的受试者施用有效量的一种或多种金属纳米酶。
[0006]
在另一个实施方案中,本发明提供了抑制患有α-突触核蛋白病或有风险患α-突触核蛋白病的受试者的细胞内α-突触核蛋白聚集的方法,所述方法包括施用有效量的一种或多种金属纳米酶。
[0007]
在另一个实施方案中,本发明提供了抑制患有α-突触核蛋白病或有风险患α-突触核蛋白病的受试者的α-突触核蛋白细胞间传播的方法,所述方法包括施用有效量的一种或多种金属纳米酶。
[0008]
在另一个实施方案中,本发明提供了治疗患有α-突触核蛋白病或易患α-突触核蛋白病的哺乳动物的方法,所述方法包括向所述哺乳动物施用有效量的一种或多种pt剂。
[0009]
在另一个实施方案中,本发明提供了治疗或延缓蛋白病发病的方法,所述方法包括向有此需要的受试者施用有效量的一种或多种pt剂。
[0010]
在另一个实施方案中,本发明提供了抑制患有α-突触核蛋白病或有风险患α-突触核蛋白病的受试者的细胞内α-突触核蛋白聚集的方法,所述方法包括施用有效量的一种或多种pt剂。
[0011]
在另一个实施方案中,本发明提供了抑制患有α-突触核蛋白病或有风险患α-突触核蛋白病的受试者的α-突触核蛋白细胞间传播的方法,所述方法包括施用有效量的一种或多种pt剂。
[0012]
在首选的方面,一种或多种金属纳米酶或pt剂是纳米合金。
[0013]
在某些方面,一种或多种金属纳米酶或pt剂不包含金属氧化物。因此,在某些方面,一种或多种金属纳米酶或pt剂不包含诸如ceo2,mn3o4和/或cu
x
o的氧化物,并且根据所述方法所述氧化物将不被施用于受试者。
[0014]
在某些方面,一种或多种金属纳米酶或pt试剂将呈离散形式(比如粒子),且最长尺寸(例如直径)小于50、40、30、20、10、5、4、3、2、1或0.5纳米。
[0015]
首选的pt剂可包括例如ptcu,ptni,ptau,ptag,ptfe和/或ptsn。ptcu是特别首选
的试剂。
[0016]
在某些方面,一种或多种金属纳米酶或pt剂不包含蛋白质或多肽作为纳米酶或pt剂的组分(例如,没有与金属纳米酶或pt剂共价连接的蛋白质或肽)。
[0017]
在某些方面,一种或多种金属纳米酶或pt剂不包含聚合物基团作为纳米酶或pt试剂的组分(例如,没有与金属纳米酶或pt剂共价连接的聚合物)。
[0018]
在某些方面,一种或多种金属纳米酶或pt剂不包含有机组分(例如,没有共价键合到金属纳米酶或pt剂的有机基团)。在某些方面,一种或多种纳米酶或pt剂可以是无机的。
[0019]
在某些治疗方法中,哺乳动物或受试者患有或易患α-突触核蛋白病或障碍病症,并且优选通过给予一种或多种金属纳米酶或pt剂来治疗哺乳动物或受试者的α-突触核蛋白病或障碍病症。
[0020]
在某些治疗方法中,哺乳动物或受试者患有帕金森氏病或易患帕金森氏病,并且优选通过施用一种或多种金属纳米酶或pt剂治疗哺乳动物或受试者的帕金森氏病。
[0021]
在某些方法中,哺乳动物或受试者患有路易小体痴呆症,并且优选通过施用一种或多种金属纳米酶或pt剂治疗哺乳动物或受试者的路易小体痴呆症。
[0022]
在某些方法中,哺乳动物或受试者患有伴随痴呆的帕金森氏病,多系统萎缩和1/3的阿尔茨海默氏病(具有α-突触核蛋白病特征),且优选通过施用一种或多种金属纳米酶或pt剂治疗哺乳动物或受试者的所述此类疾病或病症。
[0023]
在某些方法中,哺乳动物或受试者患有或易患阿尔茨海默氏病或三核苷酸重复扩增疾病,并且优选通过施用一种或多种金属纳米酶或pt剂来治疗哺乳动物或受试者这种疾病或病症。
[0024]
在某些方法中,哺乳动物或受试者患有亨廷顿氏病,脊柱或延髓性肌萎缩,脊髓小脑性共济失调1型,齿龈-睑球囊性萎缩,马查多-约瑟夫病,脊髓小脑性共济失调2型,脊髓小脑性共济失调6型或脊髓小脑性共济失调7型,并且优选通过施用一种或多种金属纳米酶或pt试剂治疗哺乳动物或受试者的这种疾病或病症。
[0025]
在其他方面,本发明还提供了治疗或药物试剂盒,其包含(a)包含一种或多种金属纳米酶的药物组合物,和(b)该药物组合物用于治疗α-突触核蛋白病的说明书。
[0026]
优选的试剂盒可包含(a)包含一种或多种金属纳米酶的药物组合物;(b)该药物组合物用于治疗有路易体的帕金森氏病痴呆症,伴随痴呆的帕金森氏病,多系统萎缩症,1/3的阿尔茨海默氏病(具有α-突触核蛋白病特征),阿尔茨海默氏病或三核苷酸重复扩增疾病的使用说明。
[0027]
另外的试剂盒可包含(a)包含一种或多种pt剂的药物组合物;(b)该药物组合物用于治疗α-突触核蛋白病的说明书。
[0028]
另外的试剂盒可包含(a)包含一种或多种pt剂的药物组合物;(b)该药物组合物用于治疗有路易体的帕金森氏病痴呆症,伴随痴呆的帕金森氏病,多系统萎缩症,1/3的阿尔茨海默氏病(具有α-突触核蛋白病特征),阿尔茨海默氏病或三核苷酸重复扩增疾病的使用说明。
[0029]
用于本方法的合适且优选的金属纳米酶和pt剂,试剂盒和组合物易于识别。特别地,可以根据以下实施例3的方案评估候选金属纳米酶或pt剂。优选的候选金属纳米酶或pt剂在该实施例3中表现出至少5%,10%,20%,30%,40%,50%,60%,70%,80%或90%或
更强的活性,其在实施例3中描述为ptcu。
[0030]
下文公开了本发明的其他方面。
附图说明
[0031]
专利或申请文件包含至少一张彩色附图。专利局将根据要求提供必要的费用,并提供带有彩色附图的本专利或专利申请公开的副本。
[0032]
图1(包括图1a至1i)。ptcu nas的形成和类过氧化物酶、类过氧化氢酶、类sod活性和清除自由基的抗氧化能力。图1a:透射电子显微镜(tem),图1b:xps和图1c:pt/cu摩尔比为1/1的ptcu nas的x射线衍射(xrd)图。图1d:ptcu nas模拟3种氧化还原酶(pod:过氧化物酶,sod:超氧化物歧化酶,cat:过氧化氢酶)的示意图。图1e:h2o2存在下,类pod的ptcu nas催化tmb的紫外可见光谱。图1f:不同剂量的ptcu nps随时间的吸光度。图1g:电子自旋共振(esr)血氧饱和度测定法表征ptcu nps的类cat活性减少h2o2,在2mm h2o2存在下,在密闭室中添加ptcu nps前后,pdt的esr谱随时间的变化。图1h:ptcu nas的类sod活性还原超氧化物的esr谱。图1i:ptcu nps以时间依赖性方式清除dpph自由基的活性。
[0033]
图2(包括图2a-2j)。ptcu nas在体外减少了由pff诱导的活性氧(ros),α-syn病理和神经毒性。图2a:ptcu nas降低了pff诱导的ros。在体外培养7天后,将pff(10μg/ml)和ptcu nas(1μm)添加到小鼠原代神经元中。为了评估ros水平,在pff处理后两天,将神经元与cm-h2dcfda(2μm)孵育30分钟。比例尺,100μm。图2b:ros水平的定量分析。数据为均值
±
sd,n=3次独立实验,one-way anova,进行tukey校正。图2c:ptcu nas降低了pff诱导的ps129免疫反应性。体外培养7天的神经元用pff和ptcu或对照载体处理,处理后7天用抗ps129评估ps129免疫反应性水平。比例尺,50μm。图2d:ps129免疫反应性的定量分析。数据为均值
±
sd,n=3次独立实验,one-way anova,进行tukey校正。图2e和2f:可溶和不可溶部分中α-syn的免疫印迹。体外培养7天的神经元用pff和ptcu或对照载体处理,处理7天后,用1%tx-100提取神经元裂解液以得到tx可溶级分,然后用2%sds提取tx不溶级分。通过抗α-syn抗体评估α-syn水平。图2g和2h:不溶(左图)和可溶(右图)α-syn的定量分析。数据为均值
±
sd,n=5-6次独立实验,one-way anova,进行tukey校正。图2i:ptcu nas阻断了pff诱导的神经毒性。在pff处理后15天进行毒性测定,通过抗neun免疫染色评估。比例尺,100μm。图2j:神经毒性的定量分析。数据为均值
±
sd,n=3-5个独立实验,one-way anova,进行tukey校正。*p《0.05,**p《0.01,***p《0.001,****p《0.0001,ns,无显着性差异。
[0034]
图3(包括图3a和3b)。ptcu nas在体外抑制α-syn的传播。图3a:α-syn传递体外实验的流程(上)和在微流体腔中进行ptcu nas处理的实验设计(下)。在第1室和第2室中培养神经元。体外培养神经元7天,将pff添加在第1室中。将ptcu nas(1μm)同时处理到第2室。7天后将神经元用4%pfa固定,进行免疫染色。图3b:用于表征α-syn传播的ps129免疫染色。用抗ps129抗体对神经元进行免疫染色。比例尺,100μm。图3c:ps129免疫染色的定量。数据为平均值
±
sd,n=4次独立实验,unpaired student's t-test。**p《0.01,ns,无显着性差异。
[0035]
图4(包括图4a-4h)。ptcu nas在体内抑制α-syn的传递。图4a:用ptcu nas处理的pff动物实验的流程(上)以及pff和ptcu/对照载体的立体定位注射位点(下)。在两个月大时对小鼠进行立体定位注射pff和ptcu/对照载体,并在注射pff后两个月处死小鼠。图4b:
在黑质(sn)和纹状体(st)中的ps129免疫染色。脑切片用抗ps129抗体和抗th(酪氨酸羟化酶)抗体染色。比例尺,50μm。图4c,4d:ps129免疫染色的定量。数据为平均值
±
sd,每组n=6只小鼠,unpaired student's t-test。*p《0.05,ns,无显着性差异。图4e,4f:sn的脑溶解产物免疫印迹分析。用1%tx-100提取脑溶解产物以得到tx可溶性部分,然后用2%sds提取出tx不溶性部分。用抗α-syn抗体评估总α-syn水平。图4g,4h:脑溶解产物的免疫印迹定量分析。数据为平均值
±
sd,每组n=4只小鼠,unpaired student's t-test。*p《0.05,ns,无显着性差异。
[0036]
图5:ptcu纳米酶清除ros并在体外和体内预防病理性α-突触核蛋白诱导的病理,神经毒性和细胞间传递的示意图。合成的ptcu na在功能上模仿了三种氧化还原酶,包括过氧化物酶(pod),过氧化氢酶(cat)和超氧化物歧化酶(sod),清除自由基(dpph),并在无细胞系统中显示出卓越的抗氧化能力。在散发的pd模型中,在神经元培养物中添加pff会引起ros水平升高,α-syn聚集、病理和神经毒性。此外,pff诱导的聚集体可进一步引起细胞间传播和神经变性。ptcu nas充当纳米酶,可以清除ros,并显着降低pff诱导的病理、神经毒性和细胞间传播。
[0037]
图6(包括图6a-6c)。图6a:hrtem图像。图6b:ed图案。6c:由pt/cu摩尔比为1/1的ptcu nas的直径计算得出的尺寸分布。ed图案显示出衍射点叠加在具有明显衍射指数的环上(图6b),这与面心立方(fcc)多晶结构一致。
[0038]
图7是pt/cu比为1的ptcu nas的eds谱。
[0039]
图8(包括图8a-b)。h2o2存在下,tmb在hrp催化下的紫外可见光谱(a),以及在不同剂量的hrp下吸光度随时间的变化(b)。
[0040]
图9(包括图9a-9b)。在存在和不存在ptcu催化的情况下,h2o2溶液的紫外可见光谱随时间的演变(a)。结果表明在测试期间吸收光谱没有变化,表明h2o2本身很稳定,无催化剂条件下不可分解。ptcu nas还原h2o2的类过氧化氢酶活性依赖于浓度(b)。
[0041]
图10(包括图10a-10b)。通过nbt方法检测ptcu nps的类sod活性的方案及机理(a),使用nbt作为探针分子的uv-vis光谱证明了ptcu nps和sod还原超氧化物的能力(b)。nbt是超氧化物的特异性探针。无色的nbt可以与超氧化物反应生成蓝色产物nbt formazan,其特征吸收带在545nm。在存在sod或ptcu nps的情况下,蓝色和吸光度均明显降低,表明ptcu nas表现出类似于sod的活性以消除超氧化物。
[0042]
图11(包括图11a-11b)。dpph溶液的uv-vis光谱(a)和522nm处的吸光度变化(b)。b中的插图代表与a中的红色方块相对应的放大视图。
[0043]
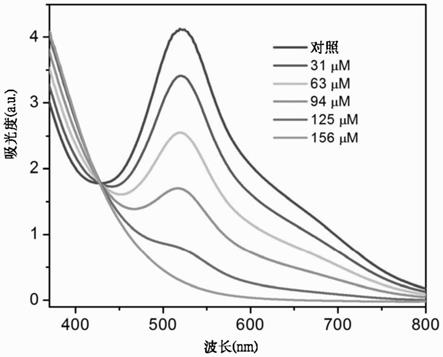
图12:浓度依赖的抗坏血酸(aa)的dpph清除活性。当dpph与抗氧化剂(例如aa)反应时,其独特的颜色不再存在。这种脱色和相应的520nm吸收峰的消失为研究抗氧化剂清除dpph的活性提供了一种方便的方法。
[0044]
图13(图13a-13d)。具有不同的pt/cu原子比的(a)3/1,(b)1/1和(c)1/3的ptcu纳米合金的tem图像。(d)不同pt/cu比的ptcu nas的粒子尺寸(直径)分布。
[0045]
图14.不同样品的测得pt含量,粒子尺寸和(111)面d值与ptcu nas中计算pt含量的关系。
[0046]
图15(包括图15a-c)。ptcu nas的类过氧化物酶,类过氧化氢酶和类sod活性取决于其组成。
[0047]
图16(图16a-16d)(a)通过透射电子显微镜(tem)表征了α-syn单体和pff。比例尺,100nm。(b)小鼠α-syn pff长度的分布。小鼠pff的平均长度为45.4nm(n=250)。(c)通过抗α-突触核蛋白抗体的免疫印迹来表征α-syn单体和pff。(d)硫代黄素t(tht)荧光表征α-syn单体和pff。定量数据分析为平均值
±
sd,n=5次独立实验,unpaired student's t test。****p<0.0001。
[0048]
图17(包括图17a-b)。(a)含或不含ptcu纳米酶条件下的α-syn的硫黄素t(tht)结合动力学测定。(b)聚集24小时后,含或不含ptcu纳米酶条件下的α-syn聚集体的免疫印迹分析。
[0049]
图18(包括图18a-b)。(a)ptcu nas阻断pff诱导的神经毒性的明场图像。pff处理15天后获得图像。(b)神经毒性定量分析。数据为平均值
±
sd,n=3次独立实验,one-way anova,进行tukey校正。****p《0.0001,ns,无显着性差异。
[0050]
图19(包括图19a-d)。(a,b)纹状体(st)的脑溶解产物的免疫印迹。用1%tx-100提取脑溶解产物以得到tx可溶性部分,然后用2%sds提取出tx不溶性部分。用抗α-syn抗体评估总α-syn水平。(c,d)脑溶解产物的免疫印迹的定量分析。数据为平均值
±
sd,每组n=4只小鼠,unpaired student's t test。*p《0.05,ns,无显着性差异。
[0051]
图20(包括图20a-c)。ph对ptcu nas清除h2o2活性的影响。(a)ptcu nas与rab5,rab7和lamp1共定位。比例尺,5μm。(b)在不同的ph条件下,ptcu nas催化的h2o2(20mm)分解产生氧气的典型动力学曲线。(c)氧气产生速度和ph值之间的关系。
[0052]
图21(包括图21a-b)。(a)用脑-pbs或脑裂解液处理ptcu nas 1小时。通过考马斯亮蓝染色确定吸附到nas上的蛋白质的量。(b)has蛋白冠对ptcu nas类过氧化物酶活性的影响。在不存在(对照)和存在ptcu nas或ptcu-hsa络合物的情况下,含有tmb和h2o2的样品在650nm处的吸光度是时间的函数。
具体实施方式
[0053]
本文所指的突触核蛋白病(也称为α-突触核蛋白病)是神经退行性疾病,其特征在于α-突触核蛋白的聚集体在神经元、神经纤维或神经胶质细胞中的异常积聚。它们的特征在于多巴胺能系统和中枢神经系统其他区域的退化。它们在临床上表现为运动障碍、认知障碍、自主功能障碍以及神经病理学上形成α-突触核蛋白聚集体,有时以路易体(lb)的形式出现。突触核蛋白病包括帕金森氏病(pd),路易体痴呆(dlb),阿尔茨海默氏病的路易体变体,帕金森氏病(pd)和阿尔茨海默氏病(ad)以及多系统萎缩(msa)。
[0054]
治疗活性是指可用于或可能用于预防或治疗疾病的试剂的活性。筛选系统可以是体外的、细胞的、动物的或人的。尽管可能需要进行进一步测试以确定治疗疾病的实际预防或治疗效用,但仍可将试剂描述为具有治疗活性。
[0055]“受试者”是指可以对其应用本发明的方法和/或可以对其施用本发明的试剂的生物。受试者可以是哺乳动物,包括人类,或哺乳动物器官或哺乳动物细胞,包括人类器官和/或人类细胞。
[0056]“治疗”涵盖哺乳动物的疾病状态的治疗,包括:(a)防止在哺乳动物中发生疾病,特别是当这种哺乳动物易患疾病,尚未被诊断为患有该疾病时;(b)抑制疾病状态,例如阻止其发展;和/或(c)减轻疾病状态,例如引起疾病状态消退,直到达到期望的终点。治疗还
包括改善疾病的症状(例如减轻疼痛或不适),其中这种改善可以或不可以直接影响疾病(例如,病因,传播,表达等)。
[0057]
可以将包含一种或多种治疗性助剂(例如,一种或多种金属纳米酶)的药物组合物施用于受试者,并且可以包含常规的药学上可接受的载体,赋形剂或稀释剂。
[0058]
术语“药学上可接受的”是指在合理的医学判断范围内适用于与人和动物的组织接触而没有过度毒性、刺激、过敏反应或其他问题或并发症,与合理的获益/风险比相称的那些化合物、材料、组合物、载体和/或剂型。
[0059]“药学上可接受的赋形剂”或“药学上可接受的载体”是指可用于制备通常是安全,无毒且生物学上或其他方面均无害的药物组合物的赋形剂或载体,包括兽药和人用药物可接受的赋形剂。药学上可接受的赋形剂的实例包括但不限于无菌液体,水,缓冲盐水,乙醇,多元醇(例如甘油,丙二醇,液体聚乙二醇等),油,清洁剂,助悬剂,碳水化合物(例如葡萄糖)(例如乳糖,蔗糖或葡聚糖),抗氧化剂(例如抗坏血酸或谷胱甘肽),螯合剂,低分子量蛋白质或其合适的混合物。
[0060]
药物组合物可以散装或剂量单位形式提供。为了易于给药和剂量均匀,以剂量单位形式配制药物组合物是特别有利的。如本文所用,术语“剂量单位形式”是指适合作为待治疗受试者的单位剂量的物理上离散的单位;每个单元包含预定量的活性化合物,该活性化合物经计算可与所需的药物载体一起产生所需的治疗效果。本发明的剂量单位形式的规范由活性化合物的独特特性和期待实现的特定治疗效果决定,并直接取决于该活性化合物的独特特性。剂量单位形式可以是安瓿,小瓶,栓剂,糖衣丸,片剂,胶囊,静脉输液袋或气雾剂吸入器上的单个泵。
[0061]
在治疗应用中,剂量取决于试剂,接受患者的年龄,体重和临床状况,以及进行治疗的临床医生或执业医师的经验和判断以及影响所选剂量的其他因素而变化。通常,剂量应为治疗有效量。通过已知的剂量方案可以容易地确定特定金属纳米酶或pt剂的最佳剂量。在某些疗法中,ptcu可以以0.1μg/kg受试者体重和100μg/kg受试者体重的量以日剂量给予受试者,在一天中一次或多次给予。
[0062]
在实施方案中,待治疗的受试者是人类,无论是男性还是女性。在某些方面,人类将是成年人(至少16、18或21岁)或老年人(例如至少65、70或75岁)。
[0063]
药物组合物可以采取任何合适的形式(例如,液体,气雾剂,溶液,吸入剂,薄雾,喷雾剂;或固体,粉末,软膏,糊剂,乳膏,洗剂,凝胶,贴剂等)用于通过任何所需途径(例如,肺,吸入,鼻内,口服,颊,舌下,肠胃外,皮下,静脉内,肌肉内,腹膜内,胸膜内,鞘内,经皮,经粘膜,直肠等)。例如,本发明的药物组合物可以是通过吸入或吹入(通过口或鼻)通过气雾剂给药的水溶液或粉剂形式,或者是用于口服给药的片剂或胶囊剂形式。以无菌水溶液或分散液的形式,适于通过直接注射或通过添加到用于静脉内输注的无菌输注液中来给药;或以用于经皮或经粘膜给药的洗剂,霜剂,泡沫剂,贴剂,混悬剂,溶液或栓剂的形式。
[0064]
在实施方案中,药物组合物包含可注射形式。
[0065]
药物组合物可以是口服可接受的剂型形式,包括但不限于以乳剂,水性混悬剂,分散剂或溶液形式的胶囊,片剂,口腔形式,锭剂,锭剂和口服液。胶囊可包含本发明化合物与惰性填充剂和/或稀释剂例如药学上可接受的淀粉(例如玉米,马铃薯或木薯淀粉),糖,人造甜味剂,粉末状纤维素,例如结晶和微晶纤维素的混合物,面粉,明胶,口香糖等。
[0066]
药物组合物可以是适合肠胃外给药的无菌水溶液或分散液形式。本文所用的术语“肠胃外”包括皮下,皮内,静脉内,肌肉内,关节内,动脉内,滑膜内,胸骨内,鞘内,病变内和颅内注射或输注技术。
[0067]
药物组合物可以是适于通过直接注射或通过添加到用于静脉内输注的无菌输注液中而给药的无菌水溶液或分散液的形式,并且包含含有水,乙醇,多元醇(例如,甘油、丙二醇和液态聚乙二醇),合适的混合物或一种或多种植物油。本发明化合物的游离碱或药理学上可接受的盐的溶液或悬浮液可以在与表面活性剂适当混合的水中制备。合适的表面活性剂的例子在下面给出。分散液也可以在例如甘油、液体聚乙二醇及其在油中的混合物中制备。
[0068]
除了存在于制剂中的任何载体或稀释剂(例如乳糖或甘露醇)以外,用于本发明方法的药物组合物还可包含一种或多种添加剂。一种或多种添加剂可包含一种或多种表面活性剂或由其组成。表面活性剂通常具有一个或多个长的脂族链,例如脂肪酸,使它们能够直接插入细胞的脂质结构中,以增强药物的渗透和吸收。
[0069]
合适且优选的金属纳米酶和pt剂可以容易地制备。如在下面的实施例1中提出的制备方法。
[0070]
试剂盒
[0071]
如所讨论的,本发明提供了包括一种或多种纳米酶或一种或多种pt剂的治疗试剂盒。
[0072]
在实施方案中,试剂盒中的组合物适合于递送(例如局部注射或口服)给受试者。
[0073]
本发明还提供了用于本发明方法的包含药物组合物的包装和试剂盒。该试剂盒可以包括一个或多个选自瓶子,小瓶,安瓿,泡罩包装和注射器的容器。试剂盒可进一步包括一种或多种用于治疗和/或预防本发明的疾病、病症或失调的说明书、一个或多个注射器、一个或多个施加器、或适合于重构药物组合物的无菌溶液。
[0074]
实施例
[0075]
下列实施例说明了本发明的某些具体实施方案,并不意味着限制本发明的范围。通过以下实施例和详细协议进一步说明本文的实施方案。但是,这些示例仅旨在说明实施例,而不应解释为限制本文的范围。在本技术中引用的所有参考文献,已公开的专利和专利申请的内容均通过引用并入本文。
[0076]
实施例1:ptcu nas的合成和抗氧化活性。
[0077]
ptcu纳米合金的合成
[0078]
在典型的ptcu纳米合金合成中,将400mg聚乙烯吡咯烷酮(pvp,mw=35000),200mg甘氨酸,2ml 20mm h2ptcl6溶液,2ml 20mm cucl2溶液混合搅拌5分钟,然后在室温下超声5分钟。随后,将该溶液转移至20ml聚四氟乙烯内胆的不锈钢高压釜中,加热至200℃,反应6小时后冷却至室温。在10278
×
g转速下,离心2次,每次15分钟,分别用乙醇和水分散,获得产物。将产物分散到4ml水中用于后续实验。用于制备ptcu纳米合金的所有化学药品均购自国药控股化学试剂有限公司(上海,中国)。
[0079]
合成的ptcu nas呈分散均匀的球形,并表现出凹凸不平的表面(图1a)。pvp包覆的ptcu nas的zeta电位为-15.3
±
1.5mv。ptcu nas悬浮液在长期存储过程中显示出良好的抗聚集性、稳定性。高分辨透射电子显微镜照片(hrtem)表明了单个粒子中部分清晰的晶格条
纹,其晶格间距为0.218nm,而该值恰好位于pt(111)面与cu(111)面对应的晶格间距值(0.228nm和0.208nm)之间(图6a)。x射线光电子能谱(xps)和能量色散x射线能谱(eds)分析证实元素pt和cu共存(图1b和7),测得pt/cu摩尔比为1.2,与pt
2+
/cu
2+
的投料比例一致。ptcu nas的平均直径为32.1
±
4.5nm(图6c)。x射线衍射(xrd)的衍射峰也显示晶面(111)和(200),位于纯pt和cu的相应峰之间(图1c)。以上数据证实了双金属合金的形成,且晶格参数随合金组成而变化。
[0080]
ptcu纳米合金的表征
[0081]
使用cary 5000uv-vis-nir光谱仪(agilent,美国)测定吸收光谱。通过x射线衍射(xrd,d8 advance衍射仪,bruker,德国)测定ptcu合金纳米颗粒的晶体结构。透射电子显微镜(tem)图像和选定区域电子衍射(saed)通过tecnai g2 f20 u-twin电子显微镜(fei,美国)在200kv的加速电压条件下获得。x射线光电子能谱使用thermo escalab 250xi多功能成像电子能谱仪(thermo fisher scientific,美国)在150w al k
α
辐射和约3
×
10-9
mbar的基本压力下表征,所测结合能以c1s(284.8ev)进行校准。
[0082]
清除超氧自由基和dpph的能力检测
[0083]
ko2体系用于验证ptcu nas清除超氧自由基的能力。紫外-可见(uv-vis)吸收光谱和电子自旋共振波谱(esr)(bruker,德国)用于检测超氧自由基的产生和清除。硝基蓝四唑(nbt)作为探针分子与超氧化物反应能形成单甲臜,表现出特征的吸收光谱。bmpo作为自旋捕获分子,能和超氧负离子自由基形成自旋加合物bmpo/
·
ooh,从而表现出特征的esr信号。测试步骤为:将25mm bmpo(或0.33mm nbt)和0.7mm 18-crwon-6在10mm ph 7.4pbs溶液与sod或ptcu nas混合均匀,然后加入ko2引发超氧自由基的产生。esr测量条件:10mw微波功率;100g扫描范围和1g场调制。dpph自由基清除实验步骤:将ptcu nas加入2.5ml 0.1mg/ml dpph乙醇溶液中,然后在选定的时间间隔下记录紫外-可见(uv-vis)吸收光谱。
[0084]
类过氧化物酶和类过氧化氢酶活性检测
[0085]
在特定的时间间隔以扫描动力学模式记录吸收光谱,研究催化还原h2o2的反应动力学。一般情况下,反应在室温下进行。类过氧化物酶活性测试步骤:20μl 20mm tmb溶液和20μl 0.1m h2o2在3ml hac-naac缓冲液(10mm,ph 5.0)中混合,然后添加ptcu nas溶液以引发tmb的氧化。类过氧化氢酶活性测试步骤:20μl ptcu催化剂与一定体积0.1m h2o2在3ml pbs缓冲液(10mm,ph 7.4)中混合,记录光谱随时间的变化来计算反应速率。
[0086]
α-突触核蛋白(α-syn)pff制备
[0087]
按已发表的方法纯化重组α-syn蛋白,以5mg/ml浓度在pbs缓冲液中搅拌(1,000rpm,37℃)。搅拌7天后,将α-syn聚集体离心,pbs重悬沉淀。将样品以30%的功率超声(branson digital sonifier,branson ultrasonics,danbury,ct,美国)1分钟以获得pff。
[0088]
硫黄素t(tht)结合测定
[0089]
分别在含有或不含有ptcu nas的pbs缓冲液中聚集重组α-syn单体。收集不同时间点的α-syn聚集体,并与50μm硫黄素t(tht)孵育。使用varioskan lux读板仪(thermo fisher scientific,waltham,ma,美国)以450nm激发/485nm发射波长检测荧光信号。
[0090]
原代神经元培养
[0091]
取c57bl/6j小鼠(jackson laboratory,bar harbor,me,美国)的15.5天胎鼠用于皮层原代神经元培养。培养前,组织培养板用0.2mg/ml ploy-l-鸟氨酸孵育1小时,并用高
压灭菌的milli-q水洗涤3次。为了开展α-syn传播实验,将微流体装置(omega4 neuronal co-culture device,enuvio,quebec,加拿大)用1mg/ml poly(d)lysine孵育过夜。神经基础培养基和b-27补充剂(thermo fisher scientific,waltham,ma,美国)用于神经元培养。7天的原代皮层神经元经α-syn pff处理,同时添加ptcu nas到神经元中,孵育2天以进行ros检测,孵育7天以进行病理检测,孵育15天以进行神经毒性检测。
[0092]
免疫荧光分析和化学染色
[0093]
将神经元用4%的多聚甲醛固定,用0.2%triton x-100透化。将神经元与一抗在4℃孵育过夜。neun抗体(1:500,mab377,sigma-aldrich,st.louis,mo,美国)用于毒性实验。磷酸化α-突触核蛋白(ps129)抗体(1:1000,ab51253,abcam,cambridge,ma,美国)和map2抗体(1:500,m9942,sigma-aldrich,st louis,mo,美国)用于病理学和传播检测。然后将神经元与荧光二抗(1:1000,thermo fisher scientific,waltham,ma,美国)和hoechst(1:5000,thermo fisher scientific,waltham,ma,美国)共同孵育染色。对于脑组织切片染色,制备40μm的脑组织切片进行免疫荧光染色。将切片在封闭液(10%山羊血清,0.3%triton x-100)中室温封闭1小时,然后与磷酸化α-突触核蛋白(ps129)抗体(1:1000,ab51253,abcam,cambridge,ma,美国)和抗酪氨酸羟化酶抗体(1:1000,t2928,sigma-aldrich,st louis,mo,美国)在4℃孵育过夜。将切片与荧光二抗(1:1000,thermo fisher scientific,waltham,ma,美国)和hoechst(1:5000,thermo fisher scientific,waltham,ma,美国)共同孵育染色。使用显微镜(observer z1,zeiss,oberkochen,德国)或共聚焦显微镜(lsm 880,zeiss,oberkochen,德国)拍摄图片。
[0094]
ros分析
[0095]
cm-h2dcfda染料工作液(2μm,c6827,thermo fisher scientific,thermo fisher scientific,waltham,ma,美国)用neurobasal培养基稀释。将神经元用α-syn pff和ptcu nas处理2天,然后在37℃下与cm-h2dcfda工作溶液孵育30分钟。将神经元用4%多聚甲醛固定10分钟,并用hoechst(1:5000,thermo fisher scientific,waltham,ma,美国)染色。图使用显微镜(observer z1,zeiss,oberkochen,德国)拍摄图片。
[0096]
ptcu nas的亚细胞定位
[0097]
将ptcu nas与cy3 peg硫醇((nanocs,new york,ny,美国)在水溶液中室温孵育30分钟。用milli-q水将cy3标记的ptcu nas洗5次,并在14 000rpm离心20分钟进行纯化。然后将cy3标记的ptcu nas加入原代神经元孵育2小时后进行免疫荧光分析。rab5抗体(1:1000,ab18211,abcam,cambridge,ma,美国),rab7抗体(1:1000,2094s,cell signaling technology,danvers,ma,美国)和lamp1抗体(1:1000,ab24170,abcam,cambridge,ma,美国)分别作为早期内体,晚期内体和溶酶体标记物进行检测(图20a)。
[0098]
ph值影响纳米酶的抗氧化活性
[0099]
h2o2是
·o2-歧化反应的产物,是生物体系中的强氧化剂。为了探索不同ph值的亚细胞区域中ptcu纳米酶的抗氧化活性,我们研究了ph对ptcu nas对h2o2清除活性的影响。通过测量h2o2分解产生的o2,我们评估了各种ph条件下ptcu nas的活性。图20b显示了在含有或不含有ptcu nas的情况下,不同ph值时(ph=4.5、5.5、6.5和7.5)的o2生成速率。图20c展示了相应的氧气产生速度。结果表明,ph与ptcu nas的类过氧化氢酶的活性之间存在相关性,较高的ph值导致较高的类过氧化氢酶的活性,能分解更多的h2o2。这些也证实了ph值影
响ptcu nas的抗氧化活性,相对较高ph的环境有利于提高其抗氧化能力。
[0100]
蛋白冠研究
[0101]
为了研究在生物介质中蛋白冠的形成,收集小鼠脑组织并在pbs中孵育或与pipa缓冲液匀浆后离心。收集上清液,并与ptcu nas在37℃下孵育1小时。离心分离吸附至na的蛋白质,并通过sds-page考马斯亮蓝染色进行表征(图21a)。结果表明,ptcu nas在生物条件下可以形成蛋白冠。
[0102]
为了确定蛋白冠是否影响其功能,选择人血清白蛋白(hsa,购自sigma-aldrich)作为模型蛋白,初步研究了ptcu上蛋白冠的形成及其对类酶活性的影响。按照此前建立的方法,将pvp包被的ptcu与pbs中的1%hsa在37℃下孵化1h,收集所得的复合物在10000g下离心两次,每次10分钟进行纯化洗涤去除未结合的蛋白质。ptcu nps的zeta电位为-15.3
±
1.5mv,水中的hsa/ptcu的zeta电位变为-4.25
±
0.1mv,表明在ptcu nas上形成了hsa冠。如所预期的,在ptcu nas表面hsa冠的形成导致了其过氧化物酶活性的明显降低(图21b)。
[0103]
脑立体定向注射
[0104]
使用前先对α-syn pff进行超声处理。在无菌pbs中制备ptcu nas。注射前将3个月大的c57bl/6j小鼠(杰克逊实验室,bar harbor,me,美国)麻醉。将α-syn pff(2μl,5μg)立体定向注射至纹状体(中侧,m/l:+2.0mm;前后位,a/p:+0.2mm;背腹,d/v:+2.6mm)。每只小鼠将ptcu nas(0.35μg/2μl)立体定向注射至黑质区(中侧,m/l:+1.3mm;前后位,a/p:-3.2mm;背腹,d/v:+4.3mm)。注射以每分钟0.2μl的速率进行。注射后,将针头停留5分钟后从脑中缓慢取出。手术后监测小鼠的伤口愈合和恢复。为进行生化研究,小鼠灌注预冷的pbs,收集脑组织并储存在-80℃。为进行组织学研究,小鼠灌注预冷的pbs后灌注4%的多聚甲醛。收集脑组织并固定在4%多聚甲醛中,然后转移至30%蔗糖。制备冠状切片(40μm)用于免疫荧光分析。
[0105]
生化分析
[0106]
将神经元细胞或脑组织用裂解液(神经元:1%triton x-100在pbs中;脑组织:在50mm tris中为1%triton x-100,对于组织为150mm nacl)裂解,裂解液中加入蛋白酶抑制剂混合物(11873580001,millipore sigma,burlington,ma,美国)和磷酸酶抑制剂混合物(5872s,cell signaling technology,danvers,ma,美国)。离心裂解物,并收集上清液作为tx可溶成分。将沉淀重悬于含有2%sds的裂解缓冲液中,该裂解液带有蛋白酶抑制剂混合物(11873580001,millipore sigma,burlington,ma,美国)和磷酸酶抑制剂混合物(5872s,cell signaling technology,danvers,ma,美国)。将样品超声处理后以14,000g离心20分钟。收集上清液作为tx不溶成分。
[0107]
免疫印迹分析
[0108]
样品浓度通过bca测定(thermo fisher scientific,waltham,ma,美国)。样品用sds-聚丙烯酰胺凝胶(12%)分离,并转到pvdf膜(bio-rad)上。在室温下,将膜用含5%bsa的tris缓冲液-tween 20(tbst)封闭1小时。将膜与一抗在4℃孵育过夜,然后相应二抗(millipore sigma,burlington,ma,美国)孵育。α-突触核蛋白抗体(1:2000,610787,bd transduction,san jose,ca,美国)作为一抗用于总α-syn蛋白检测。β-actin-peroxidase抗体(1:10000,a3854,sigma-aldrich,st louis,mo,美国)用于β-actin蛋白检测。靶抗原通过化学发光底物(thermo fisher scientific,美国马萨诸塞州沃尔瑟姆)检测,
imagequant las 4000mini扫描仪(ge healthcare life sciences,pittsburgh,pa,美国)成像。
[0109]
统计分析
[0110]
通过至少三个独立的实验,使用graphpad prism 7.0进行统计分析。统计显着性由unpaired two-tailed student’s t-test(用于比较两组)或one-way anova test with tukey’s correction(用于在多个组之间进行比较)确定。所有定量数据均表示为平均值
±
sd或sem。p值小于0.05具有显着性差异。
[0111]
实施例2:
[0112]
ptcu nas的抗氧化能力反映在它们对过氧化氢还原(类过氧化物酶和类过氧化氢酶),超氧化物歧化反应(类超氧化物歧化酶(sod))和清除自由基的催化活性中。ptcu nas可以通过两种方式加速h2o2的消耗:(i)通过类过氧化物酶活性催化h2o2还原;(ii)通过类过氧化氢酶活性催化h2o2分解(图1d)。通过将ptcu nas的类过氧化物酶活性与辣根过氧化物酶(hrp)进行比较,我们发现,像hrp一样,ptcu nas可以快速催化h2o2与3,3',5,5'-四甲基联苯胺(tmb)之间的氧化还原反应,并导致h2o2还原和tmb氧化,从而产生450nm和650nm处(图1e)的特征吸收峰。ptcu nas和hrp在剂量依赖性的活性上具有相同的趋势,4.12μg/ml ptcu nas加速h2o2氧化tmb的能力相当于1u/ml hrp(图1f)。
[0113]
过氧化氢酶是存在于大多数需氧细胞中的一种胞内酶。它能够催化h2o2分解,因此有潜力用于抵抗氧化应激。为了研究ptcu nas的类过氧化氢酶活性,我们采用紫外-可见(uv-vis-nir)吸收光谱和电子自旋共振(esr)血氧饱和度法分别监测h2o2的减少和o2的产生。与对照组相比,添加ptcu nas导致h2o2吸光度随时间显着降低,表明ptcu nas在h2o2分解中表现得像过氧化氢酶一样(图9a)。为了进一步确定是否产生了分子氧,利用esr技术,使用自旋标记分子(4-oxo-2,2,6,6-tetramethyl piperidine-d16-1-15
n-oxyl(pdt)进行测定。esr测氧法基于分子氧(o2)和自旋标记物(pdt)之间的物理碰撞检测。由于o2是顺磁性的,因此pdt分子与o2之间的碰撞会产生自旋交换,导致弛豫时间缩短,从而使pdt的esr谱线更宽,峰强度更低。自旋交换的程度取决于o2的浓度,o2的细微变化会导致esr谱线宽度的响应[35]。当混合ptcu nas和h2o2时,线宽随时间增加以及esr信号峰值强度降低表明产生了o2(图1g)。此外,h2o2的分解速率依赖于ptcu nas的浓度,随着ptcu nas的浓度从2.16μg/ml增加到21.58μg/ml,我们观察到h2o2分解速率逐渐加快(图9b)。
[0114]
sod作为一种降解超氧化物的酶,在平衡ros中起着关键作用,并作为抗氧化剂保护细胞免受超氧化物的氧化损伤。为了验证ptcu nas类sod活性,利用ko2体系在非质子传递溶剂中存在冠醚的情况下原位反应生成了超氧化物,通过硝基蓝四唑(nbt)测定法验证ptcu nas清除超氧化物的能力(图10a和10b),并通过esr技术进一步证实了其类sod活性,该方法使用5-tert-butoxycarbonyl5-methyl-1-pyrroline n-oxide(bmpo)作为超氧化物的典型自旋捕获剂。将ko2添加到含有bmpo的溶液中会产生一个很强的esr信号,这归因于bmpo/
·
ooh(图1h)。当添加sod或ptcu nas时,esr信号强度大大降低,这再次表明它们对o
2-·
的催化能力。10μg/ml ptcu nas的清除效率与5u/ml天然sod的清除效率相当,表明ptcu nas具有出色的类sod活性。此外,ptcu nas的抗氧化能力也反映在它们减少自由基的能力上。1,1-二苯基-2-三硝基苯肼(dpph)(一种广泛用于定量检测抗氧化剂能力的稳定基团)被用于评估ptcu nas的抗氧化剂活性。在测试时间内,无催化剂条件下dpph本身很稳定(图
11)。而ptcu nas和抗氧化剂都可以以时间和浓度依赖的方式有效清除dpph自由基,证明了ptcu nas的抗氧化能力(图1i和12)。抗坏血酸(aa)显示出快速的抗氧化作用,其抗氧化能力取决于浓度(图12),而ptcu nas和aa之间的抗氧化机理是完全不同的。aa通过自身的化学氧化以起到抗氧化作用,而ptcu nas通过其催化性质促进电子转移起到抗氧化作用。因此,ptcu nas可以循环使用以减少dpph直到dpph被消耗为止,但需要相当浓度的aa才能消耗dpph。
[0115]
为了研究合金成分对活性的影响,我们通过改变添加的pt
2+
/cu
2+
的摩尔比,制备了pt/cu原子比分别为1/3和3/1的ptcu纳米合金。tem图像显示,以不同pt
2+
/cu
2+
的比例制备的ptcu nas均表现出良好的分散性和均匀的形状(图13)。当ptcu比从3/1(41.5
±
5.7)变为1/3(22.2
±
2.4nm)时,粒径逐渐减小(3/1:41.5
±
5.7;1/3:22.2
±
2.4nm)(图13d)。图14总结了所测pt含量、粒径和(111)晶面间距与投料pt含量的关系。随着pt
2+
的增加,所测pt含量呈线性增加,线性关系的斜率接近1.0,表明了cu
2+
和pt
2+
完全还原形成ptcu合金nps。这些表征表明,通过改变pt
2+
/cu
2+
,可以对ptcu nas的粒径、合金成分和晶体结构进行调控。我们进一步研究了不同ptcu nas的多重类酶活性(类过氧化物酶、类过氧化氢酶和类sod)(图15)。探究发现ptcu nas的类酶活性强烈依赖于它们的化学组成,随着ptcu双金属合金中pt含量的增加,类过氧化物酶、类过氧化氢酶和类sod活性均逐渐增加。
[0116]
实施例3:ptcu nas降低了α-syn pff诱导的原代皮层神经元中ros的水平。
[0117]
为了确定ptcu nas对pff诱导的细胞中ros的清除作用,将纯化的α-syn单体聚集形成成熟原纤维(约7天),超声处理形成pff[29]。与已发表的结论一致[29],tem图像表明pff呈短纤维(约45nm),而α-syn单体没有规则结构(图11a和11b)。免疫印迹实验进一步证实了pff的聚集(图16c)。我们使用硫代黄素t(tht)测定法,验证了pff与α-syn单体相比表现出增加的tht荧光强度(图16d)。为了确定ptcu nas是否可以直接调节α-syn聚集,我们进行了原纤化实验。结果表明,在硫黄素t测定(图17a)和免疫印迹(图17b)实验中,均未观察到ptcu nas对α-syn聚集的调节作用。这些结果表明ptcu nas不能直接影响α-syn的聚集。
[0118]
将外源pff处理(10μg/ml)培养7天的小鼠原代神经元细胞。培养2天后,我们通过cm-h2dcfda试剂盒(thermo fisher scientific,waltham,ma,美国)评估了ros的水平。结构表明与pbs处理的神经元相比,pff给药后两天,神经元中的ros水平显着增加(图2a和2b),而ptcu nas处理显着降低了pff诱导产生的ros水平(图2a和2b)。该结果表明pff能够诱导原代神经元中ros的水平升高,而ptcu nas显着降低了pff诱导的ros的产生,这与非细胞系统中的实验结果一致。
[0119]
实施例4:ptcu nas降低了α-syn pff诱导的原代皮层神经元中的α-syn病理。
[0120]
将外源pff处理(10μg/ml)培养7天的小鼠原代神经元细胞。给药后7天评估α-syn病理,包括丝氨酸129位点α-syn被磷酸化(ps129)和不溶性α-syn聚集体。ps129是pd中的典型病理标志物,已被广泛用于评估α-syn病理和传播水平[7,23,29,36]。与已发表的结果一致[29],与pbs处理的神经元相比,pff处理诱导了大量的ps129免疫信号(图2c和2d)。ptcu nas处理显着降低了pff处理的神经元中ps129免疫信号(减少约50%)(图2c和2d)。
[0121]
用pff和ptcu nas处理原代神经元7天后,用1%triton x-100和2%sds提取细胞中的可溶级分和不可溶级分的α-syn,并检测α-syn水平。结果表明在pff处理的神经元中观察到大量的不溶性α-syn(图2e和2g),而ptcu nas显着降低了pff诱导的不溶性α-syn的量
sci u s a,112(2015)e5308-5317.
[0154]
https://doi.org/10.1073/pnas.1514475112
[0155]
[9]j.y.li,e.englund,j.l.holton,d.soulet,p.hagell,a.j.lees,t.lashley,n.p.quinn,s.rehncrona,a.bjorklund,h.widner,t.revesz,o.lindvall,p.brundin,nat med,14(2008)501-503.
[0156]
https://doi.org/10.1038/nm1746
[0157]
[10]j.h.kordower,y.chu,r.a.hauser,t.b.freeman,c.w.olanow,nat med,14(2008)504-506.https://doi.org/10.1038/nm1747
[0158]
[11]w.li,e.englund,h.widner,b.mattsson,d.van westen,j.latt,s.rehncrona,p.brundin,a.bjorklund,o.lindvall,j.y.li,procnatl acad sci u s a,113(2016)6544-6549.
[0159]
https://doi.org/10.1073/pnas.1605245113
[0160]
[12]j.l.guo,v.m.lee,nat med,20(2014)130-138.
[0161]
https://doi.org/10.1038/nm.3457
[0162]
[13]p.brundin,r.melki,r.kopito,nat rev mol cell biol,11(2010)301-307.https://doi.org/10.1038/nrm2873
[0163]
[14]a.aguzzi,l.rajendran,neuron,64(2009)783-790.
[0164]
https://doi.org/10.1016/j.neuron.2009.12.016
[0165]
[15]f.clavaguera,t.bolmont,r.a.crowther,d.abramowski,s.frank,a.probst,g.fraser,a.k.stalder,m.beibel,m.staufenbiel,m.jucker,m.goedert,m.tolnay,nat cell biol,11(2009)909-913.
[0166]
https://doi.org/10.1038/ncb1901
[0167]
[16]s.porta,y.xu,c.r.restrepo,l.k.kwong,b.zhang,h.j.brown,e.b.lee,j.q.trojanowski,v.m.lee,nat commun,9(2018)4220.https://doi.org/10.1038/s41467-018-06548-9
[0168]
[17]m.s.feiler,b.strobel,a.freischmidt,a.m.helferich,j.kappel,b.m.brewer,d.li,d.r.thal,p.walther,a.c.ludolph,k.m.danzer,j.h.weishaupt,j cell biol,211(2015)897-911.
[0169]
https://doi.org/10.1083/jcb.201504057
[0170]
[18]e.paxinou,q.chen,m.weisse,b.i.giasson,e.h.norris,s.m.rueter,j.q.trojanowski,v.m.lee,h.ischiropoulos,j neurosci,21(2001)8053-8061.
[0171]
[19]o.scudamore,t.ciossek,j neuropathol exp neurol,77(2018)443-453.https://doi.org/10.1093/jnen/nly024
[0172]
[20]r.e.musgrove,m.helwig,e.j.bae,h.aboutalebi,s.j.lee,a.ulusoy,d.a.di monte,j clin invest,130(2019)3738-3753.
[0173]
https://doi.org/10.1172/jci127330
[0174]
[21]k.c.luk,j clin invest,129(2019)3530-3531.
[0175]
https://doi.org/10.1172/jci130351
[0176]
[22]a.l.mccormack,m.thiruchelvam,a.b.manning-bog,c.thiffault,
j.w.langston,d.a.cory-slechta,d.a.di monte,neurobioldis,10(2002)119-127.https://doi.org/10.1006/nbdi.2002.0507
[0177]
[23]t.i.kam,x.mao,h.park,s.c.chou,s.s.karuppagounder,g.e.umanah,s.p.yun,s.brahmachari,n.panicker,r.chen,s.a.andrabi,c.qi,g.g.poirier,o.pletnikova,j.c.troncoso,l.m.bekris,j.b.leverenz,a.pantelyat,h.s.ko,l.s.rosenthal,t.m.dawson,v.l.dawson,science,362(2018).https://doi.org/10.1126/science.aat8407
[0178]
[24]h.t.tran,c.h.chung,m.iba,b.zhang,j.q.trojanowski,k.c.luk,v.m.lee,cell rep,7(2014)2054-2065.
[0179]
https://doi.org/10.1016/j.celrep.2014.05.033
[0180]
[25]k.yanamandra,n.kfoury,h.jiang,t.e.mahan,s.ma,s.e.maloney,d.f.wozniak,m.i.diamond,d.m.holtzman,neuron,80(2013)402-414.https://doi.org/10.1016/j.neuron.2013.07.046
[0181]
[26]h.asai,s.ikezu,s.tsunoda,m.medalla,j.luebke,t.haydar,b.wolozin,o.butovsky,s.kugler,t.ikezu,nat neurosci,18(2015)1584-1593.https://doi.org/10.1038/nn.4132
[0182]
[27]r.shaltiel-karyo,m.frenkel-pinter,n.egoz-matia,a.frydman-marom,d.e.shalev,d.segal,e.gazit,plos one,5(2010)e13863.https://doi.org/10.1371/journal.pone.0013863
[0183]
[28]r.gordon,e.a.albornoz,d.c.christie,m.r.langley,v.kumar,s.mantovani,a.a.b.robertson,m.s.butler,d.b.rowe,l.a.o'neill,a.g.kanthasamy,k.schroder,m.a.cooper,t.m.woodruff,sci transl med,10(2018).https://doi.org/10.1126/scitranslmed.aah4066
[0184]
[29]x.mao,m.t.ou,s.s.karuppagounder,t.i.kam,x.yin,y.xiong,p.ge,g.e.umanah,s.brahmachari,j.h.shin,h.c.kang,j.zhang,j.xu,r.chen,h.park,s.a.andrabi,s.u.kang,r.a.goncalves,y.liang,s.zhang,c.qi,s.lam,j.a.keiler,j.tyson,d.kim,n.panicker,s.p.yun,c.j.workman,d.a.vignali,v.l.dawson,h.s.ko,t.m.dawson,science,353(2016).
[0185]
https://doi.org/10.1126/science.aah3374
[0186]
[30]l.a.volpicelli-daley,k.c.luk,t.p.patel,s.a.tanik,d.m.riddle,a.stieber,d.f.meaney,j.q.trojanowski,v.m.lee,neuron,72(2011)57-71.https://doi.org/10.1016/j.neuron.2011.08.033
[0187]
[31]s.kim,s.h.kwon,t.i.kam,n.panicker,s.s.karuppagounder,s.lee,j.h.lee,w.r.kim,m.kook,c.a.foss,c.shen,h.lee,s.kulkarni,p.j.pasricha,g.lee,m.g.pomper,v.l.dawson,t.m.dawson,h.s.ko,neuron,(2019).https://doi.org/10.1016/j.neuron.2019.05.035
[0188]
[32]d.kim,j.m.yoo,h.hwang,j.lee,s.h.lee,s.p.yun,m.j.park,m.lee,s.choi,s.h.kwon,s.lee,s.h.kwon,s.kim,y.j.park,m.kinoshita,y.h.lee,s.shin,s.r.paik,s.j.lee,s.lee,b.h.hong,h.s.ko,nat nanotechnol,13(2018)812-818.
[0189]
https://doi.org/10.1038/s41565-018-0179-y
[0190]
[33]w.he,y.t.zhou,w.g.wamer,x.hu,x.wu,z.zheng,m.d.boudreau,j.j.yin,biomaterials,34(2013)765-773.
[0191]
https://doi.org/10.1016/j.biomaterials.2012.10.010
[0192]
[34]c.liu,y.yan,x.zhang,y.mao,x.ren,c.hu,w.he,j.yin,nanoscale,(2020).https://doi.org/10.1039/c9nr10135g
[0193]
[35]w.he,y.liu,w.g.wamer,j.j.yin,j food drug anal,22(2014)49-63.https://doi.org/10.1016/j.jfda.2014.01.004
[0194]
[36]h.fujiwara,m.hasegawa,n.dohmae,a.kawashima,e.masliah,m.s.goldberg,j.shen,k.takio,t.iwatsubo,nat cell biol,4(2002)160-164.https://doi.org/10.1038/ncb748
[0195]
[37]h.j.kwon,d.kim,k.seo,y.g.kim,s.i.han,t.kang,m.soh,t.hyeon,angew chem int ed engl,57(2018)9408-9412.
[0196]
https://doi.org/10.1002/anie.201805052
[0197]
[38]n.singh,m.a.savanur,s.srivastava,p.d'silva,g.mugesh,angew chem int ed engl,56(2017)14267-14271.
[0198]
https://doi.org/10.1002/anie.201708573
[0199]
[39]c.hao,a.qu,l.xu,m.sun,h.zhang,c.xu,h.kuang,j am chem soc,141(2019)1091-1099.https://doi.org/10.1021/jacs.8b11856
[0200]
[40]d.furtado,m.bjornmalm,s.ayton,a.i.bush,k.kempe,f.caruso,adv mater,30(2018)e1801362.
[0201]
https://doi.org/10.1002/adma.201801362
[0202]
[41]g.chandra,a.roy,s.b.rangasamy,k.pahan,j immunol,198(2017)4312-4326.https://doi.org/10.4049/jimmunol.1700149
[0203]
[42]g.halliday,m.t.herrero,k.murphy,h.mccann,f.ros-bernal,c.barcia,h.mori,f.j.blesa,j.a.obeso,mov disord,24(2009)1519-1523.https://doi.org/10.1002/mds.22481
[0204]
[43]y.b.hu,e.b.dammer,r.j.ren,g.wang,transl neurodegener,4(2015)18.https://doi.org/10.1186/s40035-015-0041-1
[0205]
[44]x.zhang,y.liu,s.gopalakrishnan,l.castellanos-garcia,g.li,m.malassine,i.uddin,r.huang,d.c.luther,r.w.vachet,v.m.rotello,acs nano,14(2020)4767-4773.https://doi.org/10.1021/acsnano.0c00629
[0206]
[45]y.zhang,j.hao,x.xu,x.chen,j.wang,anal chem,92(2020)2080-2087.https://doi.org/10.1021/acs.analchem.9b04593
[0207]
[46]z.zhang,m.l.jorgensen,z.wang,j.amagat,y.wang,q.li,m.dong,m.chen,biomaterials,253(2020)120108.
[0208]
https://doi.org/10.1016/j.biomaterials.2020.120108
[0209]
[47]h.xiang,w.feng,y.chen,adv mater,32(2020)e1905994.https://doi.org/10.1002/adma.201905994
[0210]
[48]h.zhang,x.f.lu,z.-p.wu,x.w.d.lou,acs cent.sci.,(2020).https://doi.org/doi:10.1021/acscentsci.0c00512
[0211]
其他实施方式
[0212]
尽管已经结合本发明的细节描述了本发明,但是前述描述旨在说明而不是限制本发明的范围,本发明的范围由所附权利要求的范围限定。其他方面,优点和修改在所附权利要求的范围内。
[0213]
本文所指的专利和科学文献建立了本领域技术人员可获得的知识。本文引用的所有参考文献,例如美国专利,美国专利申请公开,指定美国的pct专利申请,已公开的外国专利和专利申请均通过引用全文并入本文。由本文引用的登录号指示的genbank和ncbi提交的文献通过引用并入本文。本文引用的所有其他公开的参考文献,文件,手稿和科学文献均通过引用并入本文。在发生冲突的情况下,以本说明书包括定义为准。另外,材料,方法和实施例仅是说明性的,不是限制性的。
[0214]
尽管已经参考本发明的优选实施例具体示出和描述了本发明,但是本领域技术人员将理解,在不脱离所附权利要求书所涵盖的本发明范围的情况下,可以在形式和细节上进行修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1