可将组合药物按比例递送至肿瘤组织的大环两亲自组装纳米颗粒的制备方法和应用与流程
[0001]
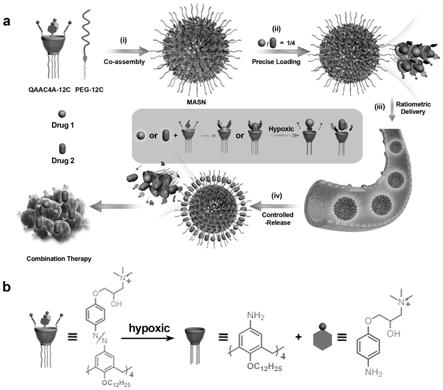
本发明属于生物医药领域,涉及一种可将组合药物按比例递送至肿瘤组织的大环两亲自组装纳米颗粒的制备方法和应用。
背景技术:
[0002]
临床上对联合化疗已经进行了广泛的研究,用以提高疗效并减少副作用。对于大多数组合化学疗法,组合中药物或活性成分的比例是一个关键参数,通常决定药物是协同作用还是拮抗作用。随着临床相关癌细胞系的发展,现在有可能通过体外研究快速确定联合化疗中药物的最佳比例,以实现有效的协同作用。然而,在体外发现的这种协同作用并不总是转化为临床益处,特别是对于传统的“鸡尾酒”疗法。由于药物的药代动力学和生物分布不同,使用“鸡尾酒”疗法几乎不可能在目标部位维持最佳药物配比。为了解决这些问题,已经开发了几种纳米载体(包括脂质体,胶束和聚合物纳米颗粒)来共同递送药物组合。这些策略有效地统一了负载药物的药代动力学和生物分布。然而,当前的纳米载体通常缺乏在药物加载和递送过程中精确控制药物比例的机制,导致批次间的差异。而且,这种不精确的比例控制所带来的不确定性导致药物组合的协同作用低下,并且在癌症治疗中的疗效无法预测。因此,迫切需要一种创新的递送策略用以有效的组合治疗,该策略需满足以下条件:1)精确加载多种药物;2)按比例递送多种药物至靶标;3)具有批次间重复性。
[0003]
在过去的几十年中,包括环糊精,杯芳烃,葫芦脲和柱芳烃在内的一系列大环分子在生物医学应用中受到越来越多的关注。这些大环分子通常用作药物输送中的分子容器,以提高药物溶解度,增强药物稳定性并减少副作用。与纳米载体不同,大环分子具有明确的分子结构,精确的空腔尺寸和分子量,因此可以通过严格的质量控制来保证批次间的一致性。而且,这些大环宿主通过主客体相互作用以特定的化学计量比(大多数为1:1)和特征性结合亲和力装载药物,从而可实现在给定浓度下对药物定量装载。但是,这种1:1的宿主-客体化学计量关系使得单个大环宿主无法对多种药物进行组装,从而限制了它们在联合化疗中的应用。因此,开发出一种可以精确加载多种药物的策略对于将基于大环的载体应用于联合化疗中至关重要。
技术实现要素:
[0004]
本发明目的是解决传统纳米载体无法将多药按比例递送至肿瘤组织的问题,提供一种可将组合药物按比例递送至肿瘤组织的大环两亲自组装纳米颗粒的制备方法和应用。
[0005]
本发明的技术方案:
[0006]
一种可将组合药物按比例递送至肿瘤组织的大环两亲的自组装纳米颗粒(masn),是通过将大环两亲化合物季铵改性的偶氮杯[4]芳烃十二烷氧基醚(qaac4a-12c)和4-(十二烷基氧基)苯甲酰胺基封端的甲氧基聚乙二醇(peg-12c)在水溶液中共组装的方式制备而成,能够精确负载至少两种药物活性物质。其中构筑单元qaac4a-12c的化学式为
ar),1.44
–
1.21(m,72h,alkyl ch2),0.80(t,j=8.0hz,12h,-ch3)ppm.
[0016]
13
c nmr(100mhz,meod,δ):209.09,159.70,158.80,148.07,146.04,135.38,124.20,122.68,115.28,75.50,31.85,31.12,30.39,29.96,29.84,29.75,29.66,29.33,26.45,22.51,13.48ppm.
[0017]
ms(maldi-tof):[m+na-h]
+
:m/z calcd.for(c
100
h
136
n8nao
8+
):1600.04,found1600.15.
[0018]
将上述制备的化合物2溶解在异丙醇溶液中,然后按照摩尔比60:1加入缩水甘油基三甲基氯化铵。将该混合物回流18小时,并真空除去溶剂。停止加热并在室温下搅拌2小时。获得黄色沉淀物(如果仍为澄清液体,则在冰水浴中搅拌10分钟),然后用异丙醇萃取,最后得到黄色沉淀物-化合物3(qaac4a-12c),产率为80%。得到的1h nrm,
13
c nmr和ms数据如下:
[0019]1h nmr(400mhz,dmso-d6,δ):7.61(d,j=8.0hz,8h,ar-h),7.29(s,8h,calix-h),6.92(d,j=8.0hz,8h,ar-h),6.05(d,j=4.0hz,4h,-ch
2-ch(oh)-),4.50(m,8h,ar-ch
2-ar),4.01(m,8h,-o-ch
2-ch(oh)-),3.54(m,8h,-n-ch
2-),3.19(s,36h,n-ch3),1.97(m,8h,-ch2-ch2-o-ar),1.48
–
1.25(m,72h,alkyl ch2),0.84(t,j=8.0hz,12h,-ch3)ppm.
[0020]
13
c nmr(100mhz,dmso-d6,δ):207.11,160.94,159.40,147.83,146.81,135.81,124.51,122.98,115.31,75.63,70.99,68.15,64.23,53.94,32.06,31.16,30.48,30.18,29.99,29.91,29.78,29.41,26.59,22.71,14.30.
[0021]
ms:[m]
4+
:m/z:calcd.for(c
124
h
192
n
12
o
124+
):510.62,found 510.6195.
[0022]
本发明提供的可将组合药物按比例递送至肿瘤组织的大环两亲自组装纳米颗粒可以作为乏氧响应载药平台应用于药物的递送中。所述纳米颗粒可以与适当的活性药物分子一起制成相应的药物组合物,适于工业应用。
[0023]
本发明的优点和有意效果:
[0024]
基于大环两亲的自组装纳米颗粒(masn)是通过将大环两亲化合物季铵改性的偶氮杯[4]芳烃十二烷氧基醚(qaac4a-12c)和4-(十二烷基氧基)苯甲酰胺基封端的甲氧基聚乙二醇(peg-12c)在水溶液中共组装的方式制备。这种自组装的结构将多个大环腔整合到单个纳米颗粒中,从而使masn能够通过宿主与客体的相互作用加载多个药物分子。qaac4a-12c是一种特殊设计的大环两亲物,在低氧条件下比在常氧条件下对一系列化疗药物的结合亲和力低得多。qaac4a-12c在常氧条件下的强键合,使得masn可以精确地加载多种药物,并且可以通过药物的初始浓度和药物分子与qaac4a-12c之间的特征结合亲和力来预测所加载药物的比例。此外,这种强大的结合亲和力还避免了血液循环和正常组织中不希望的有效载荷泄漏。当到达肿瘤时,masn的qaac4a-12c被缺氧肿瘤微环境中存在的生物还原酶还原,导致结合亲和力急剧下降以及负载药物的自发释放。通过精确的药物加载和控释机制,masn实现了按比例分配多种药物至肿瘤的治疗,显示了作为联合化疗的多药共递送平台的潜力。在这项工作中,由于非重叠细胞毒性和互补作用,使用了包括甲氨蝶呤/苯丁酸氮芥和紫杉醇/nlg919在内的两种不同药物组合。masn以体外确定的最佳药物比例将药物组合共同递送至肿瘤,从而在小鼠中获得增强的抗肿瘤作用。这些结果表明masn具备将体外鉴定的药物协同作用转化为临床益处的能力,为快速开发涉及多种分子药物的有效联合癌症疗法提供了潜在平台。
附图说明
[0025]
图1为qaac4a-12c的合成示意图。
[0026]
图2为masn的结构表征,a显示masn的粒径大小;b显示masn的zeta电位(hepes,10mm,ph=7.4)。
[0027]
图3为铝酞菁与qaac4a-12c的滴定曲线,a显示25℃下,hepes缓冲溶液中(10mm,ph=7.4),铝酞菁与qaac4a-12c的荧光滴定曲线(λ
ex
=606nm);b显示铝酞菁与qaac4a-12c的键合常数拟合曲线,由主客体1:1竞争键合模型进行拟合(λ
em
=679nm)。
[0028]
图4为荧光素钠与qaac4a-12c的滴定曲线,a显示25℃下,hepes缓冲溶液中(10mm,ph=7.4),荧光素钠与qaac4a-12c的荧光滴定曲线(λ
ex
=500nm);b显示荧光素钠与qaac4a-12c的键合常数拟合曲线,由主客体1:1竞争键合模型进行拟合(λ
em
=513nm)。
[0029]
图5显示25℃下,hepes缓冲溶液中(10mm,ph=7.4),铝酞菁与masn的荧光回复;插图显示alpcs4,masn-alpcs4在pbs中及masn-alpcs4在小鼠血清中的荧光图片。
[0030]
图6为masn的乏氧响应性,a显示加入sdt前后,qaac4a-12c的紫外吸收曲线;b显示加入不同浓度sdt后,masn-fl的荧光曲线。
[0031]
图7显示加入还原型烟碱酰胺腺嘌呤二核苷酸磷酸(nadph)和心肌黄酶(dt-diaphorase)后,masn在乏氧(a)和常氧(b)条件下的紫外变化。
[0032]
图8为masn的细胞毒性,a显示cck-8法细胞毒性实验中,不同浓度的masn对于4t1细胞存活率的影响的图;b显示cck-8法细胞毒性实验中,不同浓度的masn对于b16f10细胞存活率的影响的图。
[0033]
图9显示cck-8法细胞毒性实验中,不同浓度的mtx、masn-mtx在常氧乏氧条件下对于细胞存活率的影响的图。
[0034]
图10显示4t1细胞中加入ptx、masn-mtx在常氧乏氧条件下诱导crt蛋白外翻的流式及共聚焦图。
[0035]
图11显示4t1细胞中加入ptx、masn-mtx在常氧乏氧条件下诱导高迁移率组蛋白hmgb-1外流的共聚焦图。
[0036]
图12显示4t1细胞中加入ptx、masn-mtx在常氧乏氧条件下诱导atp外流的图。
[0037]
图13显示alpcs4和masn-alpcs4两组小鼠活体及离体的荧光成像照片。
[0038]
图14为masn比例递送ptx及nlg919至肿瘤组织图,a、b显示ptx和nlg919相较于dtx的标准曲线图;c显示pn-1/4、pn-4/1、lipo-pn-1/4、lipo-pn-4/1、masn-pn-1/4和masn-pn-4/1给药后小鼠肿瘤组织中ptx和nlg919的富集总量;d显示pn-1/4、pn-4/1、lipo-pn-1/4、lipo-pn-4/1、masn-pn-1/4和masn-pn-4/1给药后小鼠肿瘤组织中ptx和nlg919的摩尔比。
[0039]
图15为masn的抑瘤效果图,a显示pbs、mc、masn-mtx、masn-chl和masn-mc给药后各组小鼠的瘤子体积变化;b显示pbs、mc、masn-mtx、masn-chl和masn-mc给药后各组小鼠的瘤子重量;c显示pbs、mc、masn-mtx、masn-chl和masn-mc给药后各组小鼠的体重变化。
[0040]
图16显示各组小鼠肿瘤的tunle、h&e和pcna染色的共聚焦显微镜照片。
[0041]
图17为masn在免疫组合疗法中的应用,a显示pbs、pn-med、pn-opt、masn-ptx、masn-nlg919、masn-pn-med和masn-pn-opt给药后各组小鼠的瘤子体积变化;b显示pbs、mc、masn-mtx、masn-chl和masn-mc给药后各组小鼠的生存曲线;c显示pbs、mc、masn-mtx、masn-chl和masn-mc给药后各组小鼠的体重变化。
[0042]
图18为masn调控t细胞浸润图,a显示各组小鼠肿瘤中的t细胞浸润共聚焦图;b显示各组小鼠肿瘤中的t细胞浸润流式图。
[0043]
图19为masn调控t细胞活性及apc成熟图,a显示pbs、pn-med、pn-opt、masn-ptx、masn-nlg919、masn-pn-med和masn-pn-opt给药后各组小鼠肿瘤中ifn-γ
hi
cd45
+
cd8
+
的比例;b显示pbs、pn-med、pn-opt、masn-ptx、masn-nlg919、masn-pn-med和masn-pn-opt给药后各组小鼠肿瘤中ki67
hi
cd45
+
cd3
+
的比例;c显示pbs、pn-med、pn-opt、masn-ptx、masn-nlg919、masn-pn-med和masn-pn-opt给药后各组小鼠肿瘤中cd86
hi
cd80
+
cd45
+
的比例。
具体实施方式
[0044]
实施例1:大环两亲自组装纳米颗粒(masn)的制备
[0045]
1)qaac4a-12c的合成(如图1所示)
[0046]
首先将氨基杯芳烃-12碳(化合物1)溶解在四氢呋喃溶液中,随后按体积比1:0.9加入1摩尔的盐酸水溶液;随后通过注射器缓慢加入预冷至0度的亚硝酸钠的水溶液,其中亚硝酸钠与氨基杯芳烃-12碳的摩尔比为7:1,室温反应1h;将苯酚溶解在吡啶溶液中并于0度条件下缓慢加入以上得到的混合液中,室温反应16h后,将反应液导入水溶液中,沙漏抽滤收取沉淀物并用分液漏斗水洗,随后用柱层析进行提纯,有机相为体积比40:1的二氯甲烷和甲醇的混合液,得到黄色产物-化合物2,产率为20%;
[0047]
将上述化合物2溶解在异丙醇溶液中,然后按照摩尔比60:1加入缩水甘油基三甲基氯化铵,将该混合物回流18小时,并真空除去溶剂;停止加热并在室温下搅拌2小时,获得黄色沉淀物,然后用异丙醇萃取,最后得到黄色沉淀物化合物3(qaac4a-12c),产率为80%。
[0048]
2)将qaac4a-12c和peg-12c以摩尔比1:1在hepes水溶液中60-80℃超声水合制备得到大环两亲自组装纳米颗粒(masn)。结果如图2所示,masn大小为135.4
±
13.7nm,zeta电位为2.92
±
0.62mv。
[0049]
实施例2:偶氮杯芳烃qaac4a-12c与药物分子键合常数的测定
[0050]
测试方法:荧光滴定法。
[0051]
测试工具:测试选用石英比色皿为样品池,测试光路10mm,仪器型号为varian cary eclipse,配有型号为cary single-cuvette peltier的比色皿控温装置。
[0052]
试剂:荧光素钠(fl)购置于上海毕得医药科技有限公司
[0053]
alpcs4购置于北京安诺轮生物科技有限公司
[0054]
紫杉醇购置于大连美仑生物技术有限公司。
[0055]
苯丁酸氮芥,甲氨蝶呤,nlg919购置于美国默克公司。
[0056]
qaac4a-12c和光致发光分子的荧光滴定实验均在室温(25℃)进行。首先配制qaac4a-12c、alpcs4、fl的母液,将其分别溶于4-(2-羟乙基)-1-哌嗪乙磺酸缓冲溶液(hepes,10mm,ph=7.4)中,配置浓度均为100μm。测试时先将qaac4a-fl(0.5/0.3μm)荧光传感对配置于荧光池内,hepes定容到体积2.5ml。将活性药物分子溶于hepes缓冲液中(10mm,ph=7.4),配置浓度100μm,并向其加入荧光传感对,使荧光传感对浓度与荧光池内一致,hepes定容至1ml。随后将活性药物分子溶液以预定体积加入荧光池内,记录荧光强度变化。荧光滴定数据由主客体1:1竞争键合模型进行拟合,测定主客体包结的键合常数ka。结果参见图3和图4。
eclipse,配有型号为cary single-cuvette peltier的比色皿控温装置。测试选用石英比色皿为样品池,测试光路10mm。
[0073]
实验步骤:首先配制qaac4a-12c,fl的母液,将其分别溶于hepes缓冲溶液(10mm,ph=7.4)中,配制浓度均为100μm。取qaac4a-12c母液稀释到10μm,体积2.5ml,测试400nm处紫外吸收随时间变化,3分钟时加入2.0mm sdt,测试结果如图6中a所示。图6中a是qaac4a-12c紫外吸收随时间变化曲线。从图6中a看出,加入sdt后,qaac4a-12c中偶氮键对应的紫外吸收随时间逐渐下降,说明qaac4a-12c能被sdt还原,具有乏氧响应性。
[0074]
取qaac4a-12c,fl母液,配制masn-fl(2/2μm)的溶液,hepes定容至2.5ml,测试荧光光谱。随后加入0-1400μm sdt,再次测试荧光光谱。如图6中b所示:随着sdt浓度的提高,fl的荧光恢复,说明fl被从qaac4a-12c空腔释放出来。
[0075]
实施例5:乏氧响应验证-酶还原反应实验
[0076]
测试方法:紫外-可见分光光谱法。
[0077]
测试工具:日本岛津uv-3600紫外-可见分光光度计,配有控温模块(型号:ptc-348wi),测试样品选用岛津自带石英比色皿,光程10mm。
[0078]
试剂及其来源:
[0079]
还原型辅酶ii(nadph)购置于北京伊诺凯科技有限公司。
[0080]
dt-硫辛酰胺脱氢酶(dt-diaphorase)购置于西格玛奥德里奇(上海)贸易有限公司。
[0081]
实验步骤:首先配制masn、dt-硫辛酰胺脱氢酶、nadph的母液,将其溶于磷酸盐缓冲溶液(pbs,10mm,ph=7.4)中,配制浓度均为100μm。分别取masn、dt-硫辛酰胺脱氢酶、nadph母液,配制体积2.5ml含2μm masn、1.0μm dt-硫辛酰胺脱氢酶、50μm nadph的试样。然后将试样转移到荧光池内,向其鼓吹氮气,除氧气,营造乏氧条件,测试不同时刻下的紫外吸收,测试结果如图7所示。masn中偶氮键对应的紫外吸收随时间逐渐下降,而常氧条件下偶氮键对应的紫外吸收随时间无明显变化。说明组成masn的qaac4a-12c中的偶氮键能被dt-硫辛酰胺脱氢酶和nadph在乏氧条件下特异性还原,具有乏氧响应性。
[0082]
实施例6:masn的毒性实验
[0083]
测试方法:cck-8法进行细胞毒性实验。
[0084]
试剂及其来源:
[0085]
鼠源4t1乳腺癌细胞,b16f10黑色素瘤细胞购置于天津益博恒泰生物科技有限公司。
[0086]
胎牛血清(fbs)和dmem培养基购置于美国thermo fisher scientific公司。
[0087]
cck-8购置于日本同仁公司。
[0088]
青霉素链霉素购置于天津百赛斯生物科技有限公司。
[0089]
实验步骤:
[0090]
1、培养基使用dmem,加有10%fbs和1%青霉素链霉素。将癌细胞置于37℃、5%co2细胞培养箱中孵育,每次在实验之前,将细胞预培养直至达到汇合。收集4t1对数期细胞,调整细胞悬液浓度,每孔加入100μl,铺板使待测细胞调密度至10000每孔,边缘孔用无菌pbs填充。
[0091]
2、在5%co2,37℃下孵育,至细胞单层铺满孔底(96孔平底板),加入浓度梯度的
masn(1μm、2μm、4μm、8μm、16μm)。
[0092]
3、常氧条件:将96孔板置于5%co2,37℃培养箱中培养24小时。乏氧条件:将96孔板置于乏氧小室,通入5%co2,94%n2,1%o2混合气体,随后关闭进气口和出气口,将其置于37℃培养箱中培养24小时。
[0093]
4、小心吸去孔内培养液,每孔加入100ul新鲜配置的cck-8工作液(1/9,v/v),继续培养1.5小时。
[0094]
5、终止培养。在酶联免疫检测仪od 450nm处测量各孔的吸光值。细胞存活率可以通过下面的公式计算得到:细胞存活率=(od
450
(samples)/(od
450
(control)
×
100%。
[0095]
从图8的cck-8法细胞毒性结果看出,masn载体在常氧/乏氧条件下均无明显细胞毒性。
[0096]
实施例7:masn-mtx和mtx在常氧和乏氧条件下的毒性实验
[0097]
按照与实施例5相同的方式进行实验,结果参见图9。
[0098]
图9中,浓度表示mtx的浓度(10,30,50,70,90nm),masn-mtx组中masn与mtx的浓度比为2:1。从图9的细胞毒性看出,常氧条件下,包合物masn-mtx细胞毒性降低。乏氧条件下,包合物masn-mtx细胞毒性比常氧条件的下细胞毒性大,说明包合物masn-mtx具有乏氧释放的特性。
[0099]
实施例8:masn-ptx在常氧和乏氧条件下诱导肿瘤免疫原性死亡
[0100]
肿瘤免疫原性死亡(icd)的特征在于细胞凋亡前钙网蛋白(crt)外翻,细胞凋亡后高迁移率族盒1(hmgb-1)的外流以及atp的分泌
[0101]
crt的外翻和hmgb-1的外流通过流式细胞仪和免疫荧光两种方式进行表征。
[0102]
流式细胞仪:将4t1细胞以2
×
104细胞/孔的密度接种在12孔板中过夜,然后向细胞中加入20μm的ptx或masn-ptx,常氧或乏氧培养24h。接下来,将细胞用冷pbs洗涤两次,然后根据供应商的操作步骤将细胞与结合了atto488的crt抗体一起孵育用于流式细胞仪检测。
[0103]
免疫荧光:将4t1细胞以1
×
105细胞/孔的密度接种在35mm共聚焦培养皿(ф=15mm)中过夜,然后向细胞中加入2μm的ptx或masn-ptx,常氧或乏氧培养24h。孵育后,将细胞用冷pbs冲洗,并在室温下用4%多聚甲醛固定15分钟,pbs洗去多聚甲醛后与5%fbs孵育30分钟以实现对非特异性结合位点的阻断。室温下与一抗孵育1h,然后与pbs洗涤3次后,与alexa594偶联的单克隆二抗孵育30分钟。最后,将细胞用4',6-二脒基-2-苯基吲哚(dapi)染色并通过clsm观察。
[0104]
atp的细胞外分泌水平用市售的atp测定试剂盒测定。将4t1细胞以2
×
104细胞/孔的密度接种到24孔板中过夜,然后向细胞中加入20μm的ptx或masn-ptx,常氧或乏氧培养24h。收集细胞培养上清液,并根据制造商的说明使用atp分析试剂盒测试atp含量。
[0105]
如图10,图11,图12所示,乏氧条件下,masn-ptx与ptx处理的细胞表面crt升高,hmgb-1下调,atp升高,表明masn可在乏氧条件下特性诱导icd的产生。
[0106]
实施例9:masn-alpcs4活体成像
[0107]
选取雌性6-8周balb/c裸鼠(购买于北京维通利华公司)。将1
×
1064t1癌细胞皮下注射到balb/c裸鼠的左乳脂垫中。待肿瘤生长至200mm3,将荷瘤小鼠随机分为两组,尾静脉注射200μlalpcs4和masn-alpcs4,给药剂量按0.89mg
·
kg-1
alpcs4。在注射后1、3、6、12和24
小时麻醉小鼠并通过ivis lumina成像系统成像。并在注射24小时后处死小鼠,收集肿瘤以及主要器官(脾,肾,肺,肝,心脏和肠道),然后进行离体成像。
[0108]
如图13所示,仅从注射masn-alpcs4的小鼠肿瘤中可以观察到荧光信号,且荧光信号的强度随时间增强并在12h达到最大值,表明masn仅在肿瘤组织响应性释放了alpcs4。相比之下,注射游离alpcs4的小鼠的肿瘤部位荧光分布则不清晰,且荧光较弱。从离体成像中也观察到了相似的结果(图13中b)。因此,可以肯定地说masn可以有效地将负载的药物递送至肿瘤组织。
[0109]
实施例10:masn将多药比率递送至肿瘤组织
[0110]
在该项研究中,我们选择ptx和nlg919作为模型药物。然后将ptx和nlg919以摩尔比为1:4或4:1负载入masn中(300μm,pn-1/4=60μm/240μm;pn-4/1=240μm/60μm),用以制备与masn-pn-1/4和masn-pn-4/1。为了更好地进行比较,使用聚乙二醇化脂质体制备了lipo-pn-4/1和lipo-pn-1/4作为比较组。
[0111]
聚乙二醇化脂质体制备方法:聚乙二醇化脂质体由1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](peg2000-dspe),胆固醇和氢化的l-α-磷脂酰胆碱制成(hspc)。具体说来,首先将胆固醇,peg2000-dspe和hspc溶解在氯仿中,制备浓度分别为3.73mg/ml,3.73mg/ml和11.17mg/ml储存液。将ptx和nlg919溶解在甲醇中,分别得到浓度为1.28mg/ml(1.5mm)和0.423mg/ml(1.5mm)的溶液。然后,通过混合250μlpeg2000-dspe,250μlhspc,250μl胆固醇,480μlptx,120μlnlg919和1650μl氯仿,制备含有ptx和nlg919的脂质膜。用旋转蒸发仪干燥溶液,并在真空中进一步干燥过夜。然后将脂质膜重新溶解在3ml pbs中,从而形成lipo-pn-4/1。通过混合250μl peg2000-dspe,250μlhspc,250μl胆固醇,120μlptx,480μlnlg919和1650μl氯仿,类似地制备lipo-pn-1/4。
[0112]
选取雌性6-8周balb/c裸鼠(购买于北京维通利华公司)。将1
×
1064t1癌细胞皮下注射到balb/c裸鼠的左乳脂垫中。待肿瘤生长至500mm3,将荷瘤小鼠随机分为六组(n=4),并静脉注射200μl masn-pn-1/4,masn-pn-4/1,lipo-p/n(1/4),lipo-p/n(4/1),pn-1/4和pn-4/1。注射后24小时处死小鼠,然后收集0.5g肿瘤组织并用gentlemacs解离器匀浆。用等体积的甲醇提取肿瘤组织中的ptx和nlg919。通过以12000rpm离心15分钟除去水溶性蛋白质,收集上清液,并用eppendorfplus旋转蒸发。残留物用甲醇调节至等体积,然后通过以12000rpm离心15分钟进一步除去水溶性蛋白质以及其他杂质或盐。收集上清液并过220nm有机相滤膜,然后加入多西紫杉醇作为内标(终浓度为500nm)以进行超高效液相色谱串联质谱分析(uplc-ms/ms)(waters apgc/uplc xevo tq-s,acquityuplc beh c18色谱柱(1.7μm,2.1mm
×
100mm,50℃)测定。色谱分离是通过由乙腈和水(含0.2%甲酸,v/v)组成的流动相进行的,梯度洗脱范围为5:95至100:0(乙腈/水,v/v)。流动相的流速设置为0.3ml min-1
,进样量为5μl。对于dtx:在34v电压下为m/z 808.8
→
m/z 527.4。对于ptx:在14v电压下m/z 854.2
→
m/z 569.5,m/z 854.2
→
m/z 286.2和m/z 854.2
→
m/z 105.2。对于nlg919,在40v电压下为m/z 283
→
m/z 103和m/z 283
→
m/z 95。根据每组的相应浓度确定ptx和nlg919分别达到250nm至15.625nm的标准曲线。
[0113]
我们根据牛顿-拉夫森算法三次方程,通过键合常数和1:1的键合模式确定masn-pn-1/4和masn-pn-4/1中ptx与nlg919的负载比分别为1/4.09和3.91/1。用uplc-ms/ms测定的lipo-pn-1/4和lipo-pn-4/1中ptx与nlg919的负载比为1/0.92和2.65/1。如图14所示,相
对于ptx和nlg919混合物,masn和脂质体均改善了ptx和nlg919的肿瘤蓄积,分别增加了12.2倍和4.75倍。但是,注射了lipo-pn-1/4和lipo-pn-4/1的小鼠在肿瘤中显示出的ptx与nlg919的摩尔比与负载药物的初始比不同。相比之下,masn则将ptx和nlg919按负载比例递送至肿瘤组织,其中用masn-pn-1/4和masn-pn-4/1治疗的小鼠在肿瘤中的药物比率为1/4.14和4.09/1。该结果表明masn能够按比例地将多种药物按比例递送至肿瘤的能力,这为masn作为涉及多种药物的联合化疗的理想递送平台提供了巨大的潜力。
[0114]
实施例11:masn优化组合治疗的抗肿瘤功效
[0115]
将1x106个4t1细胞原位注射到6-8周的雌性balb/c小鼠乳腺中,等到瘤子体积大小长到100mm3。肿瘤大小通过游标卡尺测量,并使用以下公式计算肿瘤体积:v=w2×
l/2,其中w和l分别是肿瘤的最短和最长直径。将小鼠随机分为pbs,mtx+chl(mc),masn-mtx,masn-chl和masn-mc五组,每组6只小鼠。尾静脉注射各组药物,每次注射前测量小鼠长短轴直径。给药量以masn 6.56mg
·
kg-1
计。每三天给一次药持续19天。从给药第一天开始测量小鼠瘤子体积及小鼠体重。为了评估潜在的毒性,监测小鼠的体重减轻并实施安乐死。
[0116]
如图15中a和b所示,与对照组相比,masn-mc组肿瘤生长速度降低,停止给药后有短期抑制作用,证明masn-mc具有良好的抑瘤效果。监测小鼠体重可知,五组均无显著毒性。
[0117]
药后第28天,将小鼠杀死并取出肿瘤用于拍照和瘤子重量检测,结果参见图15中c。根据差异显著性分析,masn-mc组肿瘤重量与对照组相比具有显著差异性(p<0.0001),证明masn-mc具有良好的抑瘤效果。
[0118]
实施例12:h&e,tunel,pcna染色
[0119]
h&e染色步骤:将小鼠肿瘤细胞置于4%多聚甲醛(sigma)中固定24小时后,送天津易生源生物技术有限公司进行石蜡切片及h&e染色实验。随后进行显微镜分析。
[0120]
tunle染色步骤:将小鼠肿瘤进行冰冻切片处理,pbs湿润15min后遵循roach公司提供的实验手册进行染色。
[0121]
pcna染色步骤:将冰冻切片从-80℃取出,恢复至室温,0.1%triton x-100处理15分钟后,pbs洗掉triton,5%bsa(sigma)封闭1小时后加入一抗(pcna一抗,大鼠来源,sigma),4℃避光过夜。12小时后pbs洗掉一抗,然后加入荧光标记的二抗(山羊抗大鼠)。1小时后封片共聚焦显微镜拍照分析。
[0122]
如图16所示,由显微镜观察到masn-mc组细胞核固缩,核质分离,细胞核外流。masn-mc组细胞坏死程度明显高于其他三组,证明masn-mc组具有良好的杀伤肿瘤的效果。从tunel的凋亡指标及pcna的增殖指标中也可以得到类似的结果,即masn-mc具有良好的肿瘤杀伤效果。
[0123]
实施例13:masn在多药组合免疫疗法中的应用
[0124]
将1x106个4t1细胞原位注射到6-8周的雌性balb/c小鼠乳腺中,等到瘤子体积大小长到300mm3。肿瘤大小通过游标卡尺测量,并使用以下公式计算肿瘤体积:v=w2×
l/2,其中w和l分别是肿瘤的最短和最长直径。将小鼠随机分为pbs,pn-med(ptx:nlg919=4:1),pn-opt(ptx:nlg919=1:4),masn-ptx,masn-nlg919,masn-pn-med和masn-pn-opt七组,每组6只小鼠。尾静脉注射各组药物,每次注射前测量小鼠长短轴直径。给药量以masn 6.56mg
·
kg-1
计。每两天给一次药持续15天。从给药第一天开始测量小鼠瘤子体积及小鼠体重。为了评估潜在的毒性,监测小鼠的体重减轻并实施安乐死。
[0125]
如图17所示,与pn-opt及masn-pn-med相比,masn-pn-opt组肿瘤生长速度降低,停止给药后有短期抑制作用,证明masn-pn-opt具有良好的抑瘤效果,可以将体外鉴定的最优摩尔比转化为体内的抑瘤效果。监测小鼠体重可知,各组均无显著毒性。
[0126]
实施例14:masn促进t细胞肿瘤浸润
[0127]
t细胞浸润通过流式细胞术及免疫荧光染色两种手段表征。
[0128]
免疫荧光染色:将冰冻切片从-80℃取出,恢复至室温,pbs湿润切片15分钟,5%bsa(sigma)封闭1小时后加入cd4,cd8及crt一抗(二者种属不同),4℃避光过夜。12小时后pbs洗掉一抗,然后分别加入一抗各自对应的荧光二抗。1小时后封片共聚焦显微镜拍照分析。
[0129]
流式细胞术:将新鲜收获的肿瘤组织切成小块,并使用gentlemacs dissociator匀浆,然后用70
×
10-6
m细胞滤网对肿瘤匀浆液过滤以制备单细胞悬液。收集细胞并稀释至1
×
107细胞/ml。向细胞悬液中加入荧光抗体偶联的一抗,室温孵育30分钟。染色后,将细胞用4%多聚甲醛固定并通过流式细胞仪进行分析。
[0130]
如图18所示,masn-pn-opt组t细胞浸润程度明显升高,表明masn-pn-opt可以有效调控小鼠肿瘤微环境。
[0131]
实施例15:masn恢复肿瘤浸润t细胞活性,促进抗原提呈细胞成熟
[0132]
实验方法:将新鲜收获的肿瘤组织切成小块,并使用gentlemacs dissociator匀浆,然后用70
×
10-6
m细胞滤网对肿瘤匀浆液过滤以制备单细胞悬液。收集细胞并稀释至1
×
107细胞/ml。向细胞悬液中加入荧光抗体偶联的一抗,室温孵育30分钟。染色后,将细胞用4%多聚甲醛固定并通过流式细胞仪进行分析。
[0133]
如图19所示,masn-pn-opt可有效保留浸润t细胞活性,并可大幅度促进抗原提呈细胞成熟。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1