含有帕拉米韦的氯化钠注射液及其制备方法与流程
[0001]
本发明属于医药技术领域,具体的涉及到一种含有帕拉米韦的氯化钠注射液及其制备方法。
背景技术:
[0002]
帕拉米韦(peramivir),由美国生物晶体药品股份有限公司研制开发,是继扎那米韦和奥司他韦研发成功并于1999年上市之后的又一新型神经氨酸酶(na)抑制剂类抗流感病毒药物,用于成人和儿童的甲型和乙型流感的治疗和预防。
[0003]
帕拉米韦目前已经被开发为抗病毒类药物并且具体地用于流感治疗。作为神经氨酸酶抑制剂,帕拉米韦能够有效抑制所有类型的流感病毒的复制。帕拉米韦能够用过注射使用并且已知耐受性好并仅导致轻微的副作用。帕拉米韦是一种流感神经氨酸酶抑制剂,帕拉米韦可以杀死高致病性的h5n1禽流感病毒,可以有效对抗h5n1禽流感病毒。临床前研究结果显示,它可以有效地作用于多种流感病毒(包括h5n1病毒)。它是一钟以流感病毒表面糖蛋白神经氨酸酶为作用靶点的新型环戊烷类抗流感药物。实验室的测试显示,帕拉米韦能有效对抗每一种已知的h5n1病毒,而且杀伤力特强,不容易令病毒出现抗药性。
[0004]
由于帕拉米韦口服利用度较低,主要制成注射液等胃肠外制剂,如cn101314579a公开了无水帕拉米韦晶体及其药物组合物,包括含有200mg帕拉米韦晶体的注射液:无水帕拉米韦晶体200mg,甘露醇、盐酸适量以及注射用水加至100ml。以及冻干粉针:无水帕拉米韦晶体200mg,甘露醇、盐酸适量以及注射用水加至20ml冻干。该发明中存在的问题是1)注射液中帕拉米韦的浓度小,约为2mg/ml;2)冻干分针的制备工艺中采用的是过滤除菌,需要采用无菌生产工艺,无菌的保证水平低于终端灭菌工艺。
[0005]
cn102058522a公开了一种哌拉米韦注射液及其制备方法,由哌拉米韦、非水溶剂、助溶剂和注射用水组成。其中哌拉米韦与非水溶剂的重量体积比(g/ml)为1∶10-100,非水溶剂在处方中的用量比为20~60%(v/v),助溶剂用量为1~20%(w/v),所述非水溶剂为乙醇、丙二醇、甘油、聚乙二醇中的一种或几种的混合溶剂,所述助溶剂为葡萄糖、山梨醇、甘露醇、环己六醇中的一种或几种。提供一种可以用任意比例的注射用水、氯化钠或葡萄糖输液稀释,而保持溶液澄明度的哌拉米韦注射液及其制备方法。该注射液既可提高帕拉米韦溶解性,又可以满足注射用药要求的合理的制剂处方和制备方法,通过使用适量的非水溶剂和助溶剂,增加帕拉米韦的溶解度和保持溶液的稳定性,避免在临床稀释使用时出现溶液浑浊、无法给药等问题的发生,尽可能降低非水溶剂的用量,提高了原药浓度。该发明存在的问题是需要使用非水溶剂和助溶剂增加帕拉米韦的溶解度和保持溶液的稳定性,但非水溶剂如乙醇、丙二醇、甘油、聚乙二醇存在一定的血管刺激性,影响临床用药。
[0006]
专利cn107281096a公开了一种含帕拉米韦的水针剂及其制备方法,其特征在于水针剂由帕拉米韦、药用辅料和注射用水组成,其中药用辅料包涵纳米级蒙脱石的平均粒径为12nm-15nm,注射用水需煮沸后降温至45℃后进行配液,灭菌工艺为121℃灭菌10min。该发明存在的问题是1)加入注射剂中不常用的辅料纳米级的蒙脱石,药物的安全性存在一定
的挑战;2)注射用水需煮沸后降温至45℃后进行配液,而在生产过程中将注射用水煮沸需要特殊的生产设备进行处理,生产工艺较复杂,不利于商业化生产;3)灭菌工艺为121℃灭菌10min,采用的是残存概率法,无菌保证水平没有终端灭菌工艺高。
[0007]
因此仍有必要提供一种稳定的帕拉米韦氯化钠注射液及其制备方法,使产品具有较好的稳定性,较高的无菌保证水平,方便临床用药以及工艺简单、生产成本低、适合商业化生产。
技术实现要素:
[0008]
本发明提供了一种含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于处方中每ml中含有10mg帕拉米韦,9mg的氯化钠,盐酸或氢氧化钠适量。
[0009]
根据本发明含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于所述的帕拉米韦氯化钠注射液的规格为150mg/15ml,即每支产品中含有150mg帕拉米韦,135mg氯化钠,盐酸和氢氧化钠适量。
[0010]
根据本发明含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于用ph调节剂盐酸或氢氧化钠调节溶液ph值至5.0~8.5。
[0011]
根据本发明含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于制备帕拉米韦氯化钠注射液过程中采用终端灭菌工艺,即121℃12min的灭菌工艺。
[0012]
根据本发明含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于制备的帕拉米韦氯化钠注射液为等渗溶液。
[0013]
根据本发明含有帕拉米韦的氯化钠注射液及其制备方法,其特征在于帕拉米韦氯化钠注射液的渗透压浓度范围为270~330mmol/l。
[0014]
根据本发明帕拉米韦的氯化钠注射液及其制备方法,其特征在于制备方法包含如下步骤:
[0015]
a.称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至5.0~8.5;
[0016]
b.溶液中补加注射用水至处方量;
[0017]
c.经0.22μm的pvdf滤芯过滤,得到每1ml含帕拉米韦10mg的帕拉米韦氯化钠溶液;
[0018]
d.灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的帕拉米韦氯化钠溶液;
[0019]
e.将帕拉米韦氯化钠溶液采用终端灭菌工艺,即121℃12min的灭菌工艺进行灭菌。
[0020]
发明人研究发现,帕拉米韦在去离子化水和0.9%氯化钠注射液中略溶,而在ph1~13的不同ph值溶液中,帕拉米韦的溶解度增大,帕拉米韦的溶解度可以达到15mg/ml~20mg/ml。当ph值大于8.5时,帕拉米韦易发生碱性水解,导致药物的稳定性下降,当ph值小于5时,帕拉米韦易发生酸性水解,导致药物的稳定性下降。当帕拉米韦的ph值在5~8.5范围时,帕拉米韦不仅具有良好的水溶性,同时帕拉米韦在该ph范围具有较好的溶液稳定性。
[0021]
发明人研究发现,当帕拉米韦氯化钠注射液中含有150mg帕拉米韦,135mg氯化钠,盐酸和氢氧化钠调节溶液ph值至5~8.5,注射用水定容至15ml,该帕拉米韦氯化钠注射液具有良好的稳定性,可以耐受终端灭菌工艺,即采用121℃12min灭菌工艺后杂质相对于未灭菌工艺,杂质不会出现显著增加。
[0022]
根据本发明,制备的帕拉米韦氯化钠注射液不仅具有较好的稳定性,同时生产工艺简单,无菌保证水平高,适合商业化生产。
具体实施方式
[0023]
为了使本领域的技术人员更好地理解本发明的技术方案,特给出以下具体实施例,但本发明不限定于以下实施例。
[0024]
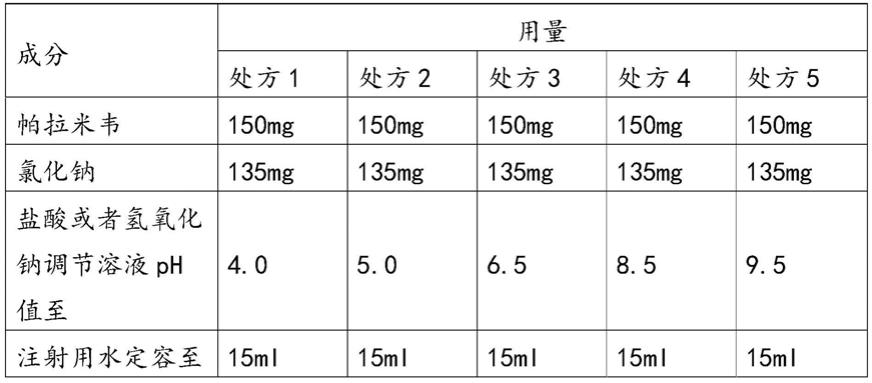
对比实施例1:
[0025][0026]
处方1的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值4.0;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0027]
处方2的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值5.0;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0028]
处方3的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值6.5;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0029]
处方4的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值8.5;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0030]
处方5的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值9.5;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0031]
分别将处方1、处方2、处方3、处方4和处方5分别放置在加速条件下(40℃、75%rh)
考察稳定性情况,考察结果见表1加速条件下的稳定性。
[0032]
表1:加速条件下稳定性
[0033][0034]
结果分析:帕拉米韦氯化钠注射液在ph5.0~8.5较稳定,当ph值为4.0和9.5时,帕拉米韦氯化钠注射液较不稳定,总杂质超过0.2%。
[0035]
对比实施例2:
[0036][0037]
处方6的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值6.5;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液。
[0038]
处方7的制备方法为:称取室温的90%注射用水,加帕拉米韦、氯化钠溶解后混合均匀,用ph调节剂盐酸或氢氧化钠调节溶液ph值至目标ph值6.5;溶液中补加注射用水至处方量;经0.22μm的pvdf滤芯过滤;灌装得到每瓶中含有帕拉米韦的浓度为150mg/15ml的溶液,采用湿热灭菌121℃12min灭菌。
[0039]
分别将处方6、处方7、处分别放置在加速条件下(40℃、75%rh)考察稳定性情况,考察结果见表2加速条件下的稳定性。
[0040]
表2:加速条件下稳定性
[0041]
40℃、75%rh处方6处方70月总杂质0.03%0.03%加速6月总杂质0.12%0.13%
[0042]
结果分析:帕拉米韦氯化钠注射液分别采用过滤除菌和湿热灭菌121℃12min,0月和加速6月的总杂质未发现显著差异,说明帕拉米韦氯化钠注射液可以耐受终端灭菌工艺。
[0043]
在本说明书的描述中,参考术语“一个实施例/方式”、“一些实施例/方式”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例/方式或示例描述的具体特征、结构、材料或者特点包含于本申请的至少一个实施例/方式或示例中。在本说明书中,对上
述术语的示意性表述不必须针对的是相同的实施例/方式或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例/方式或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例/方式或示例以及不同实施例/方式或示例的特征进行结合和组合。
[0044]
此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。在本申请的描述中,“多个”的含义是至少两个,例如两个,三个等,除非另有明确具体的限定。
[0045]
本领域的技术人员应当理解,上述实施方式仅仅是为了清楚地说明本公开,而并非是对本公开的范围进行限定。对于所属领域的技术人员而言,在上述公开的基础上还可以做出其它变化或变型,并且这些变化或变型仍处于本公开的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1