一种肾病药物组合物及其制备方法与流程
1.本发明属于药物制剂技术领域,具体涉及一种适合肾透析患者使用的药物组合物及其制备方法。
背景技术:
2.盐酸西那卡塞是一种用于治疗慢性肾脏病(ckd)维持性透析患者的继发性甲状旁腺功能亢进症的拟钙剂。其结构式为:盐酸西那卡塞原料药为bcs iv类药物,低溶解低渗透。原料药在生理ph范围内溶解度受ph值影响大,当ph值大于4时,原料药溶解度低于1mg/ml,溶解度限制可能会导致体内生物利用度低。因此本品为了保证生物利用度,需要提高制剂溶出速率和溶出量。
3.盐酸西那卡塞原料药药用晶型为晶型i,中国专利cn101522606a公开了制备晶型i所用溶剂为醇类溶剂、酮类溶剂、二氯甲烷、酯类溶剂、质子惰性溶剂或其混合物。
4.粒径和振实密度检测结果如下:按专利所述溶剂结晶,多种条件下得到的原料药粒径和振实密度均较小,且质地轻盈。使用上述性状原料药制备处方,在湿法制粒干燥环节,原料药不易附着于辅料表面,加之原料药质地轻盈,干燥过程原料药容易吸附于设备、滤袋表面,导致物料损耗。因此,制剂生产过程中需要通过辅料和工艺方式改善原料药轻且飘的特性,保证生产过程原料药不损耗。
5.综上,本品制剂开发需克服两个方面难点:一是提高溶出速率和溶出量;二是提高工艺过程收率及稳定性。
6.中国专利cn102885792a利用微粉化将原料药粉碎至5μm~15μm以提高药物的体外溶出。但本品原料药静电较大,微粉化过程物料损耗较大,且引起的粉尘容易导致gmp车间交叉污染。将本品原料药置于水溶液中,可明显发现原料药浮于溶液表面,极难润湿,原料
药粒径越小越难以润湿。因此单纯靠降低原料药粒径不足以达到提高溶出速率的目的,还需要解决原料药润湿性问题。
7.中国专利cn1946382b公开了一种含盐酸西那卡塞的药物组合,制得的片剂按美国药典usp 26/nf 21第711章中所指导的溶出试验,用usp 2装置于37摄氏度与75rpm转速下测定在900ml 0.05n hcl介质中溶出特性,可满足约50
‑
125%目标量化合物从试验开始不迟于30min由组合物中释放。但按该专利所述处方工艺制备制剂,在上述条件下检测,并非所有处方比例均可满足30min溶出量高于50%。溶出度检测结果表明,按中国专利cn 1946382 b处方工艺制备片剂,用usp 2装置于37摄氏度与75rpm转速下测定在900ml 0.05n hcl介质中溶出特性,当聚乙烯吡咯烷酮用量为5%时,30min溶出量不到40%。在该专利保护的处方比例范围内,一些处方并不能达到所谓溶出效果。同时该药物组合在50rpm转速条件下片剂堆积严重,溶出不完全,该片剂溶出速率仍未达到理想状态,仍有改进空间。
8.中国专利cn 1946382 b还公开的一种含盐酸西那卡塞的药物组合制备工艺,按该专利制备片剂,在一些处方比例条件下干燥后物料原料药含量损耗可达10
‑
55%,生产过程物料平衡达不到要求,重复制备三批,各批之间颗粒含量差异较大。中国专利cn 1946382 b所保护的处方比例范围内,一些处方比例生产可行性存在问题,原料药损耗大且损耗程度不可控,不利于稳定生产工艺。
技术实现要素:
9.针对胃肠的蠕动慢的病人,需要提供一种更好溶出的药物制剂,而在人体外测试溶出速率时,50rpm转速是个更好的模拟条件。在本发明的研发过程中,令人意想不到的是,当在900 ml 0.05n hcl环境下测试溶出速率时,转速低于75rpm,例如转速为50rpm时,聚乙烯吡咯烷酮的用量在1
‑
5%,随着用量增大,粘合剂粘度提高,颗粒紧实程度加大,其溶出速率随着聚乙烯吡咯烷酮的用量的增加而降低;但当继续增加其用量时,其样品的溶出速率反而增加,例如在用量范围为5.3
‑
7.5%时,由于聚乙烯吡咯烷酮溶液会在原料药表面形成一层亲水膜,提高了溶出过程中原料药的润湿性,使得原料药溶解速率和溶解度均显著提高,在50rmp转速条件下仍可以表现出较快的溶出。
10.除此之外,本发明的另一个惊奇的发现,在于盐酸西那卡塞药物制剂的制备工艺中,聚乙烯吡咯烷酮的用量较小时,原料药不能有效的被粘结,从而在流化床干燥时会导致原料药无法有效与辅料吸附,反而容易吸附到滤袋上不能被收集,从而使得制粒中原料药的含量不能被有效地的控制,不仅损失大量的原料药,而且导致生产工艺的稳定性不能被有效控制。例如,当使用聚乙烯吡咯烷酮的用量落在1
‑
5.0%时,不同批次生产的颗粒原料含量差异大。然而,当聚乙烯吡咯烷酮的用量进一步加大,例如在5.3
‑
7.5%时,本发明发现不同生产批次所制得的软材经干燥后的原料药含量趋于稳定,表明选择聚乙烯吡咯烷酮的用量为5.3
‑
7.5%,相比于其含量为1
‑
5.0%时,制粒软材的紧实程度进一步得到巩固,可以将原料药的损失有效控制在10%以下,同时也使得在生产工艺中更有利于产品的质量稳定性控制。
11.除此之外,本发明还惊奇的发现,当采用湿法工艺时,先将聚乙烯吡咯烷酮溶解于水中,以溶液的形式再与其他成分混合制粒,可使得粘合剂分布更加均匀,颗粒更加均匀,显著降低了溶出测定的批内差异,溶出试验中前15min样品的rsd值显著降低,从而得到的
药物颗粒粒度分布更窄,颗粒更加均匀。
12.因此,本发明所实际解决的技术问题是:1、本发明提供了一种药物组合物,本发明的药物组合物能够在低转速下(50rpm)具有更好的溶出速率,从而有益于胃肠道蠕动差的病人对该药物的吸收;2、本发明提供了一种药物组合物,能够减少干燥过程中原料药的耗损,从而更有效的控制产品批间的质量稳定性,提高产率;3、本发明还提供了一种药物组合物的制备工艺,在本发明的制备工艺下采用粘合剂配浆制粒,粘合剂分布更加均匀,降低了制剂批内差异。
13.为了解决上述技术问题,并达到其技术效果,本发明采用了以下技术方案:一种盐酸西那卡塞的药物组合物,其特征在于,以重量百分比计,所述的药物组合物包含:(1)10%至 20%重量比的盐酸西那卡塞 ;(2)5.3%至7.5%重量比的聚乙烯吡咯烷酮 ;在本发明的技术方案中,其特征在于,以重量百分比计,所述药物组合物还包含以下组分:(3)60%至 75%重量比的微晶纤维素 ;(4)5%至 15%重量比的淀粉 1500 ;(5)3%至 5%重量比的交联聚乙烯吡咯烷酮 ;(6)0.3%至 1.5%重量比的胶体二氧化硅 ;(7)0.3%至 1.5%重量比的硬脂酸镁。
14.其中,在低旋转速度采用usp ii法检测溶出曲线时,盐酸西那卡塞15min累计溶出量为96~97%(实施例2,样品5~7),而当聚乙烯吡咯烷酮的重量比为1%至5%时盐酸西那卡塞15min累计溶出量仅为62~66%,本发明组合物15min累计溶出量至少增加30%(差值)。
15.在本发明的技术方案中,其特征在于,所述的低转速速度为50rpm。
16.在本发明的技术方案中,其特征在于,所述溶出测试是在900 ml 0.05n hcl介质中进行的。
17.在本发明的技术方案中,其特征在于,在流化床制粒干燥后所得制粒的原料药含量损耗< 10%。
18.在本发明的技术方案中,以重量百分比计,所述聚乙烯吡咯烷酮的重量比为5.3%至6.5%,优选为5.4%。
19.在本发明的技术方案中,以重量百分比计,所述药物组合物包含以下组分:
除此之外,本发明还提供了一种盐酸西那卡塞的药物组合物的制备方法,其特征在于,包括以下步骤:步骤(一):按重量比称取各组分备用;步骤(二):将聚乙烯吡咯烷酮加入到纯化水中搅拌至完全溶解,配成浓度10
‑
20%(w/w)的粘合剂溶液备用;步骤(三):将盐酸西那卡塞与微晶纤维素、淀粉 1500、交联聚乙烯吡咯烷酮投入湿法制粒机中混合;步骤(四):启动制粒机搅拌及剪切功能,往制粒机中加入第一步所配备的粘合剂溶液,制成软材;步骤(五):将上述软材通过方形筛网整粒;步骤(六):将整粒后的软材用沸腾干燥设备进行干燥,并控制干颗粒水分;步骤(七):将上述干燥后的颗粒用筛网整粒;步骤(八):将整粒后的物料与胶体二氧化硅、硬脂酸镁进行混合;步骤(九):压片,并最终完成包衣。
20.在本发明的技术方案中,其中,其中步骤(六)干燥后颗粒水分的含量控制在<4%。
21.在本发明的技术方案中,其中,所述盐酸西那卡塞粒径控制范围为d90≤30微米、d50≤15微米、d10≤5微米时,具有更有的溶出速率。
22.在一些实施例中,上述盐酸西那卡塞组合物压片前颗粒具有的颗粒 d50 用筛分分析法测量在 50μm 至 130μm 范围内,优选范围为 50μm 至 100μm。
附图说明
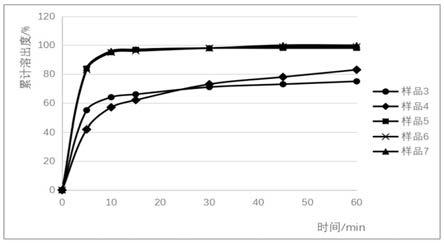
23.图1为不同聚乙烯吡咯烷酮用量处方溶出速率 50rpm。
24.图2为不同预胶化淀粉与微晶纤维素比例处方 50rpm。
25.图3为实施例4处方溶出速率 50rpm。
具体实施方式实施例
26.实施例1:聚乙烯吡咯烷酮不同加入方式对比注:1、纯化水用量占制粒物料量的40
‑
50%(w/w),并在湿法制粒干燥环节去除;2、纯化水在包衣过程中去除。
27.批号1样品软材制备过程如下:
⑴
粘合剂配制:将处方量聚乙烯吡咯烷酮溶解于适量纯化水中,配成浓度范围10
‑
20%(w/w)的溶液备用。
28.⑵
将盐酸西那卡塞原料药、预胶化淀粉、微晶纤维素(内加)、交联聚乙烯吡咯烷酮(xl)(内加)过40目筛网后置于高剪切湿法制粒中,设置搅拌桨转速80
‑
130rpm,混合5min。
29.⑶
在步骤(2)物料中加入聚乙烯吡咯烷酮水溶液,设置搅拌桨转速80
‑
130rpm,剪
切转速1200rpm,制粒5
‑
7min。
30.批号2样品软材制备过程如下:
⑴
将盐酸西那卡塞原料药、预胶化淀粉、微晶纤维素(内加)、聚乙烯吡咯烷酮k29/32、交联聚乙烯吡咯烷酮(xl)(内加)过40目筛网后置于高剪切湿法制粒中,设置搅拌桨转速80
‑
130rpm,混合5min。
31.⑵
在步骤(2)物料中加入纯化水,设置搅拌桨转速80
‑
130rpm,剪切转速1200rpm,制粒5
‑
7min。
32.上述批号1和批号2软材均经历以下步骤:a)采用10mm*10mm筛网整粒后投入流化床中进行干燥,干燥至颗粒干燥失重小于4%。b)干燥后物料用1.0mm筛网整粒。c)计算外加物料用量,然后将除硬脂酸镁外的物料与制粒颗粒混合均匀。d)加入硬脂酸镁混合3
‑
5min。e)根据压片颗粒含量计算理论片重,按理论片重压片,控制素片含量范围为95%
‑
105%,控制素片硬度范围60
‑
120n。f)包衣。
33.批号1和批号2样品制粒颗粒粒度分布如下:批号1和批号2样品溶出前15minrsd值如下(单位%):结果表明,聚乙烯吡咯烷酮配成水溶液制粒制成的颗粒粒度分布更窄,颗粒更加均匀,溶出前15minrsd更小。
34.实施例2:不同聚乙烯吡咯烷酮用量处方及其制备工艺
注:纯化水在湿法制粒干燥环节去除批号3~4样品制备工艺同批号2;批号5~6样品制备工艺同批号1。
35.制得的干燥后颗粒混粉含量检测结果如下:制得的干燥后颗粒粒度分布(d50)检测结果如下:结果表明,随着聚乙烯吡咯烷酮用量增加,干燥后颗粒含量总体呈上升趋势。具体表现为聚乙烯吡咯烷酮用量1%~5.3%范围内,颗粒含量随其用量增加而上升,特别是5.0%
‑
5.3%范围内随着聚乙烯吡咯烷酮用量增加及及其加入方式的改变,颗粒含量增幅显著;聚乙烯吡咯烷酮用量5.3%~7.5%范围内,颗粒含量差异不大,均接近100%。制粒后颗粒粒度分布(d50)数据显示颗粒紧实度随着聚乙烯吡咯烷酮用量增大而提高,粒径分布趋势与颗粒含量结果相符。
36.制得的批号3~7批样品在900ml 0.05n hcl介质中采用usp ii法50rpm下检测溶出曲线,所
得结果如下(见附图1):注:批号3和批号4样品由于颗粒含量偏低,为使制剂均达到标识含量,这两批样品所压片重较大,溶出过程中存在明显堆积现象。
37.结果表明,在50rpm条件下样品前期溶出速率随聚乙烯吡咯烷酮用量增加,先降低后升高;后程溶出量与聚乙烯吡咯烷酮用量及片重均相关。当聚乙烯吡咯烷酮用量在1%~5.0%范围内时,样品前期溶出速率随其用量增加而降低,后程溶出量随颗粒含量增加而升高。继续增加用量至5.3%同时将其加入方式改为配成溶液加入,样品前期溶出速率不降反升,同时由于聚乙烯吡咯烷酮用量增加,颗粒紧实程度增大,颗粒含量几乎无损失,每片中所含不溶性辅料量相对少,辅料对原料药堆积作用弱,因此片剂后程依然保持较高溶出量。聚乙烯吡咯烷酮用量5.3%~7.5%范围内,样品在低转速条件下均可保持较快溶出。
38.实施例3:不同预胶化淀粉与微晶纤维素比例处方及其制备注:纯化水在湿法制粒干燥环节去除样品制备工艺同批号1。
39.步骤(6)制得的干燥后颗粒混粉含量检测结果如下:结果表明,样品8、样品9和样品10的颗粒含量损失均达到20%以上,改变预胶化淀粉和微晶纤维素比例并未能带来颗粒收率的改进。
40.制得的样品分别在900 ml 0.05n hcl介质中采用usp ii法50rpm条件下检测溶出曲线,所得结果如下(见附图2):
结果表明,样品8、样品9和样品10的溶出速率在50rpm条件下差异均不大,均不能完全溶出。改变预胶化淀粉和微晶纤维素比例并未能引起溶出速率的巨大改进。
41.实施例4:制备工艺同批号1样品。
42.制得的干燥后颗粒混粉含量检测结果如下:结果表明,当聚乙烯吡咯烷酮用量在5.3%~7.5%范围并采取溶液形式制粒时,预胶化淀粉用量在5%~10%范围,微晶纤维素比例在60%~75%范围内时,可保证颗粒含量接近100%。
43.制得的批号11~13批样品在900ml 0.05n hcl介质中采用usp ii法50rpm下检测溶出曲线,所得结果如下(见附图3):结果表明,当聚乙烯吡咯烷酮用量在5.3%~7.5%范围并采取溶液形式制粒时,预胶化淀粉用量在5%~10%范围,微晶纤维素比例在60%~75%范围内时,可保证样品在较低转速下仍保持较快溶出。
44.上述实施例仅为充分说明本发明而列举的具体实施例,本发明的保护范围以权利要求书的内容为准,而不限于上述具体实施方式。说明书中公开的所有内容,包括摘要和附图,以及公开的所有方法和步骤,都可以任意组合,除非这些特征和/或步骤是相互排斥的组合。说明书中公开每一个技术特征,包括摘要和附图,除非另有说明,都可以被实现相同、等同或类似目的的技术特征所替换。因此,除非另有说明,本发明公开的每个技术特征仅是通常系列中的等同或类似的技术特征的一个实例。本领域的技术人员在本发明基础上所作的不脱离本发明实质内容的等同替代或变换,亦均在本发明的保护范围之内。而这样的修改亦均在本发明的保护范围之内。本申请引用的每个参考文献在此均引用其全文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1