多羟基苯酚类化合物的应用、放射性药物组合物及制法的制作方法
1.本发明属于放射性药物技术领域,具体涉及多羟基苯酚类化合物的应用、放射性药物组合物及制法。
背景技术:
2.镥177(
177
lu)标记的药物目前已广泛应用于多种癌症的放射性治疗,如:
177
lu标记的psma617(
177
lu
‑
psma617)可应用于前列腺癌的治疗,
177
lu标记的dotatate(
177
lu
‑
dotatate)可应用于神经内分泌肿瘤的治疗。其治疗原理是
177
lu标记的药物可以特征性地与肿瘤细胞表面抗原结合甚至内化,然后利用
177
lu的短射程β射线对肿瘤细胞进行强烈杀伤进而遏制肿瘤生长甚至清除肿瘤。
177
lu的半衰期为6.7天,由此可见
177
lu标记的药物具备远程运输的基本条件。
3.而在现有技术中,
177
lu标记的药物存在稳定性不好的问题,严重限制了药物的使用、运输和储存。现有技术中一般通过
177
lu标记的药物保存于10%的乙醇溶液中于增加稳定性,但乙醇为挥发性溶剂,运输、储存条件较为苛刻。因此,提供一种稳定剂,能有效保证放射性药物的稳定性,便于运输和储存,成为了本领域技术人员亟待解决的问题。
技术实现要素:
4.申请人经过大量实验、付出了创造性劳动后发现,
177
lu因自身的衰变固有属性,放射β和γ射线,进而在水溶液中产生多种自由基,是影响放射性药物自身稳定性的主要原因。本发明的目的之一在于,提供多羟基苯酚类化合物作为放射性药物稳定剂的应用,解决现有技术中
177
lu因自身衰变,产生多种自由基,影响放射性药物稳定性的问题。
5.本发明的目的之二在于,提供了包含该多羟基苯酚类化合物的放射性药物组合物。
6.本发明的目的之三在于,提供放射性药物组合物的制备方法。
7.为实现上述目的,本发明采用的技术方案如下:
8.本发明所述的多羟基苯酚类化合物作为放射性药物稳定剂的应用。
9.本发明的多羟基苯酚类化合物结构中有多个酚羟基,具备自由基捕获能力,可以清除
177
lu药物溶液中的自由基,提升药物稳定性。
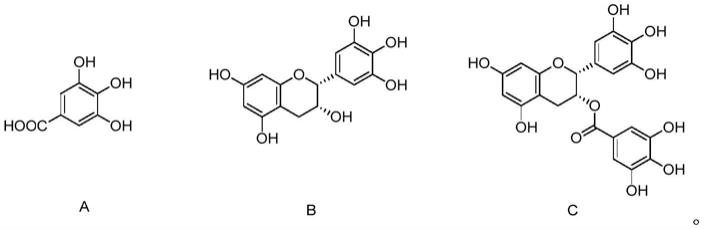
10.本发明的部分实施方案中,所述多羟基苯酚类化合物包括化合a、化合物b、化合物c中的任意一种或几种,
11.12.化合物a为没食子酸,又称“五倍子酸”,“棓酸”,化学名为“3,4,5
‑
三羟基苯甲酸”,分子式为c7h6o5。化合物b为表没食子儿茶素,又称“绿茶儿茶酚”,分子式为c
15
h
14
o7。化合物c为表没食子儿茶素没食子酸酯,分子式为c
22
h
18
o
11
。
13.本发明所述的包括上述的多羟基苯酚类化合物的放射性药物组合物,该放射性药物组合物包括核素标记的药物、以及所述多羟基苯酚类化合物。
14.本发明的部分实施方案中,所述核素标记的药物为
177
lu标记的药物。
15.本发明的部分实施方案中,所述核素标记的药物为
177
lu
‑
psma617或
177
lu
‑
dotatate。
16.本发明的部分实施方案中,所述核素标记的药物的放射强度为0.25毫居里时,多羟基苯酚类化合物的用量为0.5~5μg。
17.本发明所述的放射性药物组合物的制备方法,将所述多羟基苯酚类化合物加入到核素标记的药物溶液中,混合均匀,即得。
18.本发明的部分实施方案中,将多羟基苯酚类化合物制备成溶液后,再加入到所述核素标记的药物溶液中。
19.本发明的部分实施方案中,将多羟基苯酚类化合物制备成1~10mg/ml的溶液后,再加入到体积比活度为0.1~2毫居里/微升的核素标记的药物溶液中。
20.与现有技术相比,本发明具有以下有益效果:
21.本发明设计科学,构思巧妙。本发明创造性地采用多酚羟基化合物作为放射性药物稳定剂,实验结果表明,采用了本发明的多酚羟基化合物的放射性化合物,储存96小时后放化纯仍旧高于95%,具有良好的稳定效果。
具体实施方式
22.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
23.实施例1
24.本实施例公开了
177
lu
‑
psma617的标记合成。
25.吸取
177
lucl3溶液200μl(盐酸浓度0.05m,体积比活度1mci/1μl)加入至无菌西林瓶内,然后加入无菌无热源的50μl 0.25m醋酸钠缓冲液,再加入1ml无菌无热源生理盐水稀释反应液,然后加入psma617(100μg)药物前体。立即放置于恒温震荡金属浴上在80
‑
100℃,300
‑
500rpm下反应15
‑
30min。反应结束后冷却至室温,移取5μl反应液,稀释十倍后取5μl使用radio
‑
hplc测量其放射化学纯度。
26.radio
‑
hplc测定方法的色谱条件为:岛津lc
‑
2030hplc;放射性检测器:bioscan flow
‑
count;安捷伦c18反相柱(4.6mm
×
250mm,填料粒径5μm);流动相a:乙腈(含0.1%(v/v)三氟乙酸),流动相b:水(含0.1%(v/v)三氟乙酸);流速:1ml/min;梯度洗脱:流动相a含量从10%(v/v)(0分钟)逐渐增加至90%(v/v)(15min)。游离
177
lu保留时间为:3.0
±
0.5min;
177
lu
‑
psma617保留时间为9.8
±
0.5min。分别对hplc上述两个信号峰进行积分,
177
lu
‑
psma617的峰面积占据所有峰面积和的百分比即为
177
lu
‑
psma617的放射化学纯度。
27.实施例2
28.本实施例公开了
177
lu
‑
dotatate的标记合成。
29.吸取
177
lucl3溶液200μl(盐酸浓度0.05m,体积比活度1mci/1μl)加入至无菌西林瓶内,然后加入无菌无热源的50μl 0.25m醋酸钠缓冲液,再加入1ml无菌无热源生理盐水稀释反应液,然后加入dotatate(100μg)药物前体。立即放置于恒温震荡金属浴上在80
‑
100℃,300
‑
500rpm下反应15
‑
30min。反应结束后冷却至室温,移取5μl反应液,稀释十倍后取5μl使用radio
‑
hplc测量其放射化学纯度。
30.radio
‑
hplc测定方法的色谱条件为:岛津lc
‑
2030hplc;放射性检测器:bioscan flow
‑
count;安捷伦c18反相柱(4.6mm
×
250mm,填料粒径5μm);流动相a:乙腈(含0.1%(v/v)三氟乙酸),流动相b:水(含0.1%(v/v)三氟乙酸);流速:1ml/min;梯度洗脱:流动相a含量从10%(v/v)0min)逐渐增加至90%(v/v)(15min)。游离
177
lu保留时间为:3.0
±
0.5min;
177
lu
‑
dotatate保留时间为9.4
±
0.5min。分别对hplc上述两个信号峰进行积分,
177
lu
‑
dotatate的峰面积占据所有峰面积和的百分比即为
177
lu
‑
dotatate的放射化学纯度。
31.实施例3
32.本实施例公开了本发明的放射性药物组合物的制备方法:
33.称取化合物a(100mg)溶于1.00ml无菌生理盐水中,制备成化合物a的储备液,其浓度为100mg/ml。然后分别取储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物a的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
34.将该四种溶液分别与等体积的
177
lu
‑
psma617(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物a浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
35.将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例1的色谱条件测定
177
lu
‑
psma617的放射化学纯度。
36.另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
psma617混合,阳性对照组为临床使用的含10%乙醇的
177
lu
‑
psma617。空白对照组和阳性对照组中
177
lu
‑
psma617的体积比活度为0.5mci/ul。
37.结果显示化合物a可以有效减弱
177
lu
‑
psma617的辐射自分解。具体测试条件和结果如下表所示:
38.表1化合物a对
177
lu
‑
psma617稳定性的影响结果表
39.[0040][0041]
测试结果:添加化合物a可以显著延缓
177
lu
‑
psma617的自分解,当产物溶液中化合物a浓度达到5mg/ml(0.5%)时,储存96小时后放化纯仍旧高于95%。稳定效果超过临床常用的10%乙醇存储体系。
[0042]
实施例4
[0043]
本实施例公开了本发明的放射性药物组合物的制备方法:
[0044]
称取化合物a(100mg)溶于1.00ml无菌生理盐水中,制备成化合物a的储备液,其浓度为100mg/ml。然后分别取储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物a的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
[0045]
将该四种溶液分别与等体积的
177
lu
‑
dotatate(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物a浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
[0046]
将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时)取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例2的色谱条件测定
177
lu
‑
dotatate的放射化学纯度。
[0047]
另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
dotatate混合,阳性对照组为临床使用的含10%乙醇的
177
lu
‑
dotatate。空白对照组和阳性对照组中
177
lu
‑
dotatate的体积比活度为0.5mci/ul。结果显示化合物a可以有效减弱
177
lu
‑
dotatate的辐射自分解。具体如下表所示:
[0048]
表2化合物a对
177
lu
‑
dotatate稳定性的影响结果表
[0049]
[0050][0051]
实施例5
[0052]
本实施例公开了本发明的放射性药物组合物的制备方法:
[0053]
称取化合物b(100mg)溶于1.00ml无菌生理盐水中,制备成化合物b的储备液,其浓度为100mg/ml。然后分别取该储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物b的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
[0054]
将该四种溶液分别与等体积的
177
lu
‑
psma617(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物b浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
[0055]
将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时)取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例1的色谱条件测定
177
lu
‑
psma617的放射化学纯度(标记率)。
[0056]
另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
psma617混合,阳性对照组为临床含10%乙醇的
177
lu
‑
psma617。空白对照组和阳性对照组中
177
lu
‑
psma617的体积比活度为0.5mci/ul。
[0057]
结果显示化合物b可以有效减弱
177
lu
‑
psma617的辐射自分解。具体如下表所示:
[0058]
表3化合物b对
177
lu
‑
psma617稳定性的影响结果表
[0059]
[0060][0061]
测试结果:添加化合物b可以显著延缓
177
lu
‑
psma617的自分解,当产物溶液中化合物b浓度达到5mg/ml(0.5%)时,储存96小时后放化纯仍旧高于95%。稳定效果超过临床常用的10%乙醇存储体系。
[0062]
实施例6
[0063]
本实施例公开了本发明的放射性药物组合物的制备方法:
[0064]
称取化合物b(100mg)溶于1.00ml无菌生理盐水中,制备成化合物b的储备液,其浓度为100mg/ml。然后分别取该储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物b的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
[0065]
将该四种溶液分别与等体积的
177
lu
‑
dotatate(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物b浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
[0066]
将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时)取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例2的色谱条件测定
177
lu
‑
dotatate的放射化学纯度。
[0067]
另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
dotatate混合,阳性对照组为临床含10%乙醇的
177
lu
‑
dotatate。空白对照组和阳性对照组中
177
lu
‑
dotatate的体积比活度为0.5mci/ul。
[0068]
结果显示化合物b可以有效减弱
177
lu
‑
dotatate的辐射自分解。具体如下表所示:
[0069]
表4化合物b对
177
lu
‑
dotatate稳定性的影响结果表
[0070][0071]
测试结果:添加化合物b可以显著延缓
177
lu
‑
dotatate的自分解,当产物溶液中化合物b浓度达到5mg/ml(0.5%)时,储存96小时后放化纯仍旧高于95%。稳定效果超过临床常用的10%乙醇存储体系。
[0072]
实施例7
[0073]
本实施例公开了本发明的放射性药物组合物的制备方法:
[0074]
称取化合物c(100mg)溶于1.00ml无菌生理盐水中,制备成化合物c的储备液,其浓度为100mg/ml。然后分别取该储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物c的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
[0075]
将该四种溶液分别与等体积的
177
lu
‑
psma617(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物c浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
[0076]
将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时)取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例1的色谱条件测定
177
lu
‑
psma617的放射化学纯度。
[0077]
另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
psma617混合,阳性对照组为临床含10%乙醇的
177
lu
‑
psma617。空白对照组和阳性对照组中
177
lu
‑
psma617的体积比活度为0.5mci/ul。
[0078]
结果显示化合物c可以有效减弱
177
lu
‑
psma617的辐射自分解。具体如下表所示:
[0079]
表5化合物c对
177
lu
‑
psma617稳定性的影响结果表
[0080][0081]
测试结果:添加化合物c可以显著延缓
177
lu
‑
psma617的自分解,当产物溶液中化合物c浓度达到5mg/ml(0.5%)时,储存96小时后放化纯仍旧高于95%。稳定效果超过临床常用的10%乙醇存储体系。
[0082]
实施例8
[0083]
本实施例公开了本发明的放射性药物组合物的制备方法:
[0084]
称取化合物c(100mg)溶于1.00ml无菌生理盐水中,制备成化合物c的储备液,其浓度为100mg/ml。然后分别取该储备液10μl、20μl、50μl、100μl,使用无菌超纯水稀释至1.00ml,获得化合物c的四种不同浓度的溶液:1mg/ml、2mg/ml、5mg/ml、10mg/ml。
[0085]
将该四种溶液分别与等体积的
177
lu
‑
dotatate(体积比活度为0.5mci/μl)混匀,得到四种放射性药物组合物溶液(其中化合物c浓度分别为:0.5mg/ml、1mg/ml、2.5mg/ml、5mg/ml)。
[0086]
将该四种混合溶液置于室温(25℃)下储存一定时间,分别于6小时、12小时、24小时、48小时、96小时)取样,使用放射性高效液相色谱(radio
‑
hplc)按实施例2的色谱条件测定
177
lu
‑
dotatate的放射化学纯度。
[0087]
另设空白对照组和阳性对照组,其中空白对照组采用等体积的生理盐水与
177
lu
‑
dotatate混合,阳性对照组为临床含10%乙醇的
177
lu
‑
dotatate。空白对照组和阳性对照组中
177
lu
‑
dotatate的体积比活度为0.5mci/ul。
[0088]
结果显示化合物c可以有效减弱
177
lu
‑
dotatate的辐射自分解。具体如下表所示:
[0089]
表6化合物c对
177
lu
‑
dotatate稳定性的影响结果表
[0090][0091]
测试结果:添加化合物c可以显著延缓
177
lu
‑
dotatate的自分解,当产物溶液中化合物c浓度达到5mg/ml(0.5%)时,储存96小时后放化纯仍旧高于95%。稳定效果超过临床常用的10%乙醇存储体系。
[0092]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1