一种脱细胞基质、骨修复支架及其制备方法与流程
本发明涉及生物医学工程和生物医用材料技术领域,尤其是涉及一种脱细胞基质、骨修复支架及其制备方法。
背景技术:
来源于脱细胞基质的各种生物支架材料,在动物实验的临床前研究和人种疾病的临床应用中,已经取得了成功。通过去除各种组织器官中异种或同种异体细胞,保留其中复杂的结构和功能蛋白,即可得到相应组织器官的脱细胞基质。不同的脱细胞方法直接影响所得脱细胞基质的成分和超微结构,进而影响其性能。
目前对骨进行脱细胞处理以制备脱细胞基质,通常采用氯仿和甲醇混合液等有机溶剂,而由于骨组织微孔具有亲水性,这会妨碍微孔与有机溶剂的接触,进而影响潜在的抗原物质在处理过程中的去除,进而影响脱细胞基质的性能;另外,对于在处理过程中微孔深层表面吸附的有机溶剂,在清洗过程中可能没有完全清除,进而会造成有害物质残留,应用于人体可能会危害人体健康。因此,迫切需要寻求一种新型安全可靠的脱细胞基质制备方法。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出一种脱细胞基质、骨修复支架及其制备方法。
本发明的第一方面,提供一种脱细胞基质的制备方法,包括以下步骤:
s1、将骨组织器官进行脱细胞处理;
s2、对步骤s1处理所得产物进行超临界二氧化碳萃取。
根据本发明实施例的脱细胞基质的制备方法,至少具有如下有益效果:该制备方法通过先对骨组织器官进行脱细胞处理,再进行超临界二氧化碳萃取,其中,以超临界二氧化碳作为萃取剂,其比液体更易于扩散进入骨组织器官的微孔内,且具有很好的溶质能力,通过超临界二氧化碳萃取可使骨组织的微孔性更显著,可应用于制备生物支架材料,有利于移植后骨的诱导生长,不会引入有毒的化学物质,且一些非极性化合物(如碳水化合物、油、脂肪等)可溶于超临界二氧化碳,安全可靠,所制得脱细胞基质具有优秀的生物相容性。
根据本发明的一些实施例,步骤s1具体包括:将所述骨组织器官用含乙二胺四乙酸的pbs缓冲溶液进行脱细胞,而后用含十二烷基硫酸钠的tris缓冲液浸泡,再用pbs缓冲溶液进行洗涤。具体可将骨组织器官在室温下依次用含0.1~0.3%乙二胺四乙酸的pbs缓冲溶液脱细胞1~2h,含0.1~0.4%十二烷基硫酸钠的10mmtris缓冲液浸泡6~10h,再用pbs多次洗涤直到没有气泡。
根据本发明的一些实施例,步骤s2中,所述超临界二氧化碳萃取的萃取压力为15~20mpa,萃取温度为35~40℃,优选萃取温度为37℃。可设置最小压力为6~8mpa,最大压力为15~20mpa,系统温度为35~40℃;在最大压力下暴露10~15min,流速为10kg/h,随后在5~10min内降至常压。通过设置最小压力,以保证在处理过程中二氧化碳一直处于超临界状态。
根据本发明的一些实施例,所述骨组织器官选自松质骨、皮质骨中的至少一种,具体可采用来源于人、猪、狗、兔等的松质骨和皮质骨,如2~16周奶牛上肢软骨下区骨小梁;另外,在进行脱细胞处理前,可对骨组织器官先进行清洗,具体可采用高压水清洗。
本发明的第二方面,提供一种脱细胞基质,其由本发明第一方面所提供的任一种脱细胞基质的制备方法制得,所述脱细胞基质具有三维多孔结构。
本发明的第三方面,提供一种骨修复支架,其包括本发明第二方面所提供的任一种脱细胞基质和载药微球,所述载药微球吸附于所述脱细胞基质的表面和孔道内。
根据本发明实施例的骨修复支架,至少具有如下有益效果:该骨修复支架采用以上脱细胞基质与载药微球结合,其中,脱细胞基质具有优秀的生物相容性,载药微球具有药物缓释,两者结合使产品支架具有三维多孔结构,同时还有良好的释药性能,从而可弥补由于载药微球本身的形状和尺寸影响,不适合单独用于骨修复,以及脱细胞基质只能提供药物的短期释放,无法长效释放药物以持续刺激“病灶”部位,导致脱细胞基质也难以单独治疗缺损组织的缺陷。
根据本发明的一些实施例,所述载药微球包括载体微球和负载于所述载体微球上的药物,所述药物包括骨修复药物和/或生长因子,所述载体微球的原料包括可降解聚酯和介孔生物玻璃。由此,载药微球在具备良好释药性能的同时,还具有成骨分化能力,能有效促进骨组织的修复和重建。
其中,介孔生物玻璃可按照以下步骤制得:将2~5g十二烷胺溶于200~400ml去离子水和800ml无水乙醇中,40℃搅拌条件下顺序间隔30min加入5~10g正硅酸乙酯、1~9g磷酸三乙酯和6~13g四水硝酸钙,加入完全后,继续搅拌3h,而后将产生的白色凝胶离心或过滤后真空干燥24h,最后于600~700℃煅烧2~4h,得到介孔生物玻璃。
根据本发明的一些实施例,所述可降解聚酯选自聚乳酸、聚乳酸-羟基乙酸共聚物、聚己内酯、聚3-羟基烷酸酯、聚(3-羟基丁酸酯)、聚(3-羟基丁酸酯-co-3-羟基戊酸酯)、聚三亚甲基碳酸酯、聚丁二酸丁二酯中的至少一种;优选地,所述可降解聚酯的分子量为1.0~6.0万道尔顿。
根据本发明的一些实施例,所述药物选自骨形态发生蛋白-2(bmp-2)、骨形态发生蛋白-7(bmp-7)、血管内皮生长因子(vegf)、阿仑膦酸钠、柚皮甙、白藜芦醇中的至少一种;优选地,所述载药微球的载药率为40~80%,药物释放周期为21~24天。采用以上载药微球,药物控释能力强,适用于组织缺损、细菌感染、炎症等疾病的治疗。
本发明的第四方面,提供一种本发明第三方面所提供的任一种骨修复支架的制备方法,包括以下步骤:
(1)制备载药微球;
(2)将所述载药微球与脱细胞基质混合,以使所述载药微球覆于所述脱细胞基质的表面和填充于所述脱细胞基质的孔道中,在37~55℃条件下保温至所述载药微球粘结在所述脱细胞基质上。
以上制备方法,通过将载药微球与脱细胞基质混合,使载药微球覆于脱细胞基质的表面和均匀填充于脱细胞基质的孔道中,再通过37~55℃低温融合技术使载药微球固定到脱细胞基质的表面和孔道中,载药微球与脱细胞基质的结合方式简单,对设备的要求不高,易于实现产业化。
根据本发明的一些实施例,步骤(2)中所述载药微球与所述脱细胞基质的质量比为1:(3~10)。
步骤(1)中具体可采用乳化溶剂挥发法制备载药微球。根据本发明的一些实施例,步骤(1)具体包括:将药物与介孔生物玻璃混合,得到混合粉体;而后将所述混合粉体分散于可降解聚酯溶液中,得到共混液;再将所述共混液滴加到表面活性剂的水溶液中,而后进行固液分离,制得载药微球。其中,药物与介孔生物玻璃的质量比可控制在1:(5~10);表面活性剂可采用聚乙烯醇、明胶、甲基纤维素、吐温等,表面活性剂的水溶液的浓度一般为10~30mg/ml;制得载药微球后可用270~1600目不锈钢筛网分离出目标粒径的载药微球。
附图说明
下面结合附图和实施例对本发明做进一步的说明,其中:
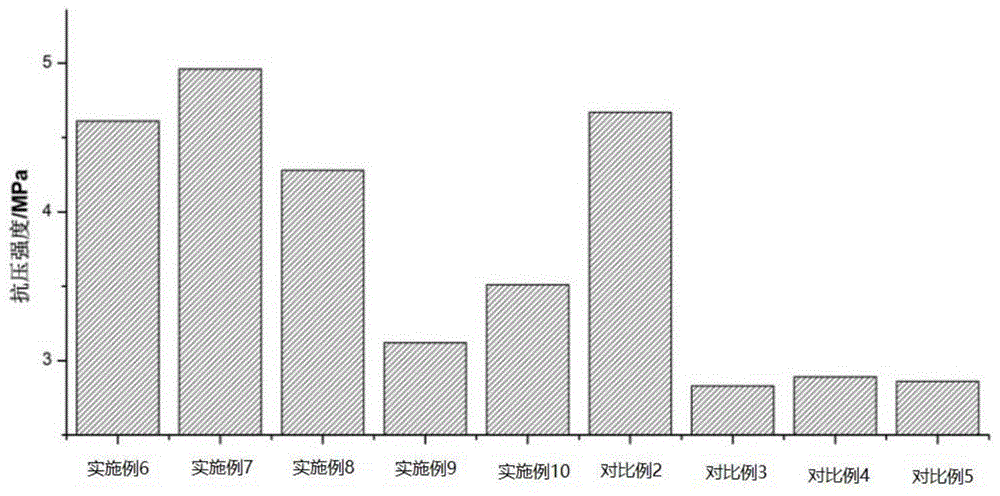
图1为本发明各实施例和对比例骨修复支架的抗压强度测试结果;
图2为本发明实施例6~10和对比例3骨修复支架的体外药物释放性能测试结果。
具体实施方式
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
(一)脱细胞基质的制备
实施例1
一种脱细胞基质,其制备方法包括以下步骤:
取6周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.2%乙二胺四乙酸的pbs缓冲溶液脱细胞2h,含0.3%十二烷基硫酸钠的10mmtris缓冲液浸泡6h,再用pbs多次洗涤直到没有气泡;随后使用超临界二氧化碳萃取技术对其进行处理,设置最小压力为6mpa,最大压力为15mpa,系统温度为37℃;具体先在最大压力下暴露12min,流速为10kg/h,随后在6min内降至常压,制得具有三维多孔结构的脱细胞基质。
实施例2
一种脱细胞基质,其制备方法包括以下步骤:
取4周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.1%乙二胺四乙酸的pbs缓冲溶液脱细胞1h,含0.25%十二烷基硫酸钠的10mmtris缓冲液浸泡7h,再用pbs多次洗涤直到没有气泡;随后使用超临界二氧化碳技术对其进行处理,设置最小压力为8mpa,最大压力为18mpa,系统温度为37℃;具体在最大压力下暴露10min,流速为10kg/h,随后在10min内降至常压,制得具有三维多孔结构的脱细胞基质。
实施例3
一种脱细胞基质,其制备方法包括以下步骤:
取16周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.3%乙二胺四乙酸的pbs缓冲溶液脱细胞2h,含0.1%十二烷基硫酸钠的10mmtris缓冲液浸泡10h,再用pbs多次洗涤直到没有气泡;随后使用超临界二氧化碳技术对其进行处理,设置最小压力为7mpa,最大压力为20mpa,系统温度为37℃;具体在最大压力下暴露15min,流速为10kg/h,随后在5min内降至常压,制得具有三维多孔结构的脱细胞基质。
实施例4
一种脱细胞基质,其制备方法包括以下步骤:
取8周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.1%乙二胺四乙酸的pbs缓冲溶液脱细胞1.5h,含0.2%十二烷基硫酸钠的10mmtris缓冲液浸泡8h,再用pbs多次洗涤,直到没有气泡;随后使用超临界二氧化碳技术对其进行处理,设置最小压力为8mpa,最大压力为18mpa,系统温度为37℃;具体在最大压力下暴露10min,流速为10kg/h,随后在7min内降至常压,制得具有三维多孔结构的脱细胞基质。
实施例5
一种脱细胞基质,其制备方法包括以下步骤:
取2周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.3%乙二胺四乙酸的pbs缓冲溶液脱细胞1h,含0.4%十二烷基硫酸钠的10mmtris缓冲液浸泡6h,再用pbs多次洗涤,直到没有气泡;随后使用超临界二氧化碳技术对其进行处理,设置最小压力为6mpa,最大压力为16mpa,系统温度为37℃;具体在最大压力下暴露14min,流速为10kg/h,随后在8min内降至常压,制得具有三维多孔结构的脱细胞基质。
对比例1
一种脱细胞基质,其制备方法与实施例1的不同之处在于:脱细胞处理之后不使用超临界二氧化碳萃取处理。其制备方法具体包括以下步骤:
取6周奶牛上肢软骨下区骨小梁,用高压水清洗;而后在室温下依次用含0.2%乙二胺四乙酸的pbs缓冲溶液脱细胞2h,含0.3%十二烷基硫酸钠的10mmtris缓冲液浸泡6h,再用pbs多次洗涤直到没有气泡,制得具有三维多孔结构的脱细胞基质。
(二)介孔生物玻璃的制备
以下骨修复支架制备过程所采用的介孔生物玻璃通过以下方法制得:
将4g十二烷胺溶于200ml去离子水和800ml无水乙醇中,40℃搅拌条件下顺序间隔30min加入5.8g正硅酸乙酯、6.7g磷酸三乙酯和10.9g四水硝酸钙,加入完全后,继续搅拌3h,而后将产生的白色凝胶离心或过滤后真空干燥24h,最后于650℃煅烧3h,得到介孔生物玻璃。
(三)骨修复支架的制备
实施例6
一种骨修复支架,其制备方法包括以下步骤:
(1)将20mg阿仑膦酸钠与180mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚乳酸-羟基乙酸共聚物(分子量:3万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置200ml含2g聚乙烯醇1799的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇1799水溶液中,300rpm下持续搅拌20h后将容器底部的复合微球分离出来,制得载药微球,并用900和1600目不锈钢筛网分离出目标粒径的载药微球备用;
(2)将10mg载药微球与50mg实施例1脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于40℃烘箱中,保温24h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
实施例7
一种骨修复支架,其制备方法包括以下步骤:
(1)将20mg白藜芦醇与200mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚三亚甲基碳酸酯(分子量:5万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置500ml含10g聚乙烯醇124的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇水溶液中,300rpm下持续搅拌16h后将容器底部的复合微球分离出来,制得载药微球,并用650和900目不锈钢筛网分离出目标粒径的微球备用;
(2)将10mg载药微球与30mg实施例2脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于55℃烘箱中,保温4h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
实施例8
一种骨修复支架,其制备方法包括以下步骤:
(1)将20mgbmp-7与100mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚己内酯(分子量:6万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置800ml含24g聚乙烯醇1788的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇水溶液中,800rpm下持续搅拌8h后将容器底部的复合微球分离出来,制得载药微球,并用270和460目不锈钢筛网分离出目标粒径的载药微球备用;
(3)将10mg载药微球与40mg实施例3脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于37℃烘箱中,保温24h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
实施例9
一种骨修复支架,其制备方法包括以下步骤:
(1)将20mgbmp-2与160mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚乳酸(分子量:1万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置600ml含24g聚乙烯醇1788的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇水溶液中,400rpm下持续搅拌16h后将容器底部的复合微球分离出来,制得载药微球,并用460和1600目不锈钢筛网分离出目标粒径的载药微球备用。
(2)将10mg载药微球与100mg实施例4脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于45℃烘箱中,保温16h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
实施例10
一种骨修复支架,其制备方法包括以下步骤:
(1)将20mgbmp-2与120mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚(3-羟基丁酸酯-co-3-羟基戊酸酯)(分子量:4万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置400ml含20g聚乙烯醇1799的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇水溶液中,500rpm下持续搅拌12h后将容器底部的复合微球分离出来,制得载药微球,并用460和650目不锈钢筛网分离出目标粒径的载药微球备用;
(2)将10mg载药微球与90mg实施例5脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于50℃烘箱中,保温16h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
对比例2
一种骨修复支架,本对比例骨修复支架与实施例6的不同之处在于:微球中不负载药物。其制备方法具体包括以下步骤:
(1)将180mg介孔生物玻璃分散于含10ml含1g聚乳酸-羟基乙酸共聚物(分子量:3万)的二氯甲烷溶液中,得到介孔生物玻璃/可降解聚酯共混液;配置200ml含2g聚乙烯醇1799的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇1799水溶液中,300rpm下持续搅拌20h后将容器底部的复合微球分离出来,制得微球,并用900和1600目不锈钢筛网分离出目标粒径的微球备用;
(2)将10mg微球与50mg实施例1脱细胞基质混合,以使微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于40℃烘箱中,保温24h直至微球牢固的粘结在脱细胞基质上,制得骨修复支架。
对比例3
一种骨修复支架,本对比例骨修复支架与实施例6的不同之处在于:不含微球,药物直接与脱细胞基质复合。其制备方法具体包括以下步骤:
将50mg实施例1脱细胞基质浸泡于1ml含20mg阿仑膦酸钠的水溶液中,置于40℃烘箱中,保温24h,制得骨修复支架。
对比例4
一种骨修复支架,本对比例骨修复支架与实施例6的不同之处在于:不含载药微球。其制备方法具体包括以下步骤:
将50mg实施例1脱细胞基质浸泡于1ml水中,置于40℃烘箱中,保温24h,制得骨修复支架。
对比例5
一种骨修复支架,本对比例骨修复支架与实施例6的不同之处在于:采用对比例1脱细胞基质代替实施例1脱细胞基质。其制备方法具体包括以下步骤:
(1)将20mg阿仑膦酸钠与180mg介孔生物玻璃混合得到药物与介孔生物玻璃的混合粉体,然后将上述混合粉体分散于含10ml含1g聚乳酸-羟基乙酸共聚物(分子量:3万)的二氯甲烷溶液中,得到载药的介孔生物玻璃/可降解聚酯共混液;配置200ml含2g聚乙烯醇1799的水溶液,然后将上述共混液缓慢滴加到聚乙烯醇1799水溶液中,300rpm下持续搅拌20h后将容器底部的复合微球分离出来,制得载药微球,并用900和1600目不锈钢筛网分离出目标粒径的载药微球备用;
(2)将10mg载药微球与50mg对比例1脱细胞基质混合,以使载药微球覆于脱细胞基质的表面和填充于脱细胞基质的孔道中,置于40℃烘箱中,保温24h直至载药微球牢固地粘结在脱细胞基质上,制得骨修复支架。
(四)骨修复支架的性能测试
采用以下方法分别对实施例6~10和对比例2~5骨修复支架进行性能测试,具体如下:
1、抗压强度测试
采用万能材料测试机对骨修复支架的抗压强度和抗压模量进行测试,测试时,探头的下降速度为5mm/min,取骨修复支架的规格为:直径为10mm,高度为20mm,测试所得结果如图1所示。由图1可知,脱细胞基质复合载药微球后,其抗压强度得到大幅度提升,更适于骨缺损的修复。其中,对比例5中采用未经超临界二氧化碳萃取处理制得的脱细胞基质代替实施例1脱细胞基质,所得脱细胞基质残留脂肪等物质,不利于与载药微球的结合,载药微球易从脱细胞基质上脱落,进而制得的骨修复支架抗压强度低于其他实施例骨修复支架的抗压强度。
2、体外细胞毒性评价
取以上制得的骨修复支架,按gb/t16886.5的要求进行评价,并按“浸提液细胞毒性形态学定性分级”进行计分。实验结果如下表1所示。
表1实施例6~10和对比例2~5骨修复支架的体外细胞毒性计分
由上表1可知,各实施例骨修复支架均无细胞毒性。
3、体外药物释放性能检测
将实施例6~10和对比例3的骨修复支架进行体外溶质释放评价,具体评价方法如下:体外溶质释放实验是在37℃,60rmp条件下,在恒温摇床中进行。具体将500mg的支架浸渍在200mlpbs(ph=7.4)中,定期收集测试液,并补充等量的pbs,将收集的测试液用高效液相色谱法(hplc)测定溶质含量;将某时间点溶质的吸光度代入到其标准曲线中,得到该时间点溶质释放的实际量;将实际量除以材料中负载溶质的总量,即得到该时间点溶质的累积释放量。按照以上方法对骨修复支架进行体外溶质释放评价,所得结果如图2所示。
由图2可知,与实施例6骨修复支架相比,对比例3骨修复支架不含微球,药物直接与脱细胞基质复合,进而使得对比例3骨修复支架缺少对药物的缓控释功能,只能提供药物的短期释放。
由上可知,本发明将载药微球复合至脱细胞基质后,可以保持良好的生物相容性,可大幅度提升材料的抗压强度,并可赋予材料药物的缓控释功能,使其适用于骨组织的修复和再生。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!