共载DTIC和miRNA-34a的靶向纳米给药系统及其制备方法和应用与流程
共载dtic和mirna-34a的靶向纳米给药系统及其制备方法和应用
技术领域
[0001]
本发明属于医药技术领域,涉及共载dtic和mirna-34a的靶向纳米给药系统及其制备方法和应用。
背景技术:
[0002]
恶性黑色素瘤(mm)是一种高度侵入性、高度转移且对放疗和化疗不敏感的恶性肿瘤,是皮肤癌中最常见的恶性疾病之一,5年生存率小于5%,平均中位生存时间仅6个月。目前尚无针对转移性恶性黑色素瘤(mmm)的有效治疗方法。临床上主要采用细胞毒性达卡巴嗪(dtic)治疗转移性恶性黑色素瘤,然而,dtic是一种靶向性差、副作用强、应答率低的dna烷基化制剂,是造成耐药、转移和复发的主要原因,使得黑色素瘤治疗失败。近年来发现,恶性黑色素瘤的发展与多种癌基因和抑癌基因的突变有关,针对突变基因的基因疗法为黑色素瘤治疗提供了新思路。
[0003]
微小rna(mirna)是治疗癌症的新策略。mirna是高度保守的小型非编码rna,可在转录水平上调控基因表达,mirna的异常调节与许多癌症有关。研究人员发现,mirna-34a可以参与p53通路并调节其表达,p53通过抑制sirti和e2f3的活性,可以有效抑制恶性黑色素瘤细胞的增殖、侵袭和转移。
[0004]
单独的化学疗法或基因疗法在肿瘤治疗方面存在很多缺陷,将两者结合的联合疗法可以协同治疗肿瘤,克服单一疗法的不足。将mirna-34a和dtic相联合,dtic和mirna-34a发挥协同作用,增强对恶性黑色素瘤细胞的杀伤作用并抑制其侵袭和转移。
[0005]
纳米载体是一种非常有效的药物递送载体,已经广泛应用于疾病治疗。tai等报道了基于含有精氨酸和组氨酸的二硫键交联的聚乳酸的阳离子还原反应载体,所述载体可在体内外有效传递基因药物(tai z,wang x,tian j,gao y,zhang l,yao c,wu x,zhang w,zhu q,gao s:biodegradable stearylated peptide with internal disulfide bonds for efficient delivery of sirna in vitro and in vivo.biomacromolecules 2015,16(4):1119-1130.)。然而,该阳离子还原反应载体仅装载了基因药物,不能装载、传递和靶向释放化合物药物。
技术实现要素:
[0006]
针对现有技术的不足和实际需求,本发明提供了共载dtic和mirna-34a的靶向纳米给药系统及其制备方法和应用,化疗药物和基因药物共载于新型多肽胶束中,克服了化疗过程中药效低、副作用强和耐药性等问题,实现了对黑色素瘤的协同治疗效果。
[0007]
为达此目的,本发明采用以下技术方案:
[0008]
第一方面,本发明提供了一种共载dtic和mirna-34a的靶向纳米给药系统,所述靶向纳米给药系统包括聚乳酸-多肽胶束和共载于所述聚乳酸-多肽胶束中的dtic和mirna-34a。
[0009]
本发明中,以两亲性聚乳酸-多肽胶束为药物载体,将化疗药物dtic和基因药物mirna-34a包载于胶束载体中,所述两亲性聚乳酸-多肽胶束在中性环境下结构稳定,在酸性条件下结构解聚,释放包载的dtic和mirna-34a,实现了药物的靶向释放,所述靶向纳米给药系统将化学疗法和基因疗法相结合,对黑色素瘤细胞具有显著增强的协同治疗作用。
[0010]
优选地,所述聚乳酸-多肽胶束由两亲性聚乳酸-多肽聚合物自组装形成,所述两亲性聚乳酸-多肽聚合物包括seq id no:1所示的亲水性多肽和提供组装驱动力的疏水性聚乳酸;
[0011]
所述亲水性多肽形成聚乳酸-多肽胶束的外壳,所述疏水性聚乳酸形成聚乳酸-多肽胶束的内核;
[0012]
所述两亲性聚乳酸-多肽聚合物上还连接有靶向黑色素瘤细胞的多肽适配体;
[0013]
seq id no:1:hhhrrrrrrrr。
[0014]
优选地,所述多肽适配体包括seq id no:2所示的氨基酸序列;
[0015]
seq id no:2:yckvilthrcy。
[0016]
本发明中,在聚乳酸-多肽胶束上连接靶向黑色素瘤细胞的多肽适配体,提高了靶向纳米给药系统对黑色素瘤细胞的靶向性和渗透性,解决了dtic靶向性差的问题,显著提高了靶向纳米给药系统的靶向治疗效果。
[0017]
优选地,所述聚乳酸-多肽胶束具有式i所示的结构式;
[0018][0019]
优选地,所述靶向纳米给药系统的粒径为150~250nm,优选为150nm。
[0020]
第二方面,本发明提供了一种第一方面所述的共载dtic和mirna-34a的靶向纳米给药系统的制备方法,所述制备方法包括以下步骤:
[0021]
(1)向聚乳酸-多肽胶束中滴加dtic,进行超声乳化处理;
[0022]
(2)将超声乳化后的混合液进行磁力搅拌,去除未包封的dtic后,制得包载dtic的聚乳酸-多肽胶束;
[0023]
(3)向所述包载dtic的聚乳酸-多肽胶束中加入mirna-34a,混合孵育,得到所述共载dtic和mirna-34a的靶向纳米给药系统。
[0024]
优选地,步骤(1)所述dtic与所述聚乳酸-多肽胶束的质量比为(0.5~1):1,例如
可以是0.5:1、0.6:1、0.7:1、0.8:1、0.9:1或1:1,优选为0.6:1。
[0025]
优选地,步骤(1)所述超声乳化处理的温度为0~4℃,例如可以是0℃、1℃、2℃、3℃或4℃,优选为0℃。
[0026]
优选地,步骤(1)所述超声乳化处理的功率为80~150w,例如可以是80w、90w、100w、110w、120w、130w、140w或150w,优选为100w。
[0027]
优选地,步骤(1)所述超声乳化处理的时间为20~40s/次,共进行2~4次,优选为30s/次,共进行2次。
[0028]
优选地,步骤(2)所述磁力搅拌的时间为12~24h,例如可以是12h、13h、14h、15h、16h、17h、18h、19h、20h、21h、22h、23h或24h。
[0029]
优选地,步骤(2)所述去除未包封的dtic采用过滤的方法进行。
[0030]
优选地,步骤(3)所述mirna-34a与所述包载dtic的聚乳酸-多肽胶束的n/p比为(2.5~20):1,例如可以是2.5:1、5:1、10:1或20:1,优选为10:1。
[0031]
优选地,步骤(3)所述混合孵育的温度为15~30℃,例如可以是15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃或30℃。
[0032]
优选地,步骤(3)所述混合孵育的时间为20~60min,例如可以是20min、25min、30min、35min、40min、45min、50min、55min或60min,优选为30min。
[0033]
作为优选技术方案,所述共载dtic和mirna-34a的靶向纳米给药系统的制备方法包括以下步骤:
[0034]
(1)按dtic与聚乳酸-多肽胶束的质量比为(0.5~1):1向聚乳酸-多肽胶束中滴加dtic,在0~4℃、80~150w下超声乳化处理20~40s/次,共进行2~4次;
[0035]
(2)将超声乳化后的混合液磁力搅拌12~24h,过滤去除未包封的dtic后,制得包载dtic的聚乳酸-多肽胶束;
[0036]
(3)按照n/p比为(2.5~20):1向所述包载dtic的聚乳酸-多肽胶束中加入mirna-34a,15~30℃避光混合孵育20~60min,得到所述共载dtic和mirna-34a的靶向纳米给药系统。
[0037]
第三方面,本发明提供了第一方面所述的靶向纳米给药系统在制备肿瘤治疗药物中的应用。
[0038]
优选地,所述肿瘤包括黑色素瘤。
[0039]
与现有技术相比,本发明具有如下有益效果:
[0040]
(1)本发明采用两亲性聚乳酸-多肽胶束作为载药系统,构建共载化疗药物dtic和基因药物mirna-34a的靶向纳米给药系统,聚乳酸-多肽胶束有效将dtic和mirna-34a递送至细胞质中,细胞摄取率高,细胞毒性低,安全性高;
[0041]
(2)本发明传递至细胞质中的dtic和mirna-34a发挥协同作用,有效抑制黑色素瘤细胞增殖并促进黑色素瘤细胞凋亡;
[0042]
(3)本发明的共载dtic和mirna-34a的靶向纳米给药系统的体内药效显著,聚乳酸-多肽胶束介导dtic和mirna-34a躲避res清除,靶向至肿瘤部位,发挥协同抗肿瘤增殖作用,治疗效果好,安全性高,为临床治疗黑色素瘤和其他肿瘤提供了参考和有益借鉴。
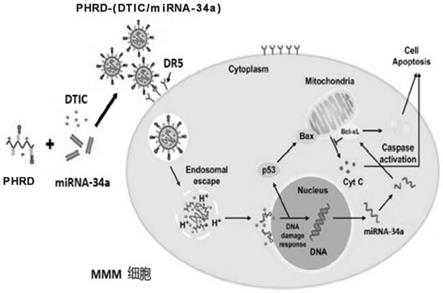
34a的聚乳酸-多肽胶束(co-phrd),同时设置对照组phrd-pe-dtic(载有pe标记dtic)、phrd-fam-mirna-34a(载有fam标记mirna-34a),考察dtic和mirna-34a在phrd的介导下进入细胞的情况,原理示意图如图1所示。
[0059]
步骤如下:
[0060]
a375细胞使用含10%胎牛血清的dmem培养基、在37℃、5%co2条件下培养,每隔1天换液一次,生长至80%融合状态用于实验;将a375细胞以3
×
105个/孔的密度铺于12孔板中,向每孔中添加不含血清的dmem培养基至体积为1ml,随后将12孔板置于co2孵箱中继续培养24h;
[0061]
弃旧培养基,分别加入新制备的phrd-pe-dtic、phrd-fam-mirna-34a或co-phrd,置于co2孵箱中继续培养1h和4h;
[0062]
取出12孔板,弃旧培养基,pbs洗涤1次后进行胰酶消化,1300rpm离心5min收集细胞,用pbs重悬洗涤1次,再加入300μl pbs重悬,以12孔板中未作处理的细胞为阴性对照,利用流式细胞仪检测a375细胞对pe-dtic和fam-mirna-34a的摄取情况。
[0063]
图2a为pe流式细胞仪的检测数据,从图2a和图2b可以看出,a375对1h co-phrd、4h co-phrd和phrd-pe-dtic有很高的摄取能力,摄取率分别为75.12
±
5.03%、99.91
±
6.39%和99.51
±
5.34%,但是对单独的pe-dtic几乎不摄取;
[0064]
图2c为fam流式细胞仪的检测数据,从图2c和图2d可以看出,a375对4h co-phrd和phrd-fam-mirna-34a有很高的摄取能力,摄取率分别为94.9
±
6.14%和88.96
±
5.02%,对1h co-phrd的摄取率为13.25
±
4.01%,可能受到孵育时间的影响,但也明显高于单独的fam-mirna-34a。
[0065]
说明黑色素瘤a375细胞可以高效摄取共载有化疗药物dtic和基因药物mirna-34a的多肽胶束co-phrd。
[0066]
实施例3 phrd-(dtic/mirna-34a)的抗黑色素瘤细胞增殖作用
[0067]
本实施例采用细胞生存力测定法监测blank-phrd、游离dtic、游离mirna-34a、phrd-dtic和phrd-mirna-34a在a375细胞中的细胞毒性。
[0068]
将a375细胞以5000个/孔的密度铺板于96孔板中,隔天加入上述药物,于培养箱中培养72h;再加入20μg/ml mtt避光孵育4h,吸去液体,每孔加入150μl dmso,震荡混匀后置于酶标仪上,测定490nm处吸光度。
[0069]
如图3a所示,a375或nih3t3与blank-phrd(0.1~100μg/ml)孵育72小时后,未观察到明显的细胞毒性,blank-phrd在浓度高达100μg/ml时,对细胞活力也没有显著影响,细胞活力均保持在大约80%以上,说明该靶向递释系统具有良好的安全性,是一种安全的药物载体。
[0070]
如图3b所示,在几乎所有浓度下,phrd-dtic的抑制作用均高于游离dtic的抑制作用,这可能是由于大小约150nm的纳米载体可以被细胞快速摄取并从phrd-dtic中持续释放dtic,而游离的疏水性dtic需要在蛋白通道(例如脂蛋白、白蛋白和酸性糖蛋白)的帮助下才能进入细胞;同样,如图3c所示,在几乎所有浓度下,phrd-mirna-34a的抑制作用均高于游离mirna-34a的抑制作用,表明phrd成功将mirna-34a递送至细胞中导致细胞活力丧失。
[0071]
游离dtic的ic50为6.287
±
4.106μg/ml,phrd-dtic的ic50为2.609
±
2.425μg/ml,游离mirna-34a的ic50为1.894
±
4.627μg/ml,phrd-mirna-34a的ic50为1.81
±
5.13μg/ml。
说明phrd载dtic与mirna-34a可以增强dtic和mirna-34a对a375细胞的抗增殖作用。
[0072]
实施例4 dtic和mirna-34a的协同作用
[0073]
将a375细胞以5000个/孔的密度接种于96孔板中,每孔加入200μl含10%fbs的新鲜dmem培养基,37℃、5%co2孵箱中培养24h;根据游离dtic、游离mirna-34a、phrd-dtic和phrd-mirna-34a的ic50,选用ic50浓度以下的浓度进行协同作用考察。
[0074]
利用mtt法、联合指数和等效线分析法,以a375细胞为研究对象,设置不同药物梯度(dtic:0.1、0.3、1、3μg/ml,mirna-34a:0.5、1、1.5、2μg/ml,phrd-dtic:0.1、0.3、1、3μg/ml,phrd-mirna-34a:0.5、1、1.5、2μg/ml),进行单独及联合给药,测定72h细胞存活率,并用联合用药软件compusyn分析得到等效线图及联合指数ci。
[0075]
如图4a和图4b所示,dtic与mirna-34a联合用药、phrd-dtic与phrd-mirna-34a联合用药均能显著抑制a375的生长。具体地,在dtic为3μg/ml、mirna-34a为1μg/ml的剂量下,具有最小的ci值,ci<1,表明dtic和mirna-34a具有协同效应;在phrd-dtic为1μg/ml、phrd-mirna-34a为0.5μg/ml的剂量下,具有最小的ci值,ci<1,表明phrd-dtic和phrd-mirna-34a具有协同效应,并且载药胶束在更小的浓度下起到抑制作用。
[0076]
实施例5 phrd-(dtic/mirna-34a)诱导黑色素瘤细胞凋亡作用
[0077]
本实施例进一步考察dtic和mirna-34a对a375细胞凋亡的影响。
[0078]
待a375细胞培养至80%融合状态时,胰酶消化并计数,以3
×
105个/孔的密度接种于12孔板中,每孔加入含10%fbs的新鲜dmem培养基,于37℃、5%co2孵箱中培养24h;
[0079]
弃去培养基,更换为新鲜的含10%fbs的dmem培养基,将游离dtic、游离mirna-34a、dtic+mirna-34a、phrd-dtic、phrd-mirna-34a、phrd-(dtic/mirna-34a)加入培养孔中,37℃、5%co2培养箱中培养72h;
[0080]
取出培养板,pbs清洗一次,胰酶消化后离心收集,pbs清洗三次,重悬于300μl pbs中;依次加入5μl apc annexin v和10μl pi,涡旋混匀,避光孵育15min;加入400μl annexin v binding buffer,进行流式细胞仪上机检测。
[0081]
从图5a和图5b可以看出,向a375中添加dtic、mirna-34a、dtic+mirna-34a、phrd-dtic、phrd-mirna-34a或phrd-(dtic/mirna-34a)(co-phrd)后,a375细胞凋亡率分别为12.07%、5.23%、40.82%、28.3%、19.63%或60.25%,co-phrd的介导的细胞凋亡率显著高于phrd-dtic和phrd-mirna-34a(p<0.01)。说明多肽胶束共载化疗药物dtic和基因药物mirna-34a可以起到协同促a375细胞凋亡的作用,且可能将细胞凋亡阻滞于晚期阶段,有待进一步验证。
[0082]
实施例6 phrd-(dtic/mirna-34a)的体内药效
[0083]
本实施例首先建立人黑色素瘤细胞裸鼠移植瘤模型:取对数生长期的a375细胞,吸去培养基,pbs清洗后用胰酶消化,二次清洗后进行细胞计数,然后用无菌pbs调整细胞浓度至2
×
107个/ml;加入等体积基质胶bd matrigel(-80℃保存,使用前一晚置于4℃)混匀,接种前置于冰盒中;选取balb/c裸鼠,取细胞悬液接种至裸鼠背部皮下(0.2ml/只)。
[0084]
本实施例进一步研究载有dtic的胶束在a375人荷瘤裸鼠体内的抗肿瘤作用以及dtic和mirna-34a的协同作用。
[0085]
每隔2天对实施例7构建的肿瘤小鼠的体重与肿瘤大小进行测量,肿瘤体积=(最长径
×
垂直径2)/2,待肿瘤体积长至100mm3,每隔4天给药;具体给药方法为将以下各组药物
溶于0.l ml pbs中,经超声分散后尾静脉注射至肿瘤小鼠内。
[0086]
分组如下:pbs空白对照组(control)、phrd组(blank-phrd)、dtic组、phrd-dtic组、phrd-mirna-34a组、phrd-(dtic/mirna-34a)组(co-phrd)。
[0087]
如图6a所示为肿瘤体积随时间推移的变化,与control相比,blank-phrd对肿瘤生长的抑制作用非常不明显,说明多肽胶束本身不具有抗肿瘤增殖作用;游离dtic、phrd-dtic、phrd-mirna-34a和co-phrd均在不同水平上显示出抑瘤效果。结合图6b可以看出,与其他组相比,co-phrd显示出显著的抗肿瘤活性,说明了dtic和mirna-34a的协同作用(p<0.01)。
[0088]
综上所述,本发明基于两亲性聚乳酸-多肽胶束,构建共载化疗药物dtic和基因药物mirna-34a的靶向纳米给药系统,所述靶向纳米给药系统细胞摄取率高,安全性高,进入黑色素瘤细胞质中的dtic和mirna-34a发挥协同抗肿瘤作用,在黑色素瘤治疗领域具有广泛的应用前景。
[0089]
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1