一种光控释放锌离子的纳米粒子及其制备方法与应用
1.本发明属于医用材料技术领域,具体涉及一种光控释放锌离子的纳米粒子及其制备方法与应用。
背景技术:
2.锌离子是人体中含量仅次于铁离子的过渡金属离子,参与人体的很多生理过程,例如信号传输和调节基因表达等,其中大部分锌离子以金属蛋白的形式紧密键合,从而维持蛋白的正常生理功能。其中有些酶活性的激活需要锌离子的参与,这些酶统称为锌酶,例如碳酸酐酶、天冬氨酸蛋白水解酶和蛋白磷酸酶等,这些酶广泛分布于体内,在细胞代谢、维持细胞酸碱平衡、参与细胞凋亡过程等方面发挥着重要的作用。而这些锌酶的活性均受到锌离子浓度的影响,并与生理活动密切相关。因此通过调控锌离子浓度,可以有效调控锌酶活性及相应的生理过程。
3.传统的锌离子浓度的调控方法通常基于锌盐(例如,葡萄糖酸锌,硫酸锌),氧化锌或锌离子络合物(例如吡啶硫酮锌)等。但是,这些方法很难精确控制释放的锌离子的浓度和位置,并且存在进细胞效率低,对细胞的毒性强等缺点。不加以控制的锌离子释放可能会导致锌离子浓度过高,从而引起严重的副作用,例如铜和铁离子摄入不足,免疫功能受损和其他明显的毒性症状。因此,精准的锌离子释放方法显得十分必要。
4.通过光来调控金属离子的释放具有高时空分辨性的优势,可以精准控制锌离子释放的区域及浓度。目前已经报道了几种不同的锌离子光控释放体系,然而,这些传统的光控释放锌离子的方法,通常需要在锌离子配体上修饰光剪切基团,不仅合成步骤复杂,而且由于光剪切反应普遍存在副反应,很可能生成毒副产物。因此,为了实现锌离子的精准控释,需要构建一种合成简单、生物相容性好的光控释放锌离子体系。
技术实现要素:
5.为解决现有技术的缺点和不足之处,本发明的首要目的在于提供一种光控释放锌离子的纳米粒子的制备方法。
6.本发明的另一目的在于提供上述方法制得的一种光控释放锌离子的纳米粒子。
7.本发明的再一目的在于提供上述一种光控释放锌离子的纳米粒子在体外非治疗目的调控锌酶活性的应用。
8.本发明目的通过以下技术方案实现:
9.一种光控释放锌离子的纳米粒子的制备方法,是由锌离子配合物、两亲性聚合物和细胞穿透性多肽制成,具体包括以下步骤:
10.(1)将式i所示的锌离子配合物溶解于二甲基亚砜(dmso)中,并加入到两亲性聚合物水溶液中,超声反应,得到纳米粒子溶液;
[0011][0012]
式i中,r1、r2为独立的氢、c1‑6烷基、卤素、c1‑6烷基氧基或c1‑6烷基硫基;
[0013]
其中两亲性聚合物为二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇(dspe
‑
peg)、二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
马来酸酐(dspe
‑
peg
‑
mal)、二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
羧基(dspe
‑
peg
‑
cooh)、二硬脂酰基磷脂酰乙醇胺
ꢀ‑
聚乙二醇
‑
氨基(dspe
‑
peg
‑
nh2)、二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
炔基 (dspe
‑
peg
‑
c≡ch)和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
叠氮(dspe
‑
peg
‑
n3)中的至少一种;
[0014]
(2)在步骤(1)的纳米粒子溶液中加入细胞穿透性多肽,室温下反应,得到含有光控释放锌离子的纳米粒子的溶液,超滤离心除去残余的有机溶剂并浓缩,得到光控释放锌离子的纳米粒子。
[0015]
优选地,步骤(1)所述锌离子配合物为2
‑
(2
‑
羟苯基)
‑
苯并噻唑啉。
[0016]
优选地,步骤(1)中两亲性聚合物为二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
ꢀ‑
2000与二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000
‑
马来酸酐的混合物。
[0017]
优选地,步骤(1)所述二甲基亚砜与水的体积比为1:(10
‑
1000),锌离子配合物和两亲性聚合物的质量比为1:(1
‑
5)。
[0018]
优选地,步骤(1)所述锌离子配合物溶解于二甲基亚砜后所得溶液的浓度为10
‑
100mmol/l。
[0019]
优选地,步骤(1)所述超声的时间为5
‑
30分钟。
[0020]
优选地,步骤(2)所述细胞穿透性多肽与两亲性聚合物的摩尔比为1
‑
10: 1。
[0021]
优选地,步骤(2)所述细胞穿透性多肽为tat(rkkrrqrrrc)、 rqikiwfqnrrmkwkk、galflgwlgaagstmgawsqpkkkrkv、 aavallpavllallap、liklwshlihiwfqnrrlkwkkk、 klalklalkalkaalkla和gwtlnsagyllkinlkalaalakkil中的至少一种。
[0022]
优选地,步骤(2)所述反应的时间为0.5
‑
3小时。
[0023]
由上述方法制得的光控释放锌离子的纳米粒子,可通过光调控锌离子的释放,其中光源包括365nm紫外光或白光。
[0024]
由上述制得的光控释放锌离子的纳米粒子可以用于对锌酶活性的调控。
[0025]
上述方法制得的一种光控释放锌离子的纳米粒子。
[0026]
上述一种光控释放锌离子的纳米粒子在体外非治疗目的调控锌酶活性中的应用。
[0027]
优选地,所述锌酶为碳酸酐酶、蛋白磷酸酶2a、caspase
‑
3酶。
[0028]
在本发明中,“锌酶”是指在活性中心需要有锌离子参与的酶。
[0029]
与现有技术相比,本发明具有以下优点及有益效果:
[0030]
1、本发明的纳米粒子在紫外光或白光照射下可以实现快速、精准的锌离子释放。
[0031]
2、本发明的纳米粒子可以快速进入细胞,纳米粒子具有良好的生物相容性,并能够实现细胞内外的锌酶活性的调控。
附图说明
[0032]
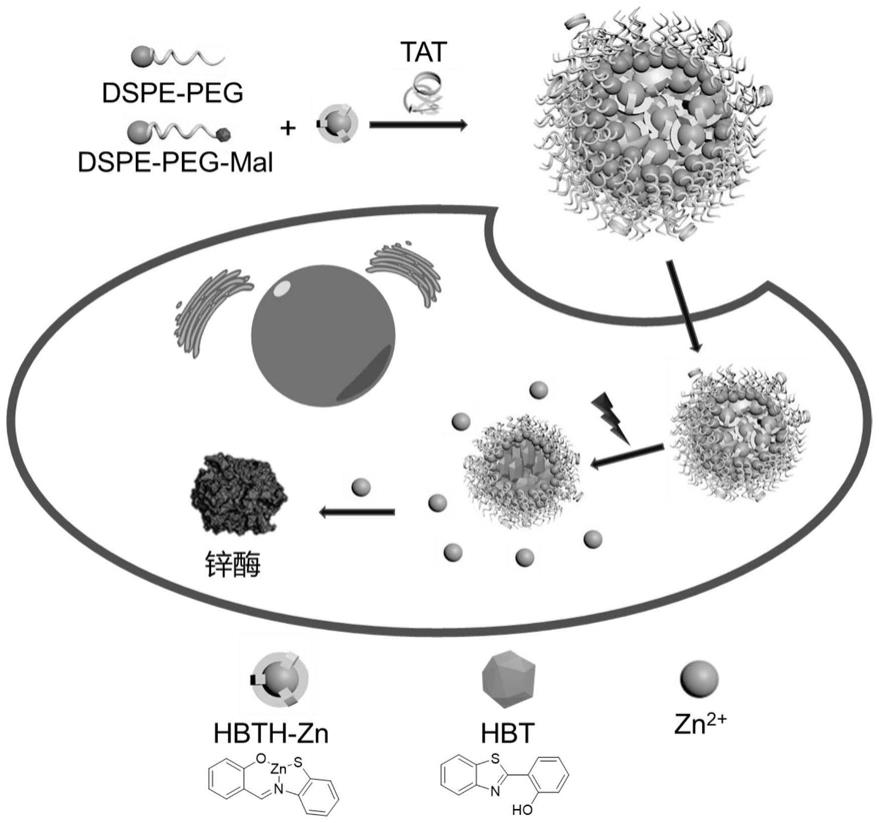
图1为hbth
‑
zn
‑
tat纳米粒子通过光触发释放锌离子调节锌酶活性的示意图。
[0033]
图2为通过动态光散射和透射电镜表征的hbth
‑
zn纳米粒子在修饰细胞穿透性多肽tat(rkkrrqrrrc)之前(a)和之后(b)的粒径,插图为相应的透射电子显微镜照片,比例尺为250nm。
[0034]
图3为hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子)在白光照射下(a)紫外可见吸收和(c)荧光光谱随光照时间的变化;(b)hbth
‑
zn
‑
tat 纳米粒子在405nm处的吸收相对强度随光照时间的变化;(d)在最大发射波长处的荧光强度和初始荧光强度的比值(i/i0)随光照时间的变化;激发波长为 365nm。
[0035]
图4为hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子)在365nm 紫外灯照射下(a)紫外可见吸收和(c)荧光光谱随光照时间的变化;(b) hbth
‑
zn
‑
tat纳米粒子在405nm处的吸收相对强度随光照时间的变化;(d) 在最大发射波长处的荧光强度和初始荧光强度的比值(i/i0)随光照时间的变化。激发波长为365nm。
[0036]
图5为hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子)在365nm 紫外灯光照下,在不同ph的缓冲溶剂中的紫外可见吸收和荧光强度随光照时间的变化。(a,d)ph=5.0;(b,e)ph=7.0;(c,f)ph=9.0。
[0037]
图6(a)为hbth
‑
zn
‑
tat纳米粒子(含100μmol/l的hbth
‑
zn分子) 在白光光照下的锌离子释放曲线;(b)随着白光光照时间的变化,碳酸酐酶降解底物生成的4
‑
硝基苯酚在pbs缓冲液(10mmol/l,ph=7.4)中400nm处吸光度变化,其中除去内源锌的碳酸酐酶的浓度为0.3mg/ml,乙酸4
‑
硝基苯酯浓度为1mmol/l,hbth
‑
zn
‑
tat纳米粒子中含有10μmol/l的hbth
‑
zn分子。
[0038]
图7(a)为hbth
‑
zn
‑
tat纳米粒子(含100μmol/l的hbth
‑
zn分子) 在365nm紫外光照射下的锌离子释放曲线;(b)随着紫外光光照时间的变化,碳酸酐酶降解底物生成的4
‑
硝基苯酚在pbs缓冲液(10mmol/l,ph=7.4)中 400nm处吸光度变化,其中除去内源锌的碳酸酐酶的浓度为0.3mg/ml,乙酸 4
‑
硝基苯酯浓度为1mmol/l,hbth
‑
zn
‑
tat纳米粒子中含有10μmol/l的 hbth
‑
zn分子。
[0039]
图8为与含有不同hbth
‑
zn分子浓度的hbth
‑
zn
‑
tat纳米粒子共孵育后,(左)nih
‑
3t3细胞或(右)pc
‑
12细胞在有或没有白光照射(10mw
·
cm
‑2, 15分钟)时的细胞毒性。
[0040]
图9(a)是用fluozin
‑
3(1.0μmol/l)和hbth
‑
zn
‑
tat纳米粒子(含50 μmol/l的hbth
‑
zn分子)共孵育的pc
‑
12细胞在白光照射下不同时间后的激光共聚焦图像;激发波长为488nm,接收波长为495
‑
650nm,比例尺为20μm; (b)用fluozin
‑
3(1.0μmol/l)和hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的 hbth
‑
zn分子)孵育的pc
‑
12细胞在白光光照不同时间后,用流式细胞术测定 fluozin
‑
3荧光强度;(c)通过icp
‑
ms测量的细胞内锌离子浓度。
[0041]
图10(a)hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子)与 pc
‑
12细胞共孵育,然后在白光光照不同时间后,对细胞蛋白磷酸酶2a活性的调控;(b)hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子)与nih
‑
3t3 细胞共孵育,然后在白光光照不同时间后,对细胞caspase
‑
3酶活性的调控。
[0042]
图11为hbth
‑
zn的核磁氢谱。
[0043]
图12为hbth
‑
zn的核磁碳谱。
具体实施方式
[0044]
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0045]
本发明实施例中未注明具体条件者,按照常规条件或者制造商建议的条件进行。所用未注明生产厂商者的原料、试剂等,均为可以通过市售购买获得的常规产品。
[0046]
实施例1
[0047]
hbth
‑
zn的制备:
[0048]
向水杨醛(122mg,1.0mmol)的无水乙醇(10ml)溶液中加入2
‑
氨基苯硫醇(125mg,1.0mmol)。将混合物溶液在室温避光搅拌6小时后,产生浅黄色固体。将粗产物过滤并用乙醇洗涤,真空干燥。然后将得到的hbth(57mg, 0.25mmol)溶解在5ml乙腈中,逐滴加入溶解在2ml的甲醇中的乙酸锌(46 mg,1.0mmol)。通过过滤得到橙色固体,用甲醇和乙腈洗涤,真空干燥,得到 hbth
‑
zn(58mg,收率80%)。结构表征相关数据如下:
[0049]1h nmr(400mhz,dmso
‑
d6)δ8.72(s,1h),7.52
‑
7.30(m,3h),7.21(t,j= 8.0hz 1h),6.99
‑
6.83(m,2h),6.74(d,j=7.7hz,1h),6.55(t,j=6.9hz,1h). 13
c nmr(cdcl3,125mhz)δ161.6,144.7,144.4,135.7,133.5,132.3,126.3,122.6, 121.8,120.4,116.1,113.9。
[0050]
实施例2
[0051]
hbth
‑
zn
‑
tat纳米粒子的制备:
[0052]
将浓度100mmol/l的hbth
‑
zn的30μl dmso溶液缓慢滴加到2970μl 的含有二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000(0.5mg/ml)和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000
‑
马来酸酐(0.5mg/ml)的超纯水中,然后再加入3ml 超纯水。将该溶液在冰浴中超声5分钟(20%输出,scientz
‑
ii d超声仪)。往该溶液中加入1.5mg的tat(rkkrrqrrrc),所获得的纳米粒子进一步与 tat(rkkrrqrrrc)室温下反应2小时。然后通过超滤离心浓缩(截留分子量=10kda)以去除dmso和未反应的tat,得到纯化后的hbth
‑
zn
‑
tat纳米粒子,加水稀释以获得含有不同浓度hbth
‑
zn分子浓度的hbth
‑
zn
‑
tat纳米粒子。
[0053]
实施例3
[0054]
图2为hbth
‑
zn
‑
tat纳米粒子的粒径与表面电势表征:
[0055]
hbth
‑
zn纳米粒子和hbth
‑
zn
‑
tat纳米粒子的粒径通过动态光散射测量,其粒径分别为150.1nm和142.9nm,这与透射电子显微镜拍摄的图像中的粒径一致(图2内插图)。此外,纳米粒子修饰tat前后的zeta电位从
‑
16.3变为 22.8ev,证明了带正电荷的tat的成功修饰。
[0056]
实施例4
[0057]
如图3、4、5所示,hbth
‑
zn
‑
tat纳米粒子在光照下的紫外吸收和荧光光谱的变化证明了hbt
‑
zn在光照下发生了结构转变:
[0058]
在10mw
·
cm
‑2的白光照射下10分钟后,hbth
‑
zn
‑
tat纳米粒子在405nm 处的吸光度逐渐降低了1.9倍,而荧光强度则增强了1.3倍,并伴随着最大发射波长从570nm到510nm的蓝移(图3)。最大发射峰变为520nm可能归因于激发态的hbt的酮式发光,这通过ph依赖的pl光谱得到了证实(图5)。在 5mw
·
cm
‑2的365nm紫外光的照射下也有类似的效果(图4)。
[0059]
实施例5
[0060]
光照释放的锌离子浓度通过锌离子定量试剂盒测量。锌离子可以在白光或 365nm光照下快速释放,并在黑暗中立刻停止(图6a和图7a)。第1分钟光照后立刻释放了2μmol/l的锌离子,在15分钟的光照后可以累积释放约25 μmol/l的锌离子。基于这种光响应的快速开关性能,以碳酸酐酶为例研究了光控释放的锌离子对锌酶活性的调控。碳酸酐酶中的内源性锌离子首先通过2,6
‑ꢀ
吡啶二羧酸去除,得到除去内源锌的碳酸酐酶。根据4
‑
硝基苯酚(4
‑
硝基苯乙酸酯被碳酸酐酶水解的产物)在400nm的吸光度的测量来表征碳酸酐酶的活性(图 6b和图7b)。hbth
‑
zn
‑
tat纳米粒子在白光照射或365nm紫外光光照下,观察到4
‑
硝基苯酚的吸收逐渐增加,并且随着光照时间的延长,碳酸酐酶的活性逐渐升高,这归因于光照释放的锌离子重新激活了碳酸酐酶的活性,说明锌离子的释放和酶的调控可以通过光照hbt
‑
zn
‑
tat纳米粒子来很容易的调控。
[0061]
实施例6
[0062]
hbt
‑
zn
‑
tat纳米粒子的细胞毒性实验:
[0063]
图8为hbth
‑
zn
‑
tat纳米粒子在光照或不光照条件下,对nih
‑
3t3细胞或pc
‑
12细胞的细胞毒性的结果。将细胞(105个/ml)种于96透明孔板中,孵育24小时后,分别加入含有不同hbth
‑
zn分子浓度的hbth
‑
zn
‑
tat纳米粒子的培养基,孵育1小时后,用白光光照孔板15分钟。继续孵育24小时后,吸出旧培养基,加入含有mtt(0.5mg/ml)的培养基,孵育4小时后,吸出培养基,每孔加入100μl的dmso,并测在570nm处的吸光值。结果表明,即使在hbt
‑
zn分子浓度为50μmol/l的情况下,hbth
‑
zn
‑
tat纳米粒子仍显示出良好的生物相容性和低细胞毒性。
[0064]
实施例7
[0065]
hbth
‑
zn
‑
tat纳米粒子在细胞内光控释放锌离子:
[0066]
通过锌离子荧光探针fluozin
‑
3来检测活细胞内部光控释放的锌离子(图 9a)。细胞在孵育hbth
‑
zn
‑
tat纳米粒子(含50μmol/l的hbth
‑
zn分子) 30分钟后,共聚焦激光扫描显微镜图像显示在白光(10mw
·
cm
‑2)光照15分钟后,fluozin
‑
3的荧光逐渐增强。这说明了锌离子在活细胞内的成功释放,并且通过流式细胞术分析测定得到了进一步证实(图9b)。此外,通过icp
‑
ms 定量表征了细胞内部的锌离子浓度,结果表明,孵育hbth
‑
zn
‑
tat纳米粒子(含 50μmol/l的hbth
‑
zn分子)30分钟后,细胞内锌离子浓度约为30ng/106个细胞(图9c)。
[0067]
实施例8
[0068]
以蛋白磷酸酯酶2a和caspase
‑
3酶为例研究细胞内锌酶活性的光控调节。蛋白磷酸酯酶2a作为主要的ser/thr磷酸酶涉及几种关键的细胞信号转导途径,而caspase
‑
3可以在细胞凋亡时被激活。蛋白磷酸酯酶2a和caspase
‑
3酶均可被过量的锌离子下调。在15分钟的白光照射后,蛋白磷酸酯酶2a活性降至对照组的65%,这表明蛋白磷酸酯酶2a的活性可以通过光触发的锌离子释放来抑制(图10a)。此外,当星形孢菌素用作凋亡诱导剂时,观察到caspase
‑
3酶活性随光照时间延长而下降(图10b),这是由于光控释放的锌离子可以使 procaspase
‑
3失活。这些结果证实了hbth
‑
zn
‑
tat纳米粒子在光照射下可以有效调节细胞内锌酶的活性和相应的细胞代谢活动。
[0069]
实施例9
[0070]
图11与图12分别为hbth
‑
zn在氘代dmso中的氢谱与碳谱数据。
[0071]
对比例1
[0072]
hbth
‑
zn
‑
tat纳米粒子的制备:
[0073]
将浓度100mmol/l的hbth
‑
zn的30μl dmso溶液缓慢滴加到2970μl 的tween 20两亲性聚合物的溶液中,然后再加入3ml超纯水。将该溶液在冰浴中超声5分钟(20%输出,scientz
‑
ii d超声仪),测粒径并不均一,无法包裹成纳米粒子。
[0074]
对比例2
[0075]
hbth
‑
zn
‑
tat纳米粒子的制备:
[0076]
将浓度100mmol/l的hbth
‑
zn的30μl dmso溶液缓慢滴加到2970μl 的普兰尼克f127两亲性聚合物的溶液中,然后再加入3ml超纯水。将该溶液在冰浴中超声5分钟(20%输出,scientz
‑
ii d超声仪),测粒径并不均一,无法包裹成纳米粒子。
[0077]
对比例3
[0078]
hbth
‑
zn
‑
tat纳米粒子的制备:
[0079]
将浓度100mmol/l的hbth
‑
zn的30μl的四氢呋喃或乙醇或甲醇溶液缓慢滴加到2970μl的含有二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000(0.5mg/ml) 和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000
‑
马来酸酐(0.5mg/ml)的超纯水中,然后再加入3ml超纯水。将该溶液在冰浴中超声5分钟(20%输出,scientz
‑
iid超声仪)。纳米粒子不均一,无法包裹成纳米粒子。
[0080]
对比例4
[0081]
hbth
‑
zn
‑
tat纳米粒子的制备:
[0082]
将1mg/ml的hbth
‑
zn和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000(0.5 mg/ml)和二硬脂酰基磷脂酰乙醇胺
‑
聚乙二醇
‑
2000
‑
马来酸酐(0.5mg/ml)用四氢呋喃溶解,旋蒸除去四氢呋喃,再加入3ml超纯水。将该溶液在冰浴中超声5分钟(20%输出,scientz
‑
ii d超声仪)。采用此方法制备的纳米粒子不均一,无法包裹成纳米粒子。
[0083]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1