一种T1-T2双激活磁共振成像造影剂及其制备方法和应用与流程
本发明属于材料科学与生物医药技术领域,涉及一种t1-t2双激活磁共振成像造影剂及其制备方法和应用。
背景技术:
磁共振成像(magneticresonanceimaging,mri)具备高分辨率、无电离辐射损伤及多参数、多序列成像等优点,已成为当代临床诊断中最有力的检测手段之一。为了凸显组织间的差异,尤其是正常组织与病患部位间的差别,常使用造影剂提高成像对比度。按照作用原理,mri造影剂可以分为纵向弛豫造影剂(t1造影剂)和横向弛豫造影剂(t2造影剂),t1造影剂主要加速t1弛豫并在t1加权图像中产生“明亮”对比度,t2造影剂主要增加t2弛豫速率并产生“黑暗”对比效果。
近年来,mri造影剂的发展极大地促进了mri在肿瘤诊断领域的应用,在肿瘤微环境中,谷胱甘肽(gsh)、基质金属蛋白酶(mmp)和ph值等均与正常组织不同,利用这些生物信息,人们设计出众多响应性mri造影剂。
choi等(choijs,kims,yood,etal.distance-dependentmagneticresonancetuningasaversatilemrisensingplatformforbiologicaltargets[j].naturematerials,2017,16(5):537-542.)报道了一种基于距离调控的磁性纳米探针,主要通过t1阳性造影剂(gd-dtpa)和t2阳性造影剂(spio)两者之间的距离来调控t1激活,当两者之间距离缩短时,纳米探针的t1信号被淬灭;而在肿瘤微环境下(mmp-2),两者之间距离增大,t1信号被激活。但存在激活响应放大效果不佳的缺点。
wang等(wangz,xuex,luh,etal.two-waymagneticresonancetuningandenhancedsubtractionimagingfornon-invasiveandquantitativebiologicalimaging[j].naturenanotechnology,2020,15(6):1-9.)构建了一种gsh敏感的树枝状大分子聚合物包封的t1造影剂(卟啉螯合锰)及t2阳性造影剂(spio)纳米探针(比例20:1),进一步增强成像部位的mri信号激活放大倍数。但t1造影剂用量高,容易产生毒性,同时该体系采用的是gsh响应模式,与ph响应模式相比,存在灵敏性和特异性差的问题。
cn105188772a公开了一种基于金属氧化物纳米颗粒的t1-t2双模式磁共振成像造影剂,所述造影剂为具有核和多孔壳结构的纳米颗粒,所述核为氧化锰,所述多孔壳为掺杂源自氧化锰的锰离子的氧化铁层,所述mri造影剂不仅可用作t1造影剂,而且可用作t2造影剂,增强成像对比度。但灵敏性和特异性较差。
综合上述,提供一种能有效增强mri信号且具备高灵敏性和特异性的mri造影剂,对于mri领域具有重要意义。
技术实现要素:
针对现有技术的不足和实际需求,本发明提供一种t1-t2双激活磁共振成像造影剂及其制备方法和应用,所述t1-t2双激活磁共振成像造影剂具备ph响应性以及肿瘤靶向性,能在肿瘤部位富集,并在肿瘤微环境酸性条件下进行t1和t2信号同时激活,从而实现对肿瘤部位的高质量成像。
为实现上述目的,本发明采用以下技术方案:
第一方面,本发明提供一种t1-t2双激活磁共振成像造影剂,所述t1-t2双激活磁共振成像造影剂具有核壳结构,由内及外依次包括t2造影剂纳米颗粒、二氧化硅层、t1造影剂层和修饰层,所述t2造影剂纳米颗粒为超顺磁性氧化铁纳米颗粒。
本发明的t1-t2双激活磁共振成像造影剂中,超顺磁性氧化铁纳米粒是一种良好的mrit2造影剂,具有较高的t2弛豫率;依次包被于超顺磁性氧化铁纳米粒上的二氧化硅和t1造影剂,能够实现t1造影剂和t2造影剂信号双淬灭,并具备肿瘤微环境特异性响应能力,即当磁共振造影剂处于肿瘤附近的酸性环境中时,t1造影剂会形成游离型离子,从而脱离t2造影剂,实现t1和t2造影剂信号的同时激活;修饰层能够使得磁共振造影剂具备肿瘤靶向性,因此,所述t1-t2双激活磁共振成像造影剂在体内肿瘤周围正常组织中处于t1和t2造影剂信号双淬灭状态,而在肿瘤部位能够实现t1和t2造影剂信号同时激活,使肿瘤部位与周围正常组织呈现显著的mri信号差,从而实现对肿瘤部位的高质量成像。
优选地,所述超顺磁性氧化铁纳米颗粒的粒径为8~20nm,包括但不限于9nm、10nm、11nm、13nm、15nm、18nm或19nm。
本发明中,粒径为8~20nm的超顺磁性氧化铁纳米颗粒的超顺磁性较好,适合用作t2造影剂,当粒径低于8nm时,会影响t2造影剂信号强度,当粒径高于20nm时,会影响下一步修饰及体内应用。
优选地,所述二氧化硅层的厚度为4~12nm,包括但不限于5nm、6nm、7nm、8nm、10nm或11nm。
本发明中,控制二氧化硅层的厚度为4~12nm,即使得t1造影剂和t2造影剂的间距为4~12nm,可有效实现t1和t2造影剂信号双淬灭,当厚度小于4nm时,t1造影剂的负载量会降低,影响t1造影剂信号强度,当厚度大于12nm时,t1造影剂和t2造影剂的间距较大,影响t1和t2造影剂信号双淬灭效果。
优选地,所述t2造影剂纳米颗粒和t1造影剂层的质量比为1:(5~30),包括但不限于1:6、1:7、1:8、1:10、1:15、1:18、1:20、1:25、1:26、1:27或1:28。
优选地,所述t1造影剂层包括氧化锰和/或氧化钆。
优选地,所述修饰层包括聚乙二醇-苯硼酸。
本发明中,聚乙二醇-苯硼酸中苯硼酸分子能够与肿瘤细胞表面的唾液酸上的顺式二醇(cis-diol)特异性结合形成硼酸酯键,使得t1-t2双激活磁共振造影剂具有肿瘤靶向性。
优选地,所述聚乙二醇的分子量为2000~10000,包括但不限于2200、2500、2800、3600、4500、5500、6000、7000、8000、9000、9500或9800。
本发明中,控制聚乙二醇分子量为2000~10000,能够有效提高t1-t2双激活磁共振造影剂的生物相容性,延长其在生物体内的血液循环时间,从而增加t1-t2双激活磁共振造影剂在肿瘤部位的富集量,提升成像效果。
第二方面,本发明提供一种第一方面所述的t1-t2双激活磁共振成像造影剂的制备方法,所述制备方法包括:
对超顺磁性氧化铁纳米颗粒依次进行包被二氧化硅处理、包被t1造影剂处理和修饰处理,获得所述t1-t2双激活磁共振成像造影剂。
优选地,所述包被二氧化硅处理包括:
向溶剂中依次加入超顺磁性氧化铁纳米颗粒、聚氧代乙烯(5)壬基苯基醚、氨水和硅酸四乙酯,进行反应,得到包被有二氧化硅的超顺磁性氧化铁纳米颗粒。
优选地,所述溶剂、超顺磁性氧化铁纳米颗粒、聚氧代乙烯(5)壬基苯基醚、氨水和硅酸四乙酯的配比为(2~10)ml:(0.5~2.5)mg:(0.2~1)g:(50~200)μl:(2~20)μl,包括但不限于,3ml:0.6mg:0.3g:52μl:4μl、3ml:0.8mg:0.4g:60μl:8μl、5ml:1.5mg:0.5g:100μl:15μl、7ml:2mg:0.7g:150μl:17μl或9ml:2.4mg:0.9g:190μl:19μl。
优选地,所述溶剂包括环己烷和/或正己烷。
优选地,所述超顺磁性氧化铁纳米颗粒包括油酸修饰的超顺磁性氧化铁纳米颗粒。
优选地,所述反应的时间为2~48h,包括但不限于3h、6h、10h、15h、20h、30h、35h、40h、45h或48h。
优选地,所述包被t1造影剂处理包括向包被有二氧化硅的超顺磁性氧化铁纳米颗粒中加入氧化剂和金属盐,进行反应,得到包被有二氧化硅和t1造影剂层的超顺磁性氧化铁纳米颗粒。
优选地,所述包被有二氧化硅的超顺磁性氧化铁纳米颗粒、氧化剂和金属盐的配比为1ml:(200~600)μg:(300~1000)μg,包括但不限于1ml:210μg:310μg、1ml:250μg:350μg、1ml:300μg:400μg、1ml:350μg:450μg、1ml:500μg:600μg、1ml:550μg:800μg或1ml:580μg:950μg。
优选地,所述氧化剂包括高锰酸钾。
优选地,所述金属盐包括锰盐和/或钆盐。
优选地,所述锰盐包括硫酸锰、硝酸锰、氯化锰或乙酸锰中的任意一种或至少两种的组合,其中典型但非限制性的组合包括硫酸锰和硝酸锰的组合、硝酸锰和氯化锰的组合、氯化锰和乙酸锰的组合或氯化锰和硫酸锰的组合。
优选地,所述钆盐包括硫酸钆、硝酸钆、氯化钆或乙酸钆中的任意一种或至少两种的组合,其中典型但非限制性的组合包括硫酸钆和硝酸钆的组合、硝酸钆和氯化钆的组合、氯化钆和乙酸钆的组合或硝酸钆和乙酸钆的组合。
优选地,所述反应的时间为1~4h,包括但不限于1.5h、2h、2.5h、3h或3.5h。
优选地,所述修饰处理包括向包被有二氧化硅和t1造影剂的超顺磁性氧化铁纳米颗粒中加入氨基-聚乙二醇-苯硼酸,进行反应,获得所述t1-t2双激活磁共振成像造影剂。
优选地,所述包被有二氧化硅和t1造影剂的超顺磁性氧化铁纳米颗粒和氨基-聚乙二醇-苯硼酸的配比为1ml:(1~4)mg,包括但不限于1ml:2mg、1ml:2.5mg、1ml:3mg或1ml:3.5mg。
优选地,所述反应的时间为6~48h,包括但不限于8h、10h、12h、20h、25h、30h、35h、38h、40h、42h或46h。
作为优选的技术方案,所述t1-t2双激活磁共振成像造影剂的制备方法包括以下步骤:
(1)将油酸修饰的超顺磁性氧化铁纳米颗粒加入到溶剂中,超声处理5~10min,加入聚氧代乙烯(5)壬基苯基醚以及氨水,超声3~10min,加入硅酸四乙酯,所述超顺磁性氧化铁纳米颗粒、溶剂、聚氧代乙烯(5)壬基苯基醚、氨水和硅酸四乙酯的配比为(0.5~2.5)mg:(2~10)ml:(0.2~1)g:(50~200)μl:(2~20)μl,搅拌反应2~48h,离心收集沉淀,分别用乙醇和水洗涤2~4次,复溶于水相中;
(2)取步骤(1)产物加入高锰酸钾,搅拌5~20min,继续加入金属盐,所述步骤(1)产物、高锰酸钾和金属盐的配比为1ml:(200~600)μg:(300~1000)μg,搅拌反应1~4h,离心收集沉淀,水洗2~4次,复溶在水相中;
(3)取步骤(2)产物加入氨基-聚乙二醇-苯硼酸,所述步骤(2)产物和氨基-聚乙二醇-苯硼酸的配比为1ml:(1~4)mg,搅拌6~48h,离心收集沉淀,并复溶于水相,得到所述磁共振造影剂。
第三方面,本发明提供一种造影剂组合物,所述造影剂组合物包括第一方面所述的t1-t2双激活磁共振造影剂。
优选地,所述造影剂组合物还包括药学上可接受的辅剂。
第四方面,本发明提供所述的t1-t2双激活磁共振造影剂或第三方面所述的造影剂组合物在制备磁共振成像剂中的应用。
与现有技术相比,本发明具有以下有益效果:
(1)本发明的t1-t2双激活磁共振成像造影剂在体内肿瘤周围正常组织中处于t1和t2造影剂信号双淬灭状态,而在肿瘤部位能够实现t1和t2造影剂信号同时激活,使肿瘤部位与周围正常组织呈现显著的mri信号差,且对肿瘤细胞具有靶向性,从而实现对肿瘤部位的高质量成像;
(2)本发明中,控制二氧化硅层的厚度为间距4~12nm,即使得t1造影剂和t2造影剂的间距为4~12nm,可有效实现t1和t2造影剂信号双淬灭;
(3)本发明的t1-t2双激活磁共振造影剂,具有ph响应机制,在酸性条件下能够同时实现t1和t2造影剂信号激活,随着酸性的增加,激活效果也随之增强;能够在肿瘤部位富集并显著增强肿瘤部位的t1和t2造影剂信号强度。
附图说明
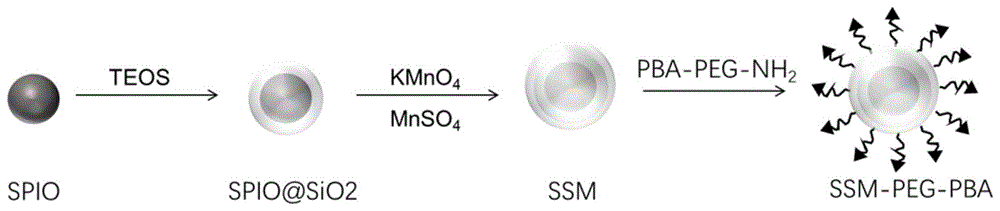
图1为实施例1制备t1-t2双激活磁共振造影剂的过程图,spio为油酸修饰的超顺磁性氧化铁,teos为硅酸四乙酯,spio@sio2为包被有二氧化硅的油酸修饰的超顺磁性氧化铁,ssm为包被有二氧化硅和氧化锰的油酸修饰的超顺磁性氧化铁,pba-peg-nh2为氨基-聚乙二醇-苯硼酸,ssm-peg-pba为t1-t2双激活磁共振成像造影剂,由内及外依次为油酸修饰的超顺磁性氧化铁纳米颗粒、二氧化硅层、氧化锰层和聚乙二醇-苯硼酸;
图2为t1-t2双激活磁共振造影剂(二氧化硅层的厚度为4nm)的透射电镜图;
图3为t1-t2双激活磁共振造影剂(二氧化硅层的厚度为8nm)的透射电镜图;
图4为t1-t2双激活磁共振造影剂(二氧化硅层的厚度为12nm)的透射电镜图;
图5为t1-t2双激活磁共振造影剂(二氧化硅层的厚度为32nm)的透射电镜图;
图6为t1-t2双激活磁共振造影剂元素分析图,fe为仅显示铁元素,si为仅显示硅元素,mn为仅显示锰元素,merge为同时显示上述三种元素;
图7为t1-t2双激活磁共振造影剂在不同ph条件下的t1和t2造影剂信号强度图;
图8为含有不同厚度二氧化硅层的t1-t2双激活磁共振造影剂的t1和t2造影剂信号强度图,a为不同厚度二氧化硅层的t1-t2双激活磁共振造影剂的t1加权成像图和t2加权成像图,b为不同厚度二氧化硅层的t1-t2双激活磁共振造影剂的t2弛豫时间倒数图,c为不同厚度二氧化硅层的t1-t2双激活磁共振造影剂的t1弛豫时间倒数图;
图9为细胞摄取半定量分析图,非靶向组为nh2-peg(无苯硼酸靶向分子)修饰的造影剂,靶向组为nh2-peg-pba(含苯硼酸靶向分子)修饰的造影剂;
图10为尾静脉注射t1-t2双激活磁共振造影剂前后小鼠体内mri成像效果图,a为尾静脉注射t1-t2双激活磁共振造影剂前后小鼠体内mrit1加权成像图和t2加权成像图,b为尾静脉注射t1-t2双激活磁共振造影剂前后小鼠体内mrit1弛豫时间倒数图,c为尾静脉注射t1-t2双激活磁共振造影剂前后小鼠体内mrit2弛豫时间倒数图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
本发明实施例中,油酸修饰的超顺磁性氧化铁纳米颗粒(10nm)购于中科雷鸣(北京)科技有限公司,氨基-聚乙二醇(分子量为5000)-苯硼酸购于西安瑞禧生物科技有限公司。
实施例1
本实施例提供一种t1-t2双激活磁共振成像造影剂,所述t1-t2双激活磁共振造影剂以油酸修饰的超顺磁性氧化铁纳米颗粒为内核,由内及外依次包被有二氧化硅层和氧化锰层,并在最外层修饰有聚乙二醇-苯硼酸,且二氧化硅层的厚度为4nm。所述t1-t2双激活磁共振成像造影剂的制备过程如图1所示,具体包括以下步骤:
(1)将1mg油酸修饰的超顺磁性氧化铁纳米颗粒加入到5ml环己烷中,超声处理5min,加入0.5g聚氧代乙烯(5)壬基苯基醚以及50μl氨水,超声10min,加入5μl硅酸四乙酯,搅拌反应2h,离心收集沉淀,分别用乙醇和水洗涤3次,复溶于1ml水相中;
(2)取1ml步骤(1)产物加入200μg高锰酸钾,搅拌10min,继续加入300μg硫酸锰,搅拌反应2h,离心收集沉淀,水洗3次,复溶在1ml水相中;
(3)取1ml步骤(2)产物加入2mg氨基-聚乙二醇-苯硼酸,搅拌24h,离心收集沉淀,并复溶于1ml水相,得到所述t1-t2双激活磁共振造影剂。
实施例2
本实施例提供一种t1-t2双激活磁共振成像造影剂,所述t1-t2双激活磁共振造影剂以油酸修饰的超顺磁性氧化铁纳米颗粒为内核,由内及外依次包被有二氧化硅层和氧化锰层,并在最外层修饰有聚乙二醇-苯硼酸,且二氧化硅层的厚度为8nm。所述磁共振成像造影剂的制备过程包括以下步骤:
(1)将1mg油酸修饰的超顺磁性氧化铁纳米颗粒加入到5ml环己烷中,超声处理5min,加入0.5g聚氧代乙烯(5)壬基苯基醚以及50μl氨水,超声10min,加入2μl硅酸四乙酯,搅拌反应12h,离心收集沉淀,分别用乙醇和水洗涤3次,复溶于1ml水相中;
(2)取1ml步骤(1)产物加入400μg高锰酸钾,搅拌10min,继续加入600μg硫酸锰,搅拌反应2h,离心收集沉淀,水洗3次,复溶在水相中;
(3)取1ml步骤(2)产物加入2mg氨基-聚乙二醇-苯硼酸,搅拌24h,离心收集沉淀,并复溶于水相,得到所述t1-t2双激活磁共振造影剂。
实施例3
本实施例提供一种t1-t2双激活磁共振成像造影剂,所述t1-t2双激活磁共振造影剂以油酸修饰的超顺磁性氧化铁纳米颗粒为内核,由内及外依次包被有二氧化硅层和氧化锰层,并在最外层修饰有聚乙二醇-苯硼酸,且二氧化硅层的厚度为12nm。所述t1-t2双激活磁共振成像造影剂的制备过程包括以下步骤:
(1)将1mg油酸修饰的超顺磁性氧化铁纳米颗粒加入到5ml环己烷中,超声处理5min,加入0.5g聚氧代乙烯(5)壬基苯基醚以及50μl氨水,超声10min,加入2μl硅酸四乙酯,搅拌反应24h,离心收集沉淀,分别用乙醇和水洗涤3次,复溶于1ml水相中;
(2)取1ml步骤(1)产物加入600μg高锰酸钾,搅拌10min,继续加入900μg硫酸锰,搅拌反应2h,离心收集沉淀,水洗3次,复溶在1ml水相中;
(3)取1ml步骤(2)产物加入2mg氨基-聚乙二醇-苯硼酸,搅拌24h,离心收集沉淀,并复溶于水相,得到所述t1-t2双激活磁共振造影剂。
实施例4
本实施例提供一种t1-t2双激活磁共振成像造影剂,所述t1-t2双激活磁共振造影剂以油酸修饰的超顺磁性氧化铁纳米颗粒为内核,由内及外依次包被有二氧化硅层和氧化锰层,并在最外层修饰有聚乙二醇-苯硼酸,且二氧化硅层的厚度为32nm。所述t1-t2双激活磁共振成像造影剂的制备过程包括以下步骤:
(1)将1mg油酸修饰的超顺磁性氧化铁纳米颗粒加入到5ml环己烷中,超声处理5min,加入0.5g聚氧代乙烯(5)壬基苯基醚以及50μl氨水,超声10min,加入4μl硅酸四乙酯,搅拌反应48h,离心收集沉淀,分别用乙醇和水洗涤3次,复溶于1ml水相中;
(2)取1ml步骤(1)产物加入600μg高锰酸钾,搅拌10min,继续加入900μg硫酸锰,搅拌反应2h,离心收集沉淀,水洗3次,复溶在1ml水相中;
(3)取1ml步骤(2)产物加入2mg氨基-聚乙二醇-苯硼酸,搅拌24h,离心收集沉淀,并复溶于水相,得到所述磁共振造影剂。
试验例1
本试验例使用透射电镜检测实施例1-4制备的t1-t2双激活磁共振造影剂的二氧化硅层的厚度。
分别配置0.5mg/ml的实施例1-4制备的t1-t2双激活磁共振造影剂样品,分别用移液枪取1μl上述配制的样品滴加在tem测试专用铜网上,待溶液自然挥干后,使用透射电镜(tem)进行观察检测。
结果如图2-图5所示,实施例1-4制备的t1-t2双激活磁共振造影剂的二氧化硅层的厚度分别为4nm、8nm、12nm和32nm。
试验例2
以对实施例1制备的t1-t2双激活磁共振造影剂为例,进行元素分析。
分别配置0.5mg/ml的实施例1-4制备的t1-t2双激活磁共振造影剂样品,分别用移液枪取1μl上述配制的样品滴加在tem测试专用铜网上,待溶液自然挥干后,使用高分辨透射电镜(hrtem)进行元素扫描分析。
结果如图6所示,本发明的t1-t2双激活磁共振造影剂中,二氧化硅和t1造影剂氧化锰依次均匀包被在t2造影剂超顺磁性氧化铁纳米颗粒上。
试验例3
以实施例1制备的t1-t2双激活磁共振造影剂为例,对本发明的t1-t2双激活磁共振造影剂的ph响应性进行分析。
将0.1mg实施例1制备的t1-t2双激活磁共振造影剂分别加入到预先配置好的ph值为7.4、6.0、5.0和4.0的1ml水溶液中,孵育过夜,然后用3.0t的磁共振扫描仪进行测试,测试得到不同ph值下的t1加权成像t1w和t2加权成像t2w。
结果如图7所示,本发明的t1-t2双激活磁共振造影剂具有良好的ph响应性,在中性环境下处于t1和t2信号双淬灭状态,而在酸性条件下能够同时实现t1而t2信号激活,随着酸性的增加,其激活效果也随之增强,通过分别计算t1和t2信号在ph=5和ph=7条件下的弛豫时间倒数差值倍数,然后相加,可算出在ph=5时,t1和t2信号激活放大倍数高达12倍。
试验例4
研究t1-t2双激活磁共振造影剂中二氧化硅层厚度对t1和t2造影剂信号的影响。
分别将实施例1-4制备的不同厚度的t1-t2双激活磁共振造影剂配置成0.1mg/ml的溶液(溶剂为水),用3.0t的磁共振扫描仪进行测试,测试得到t1加权成像t1w和t2加权成像t2w。
结果如图8所示,随着二氧化硅层的厚度的增加,t2与t1造影剂之间的间距也随之增加,t1信号一直处于淬灭状态,而对于t2信号,t2与t1造影剂之间的间距增加,t2信号逐渐增大,而当间距大于12nm,增至32nm时,t2信号几乎没有淬灭效果,而当间距小于4nm时,二氧化硅层过薄而无法附着足量的t1造影剂,无实际意义,因此本发明控制二氧化硅层的厚度为4~12nm,能够同时保持t1和t2同时淬灭的状态以及t1造影剂的负载量。
试验例5
以实施例1制备的t1-t2双激活磁共振造影剂为例,研究t1-t2双激活磁共振造影剂的肿瘤靶向性。
实验过程:用激光共聚焦专用的培养皿孵育4t1肿瘤细胞,待到细胞数量达到半数以上时,一组加入非靶向组(nh2-peg修饰的t1-t2双激活磁共振造影剂),另一组加入靶向组(实施例1制备的t1-t2双激活磁共振造影剂,即nh2-peg-pba修饰的t1-t2双激活磁共振造影剂),两种分子均用荧光分子进行标记,分别孵育0.5h、1h、2h和4h,用pbs洗三遍,然后进行细胞核染色,用激光共聚焦显微镜检测细胞摄取造影剂的情况,并统计其平均荧光强度
结果如图9所示,靶向组的荧光强度明显高于非靶向组,表明本发明的t1-t2双激活磁共振造影剂具有良好的肿瘤细胞主动靶向性。
试验例6
以实施例1制备的t1-t2双激活磁共振造影剂为例,测试t1-t2双激活磁共振造影剂的成像效果。
通过尾静脉注射实施例1制备的t1-t2双激活磁共振造影剂,剂量为10mg/kg,在注射前后将实验小鼠麻醉,并用3.0t的磁共振扫描仪进行扫描,得到其成像的t1加权成像图和t2加权成像图。
如图10所示,通过尾静脉注射本发明的t1-t2双激活磁共振造影剂,能够在小鼠体内肿瘤部位同时实现t1、t2信号双激活,显著提高肿瘤部位的t1、t2信号,实现高清成像的目的。
综上所述,本发明的t1-t2双激活磁共振造影剂,具有ph响应机制,在酸性条件下能够同时实现t1和t2造影剂信号激活,随着酸性的增加,激活效果也随之增强;能够在肿瘤部位富集并显著增强肿瘤部位的t1和t2造影剂信号。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!