一种具有产氧作用的核壳结构微球及其制备方法与流程
本发明涉及产氧材料技术领域,尤其涉及一种具有产氧作用的核壳结构微球及其制备方法。
背景技术:
当皮肤受损后,组织会快速缺氧和缺血。在氧气充足的条件下,氧气会引导新生血管生成,而缺氧则会导致细胞凋亡和炎症反应加剧,炎症反应和组织再生对能量的高需求又进一步加剧了伤口氧气供给不足的问题,形成恶性循环。更重要的是,当受损组织感知到自身缺氧的相关信号,会自主地释放“缺氧诱导因子”,诱导胶原蛋白的过度分泌过度沉积以及排列紊乱,最后导致创面的非正常愈合,形成瘢痕。瘢痕的形成往往会造成皮肤组织的畸形、挛缩和运动功能缺失,长期慢性瘢痕亦有诱发癌症的风险,不仅严重影响患者的健康,还给患者带来了巨大的经济负担。因此,通过组织干预的方式从根源上提供持续而稳定的氧气供应,对于改善组织损伤的缺氧状况是必不可少的。
研究发现,相比于正常皮肤,瘢痕组织的含氧量更少,足够的氧气对加速创面愈合以及抑制瘢痕的形成有积极的意义。鉴于此,对具有良好生物相容性的可控的产氧材料进行研究具有重要意义。目前研究较多的产氧材料分为无机过氧化物类、全氟化碳类及过氧化氢三类。
其中,无机过氧化物类产氧材料无法改变材料自身的局限性,也无法避免反应剩余物对体内组织的伤害,可能导致体内金属离子失衡紊乱,在提高细胞活性的同时也给细胞带来不利影响。全氟化碳类产氧材料的加入虽然能够在三维组织结构中创造均匀的氧气环境,但其加入后断裂应力明显降低,导致机械强度明显减弱。相比于无机过氧化物类和全氟化碳类产氧材料,过氧化氢在催化剂的作用下能够产生氧气和水,避免了副产物残留在体内造成不利干扰的问题,是理想的产氧材料。
公开号为cn111346226a的专利提供了一种自产氧纳米粒及其介导肿瘤光动力治疗的应用。该专利提供的自产氧纳米粒呈核-壳-壳的球形结构,光敏剂和过氧化氢酶分布于纳米粒内部,聚乳酸-羟基乙酸构成纳米粒内壳,最外层包被有透明质酸作为外壳,用于催化肿瘤组织中存在的过氧化氢,在肿瘤局部产生氧气,以解除肿瘤组织的缺氧状态。然而,该方法仅适用于本身含有较高浓度过氧化氢的肿瘤细胞,对于过氧化氢浓度很低的正常组织,产氧的效率将会受到明显和直接的影响。且该专利制备的自产氧纳米粒的产氧量受限于肿瘤细胞体内的过氧化氢含量,导致其存在氧气释放量少的问题。
有鉴于此,当前仍有必要设计一种改进的产氧材料的制备方法,以解决上述问题。
技术实现要素:
针对上述现有技术的缺陷,本发明的目的在于提供一种具有产氧作用的核壳结构微球及其制备方法。通过制备以过氧化氢为核体,以聚乳酸-羟基乙酸共聚物为壳层的核壳结构微球,避免过氧化氢与细胞直接接触,并使其在体内固有的过氧化氢酶的催化下反应生成氧气和水,达到产氧效果。
为实现上述目的,本发明提供了一种具有产氧作用的核壳结构微球的制备方法,包括如下步骤:
s1、将聚乳酸-羟基乙酸共聚物按照预设浓度溶于有机溶剂中,形成油相;
s2、将过氧化氢与聚乙烯吡咯烷酮充分混合至形成络合物,得到水相;
s3、将步骤s2得到的所述水相缓慢加入步骤s1得到的所述油相中,并加入聚乙烯醇,匀浆后得到初级乳液;
s4、将步骤s3得到的所述初级乳液加入含有聚乙烯醇和过氧化氢的连续相中,形成二级乳液;
s5、对步骤s4得到的所述二级乳液进行充分搅拌后,经蒸发除去步骤s1中所述有机溶剂,再进行离心处理,并收集得到微球;经洗涤、干燥后,得到具有产氧作用的核壳结构微球。
作为本发明的进一步改进,在步骤s4中,所述连续相中所述聚乙烯醇的浓度为0.6%~1.2%;所述连续相中过氧化氢的浓度高于步骤s2中所述水相中的过氧化氢浓度。
作为本发明的进一步改进,在步骤s5中,所述干燥的方式为在室温下干燥5~8h。
作为本发明的进一步改进,在步骤s1中,所述聚乳酸-羟基乙酸共聚物的预设浓度为10~15wt%。
作为本发明的进一步改进,在步骤s2中,所述水相中所述聚乙烯吡咯烷酮与所述过氧化氢的摩尔比为1:(3~9)。
作为本发明的进一步改进,在步骤s3中,所述水相与所述油相的体积比为1:(5~8)。
作为本发明的进一步改进,在步骤s4中,所述初级乳液与所述连续相的体积比为1:(40~60)。
作为本发明的进一步改进,在步骤s3中,所述匀浆的时间为30~120s,匀浆速度为5000~15000转/min;在步骤s5中,所述二级乳液的搅拌时间为3~8h,搅拌速度为250~800转/min。。
作为本发明的进一步改进,在步骤s1中,所述有机溶剂包括但不限于二氯甲烷,四氢呋喃,丙酮,乙酸乙酯,乙腈,氯仿,二氧六环,n-甲基吡咯烷酮,二甲基亚砜,二氯乙烷,二甲基乙酰胺,二甲基甲酰胺,甲酸甲酯,碳酸丙烯酯中的一种或多种混合。
为实现上述目的,本发明还提供了一种具有产氧作用的核壳结构微球,该核壳结构微球根据上述技术方案中任一技术方案制备得到,包括作为核体的过氧化氢和作为壳层的聚乳酸-羟基乙酸共聚物。
本发明的有益效果是:
(1)本发明通过将过氧化氢与聚乙烯吡咯烷酮络合后形成的水相加入含有聚乳酸-羟基乙酸共聚物的油相中,形成油包水初级乳液;再将初级乳液加入含有聚乙烯醇和过氧化氢的连续相中,形成水包油包水二级乳液,除去溶剂后经离心、洗涤、干燥,制备了以过氧化氢为核体,以聚乳酸-羟基乙酸共聚物为壳层的核壳结构产氧微球。基于该微球的核壳结构,既能够避免位于核体的过氧化氢与细胞直接接触,以免损害细胞活力;又能够有效避免过氧化氢的突释,保证使用安全。在核壳结构微球的使用过程中,微球内的过氧化氢能够在体内固有的过氧化氢酶的催化下发生反应,生成氧气和水,达到产氧效果。且产生的氧气作用于创面,延缓甚至避免了缺氧诱导因子的分泌,从而避免了因缺氧而导致的胶原过度沉积以及排列紊乱的问题,进而抑制了瘢痕的形成,具有较高的实际应用价值。
(2)本发明提供的具有产氧作用的核壳结构微球的制备方法中,通过在配制过氧化氢溶液时引入聚乙烯吡咯烷酮,能够使聚乙烯吡咯烷酮与过氧化氢形成稳定的络合物,从而减缓过氧化氢的分解,有效避免了过氧化氢的易分解性和不稳定性带来的影响。在此基础上,本发明还通过将初级乳液加入含有聚乙烯醇和过氧化氢的连续相中,并使连续相中过氧化氢的浓度高于水相中的过氧化氢浓度,形成反向浓度梯度,有效避免过氧化氢从聚乳酸-羟基乙酸共聚物的核体向壳层泄露;并通过设计适宜的干燥方式,进一步提高核壳结构微球中的过氧化氢浓度,达到更好的产氧效果。
(3)本发明提供的具有产氧作用的核壳结构微球的制备方法流程简单可控、耗时较短,成本较低;且制备的核壳结构微球具有良好的生物相容性和可控的降解速率,安全性高,产氧效果好,能够满足实际生产与应用的要求,具有较好的应用前景。
附图说明
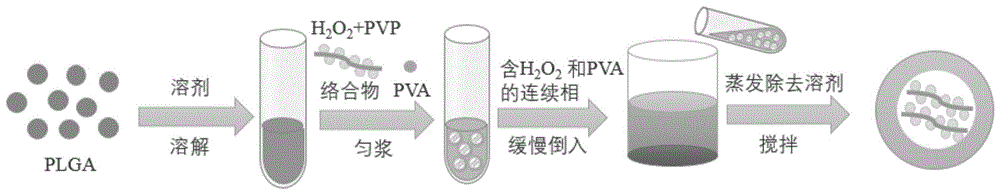
图1为本发明提供的具有产氧作用的核壳结构微球的制备流程示意图。
图2为实施例1制备的具有产氧作用的核壳结构微球的扫描电镜图。
图3为实施例1制备的具有产氧作用的核壳结构微球的粒径分布图。
图4为pva浓度不同时制备的具有产氧作用的核壳结构微球在各时段产生的氧气水平对比图。
图5为pva浓度不同时制备的具有产氧作用的核壳结构微球的总产氧水平对比图。
图6为pvp与h2o2的摩尔比不同时制备的具有产氧作用的核壳结构微球在各时段产生的氧气水平对比图。
图7为pvp与h2o2的摩尔比不同时制备的具有产氧作用的核壳结构微球的总产氧水平对比图。
具体实施方式
为了使本发明的目的、技术方案和优点更加清楚,下面结合附图和具体实施例对本发明进行详细描述。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在附图中仅仅示出了与本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
另外,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
本发明提供了一种具有产氧作用的核壳结构微球的制备方法,其制备流程示意图如图1所示,具体包括如下步骤:
s1、将聚乳酸-羟基乙酸共聚物按照预设浓度溶于有机溶剂中,形成油相;
s2、将过氧化氢与聚乙烯吡咯烷酮充分混合至形成络合物,得到水相;
s3、将步骤s2得到的所述水相缓慢加入步骤s1得到的所述油相中,并加入聚乙烯醇,匀浆后得到初级乳液;
s4、将步骤s3得到的所述初级乳液加入含有聚乙烯醇和过氧化氢的连续相中,形成二级乳液;
s5、对步骤s4得到的所述二级乳液进行充分搅拌后,经蒸发除去步骤s1中所述有机溶剂,再进行离心处理,并收集得到微球;经洗涤、干燥后,得到具有产氧作用的核壳结构微球。
在步骤s1中,所述聚乳酸-羟基乙酸共聚物的预设浓度为10~15wt%;所述有机溶剂包括但不限于二氯甲烷,四氢呋喃,丙酮,乙酸乙酯,乙腈,氯仿,二氧六环,n-甲基吡咯烷酮,二甲基亚砜,二氯乙烷,二甲基乙酰胺,二甲基甲酰胺,甲酸甲酯,碳酸丙烯酯中的一种或多种混合。
在步骤s2中,所述水相中所述聚乙烯吡咯烷酮与所述过氧化氢的摩尔比为1:(3~9)。
在步骤s3中,所述匀浆的时间为30~120s,匀浆速度为5000~15000转/min;所述水相与所述油相的体积比为1:(5~8)。
在步骤s4中,所述连续相中所述聚乙烯醇的浓度为0.6%~1.2%;所述连续相中过氧化氢的浓度高于步骤s2中所述水相中的过氧化氢浓度;所述初级乳液与所述连续相的体积比为1:(40~60)。
在步骤s5中,所述二级乳液的搅拌时间为3~8h,搅拌速度为250~800转/min;所述干燥的方式为在室温下干燥5~8h。
本发明还提供了一种具有产氧作用的核壳结构微球,该核壳结构微球根据上述技术方案制备得到,包括作为核体的过氧化氢和作为壳层的聚乳酸-羟基乙酸共聚物。
下面结合具体的实施例对本发明提供的一种具有产氧作用的核壳结构微球及其制备方法进行说明。
实施例1
本实施例提供了一种具有产氧作用的核壳结构微球的制备方法,包括如下步骤:
s1、将聚乳酸-羟基乙酸共聚物(plga)溶于二氯甲烷(dcm)溶液中,控制plga的浓度为12wt%,形成油相(o1)。
s2、将过氧化氢(h2o2)与聚乙烯吡咯烷酮(pvp)按摩尔比1:7.5混合后,在-4℃下搅拌过夜,形成水相(w1);其中,h2o2与pvp的充分混合能够形成稳定的络合物。
s3、将0.3ml步骤s2得到的水相逐滴加入2ml步骤s1得到的油相中,再加入2ml浓度为1%的聚乙烯醇,作为稳定剂和乳化剂,利用高速匀浆机在10000转/min的转速下匀浆60s,得到油包水初级乳液(w1/o1)。
s4、将步骤s3得到的全部初级乳液倒入200ml连续相(w2)中,形成水包油包水二级乳液(w1/o1/w2);该连续相中pva的浓度为1%,h2o2的浓度为15%,高于步骤s2中水相内的h2o2浓度。
s5、将步骤s4得到的二级乳液以500转/min的速度匀速搅拌4h后,蒸发除去dcm;再以5000转/min的速度离心5min,并收集得到微球;在室温下(25℃)干燥6h后,即得到具有产氧作用的核壳结构微球,该核壳结构微球可置于-20℃的冰箱中保存备用。
本实施例制备的具有产氧作用的核壳结构微球的扫描电镜图和粒径分布图分别如图1、图2所示。由图1、图2可以看出,该核壳结构微球呈球形,其粒径分布均匀,约为720~880μm,且具有较好的分散性。
实施例2~4
实施例2~4分别提供了一种具有产氧作用的核壳结构微球的制备方法,与实施例1相比,不同之处在于改变了步骤s4中连续相内的pva浓度,其余步骤均与实施例1一致,在此不再赘述。其中,实施例2~4对应的pva浓度分别为0.6%、0.8%和1.2%。
对实施例1及实施例2~4制得的具有产氧作用的核壳结构微球的产氧量进行测试,具体包括如下步骤:
按照过氧化氢酶:去离子水=1:100配制浓度为1%的过氧化氢酶溶液,再将实施例1~4制备的微球放入该过氧化氢酶溶液中,分别于0min、30min、60min和90min测试产生的氧气量。
根据上述测试结果,得到不同pva浓度下制备的微球在各时段产生的氧气水平对比图及其总产氧水平对比图,分别如图4、图5所示。
由图4可以看出,实施例1~4制备的微球均能够达到产氧效果,且实施例1(pva浓度为1%)和实施例4(pva浓度为1.2%)制备的微球能够在90min内通过微球表面的微孔持续地释放氧气。由图5可以看出,当pva浓度为1%时,氧气的释放值达到最高,主要是因为适量浓度的pva溶液能够使整个体系保持稳定。若以纯的过氧化氢溶液作为连续相,则会导致体系不稳定,使连续相中的过氧化氢分解,使核壳结构微球中的过氧化氢分解及向外释放,影响制备和产氧率;若以纯的pva溶液作为连续相,则难以使连续相(w2)中的过氧化氢浓度大于水相(w1)中的过氧化氢浓度,不能形成浓度梯度差。
实施例5~8及对比例1
实施例5~8及对比例1分别提供了一种具有产氧作用的核壳结构微球的制备方法,与实施例1相比,不同之处在于改变了步骤s2中pvp与h2o2的摩尔比,其余步骤均与实施例1一致,在此不再赘述。其中,实施例5~8对应的pvp与h2o2的摩尔比分别为1:3、1:4.5、1:6和1:9,对比例1中未添加pvp,即pvp与h2o2的摩尔比为0:1。
按照前述方法对实施例5~8及对比例1制得的具有产氧作用的核壳结构微球的产氧量进行测试,并将其结果与实施例1对比,得到pvp与h2o2的摩尔比不同时对应的微球在各时段产生的氧气水平对比图及其总产氧水平对比图,分别如图6、图7所示。在图6、图7中,对照组对应于对比例1,1:7.5对应于实施例1,1:3、1:4.5、1:6和1:9则分别对应于实施例5~8。
由图6可以看出,对比例1制备的微球仅能够持续释放氧气30min,且产氧水平明显低于实施例1及实施例5~8。而实施例1和实施例5~8制备的微球能够在体外大量过氧化氢酶的催化作用下,持续释放氧气60min,实施例1和实施例7能够持续释放氧气90min,且各实施例在30min时释氧量均达到最多。并且,为了使微球彻底反应,测试过程中使用的过氧化氢酶是过量的。实际上,人体内含有的过氧化氢酶为微量的,该核壳结构微球在人体内应用时实际能够达到更长的氧气释放时间,以达到促进创面愈合的效果。
由图7可以看出,当pvp与h2o2的摩尔比为1:7.5时,实施例1制备的微球的氧气总释放值达到最高;而对比例1中未添加pvp时制备的微球的氧气总释放值明显低于其他各实施例。这主要是因为pvp与h2o2混合后能够形成稳定的络合物,从而提高h2o2的稳定性,以保证最终制得的微球中含有较多稳定的h2o2,以达到较好的产氧效果;但当pvp过多时,其与h2o2形成的溶液粘度较大,类似油状,不易形成油包水的微球,从而影响微球的制备。
实施例9~10
实施例9~10分别提供了一种具有产氧作用的核壳结构微球的制备方法。与实施例1相比,实施例9的不同之处在于步骤s3中,将水相逐滴加入油相中后,先进行第一次高速匀浆,再加入聚乙烯醇,然后进行第二次高速匀浆。其中,两次高速匀浆的时间、转速及聚乙烯醇的添加量均与实施例1一致,在此不再赘述。与实施例9相比,实施例10的不同之处在于将第一次高速匀浆过程替换为用300w的超声发生装置超声处理30s,其余步骤均与实施例9一致,在此不再赘述。
对实施例9~10制备的具有产氧作用的核壳结构微球进行测试可以发现,采用实施例9~10提供的制备方法能够达到与实施例1相同的效果,表明步骤s3中的匀浆方式可以仅在加入聚乙烯醇后进行一次匀浆,也可以在加入聚乙烯醇前后各进行一次匀浆,还可以在加入聚乙烯醇前进行超声处理,加入聚乙烯醇后再进行匀浆,均能够达到类似的效果。
综上所述,本发明提供了一种具有产氧作用的核壳结构微球及其制备方法。通过将过氧化氢与聚乙烯吡咯烷酮络合后形成的水相加入含有聚乳酸-羟基乙酸共聚物的油相中,形成油包水初级乳液;再将其加入含有聚乙烯醇和过氧化氢的连续相中,形成水包油包水二级乳液,除去溶剂后经离心、洗涤、干燥,制备了以过氧化氢为核体,以聚乳酸-羟基乙酸共聚物为壳层的核壳结构微球。通过上述方式,本发明能够使聚乙烯吡咯烷酮与过氧化氢稳定地络合,减缓过氧化氢的分解;并利用微球的核壳结构避免过氧化氢与细胞直接接触,在保证细胞安全的同时使过氧化氢在体内的过氧化氢酶的催化下反应生成氧气和水,达到产氧效果。
需要说明的是,本领域技术人员应当理解:在步骤s1中,聚乳酸-羟基乙酸共聚物的浓度可以在10~15wt%之间调整,有机溶剂可以是二氯甲烷,四氢呋喃,丙酮,乙酸乙酯,乙腈,氯仿,二氧六环,n-甲基吡咯烷酮,二甲基亚砜,二氯乙烷,二甲基乙酰胺,二甲基甲酰胺,甲酸甲酯,碳酸丙烯酯的一种或多种混合;在步骤s3中,水相与油相的体积比可以在1:(5~8)之间调整,匀浆的时间可以是30~120s,匀浆速度可以是5000~15000转/min;在步骤s4中,初级乳液与连续相的体积比可以在1:(40~60)之间调整;在步骤s5中,二级乳液的搅拌时间可以是3~8h,搅拌速度可以是250~800转/min,均属于本发明的保护范围。
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!