一种热休克蛋白单抗修饰纳米金笼制备方法及其用途与流程
1.本发明属于靶向纳米粒子的制备领域,具体涉及到一种热休克蛋白单抗修饰纳米金笼制备方法及其用途。
背景技术:
2.纳米粒子基于其微尺度及优异的比表面积和结构的多样性,在各个领域都有广泛应用,从发现到近几十年不断的发展,其在各个领域比如抗肿瘤、抗菌、催化、载体等诸多前沿领域研究广泛,表现出强大的应用潜力。纳米粒子在抗肿瘤领域具有巨大潜力,但是纳米粒子在肿瘤部位的不足积累阻碍了其功效。纳米粒子主要通过增强的通透性和保留效应(epr效应)转运,然后在肿瘤部位积聚。这种被动积累会受到各种类型的肿瘤,组织液压力和肿瘤血管松弛的不利影响,导致纳米颗粒在肿瘤部位的吸收和富集不足,从而大大降低了纳米药物的抗肿瘤功效。另外,肿瘤细胞缺乏稳定可靠的肿瘤标记,提示开发有效的药物递送策略面临巨大挑战和迫切需求。
3.研究发现,当肿瘤细胞受到微波热疗等非致命性热刺激的威胁时,热休克反应可以激活热休克蛋白(hsps)的大量表达。这些hsp阻止了肿瘤细胞的凋亡,从而通过抑制caspase
‑
3活化,稳定细胞结构以及上调抗凋亡蛋白的表达来获得耐热性,从而提高了细胞存活率。但热刺激后,与肿瘤细胞中的其他蛋白质相比,hsp的积聚和过表达明显更高。值得注意的是热刺激hsp70是hsps家族的重要成员,它将从细胞质迁移到细胞膜。随后可以被hsp单克隆抗体,即cmhsp70识别。
技术实现要素:
4.本专利提出了一种新型的微波触发hsp靶向金纳米系统制备方法以及将其用于光热疗法,该系统专门针对无特异性标志的肿瘤。与先前专注于抑制hsp表达的研究相反,我们的策略创新地利用了在这种不可避免的不良抗凋亡反应中产生的hsp70作为肿瘤细胞的特异性靶标。首先,微波辐射的预处理诱导hsp70的过度表达和迁移。然后,以微波诱导hsp为靶标的金纳米系统与光热疗法相结合,可以改善纳米材料识别肿瘤,同时避免了传统纳米材料富集不足的缺点。研究结果显示cmhsp
‑
aunc在肿瘤中具有更高积累,可以极大地提高光热疗法的疗效。这项技术不仅能为肿瘤的靶向效率提供了崭新的视角,也为肿瘤特异性靶向治疗提供了通用基础。
5.本专利包括如下内容:
6.一种热休克蛋白单抗修饰纳米金笼制备方法,包括如下步骤:
7.步骤一、使用银纳米立方体(agnc)模板和氯金酸(haucl4)通过电流取代反应合成aunc,使用聚乙烯吡咯烷酮(pvp)作为表面稳定剂,形成pvp
‑
aunc;
8.步骤二、采用peg修饰于金纳米笼表面并取代pvp,获得peg
‑
aunc;
9.步骤三、通过酯化反应将cmhsp 70蛋白修饰于peg末端获得cmhsp70
‑
aunc。
10.优选地,所述的热休克蛋白单抗修饰纳米金笼制备方法中的步骤一中银纳米立方
体的制备方法采用多元醇辅助硫化还原法。
11.优选地,所述的热休克蛋白单抗修饰纳米金笼制备方法的步骤一包括如下过程:首先,于50ml圆底烧瓶中加入10ml乙二醇,在磁力搅拌下油浴中加热至150℃,并随后添加0.12ml 3mm nash,5min后,加入1ml3 mm盐酸溶液;之后搅拌5min,加入2.5ml浓度为20mg/ml聚乙烯基吡咯烷酮溶液(pvp,mw=55000),搅拌3min后,加入0.8ml 282mm的cf3cooag溶液;然后,将混合物的温度保持在150℃下1小时,并且随后在水浴中冷却混合物以结束反应;样品以8000转/分的速度离心10分钟并洗涤两次分别用丙酮和去离子水;最后,得到的银纳米立方体是分散在10ml去离子(di)水中,以备进一步使用。
12.优选地,所述的热休克蛋白单抗修饰纳米金笼制备方法的步骤一中,pvp
‑
aunc的制备方法包括如下过程,取分散在10ml去离子(di)水中的银纳米立方体和90ml浓度为1.5mg/ml pvp溶液在磁搅拌下均匀混合,并加热至100℃;然后,以0.2ml的速率逐滴向混合物中添加haucl4溶液(0.6mm);用紫外
‑
可见光谱(uv
‑
vis)实时监测反应的lspr峰的变化;当特征峰达到800nm左右,停止加入并降温终止反应;以8000转/分的速度离心10分钟收集产物;将收集的产物洗涤三次次用去离子水,然后用饱和氯化钠溶液除去副产品agcl;最后,将所得pvp
‑
aunc分散于10毫升去离子水供进一步使用。
13.优选地,所述的热休克蛋白单抗修饰纳米金笼制备方法中的步骤二中包括如下过程:采用1毫升制备的pvp
‑
aunc和在25℃下混合0.5ml 1mm的sh
‑
peg
‑
sc后反应12h;然后,以5000转/分的速度离心10分钟至分离未反应的sh
‑
peg
‑
sc,得到的peg
‑
aunc为分散在去离子(di)水中以备进一步使用。
14.优选地,所述的热休克蛋白单抗修饰纳米金笼制备方法中的步骤三中包括如下过程:将100μg制备的peg
‑
aunc重新分散在混合物中pbs(ph=7.4)和100μg cmhsp70溶液,在4℃下反应12小时;离心样品以去除未反应的cmhsp70,并清洗收集的产物cmhsp
‑
aunc保存在pbs中。
15.将cmhsp70
‑
aunc结合光波热疗在无特异性标志的肿瘤疾病治疗中的用途。
16.优选地,所述的cmhsp70
‑
aunc结合光波热疗在肿瘤疾病治疗中的用途,所述的肿瘤疾病包括乳腺癌、前列腺癌、结肠癌、甲状腺癌、皮肤癌。
附图说明
17.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
18.图1为本专利金纳米系统对微波诱导高表达hsp70的肿瘤细胞具有精准结合,靶向热杀伤作用的效果示意图。
19.图2为前列腺癌裸鼠模型中进行微波热疗预处理和未处理组肿瘤部位的cmhsp70
‑
aunc药物积累量效果示意图。
具体实施方式
20.下面结合实施例对本发明做进一步的详细说明,以下实施例是对本发明的解释而
本发明并不局限于以下实施例。
21.实施例:
22.1、采用多元醇辅助硫化还原法制备银纳米立方体。首先,于50ml圆底烧瓶中加入10ml乙二醇,在磁力搅拌下油浴中加热至150℃,并随后0.12ml添加3mm nash。5min,加入1ml盐酸溶液(3mm)。之后搅拌5min,加入2.5ml浓度为20mg/ml聚乙烯基吡咯烷酮溶液(pvp,mw=55000)。搅拌3min后,加入0.8ml cf3cooag(282mm)溶液。然后,将混合物的温度保持在150℃下1小时,并且随后在水浴中冷却混合物以结束反应。样品以8000转/分的速度离心10分钟并洗涤两次分别用丙酮和去离子水。最后,得到的银纳米立方体是分散在10ml去离子(di)水中,以备进一步使用。将制备的银纳米立方体和90ml浓度为1.5mg/ml pvp溶液在磁搅拌下均匀混合,并加热至100℃。然后,以0.2ml的速率逐滴向混合物中添加haucl4溶液(0.6mm)。用紫外
‑
可见光谱(uv
‑
vis)实时监测反应的lspr峰的变化。当特征峰达到800nm左右,停止加入并降温终止反应。以8000转/分的速度离心10分钟收集产物。将收集的产物洗涤三次次用去离子水,然后用饱和氯化钠溶液除去副产品agcl。最后,将所得pvp
‑
aunc分散于10毫升去离子水供进一步使用。所得pvp
‑
aunc产率为15%,水合粒径为55.6
±
4.21nm,表面电势为
‑
21.2
±
1.78mv。
23.2、巯基
‑
聚乙二醇
‑
丁二酰亚胺酯(sh
‑
peg
‑
sc,mw=5000da)通过au
‑
s键嫁接到aunc上。1毫升制备的pvp
‑
aunc和在25℃下混合0.5ml 1mm sh
‑
peg
‑
sc后反应12h。然后,以5000转/分的速度离心10分钟至分离未反应的sh
‑
peg
‑
sc,得到的peg
‑
aunc为分散在去离子(di)水中以备进一步使用。pvp
‑
aunc产率为85%,水合粒径为58.6
±
3.74nm,表面电势为
‑
17.6
±
2.11mv。
24.3、peg
‑
aunc的琥珀酰亚胺基团与cmhsp70抗体的氨基藕联制备cmhsp70
‑
aunc。将100μg制备的peg
‑
aunc重新分散在混合物中pbs(ph=7.4)和100μg cmhsp70溶液,在4℃下反应12小时。离心样品以去除未反应的cmhsp70,并清洗收集的产物cmhsp
‑
aunc保存在pbs中。cmhsp
‑
aunc产率为95%,水合粒径为61.2
±
8.45nm,表面电势为
‑
8.2
±
1.25mv。
25.如图1图2所示,采用上述方法制得的cmhsp
‑
aunc结合微波热疗对于肿瘤疾病的治疗。
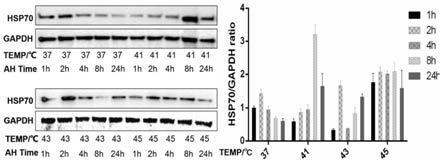
26.通过前期细胞实验和动物实验验证了该复合材料具有很强的hsp70蛋白靶向性,对于微波诱导高表达hsp70的肿瘤细胞具有精准结合,靶向热杀伤作用,如图1中细胞体外实验发现:前列腺癌细胞株微波热疗处理60min后,41℃微波加热处理60min,8h后前列腺癌细胞上hsp70表达最强。证明微波热疗能诱导肿瘤细胞高表达hsp70。
27.如图2所示,在动物实验体内发现:前列腺癌裸鼠模型进行微波热疗预处理和未处理组,8h后通过尾静脉注射cmhsp70
‑
aunc,在注射后的不同时间段,通过小动物活体荧光成像实验,发现肿瘤部位的cmhsp70
‑
aunc药物积累量越来越多(红色代表cmhsp70
‑
aunc的药物的富集程度,富集的药量越多,肿瘤区域的红色越明显越深),微波热疗预处理显着改善了cmhsp
‑
aunc的生物分布,证明微波热疗后cmhsp70
‑
aunc的靶向能力增强了。
28.鉴于该模型在前列腺中的治疗效果,基于同样的原理,我们推断,其在乳腺癌、结肠癌、甲状腺癌、皮肤癌等肿瘤疾病中也有相应的疗效。
29.此外,需要说明的是,本说明书中所描述的具体实施例,其试剂的所取名称等可以不同,其各组分的含量的细微差异,只要未产生突出的变化均包含于本发明的范围内;即凡
依本发明专利构思所述的构造、特征及原理所做的等效或简单变化,均包括于本发明专利的保护范围内。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离本发明的结构或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1