一种包含瑞德西韦的静脉输注液体制剂及制备方法与流程
1.本发明涉及瑞德西韦和增溶剂的水性药物组合物。该药物组合物实现瑞德西韦的充分增溶,且能够经历最终蒸汽灭菌并保持液体状态的长期稳定。
背景技术:
2.瑞德西韦(remdesivir,gs-5743,简称rdv)是吉利德公司研制开发的一种核苷酸类似物前药,能够抑制依赖rna的rna合成酶,具有抗病毒活性。在体外和动物模型中,瑞德西韦证实了对非典型性肺炎(sars)、中东呼吸综合征(mers)以及埃博拉病毒的病毒病原体均有活性,是一个广谱抗病毒药物。2020年10月作为治疗新型冠状病毒(covid-19)的首个药物在fda获得批准上市,商品名为veklury,可用于治疗年龄12岁、体重40千克以上的新冠患者。吉利德公司公开的瑞德西韦化合物结构式如下:
[0003][0004]
美国专利us2019083525公开了瑞德西韦的化学性质,在水中溶解度约为 0.03mg/ml,溶解度较差。在ph1-10范围内溶解呈ph依赖,酸性介质中溶解度较大,随ph值升高,溶解度降低,当ph≤4时,溶解度显著增加。瑞德西韦的溶液在ph4-5之间最稳定,且温度越低也越稳定。
[0005]
美国专利us2019083525也公开了包含瑞德西韦的可注射组合物,包含瑞德西韦、环糊精或其盐及适当的ph调节剂,并公开了制备这种可注射组合物的方法。该技术手段是通过环糊精,尤其是磺丁基倍他环糊精钠(sbecd)的包合技术来实现瑞德西韦的增溶效果的,但是仍需要保持较低的ph值(<4)来维持瑞德西韦的过饱和状态,且不能耐受高温灭菌,最终开发成了冻干制剂,降低了无菌保证水平,增加了生产成本。我们还发现当该技术手段制备得到的组合物在临床使用复溶的过程中溶解较慢,溶液在较低温度下有析出浑浊的风险,存放过程中有关物质会显著增加,并会出现颜色加深的现象。
[0006]
因此,为患者尤其是感染新型冠状病毒的患者提供一种更加稳定的含瑞德西韦的药用组合物是十分必要的。这种组合物最终如果能制备成可经历最终蒸汽灭菌的可供静脉注射的液体制剂那将是具有创造性的。
技术实现要素:
[0007]
一方面,本发明提供了一种包含瑞德西韦的水性药物组合物,其特征在于,该药物组合物包含:活性成分瑞德西韦;辅料增溶剂、酸碱调节剂和水。其中所述药用组合物中的
增溶剂为维生素e琥珀酸聚乙二醇酯(tpgs),所述酸碱调节剂包括酸化剂和碱化剂,所述水优选注射用水。
[0008][0009]
根据已公开的文献报道,已知维生素e琥珀酸聚乙二醇酯(d-α-tocopherolpolyethyleneglycol 1000 succinate,tpgs)可以促进难溶性药物的溶解,当其浓度高于临界胶束浓度时,会在水溶液中自组装成为胶束,将难溶性药物包裹其中,从而提高药物的水溶性。然而,现有文献并没有报道tpgs是否可以增加瑞德西韦或任何相关的核苷酸类似物的水溶性。
[0010]
tpgs是天然维生素e的水溶性衍生物(结构式如下),由亲水的聚乙二醇 (peg)与亲脂的生育酚琥珀酸酯(tas)发生酯化反应而得,同时兼具了peg和生育酚的生理活性,常温下是白色或淡黄色蜡状固体。tpgs最早于1950年由美国伊士曼公司开发上市,由于它既有生育酚亲脂基团,又含有聚乙二醇长链的亲水基团,故具有表面活性剂的性质。
[0011][0012]
(维生素e琥珀酸聚乙二醇酯)
[0013]
表1 tpgs的一些相关信息
[0014]
名称维生素e琥珀酸聚乙二醇酯分子量约1513g/mole(取代度20~22)溶解度在水中大约20%(w/v)cas号9002-96-4
[0015]
在尝试评估在可行的ph值下能达到的瑞德西韦的溶解度范围时,制备了一系列的tpgs浓度固定为10%(w/v)的溶液。分别进行瑞德西韦在不同ph值(1~6)的tpgs 溶液中溶解度考察。表2显示不同ph值时10%tpgs溶液中的瑞德西韦的溶解度。
[0016]
表2不同ph值时10%tpgs溶液中的瑞德西韦的溶解度
[0017][0018]
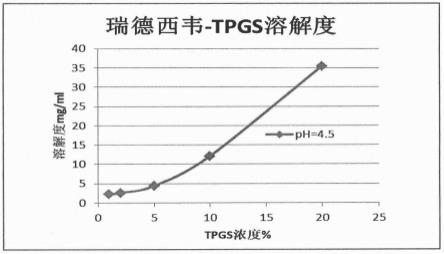
对不同浓度tpgs的酸性溶液(ph=4.5)中的瑞德西韦的溶解度也进行了评价。如图1 所示,瑞德西韦的溶解度随tpgs浓度的增加而增加,且在tpgs的浓度大于5%时溶解度显著增加,当等于10%时,能够在ph大于4的酸性溶液中维持瑞德西韦的溶解度大于10mg/
ml。
[0019]
上述研究提供了一个重要的发现,tpgs具有显著的增溶效果,例如在10ml溶液中可以溶解大于100mg剂量的瑞德西韦,更重要的是,这种增溶效果可以在ph大于4的弱酸性条件下实现。
[0020]
在本发明的一些方案中,瑞德西韦与增溶剂维生素e琥珀酸聚乙二醇酯的重量比为1∶5 至1∶20,进一步的,瑞德西韦与维生素e琥珀酸聚乙二醇酯的重量比为1∶10。
[0021]
在本发明的一些方案中,增溶剂维生素e琥珀酸聚乙二醇酯在水性药物组合物中的浓度越高,对瑞德西韦的增溶能力越强,例如在一些方案中,增溶剂维生素e琥珀酸聚乙二醇酯在水性药物组合物中的浓度为5%~20%。
[0022]
在本发明的一些方案中,盐酸被用作瑞德西韦制剂中的酸化剂,为了达到最终控制的ph 值,同时选用氢氧化钠作为碱化剂一起组成ph调节剂,以达到调节目标ph值的作用。本发明的酸化剂包括盐酸、硫酸、磷酸等无机酸,也包括柠檬酸、马来酸、酒石酸、乳酸等。
[0023]
在本发明的一些方案中,我们意外地发现,采取本发明提供的水性药物组合物可以在最终灭菌(如高压灭菌)期间经历温度变化时,瑞德西韦能够保持稳定,如表3显示,在灭菌前后未见明显的降解杂质生成。灭菌是确保任何注射用液体制剂无菌的必要步骤,活性成分不发生降解保证了注射给药的安全性和有效性。因此,本发明的制剂可直接用于静脉注射方便使用。
[0024]
表3不同灭菌条件下瑞德西韦的有关物质变化
[0025][0026]
另一方面,本发明还提供了上述静脉输注用瑞德西韦的药物组合物的制备方法,其特征在于,包含以下操作步骤:
[0027]
步骤1:向容器中加入初始体积的注射用水,向注射用水中加入增溶剂维生素e琥珀酸聚乙二醇酯,并搅拌直至溶解;
[0028]
步骤2:加入酸化剂将ph值调节至适当的水平;
[0029]
步骤3:加入瑞德西韦,搅拌直至溶解;
[0030]
步骤4:加入碱化剂将ph值调节至适当的水平;
[0031]
步骤5:加入适量注射用水以达到最终的批次体积,并混合过滤以获得均匀澄清的溶液;
[0032]
步骤6:通过高压蒸汽灭菌得到最终产品。
[0033]
制备方法中所述步骤2)中,酸化剂用于调减ph值,其特征在于调节ph值至3.5~4.0,在本发明的一些方案中,当使用盐酸、硫酸、磷酸等无机酸作为酸化剂使用时,在灭菌工艺前后,导致最终产品的ph值升高,当使用有机酸时,就没有这种现象。在本发明的一个方案中使用柠檬酸不仅方便调节,且能维持灭菌前后的ph稳定。
[0034]
制备方法中所述步骤4)中,碱化剂用于调升ph值,其特征在于调节ph值至4.0~5.0,在本发明的一个方案中,调节ph至4.5。
[0035]
如美国专利us2019083525附图1所示,瑞德西韦在ph值4.0~5.0范围内是最稳定的,而美国专利us2019083525附图2表明瑞德西韦在ph值小于4.0时溶解度才显著增加,该专利申请人即使是选择了环糊精增溶,最优的ph值范围只能选择3.5,且工艺中需要先酸化调节更低的ph,较强的酸性对工艺操作和配液设备无疑会提出额外的要求。
[0036]
又如美国专利us2019083525所述瑞德西韦在溶液形式下不稳定,酸或碱性条件下容易发生水解,产生杂质a和杂质b。
[0037][0038]
因此,才将瑞德西韦开发成冻干制剂。而针对难溶性药物的冻干工艺往往面临冻干溶液体积较大,冻干时间较长,生产成本较高,无菌保障风险较大的挑战,以美国专利us2019083525实施例1制备单剂量150mg的瑞德西韦冻干制剂为例,需要冻干22.5ml的溶液,这都对生产放大带来了极大的不便利性。
[0039]
有益效果:
[0040]
本发明意外发现维生素e琥珀酸聚乙二醇酯(tpgs)可以在较高的ph值范围下(4~5)有效增加瑞德西韦的溶解度,又能在高温条件下保持稳定,从而提供了一种包含瑞德西韦的可供静脉输注的液体制剂。本发明还提供了一种注射用瑞德西韦药物组合物的制备方法,突出地优势主要表现在以下几点:
[0041]
1、ph值提高,更接近生理可接受范围;
[0042]
2、溶解效果更好,溶解过程不需要过度酸化,溶液更稳定;
[0043]
3、无菌保障水平更高,临床使用更安全;
[0044]
4、生产周期短,生产成本更低。
附图说明
[0045]
图1不同浓度tpgs的酸性溶液(ph=4.5)中的瑞德西韦的溶解度曲线
具体实施方式
[0046]
对比实施例1(美国专利us2019083525实施例1)
[0047]
组合物组成:(rdv∶sbecd=1∶30)
[0048]
成分作用含量固体占比液体占比瑞德西韦主药150mg3.23%0.67%磺丁基倍他环糊精钠冻干赋形剂4.5g96.77%20%盐酸和氢氧化钠酸碱调节剂适量//注射用水溶剂22.5ml//
[0049]
制备工艺:
[0050]
步骤1:将磺丁基倍他环糊精钠溶解于注射用水中,获得第1溶液。
[0051]
步骤2:加入2mol/l盐酸,调节第1混合ph值至≤2(约为1.75左右),获得第二溶液(酸化)。
[0052]
步骤3:加入瑞德西韦原料药至第二混合液中形成含药混合液,即第三混合溶液。
[0053]
步骤4:加入氢氧化钠调节上述第三混合溶液ph值为3~4(约为3.5左右),形成过饱和溶液。
[0054]
步骤5:再加注射用水定容至全量,为第四溶液。
[0055]
步骤6:通过0.22μm的过滤器无菌过滤药物组合物,将过滤后的产品分装于玻璃瓶中,半加塞。
[0056]
步骤7:预冻:第一步2小时内由常温降温到-45℃,第二步在-45℃保温4小时;升华:-45℃升至-15℃干燥70小时;解析干燥:-15℃升至25℃干燥6小时。加塞轧盖得最终产品,水分4%。
[0057]
在本实施例的制备过程中发现所需盐酸浓度很高才能达到过度酸化的目的,且生产周期达到4天一批。
[0058]
实施例1
[0059]
组合物组成:(rdv∶tpgs=1∶10)
[0060]
成分作用含量固体占比液体占比瑞德西韦主药50mg9.09%0.5%tpgs冻干赋形剂0.5g90.91%5%盐酸和氢氧化钠酸碱调节剂适量//注射用水溶剂10ml//
[0061]
制备工艺:
[0062]
1)向容器中加入80%的注射用水,向注射用水中加入增溶剂tpgs,并搅拌直至溶解;
[0063]
2)加入0.2mol/l盐酸溶液将ph值调节至3.5;
[0064]
3)加入瑞德西韦,搅拌直至溶解;
[0065]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.0;
[0066]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0067]
6)121℃高压蒸汽灭菌15分钟得瑞德西韦注射液。
[0068]
实施例2
[0069]
组合物组成:(rdv∶tpgs=1∶16)
[0070]
成分作用含量固体占比液体占比瑞德西韦主药50mg5.88%0.5%tpgs冻干赋形剂0.8g94.12%8%枸橼酸和氢氧化钠酸碱调节剂适量//注射用水溶剂10ml//
[0071]
制备工艺:
[0072]
1)向容器中加入80%的注射用水,向注射用水中加入增溶剂tpgs,并搅拌直至溶解;
[0073]
2)加入枸橼酸固体粉末将ph值调节至3.6;
[0074]
3)加入瑞德西韦,搅拌直至溶解;
[0075]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.3;
[0076]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0077]
6)121℃高压蒸汽灭菌12分钟得瑞德西韦注射液。
[0078]
实施例3
[0079]
组合物组成:(rdv∶tpgs=1∶10)
[0080]
成分作用含量固体占比液体占比瑞德西韦主药150mg9.09%1%tpgs冻干赋形剂1.5g90.91%10%枸橼酸和氢氧化钠酸碱调节剂适量//注射用水溶剂15ml//
[0081]
制备工艺:
[0082]
1)向容器中加入70%的注射用水,向注射用水中加入增溶剂tpgs,并搅拌直至溶解;
[0083]
2)加入枸橼酸固体粉末将ph值调节至3.7;
[0084]
3)加入瑞德西韦,搅拌直至溶解;
[0085]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.5;
[0086]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0087]
6)115℃高压蒸汽灭菌35分钟得瑞德西韦注射液。
[0088]
实施例4
[0089]
组合物组成:(rdv∶tpgs=1∶10)
[0090]
成分作用含量固体占比液体占比瑞德西韦主药150mg9.09%1%tpgs冻干赋形剂1.5g90.91%10%盐酸和氢氧化钠酸碱调节剂适量//注射用水溶剂15ml//
[0091]
制备工艺:
[0092]
1)向容器中加入70%的注射用水,向注射用水中加入增溶剂tpgs,并搅拌直至溶解;
[0093]
2)加入0.2mol/l盐酸溶液将ph值调节至3.5;
[0094]
3)加入瑞德西韦,搅拌直至溶解;
[0095]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.5;
[0096]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0097]
6)115℃高压蒸汽灭菌40分钟得瑞德西韦注射液。
[0098]
实施例5
[0099]
组合物组成:(rdv∶tpgs=1∶12)
[0100]
成分作用含量固体占比液体占比瑞德西韦主药150mg7.69%1%
tpgs冻干赋形剂1.8g92.31%12%枸橼酸和氢氧化钠酸碱调节剂适量//注射用水溶剂15ml//
[0101]
制备工艺:
[0102]
1)向容器中加入初始体积80%的注射用水,向注射用水中加入tpgs,并混合直至溶解;
[0103]
2)加入枸橼酸固体粉末将ph值调节至4.0;
[0104]
3)加入瑞德西韦,搅拌直至溶解;
[0105]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.7;
[0106]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0107]
6)121℃高压蒸汽灭菌8分钟得瑞德西韦注射液。
[0108]
实施例6
[0109]
组合物组成:(rdv∶tpgs=1∶8)
[0110]
成分作用含量固体占比液体占比瑞德西韦主药200mg11.11%2%tpgs冻干赋形剂1.6g88.89%16%枸橼酸和氢氧化钠酸碱调节剂适量//注射用水溶剂10ml//
[0111]
制备工艺:
[0112]
1)向容器中加入初始体积80%的注射用水,向注射用水中加入tpgs,并混合直至溶解;
[0113]
2)加入枸橼酸固体粉末将ph值调节至3.9;
[0114]
3)加入瑞德西韦,搅拌直至溶解;
[0115]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至4.9;
[0116]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0117]
6)121℃高压蒸汽灭菌10分钟得瑞德西韦注射液。
[0118]
实施例7
[0119]
组合物组成:(rdv∶tpgs=1∶10)
[0120]
成分作用含量固体占比液体占比瑞德西韦主药100mg11.11%2%tpgs冻干赋形剂1.0g88.89%20%枸橼酸和氢氧化钠酸碱调节剂适量//注射用水溶剂5.0ml//
[0121]
制备工艺:
[0122]
1)向容器中加入初始体积80%的注射用水,向注射用水中加入tpgs,并混合直至溶解;
[0123]
2)加入枸橼酸固体粉末将ph值调节至3.8;
[0124]
3)加入瑞德西韦,搅拌直至溶解;
[0125]
4)加入0.2mol/l氢氧化钠溶液将ph值调节至5.0;
[0126]
5)补加注射用水定容,并混合过滤以获得均匀的澄清溶液;
[0127]
6)121℃高压蒸汽灭菌12分钟得瑞德西韦注射液。
[0128]
上述实施例1-7生产周期均为1天每批。
[0129]
实施例8为评价瑞德西韦药物组合物的质量,将对比实施例1和实施例7样品进行质量对比研究,检测性状、酸度、含量、有关物质、元素杂质。
[0130][0131]
由上表数据可见本发明的瑞德西韦药物组合物无论是有关物质还是元素杂质水平都要优于对比实施例1,且相同浓度下的ph值也比对比实施例1更接近于生理可接受范围。
[0132]
实施例9为进一步评价瑞德西韦药物组合物的稳定性,模拟临床使用将对比实施例1和实施例1-7的制剂用0.9%的生理盐水中配伍成1.0mg/ml的浓度的溶液考察低温(2~8℃)稳定性。
[0133][0134]
由上表数据可见本发明的瑞德西韦药物组合物在稀释配伍的制备中ph值变化不大,配伍溶液能保持24小时稳定,含量几乎没有下降。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1