RGD环肽/R8肽修饰的ERG联合Afa双载药脂质体冻干粉的制备方法与流程
本发明涉及一种脂质体的制备方法,尤其涉及一种麦角甾醇联合阿法替尼脂质体的制备方法,属于药物制剂技术领域。
背景技术:
肺恶性肿瘤是当今世界非良性肿瘤相关死亡的主要原因,对人类健康构成严重威胁。《2018年全球癌症发病率和死亡率估计》报道,预计2018年将有1810万新癌症病例和960万癌症死亡病例,其中非小细胞肺癌(non-smallcelllungcancer,nsclc)约占肺癌的85%,但75%的患者发现时已处于癌症中晚期,错过了手术治疗的最佳时期。
由于顺铂、紫杉醇类药物较长时间投入临床应用,但并没有改善患者的生存效益,出现耐药性、毒副反应,甚至危害患者的健康和生命。分子靶向药物治疗以其针对性强,副作用少的特点,应用越来越广泛。2004年,研究发现,nsclc与表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)突变有关,自此肺癌的治疗进入分子靶向研究的阶段。
吉非替尼(gefitinib)是第一代表皮生长因子受体(egfr)酪氨酸激酶抑制剂(tyrosinekinaseinhibitor,tki),对egfr突变的患者疗效优于化疗药物,但是患者在用药10-14个月后出现tki耐药现象,最终导致药物的疗效降低。相关研究表明这种tki耐药主要是由于egfr外显子的苏氨酸-790突变为蛋氨酸,亦称t790m突变,c-met基因扩增等引起。在前期实验研究中,本实验室采用了针对第一代分子靶向药物吉非替尼敏感的pc-9细胞以及对其耐药的a549细胞进行体外机理的研究。研究发现,不同给药时间下联合给药组对a549,pc-9细胞的抑制率相较于麦角甾醇和吉非替尼两单用组均有不同程度的提高,表明麦角甾醇与吉非替尼联用明显增强了gef对a549与pc-9细胞的敏感性。
阿法替尼(afatinib)是第二代不可逆egfr酪氨酸激酶抑制剂,是德国勃林格殷格翰公司研发的egfr和her2双重多靶点药物,即是针对tki继发性耐药开发所研制的,它携带一个反应性的丙烯酰胺基,是atp竞争苯胺基衍生物,能够阻止egfr、her2和her4激酶,形成共价键和不可逆价键。然而第二代靶向药物阿法替尼使用约9-13个月后也会产生耐药,失去抗肿瘤作用,严重影响了治疗效果。
目前市售阿法替尼为片剂,口服给药生物利用度较低,且不良反应较多,最常见的是胃肠道的不良反应,不降反应较严重者需要采取中断给药或减少剂量的措施。为提高患者的生命质量,减小耐药现象的发生,使其更好的发挥药效,开发一种具有靶向性、生物利用度高、不良反应少的阿法替尼新型制剂势在必行。
考虑到药物的不同物理化学和药代动力学特性,如溶解度,半衰期等,简单的独立给药不能达到预期的效果。因此,需要药物共同递送系统来解决这些问题。
技术实现要素:
本发明要解决上述技术问题,从而提供一种rgd环肽/r8肽修饰的erg联合afa双载药脂质体冻干粉的制备方法。本发明采用后插入法将dspe-peg3400-c(rgdfk)和dspe-peg1000-r8嵌入erg/afa-lip的脂质膜层,制备出rgd环肽/r8肽修饰的erg/afa-lip(rgd/r8-erg/afa-lip),考虑到脂质体久置易发生聚集、沉淀、易被氧化等不稳定性,所以将其制备成冻干粉剂型,通过对其处方工艺和冻干工艺的考察,得出最佳冻干粉的制备方法,且外观均匀饱满无凹陷,复溶后脂质体均一透明,粒径较小分布均匀,血清稳定性良好,体外释放度符合2015版《中国药典》要求,稳定性良好的rgd/r8-erg/afa-lip冻干粉。最后通过流式细胞凋亡技术考察rgd/r8-erg/afa-lip冻干粉对pc-9细胞的细胞凋亡作用。
本发明解决上述问题的技术方案如下:
rgd环肽/r8肽修饰的erg联合afa双载药脂质体冻干粉的制备方法,包括以下步骤:冻干保护剂以外加法的方式加入到预先制备好的rgd/r8-erg/afa-lip脂质体混悬液中;最后采用冷冻干燥法制备成复方脂质体的冻干粉;所述rgd/r8-erg/afa-lip脂质体混悬液的制备采用以下方法:先制备erg/afa-lip,后采用后插入法制备。
作为优选,冷冻干燥法的具体为快冻法,具体为先使设备中的冷阱部分的温度预先降低到最低温度,再将样品置于冷阱中。
作为优选,冷冻干燥法的预冻时间为4h。
作为优选,冷冻干燥法的冷冻干燥时间为35h。
作为优选,冻干保护剂处方为:每支脂质体冻干粉5ml中含有147mg蔗糖和147mg甘露醇,糖脂比为3:1,蔗糖与甘露醇质量比为1:1。
作为优选,采用慢冻法,在设备冷阱处放置4h后,转移到上层进行35h的冻干干燥;冻干程序:-30~-20℃:350min;-20~-10℃:350min;-10~-0℃:350min;0~10℃:350min;10~20℃:350min;20~30℃:350min。
本发明的另一个目的是提供上述方法制备得到的脂质体冻干粉。
本发明的在一个目的是提供上述脂质体冻干粉在制备抑制肿瘤细胞生长和/或诱导肿瘤细胞凋亡的靶向药物中的应用。
本发明具有以下有益效果:
1、本发明选择合适的辅料以及工艺方法,将erg/afa-lip制成稳定的脂质体冻干粉制剂,药物的生物利用度可以得到相应的提高。再利用冷冻干燥技术将液态形式的脂质体制成冻干制剂,从而延长储存时间。并对所得到的脂质体进行质量评价及稳定性研究,分析得到适合药物贮存环境的条件及影响稳定性的因素;
2、本发明成功制备了rgd/r8-erg/afa-lip冻干粉。用erg/afa-lip进行冻干工艺的考察和处方的优化实验,筛选出最佳处方工艺后将其应用到rgd/r8-erg/afa-lip中进行验证;得出最佳冻干与处方工艺为:采用慢冻法,在设备冷阱处放置4h后,转移到上层进行35h的冻干干燥(冻干程序:-30~-20℃:350min;-20~-10℃:350min;-10~-0℃:350min;0~10℃:350min;10~20℃:350min;20~30℃:350min)。冻干保护剂处方为:每支脂质体冻干粉(5ml)中含有147mg蔗糖和147mg甘露醇(糖脂比为3:1,蔗糖与甘露醇质量比为1:1)。rgd/r8-erg/afa-lip冻干粉复溶后,粒径、电位、包封率、血清稳定性良好,通过流式凋亡术检测其可以明显促进pc-9细胞的凋亡。
附图说明
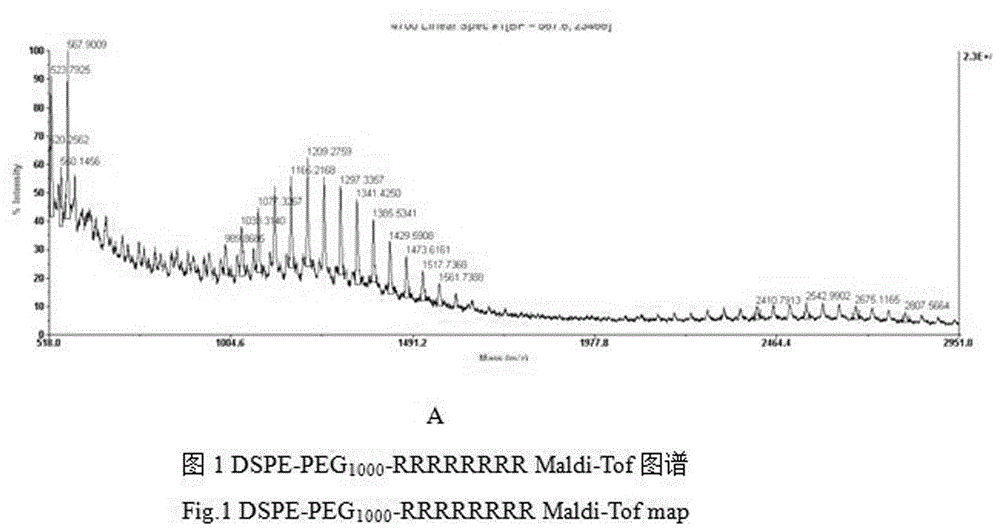
图1是dspe-peg1000-rrrrrrrrmaldi-tof图谱;
图2是dspe-peg1000-rrrrrrrrmaldi-tof图谱;
图3是dspe-peg3400-c(rgdfk)maldi-tof图谱;
图4是dspe-peg3400-c(rgdfk)maldi-tof图谱;
图5是样品及隔板的降温曲线;
图6是各脂质体透射电镜图;
图7是各脂质体粒径分布;
图8是各脂质体粒径分布;
图9是各脂质体zeta电位;
图10是各脂质体zeta电位;
图11是afa和rgd/r8-erg/afa-lip冻干粉在不同ph释放介质下的累积释放度;
图12是pc-9细胞凋亡流式图。
具体实施方式
以下结合附图对本发明进行进一步的解释说明。
本具体实施方式仅仅是对本发明的解释,并不是对本发明的限制,本领域技术人员在阅读了本发明的说明书之后所做的任何改变,只要在权利要求书的范围内,都将受到专利法的保护。
一、实验材料
(一)实验药品与试剂
阿法替尼原料药(爱必信生物科技有限公司,批号:abs47020632)
麦角甾醇原料药(≥95%,美国sigma公司,批号:bcbn4049v)
卵磷脂(大豆,>98%,上海阿拉丁生化科技股份有限公司,批号:g1813018)
高纯胆固醇(注射级,上海艾伟特医药科技有限公司,批号:b01221)
硫酸铵(上海凌峰化学试剂有限公司,批号:20120313)
柠檬酸(上海凌峰化学试剂有限公司,批号:20110725)
三氯甲烷(上海凌峰化学试剂有限公司,批号:20171017)
甲醇(色谱级,美国天地有限公司,批号:ms1922-801)
聚碳酸酯径迹蚀刻膜(型号:0.8、0.4、0.2、0.1μm,英国whatman公司)
葡萄糖(国药集团化学试剂有限公司,f20090921)
蔗糖(南宁糖业股份有限公司伶俐糖厂,批号171801)
甘露醇(青岛明月海藻集团有限公司,批号20180314)
海藻糖(源叶生物科技有限公司,批号s11052-25g)
树脂:取代度为1.03mmol/g的2-chlorotritylchlorideresin(天津市南开合成科技有限公司)
氨基酸:fmoc-arg(pbf)-oh(成都诚诺,>99%),fmoc-gly-oh(成都诚诺,>99%)
dmf(原产地韩国)
dcm(原产地韩国)
meoh(原产地日本)
diea(新德化工,99%)
hbtu(昊帆生物科技,99%)
哌啶(国药集团上海化学试剂公司,99%)
95%切割液:tfa(j.t.baker,99%)
tis(上海达瑞精细化工,98%)
edt(上海达瑞精细化工,98%)
(二)实验器材
ts-1水平摇床(海门市其林贝尔仪器制造有限公司)
ja203h分析电子天平(常州市幸运电子设备有限公司)
xs105du分析天平(瑞士梅特勒-托利多公司)
dk-450b电热恒温水槽(上海森信实验仪器有限公司)
scientz-ⅱd超声波细胞破碎仪(宁波新芝生物科技股份有限公司)
re-52a旋转蒸发器(上海亚荣生化仪器厂)
wh-861漩涡混合器(太仓华利达实验设备有限公司)
kq5200de型数控超声波清洗器(昆山市超声仪器有限公司)
agilent1260高效液相色谱仪(美国安捷伦科技有限公司)
homoex-25高压膜挤出器(上海赫默仕机电科技有限公司)
zetasizernanozs90激光粒度仪/zeta电位仪(英国马尔文仪器有限公司)
h-7650透射扫描电子显微镜(日本hitachi公司)
十二通道半自动多肽合仪(上海强耀生物科技有限公司)
virtis冻干机(上海斯高勒生物科技有限公司)
dhs20-a水分测定仪(上海精密科学仪器有限公司)
eppendorf5427r台式高速冷冻离心机(德国eppendorf公司)
eppendorf5702台式离心机(德国eppendorf公司)
hh-2数显恒温水浴锅(常州国华电器有限公司)
冷藏冷冻箱(青岛海尔股份有限公司)
thermo905超低温冰箱(美国赛默飞世尔公司)
微量移液枪(德国eppendorf公司)
synergyh1mfd多功能酶标仪(美国biotek公司)
十二通道半自动多肽合成仪(上海强耀生物科技有限公司自主设计并申请专利的半自动多肽合成仪,专利号为201020226529.2)
shimadzu高效液相色谱仪(型号:制备型,分析型,软件:class-vp.sevialsystem,厂商:shimadzu)
二、方法与结果
(一)dspe-peg1000-rrrrrrrr多肽的合成
1实验步骤
1.1树脂溶涨
将2-chlorotritylchlorideresin放入反应管中,加dcm(15ml·g-1),振荡30min。
1.2接第一个氨基酸
通过沙芯抽滤掉溶剂,加入3倍摩尔过量的fmoc-arg(pbf)-oh氨基酸,加入dmf溶解,再加入10倍摩尔过量的diea,振荡60min。用甲醇封闭。
1.3脱保护
去掉dmf,加20%哌啶dmf溶液(15ml·g-1),5min,去掉再加20%哌啶dmf溶液(15ml·g-1),15min。
1.4检测
抽掉哌啶溶液,取十几粒树脂,用乙醇洗三次,加入检测试剂检测,105℃-110℃加热5min,变深蓝色为阳性反应。
1.5洗涤
dmf(10ml·g-1)两次,dcm(10ml·g-1)两次,dmf(10ml·g-1)两次。
1.6缩合
保护氨基酸三倍过量,hbtu三倍过量,均用尽量少dmf溶解,加入反应管,立刻加入diea十倍过量.反应30min.
1.7检测
取十几粒树脂,用乙醇洗三次,加入检测试剂检测,105℃-110℃加热5min,无色为阴性反应。
1.8洗涤
dmf(10ml·g-1)一次,dcm(10ml·g-1)两次,dmf(10ml·g-1)两次。
1.9连接氨基酸
重复三至六步操作,从右到左依次连接序列中的氨基酸。直至直线序列完成。1.10抽干,洗树脂
dmf(10ml·g-1)两次,甲醇(10ml·g-1)两次,dmf(10ml·g-1)两次,dcm(10ml·g-1)两次,抽干10min。
1.11切割多肽
配制切割液(10ml·g-1)tfa95%;水1%;edt2%;tis2%,切割时间:120min。
1.12吹干洗涤
将裂解液用氮气尽量吹干,用乙醚洗六次,然后常温挥干。
1.13esi-ms鉴定
通过esi-ms鉴定直线序列为我们链接修饰前质谱无误。
1.14反应
加入dmf溶胀15min,后加入1.5mmol过量的dspe-peg1000-cooh,hatu三倍过量,均用尽量少dmf溶解,加入反应管,立刻加入diea十倍过量。反应45min。
1.15粗品
将多肽按照步骤十、十一、十二进行,得到胶状多肽粗品。
1.16冻干
将多肽加入水和乙腈溶液放入冻干机中进行浓缩,冻干成最终产品。
2实验结果
如图1所示,原料dspe-peg1000-cooh,mw:567+聚合部分≈1700,(图中的正态分布可以清晰地看到每个峰值相差44),终产物dspe-peg1000-rrrrrrrrmw:1700+1267≈2900。
如图2所示,最终聚合物部分2800左右,比2900略小,图谱稍差,也是可以的。
(二)dspe-peg3400-c(rgdfk)多肽的合成
1实验步骤
1.1树脂溶涨
将2-chlorotritylchlorideresin放入反应管中,加dcm(15ml·g-1),振荡30min。
1.2接第一个氨基酸
通过沙芯抽滤掉溶剂,加入3倍摩尔过量的fmoc-asp(oall)-oh氨基酸,加入dmf溶解,再加入10倍摩尔过量的diea,振荡60min。用甲醇封闭。
1.3脱保护
去掉dmf,加20%哌啶dmf溶液(15ml·g-1),5min,去掉再加20%哌啶dmf溶液(15ml·g-1),15min。
1.4检测
抽掉哌啶溶液,取十几粒树脂,用乙醇洗三次,加入检测试剂检测,105℃-110℃加热5min,变深蓝色为阳性反应。
1.5洗涤
dmf(10ml·g-1)两次,dcm(10ml·g-1)两次,dmf(10ml·g-1)两次。
1.6缩合
保护氨基酸三倍过量,hbtu三倍过量,均用尽量少dmf溶解,加入反应管,立刻加入diea十倍过量.反应30min。
1.7检测
取十几粒树脂,用乙醇洗三次,加入检测试剂检测,105℃-110℃加热5min,无色为阴性反应。
1.8洗涤
dmf(10ml·g-1)一次,dcm(10ml·g-1)两次,dmf(10ml·g-1)两次。
1.9连接氨基酸
重复三至六步操作,从右到左依次连接序列中的氨基酸fmoc-gly-oh,fmoc-arg(pbf)-oh,fmoc-d-phe-oh,fmoc-lys(dde)-oh。成环,去除oall保护基,后hbtu三倍过量,均用尽量少dmf溶解,加入反应管,立刻加入diea十倍过量,反应60min,去除侧链dde保护基。
1.10洗树脂
dmf(10ml·g-1)两次,甲醇(10ml·g-1)两次,dmf(10ml·g-1)两次,dcm(10ml·g-1)两次,抽干10min。
1.11切割多肽
配制切割液(10ml·g-1)tfa95%;水1%;edt2%;tis2%。切割时间:120min
1.12吹干洗涤
将裂解液用氮气尽量吹干,用乙醚洗六次,然后常温挥干。
1.13esi-ms鉴定
通过esi-ms鉴定直线环肽序列为我们链接修饰前质谱无误。
1.14反应
加入dmf溶胀15min,后加入1.5mmol过量的dspe-peg3400-cooh,hatu三倍过量,均用尽量少dmf溶解,加入反应管,立刻加入diea十倍过量,反应45min。
1.15粗品
将多肽按照步骤十、十一、十二进行,得到胶状多肽粗品。
1.16冻干
将多肽加入水和乙腈溶液放入冻干机中进行浓缩,冻干成最终产品。
2实验结果
peg乙二醇类聚合物,其maldi-tof图谱形似正态分布,严格来讲正态分布中每个峰应该相差44左右。其中,dspe-peg磷脂聚乙二醇类原料在检测maldi-tof的时候dspe会部分掉落,准确分子量是两个相加,而聚合物部分也会因为聚合的原因存在10%左右的偏差。终产物会因为序列的原因可能掉落dspe可能不会。
如图3所示,原料dspe-peg3400-cooh,mw:607+聚合部分≈4100,聚合物部分图谱稍差。终产物dspe-peg3400-c(rgdfk)分子量:原料4100+直线607≈4700。
如图4所示,前端掉落,701+聚合部分3800~3900,比4700略小。因为是聚合物,所以误差存在10%以内是可以的。
(三)erg/afa-lip冻干粉的处方工艺的研究
普通脂质体的存放形式是液态,但是脂质体在液态形式下是十分不稳定的,易造成药物泄漏,磷脂水解、氧化、产生沉淀,有关物质增多的现象,从而导致脂质体的不稳定性。本实验采用冷冻干燥法研制erg/afa-lip冻干脂质体,提高它的稳定性,延长储存时间。脂质体在冷冻干燥过程中容易发生的相分离,它产生的冰晶会破坏脂质体磷脂双分子层的结构,使得脂质体复溶后粒径增大,产生难溶性沉淀。因此,可通过添加适当的冻干保护剂来解决。冻干保护剂该具备四个特性:吸水性差,玻璃化转变温度高,不含还原基及结晶率低。
本实验选择合适的辅料以及工艺方法,将erg/afa-lip制成稳定的脂质体冻干粉制剂,药物的生物利用度可以得到相应的提高。再利用冷冻干燥技术将液态形式的脂质体制成冻干制剂,从而延长储存时间。并对所得到的脂质体进行质量评价及稳定性研究,分析得到适合药物贮存环境的条件及影响稳定性的因素。
1冻干脂质体的制备
冻干过程产生的冰晶会对脂质体结构造成损伤,并导致样品不成形,产生皱缩等的现象。为了减小冻干对脂质体的破坏作用以及一定的美观程度,使其不产生坍塌凹陷的现象,一般需要加入冻干保护剂。冻干保护剂的加入方式分为内加法和外加法。外加法是指将保护剂直接加入已制备好的脂质体混悬液中,内加法是将保护剂加入脂质体的水化介质(194.63mm的硫酸铵溶液)中共同水化。本实验先加入5%的蔗糖作为冻干保护剂进行实验。下表结果表明,冻干后内加法所得脂质体粒径显著高于外加法(p<0.01),而且冻干后的脂质体外观凹陷皱缩。综合所述,本实验选择外加法作为脂质体冻干保护剂的加入方式。
2冻干工艺优化
2.1冻干粉共熔点的测定
升华干燥时物料温度不能高于其共熔点,否则物料会融化,导致物料沸腾,干燥后的脂质体内部容易产生气泡、充气膨胀、颜色加深、干缩、溶解困难等现象[62],从而影响冻干制剂的质量。将制备好的冻干样品置于隔板上,记录隔板温度和样品温度随时间的变化值,绘制降温曲线,降温曲线如图5。
由图5可知,0~13min样品温度随着时间延长而降低,在13~14min有一小段升温过程,此时温度由1.7℃升至2.8℃,表明样品最低共熔点在1~3℃之间,所以第一阶段(升华干燥)升温温度不宜超过1℃。冷冻干燥机均可达到该生产要求。
2.2预冻速率的考察
预冻速率是冻干工艺的重要参数之一。预冻速率分为快冻法和慢冻法两种。快冻法首先是先启动冻干机的降温程序,使冷阱温度降低至-40℃后,再将样品放置冷阱中,这种方法的特点是使样品快速降温,样品可形成致密网状结构。慢冻法是先将冻干样品放置冷阱中,然后启动设备的降温功能,这种方法的特点是样品自身的温度降低较慢,形成的冰晶粗,但可以提高干燥效率。不同的预冻速率可能引起脂质体的冷冻外相层和分子层之间产生渗透压,从而导致脂质体的药物渗漏出来。因此,本实验采用慢冻法和快冻法分别进行实验。结果见下表,慢冻法和快冻法对于afa包封率和erg包封率几乎没有影响。但慢冻法粒径比快冻法小,外观较饱满,疏松,无凹陷,所以本实验选择慢冻法进行冻干样品的预冻。
预冻速率对脂质体冻干效果的影响
2.3预冻时间的考察
预冻时间的长短决定了样品是否完全冻实,这是影响冻干产品质量的关键因素。本实验分别考察了样品在冷阱中,采用慢冻法分别预冻1,2,3,4,6,8h后冻干的样品质量。按程序进行升华干燥。以样品外观是否饱满,粒径变化以及erg和afa的包封率,复溶性为评价指标,评分方法见下表,得分多者较佳。结果显示,预冻4h所得综合评分最高,所以预冻时间选择4h。
2.4冻干干燥时间的考察
冻干粉的储存温度必须低于药品的玻璃化转变温度,否则药品会出现凹陷、表面萎缩、变硬变色、结块等不良症状。而冻干粉中的含水量是影响玻璃化转变温度的一个重要因素。冻干粉中的含水量越高,其玻璃化转变温度越低,冻干粉的稳定性越差,因此水分也是控制冻干产品质量的一个重要因素。本实验分别考察20,24,35,48,72h的冻干干燥时间下的含水量,确定最佳冻干干燥时间。结果如下表所示,随着冻干时间的延长,水分含量逐渐变小。到考虑到成本与时间问题,最终选择冻干35h作为冻干时间。
按照优化后处方及制备工艺制备三批erg/afa-lip脂质体,加入保护剂,将含有保护剂的脂质体分装到西林瓶中,每瓶5ml,对冻干后脂质体的外观,复溶性,粒度分布,包封率等分别进行考察。
3.1外观评价
肉眼与透射电镜观察冻干后的erg/afa-lip的体积与冻干前体积相同,无萎缩凹陷,致密饱满。脂质体显微形态圆整,大小均一。
3.2复溶能力评价
冻干后的erg/afa-lip加入原体积注射用生理盐水,不借助其他设备仪器,手摇轻微震荡即可得到澄清的脂质体复溶液体。观察复溶时间以及复溶后清澈透明,颜色为乳白色,无沉淀。
3.3粒径评价
冻干后的erg/afa-lip加入原体积注射用生理盐水,手摇分散。冻干后复溶粒径应符合规定或与冻干前相比变化不明显。
3.4包封率的评价
冻干后的erg/afa-lip加入原体积注射用生理盐水,手振摇分散。测定各处方erg/afa-lip冻干粉的包封率,冻干前后包封率变化不大。
3.5冻干保护剂的筛选
冻干保护剂应具备如下特征:a.吸水性差;b.结晶率低;c.玻璃转化温度高;d.本身无味,与蛋白质,脂质体等不发生化学反应;e.价格便宜,易得到。本实验分别对冻干保护剂的单用及合用进行考察,筛选出适佳处方工艺。
不同种类和不同浓度的保护剂对冷冻干燥过程中脂质体的保护作用均有所不同,我们分别考察甘露醇,葡萄糖,蔗糖,海藻糖对冻干样品的作用,结果见下表。结果显示甘露醇由于自身结晶的支撑能力较强,容易获得饱满的外观,但是结晶的形成又会对脂质体结构造成破坏,导致脂质体的包封率显著性下降和粒径显著性增大。蔗糖外观性较差,塌陷,但粒径较小,复溶时间较短,分散性较好,erg包封率和afa包封率较高。葡萄糖与海藻糖作为保护剂,复溶后粒径的pdi值偏高,分散性不佳。因此考虑用甘露醇作为支撑剂以使冻干产品获得良好的外观,将其与蔗糖进行进一步的合用筛选。
本实验通过改变糖脂比以及蔗糖与甘露醇之间的比例,设计9组试验,具体试验如下表所示。以冻干前后脂质体的外观,复溶时间,粒径均值,erg和afa包封率作为选择指标,考察其对冻干制品的保护作用。试验结果见下表。结果显示,处方4评分最高。所以最终确定的冻干粉处方工艺为:糖脂比=3:1,蔗糖:甘露醇=1:1(147mg:147mg)。
制备rgd/r8-erg/afa-lip样品,选用上表中的处方4进行验证试验,结果见下表。结果显示,各组别的外观均完整疏松,均匀饱满。三批冻干粉复溶时间均小于30s,平均粒径100.2±0.43nm,pdi0.210±0.007,erg包封率92.87±1.32%,afa包封率92.60±0.77%。综上所述,通过以上冻干工艺和处方考察,确定最终冻干工艺如下:采用慢冻法,在设备冷阱处放置4h后,转移到上层进行35h的冻干干燥(冻干程序:-30~-20℃:350min;-20~-10℃:350min;-10~-0℃:350min;0~10℃:350min;10~20℃:350min;20~30℃:350min)。冻干保护剂处方为:每支脂质体冻干粉(5ml)中含有147mg蔗糖和147mg甘露醇(糖脂比为3:1,蔗糖与甘露醇质量比为1:1)。
4.1形态观察
4.1.1外观形态
rgd-erg/afa-lip溶液,r8-ergafa-lip溶液,rgd/r8-erg/afa-lip溶液以及rgd/r8-erg/afa-lip冻干粉复溶后均呈现乳白色,色泽均匀,透亮,无沉淀。rgd/r8-erg/afa-lip冻干粉外观完整疏松,均匀饱满,无凹陷。
4.1.2显微形态
透射电镜观察脂质体。采用负染法制备样品。在室温条件下,取rgd/r8-erg/afa-lip以及rgd/r8-erg/afa-lip冻干粉样品,滴至电镜专用的铜网上,用滤纸吸干多余的样品溶液,静置1min后,采用1%磷钨酸负染,静置30s,再用滤纸吸干铜网多余染液,自然挥干后,用电镜观察并拍照,结果见图6。透射电镜结果表明,各脂质体形态圆整,粒径分布均匀,大约在120nm左右。
4.2粒径及其分布
室温条件下,取erg/afa-lip,rgd-erg/afa-lip,r8-erg/afa-lip,rgd/r8-erg/afa-lip,rgd/r8-erg/afa-lip冻干粉样品,取1ml注入样品池,采用激光粒度仪测定平均粒径及其分布。结果见图7和图8。结果表明,erg/afa-lip的平均粒径为107.9±0.19nm,多分散系数pdi为0.235±0.013,小于0.3,rgd-erg/afa-lip的平均粒径为125.2±1.76nm,pdi为0.249±0.016,小于0.3,r8-erg/afa-lip的平均粒径为112.0±0.77nm,pdi为0.252±0.013,小于0.3,rgd/r8-erg/afa-lip的平均粒径为108.2±0.46nm,pdi为0.293±0.007,小于0.3,rgd/r8-erg/afa-lip冻干粉复溶后的平均粒径为107.2±0.287nm,pdi为0.294±0.007,小于0.3,可见各脂质体的粒径分布较集中。
4.3zeta电位测定
室温条件下,取erg/afa-lip,rgd-erg/afa-lip,r8-erg/afa-lip,rgd/r8-erg/afa-lip,rgd/r8-erg/afa-lip冻干粉样品,注入样品池采用zeta电位仪测定其电位,结果见图9和图10。结果显示erg/afa-lip的zeta电位为-1.15±0.31mv,rgd-erg/afa-lip的zeta电位为-11.27±0.73mv,r8-erg/afa-lip的zeta电位为-8.00±0.66mv,rgd/r8-erg/afa-lip的zeta电位为-8.61±0.15mv,rgd/r8-erg/afa-lip冻干粉复溶后的zeta电位为-2.49±0.18mv。
4.4包封率与药物含量测定
3批rgd/r8-erg/afa-lip冻干粉样品,其中afa的平均包封率为92.45±0.61%。erg的平均包封率为92.87±1.32%。
本实验考察在不同ph条件下的afa药物的体外释放度情况。精密吸rgd/r8-erg/afa-lip冻干粉溶液4ml,afa的柠檬酸溶液4ml,置透析袋中后用透析夹夹紧,投入ph分别为7.4和6.5的含40%甲醇的磷酸盐缓冲液各100ml中,置于恒温水浴振荡器(振摇速率100rpm·min-1,释放温度37℃)中,于第0.25,0.5,0.75,1,2,4,6,8,10,12,24h吸取透析液1ml,并立刻补充1ml新鲜透析介质。采用0.45μm的微孔滤膜过滤样品,通过hplc检测,进样20μl测定峰面积,代入线性回归方程计算各取样点下afa的释药浓度,计为c1,afa总药量记为m0。按照如下公式进行计算:
其中,c1为各取样点中afa释放的浓度,v0为释放介质体积,v为取样体积,m0为afa总药量。
由图11结果表明,在ph7.4下的含40%甲醇的磷酸盐缓冲液中,24h内afa原料药的累积释放百分率为94.92%,rgd/r8-erg/afa-lip冻干粉累积释放百分率为95.25%。在ph6.5的条件下,含40%甲醇的磷酸盐缓冲液中,24h内afa原料药累积释放百分率为98.21%,几乎完全释放,rgd/r8-erg/afa-lip冻干粉的累积释放百分率为96.95%。在ph7.4下的含40%甲醇的磷酸盐缓冲液中,0.5h内rgd/r8-erg/afa-lip冻干粉的累积释放百分率为21.26%<40%,6h内rgd/r8-erg/afa-lip冻干粉的累积释放百分率为82.64%>80%;24h,rgd/r8-erg/afa-lip冻干粉的累积释放百分率为95.25%。在ph6.5下的含40%甲醇的磷酸盐缓冲液中,0.5h内rgd/r8-erg/afa-lip冻干粉的累积释放百分率为22.47%<40%,6h内rgd/r8-erg/afa-lip冻干粉的累积释放百分率为87.09%>80%,24h,rgd/r8-erg/afa-lip冻干粉的累积释放百分率为96.95%。2015版《中国药典》关于脂质体突释效应的要求:开始0.5h的释放量应≤40%,且24h的累积释放百分率大于80%。在释放介质为ph6.5和ph7.4的含40%甲醇的磷酸盐缓冲液下,rgd/r8-erg/afa-lip冻干粉均符合该要求。
4.6血清学稳定性考察
取rgd/r8-erg/afa-lip及其冻干粉各1ml,与0.22μm微孔滤膜过滤的胎牛血清等体积混合,分别于0、0.5、1、3、5、8和24h取100μl,用超纯水稀释10倍,采用马尔文粒径仪测定其粒径。结果见下表,在24h内,rgd/r8-erg/afa-lip冻干粉粒径稳定在110nm左右,血清稳定性良好。
用体外培养pc-9细胞,给予erg/afa-lip、rgd-erg/afa-lip、r8-erg/afa-lip、rgd/r8-erg/afa-lip、rgd/r8-erg/afa-lip冻干粉组刺激48h,采用annexinv-fitc/pi双染流式细胞术检测各组凋亡情况。取对数生长期的pc-9细胞数目为1.5×105个·ml-1,800rpm·min-1离心5min,滴管吹打混匀成单细胞悬液,每孔加入2ml完全培养基于6孔培养板内,分别设置每个药每个浓度3个复孔,实验平行测定3次。于37℃、5%co2培养箱中培养至细胞融合80%后加药处理48h后收集上清及细胞1.0×106个,用预冷的pbs洗涤2遍,800rpm·min-1离心5min,弃上清,然后加入500μlapoptosispositivecontrolsolution重悬,置冰上孵育30分钟,加入适量预冷1×bindingbuffer重悬,并加入数量相同并且称为处理的活细胞与之混合,再加入预量预冷pbs离心洗涤,弃上清,用预冷1×bindingbuffer补充至1.5ml,等单染管分别加入5μlannexinv-fitc或10μlpi,避免光照射5分钟。在流式细胞仪上,用空白管调节fsc,ssc和荧光通道的电压,并在此电压条件下,用单染管调节荧幕光通道的补偿。最后过400目筛网后,1h内采用流式细胞仪检测细胞凋亡率。实验重复3次。
试验结果见图12和下表。结果表明,各给药组的细胞凋亡率均极显著高于空白对照组(p<0.01)。rgd/r8-erg/afa-lip和rgd/r8-erg/afa-lip冻干粉组之间的凋亡率没有显著性差异(p>0.05),表明将rgd/r8-erg/afa-lip制备成冻干粉,对pc-9细胞的凋亡作用并不会减弱。其中,rgd/r8-erg/afa-lip和rgd/r8-erg/afa-lip冻干粉组的细胞凋亡率相对于单靶头修饰脂质体,均有极显著性差异(p<0.01)。rgd-erg/afa-lip和r8-erg/afa-lip与erg/afa-lip相比没有显著性差异(p>0.05)。说明双靶头修饰较单靶头修饰效果好。
药物在长期的储存过程中,会产生降解产物,使得药物疗效降低,产生毒副作用,从而影响药品的质量,安全性和有效性。药物的稳定性是根据所含成份或制剂特性,质量要求进行设置,以便客观,全面地评价药品的稳定性。本实验对脂质体的稳定性考察主要从物理稳定性和化学稳定性两方面进行。
5.1物理稳定性
脂质体属于胶体分散体系,是热力学不稳定体系。本文对erg/afa-lip冻干脂质体的物理稳定性研究主要包括erg/afa-lip冻干脂质体的外观,复溶时间,复溶后的粒径,erg与afa的包封率等。将erg/afa-lip脂质体冻干粉,分别于4℃,25℃条件下避光密闭放置,以外观,复溶时间,复溶后的粒径分布,erg与afa的包封率为评价指标考察erg/afa-lip脂质体冻干粉的物理稳定性,结果见下表。
由上表可以看出,在4℃和25℃放置10d后,4℃下冻干粉复溶时间比25℃下冻干粉复溶时间小;粒径变化不大,都稳定在120nm左右;但4℃条件下afa包封率与erg包封率比25℃略高。因此,该冻干粉在4℃下比25℃条件下物理稳定性好。
5.2化学稳定性
脂质体的化学稳定性有两个方面,首先是脂质体中包封的药物的稳定性,可通过检查药物的含量进行考察。另一方面脂质体的膜材成分含有磷脂,磷脂不稳定,结构中含有不饱和键容易发生氧化水解,因此需要检查有关物质指标的考察。将erg/afa-lip冻干脂质体,分别于4℃,25℃条件下放置,以erg与afa的含量,有关物质为指标考察erg/afa-lip冻干脂质体的化学稳定性,结果见下表。
由上表可以看出,在4℃和25℃放置10d后,冻干粉afa含量与erg含量均有略微下降趋势,但下降含量相差不大;但4℃条件下所产生的杂质略微小于25℃下的杂质含量。因此,该冻干粉在4℃下比25℃条件下化学稳定性好。
5.3影响因素试验
影响因素试验是在剧烈条件下进行的,目的是为了了解影响药物稳定性的因素,从而对于包装材料,贮存的条件提供科学的依据,同时可以确定药品的有效期。同时也为加速试验和长期试验应采用的温度和湿度等条件提供理论依据。本文按照2015版中国药典与“药物制剂稳定性指导原则”的规定,分别对三批erg/afa-lip脂质体冻干粉进行高温,高湿,光照试验。
5.3.1高温试验
将erg/afa-lip冻干脂质制剂密封,避光,置60℃恒温烘箱中,分别于第0,5,10天取样进行检测,结果见下表。
由上表可以得出:60℃放置5d和10d后,外观有轻微凹陷,复溶时间明显增长,粒径明显变大,erg与afa含量变化略小,但erg包封率与afa包封率明显下降。说明高温对冻干粉脂质体具有显著的影响,因此要低温保存。
5.3.2高湿试验
取三批脂质体冻干粉敞口,避光,置恒湿密闭容器中,于25℃,rh90%±5%的环境下,分别于第0,5,10天取样,hplc进行检测,结果见下表。
由上表可以得出,25℃,rh90%±5%条件下,放置5d和10d后,外观明显凹陷,复溶时间明显增长,粒径明显变大,erg与afa含量变化略小,但erg包封率与afa包封率明显下降。说明高湿对脂质体冻干粉具有明显的影响,因此保存时要置于干燥密闭的条件下。
5.3.3光照试验
取三批脂质体冻干粉密封,置4500lx±500lx的光照条件下,分别于第0,5,10天取样进行检测,结果见下表。
由上表可以得出,4500lx±500lx的光照条件下,放置10d,外观完整疏松,均匀饱满,复溶时间比较短。粒径变化不大;erg含量变化较小,包封率几乎不变;afa含量变化不大,包封率显著下降,表明强光照对脂质体冻干粉的稳定性具有显著的影响,因此储存时要注意避光。
三、分析与讨论
本部分实验,采用后插入法将dspe-peg3400-c(rgdfk)和dspe-peg1000-r8嵌入erg/afa-lip的脂质膜层,制备出rgd环肽与r8肽修饰的erg/afa-lip(rgd/r8-erg/afa-lip)。rgd由精氨酸-甘氨酸-天冬氨酸三肽组成,它能与多种整合素受体靶向识别与结合。r8属于一种细胞穿膜肽,由8个精氨酸组成的阳离子寡聚细胞穿膜肽,简称r8,具有穿膜作用好、细胞毒性小等特点。rgd环肽和r8肽通过peg连接到dspe上,以dspe-peg3400-c(rgdfk)和dspe-peg1000-r8作为磷脂材料,以直接修饰脂质体以避免血液循环过程中从脂质体表面脱离,并提高了共修饰脂质体的稳定性。考虑到脂质体本身不稳定的问题,将其制备成冻干粉剂型,对其形态、粒径分布、zeta电位、血清学稳定性、体外释放、稳定性以及有关物质进行初步考察,通过体外流式细胞术检测细胞凋亡实验进行了体外药效的考察。又对rgd/r8-erg/afa-lip冻干粉进行了稳定性的考察。
本实验首先进行了冻干工艺的考察。升华干燥时rgd/r8-erg/afa-lip温度不能高于其共熔点,否则会使其融化,导致沸腾现象出现,干燥后的脂质体内部容易产生气泡、充气膨胀、颜色加深、干缩、溶解困难等现象,从而影响冻干制品的质量。经过考察,第一阶段(升华干燥)升温温度不超过1℃。冷冻干燥机均可达到该生产要求。
预冻速率是冻干工艺的重要参数之一,直接影响冻干样品的冻干效果。预冻速率分为快冻法和慢冻法两种。快冻法是先启动冻干机的降温程序,使冷阱温度降低至-40℃后,再将样品放置冷阱中,这种方法的特点是样品快速降温,样品可形成致密网状结构。慢冻法是先将冻干样品放置冷阱中,然后启动设备降温功能,这种方法的特点是样品自身的温度降低得较慢,形成的冰晶粗,但可以提高干燥效率。不同的预冻速率可能引起脂质体的冷冻外相层和分子层之间产生渗透压,从而导致脂质体的药物渗漏出来。因此,本实验采用慢冻法和快冻法分别进行实验。本实验考察出的预冻速率为慢冻法。
预冻时间的长短决定了样品是否完全冻实,这是影响冻干产品质量的关键因素。本实验分别考察了样品在冷阱中,采用慢冻法分别预冻1,2,3,4,6,8h后冻干的样品质量。按程序进行升华干燥。以样品外观是否饱满,粒径变化以及erg和afa的包封率,复溶性为评价指标进行综合评分,最后考察出预冻时间为4h。
冻干粉的储存温度必须低于药品的玻璃化转变温度,否则药品会出现凹陷、表面萎缩、变硬变色、结块等不良现象。而冻干粉中的含水量是影响玻璃化转变温度的一个重要因素。冻干粉中的含水量越高,其玻璃化转变温度越低,冻干粉的稳定性越差,因此水分也是控制冻干产品质量的一个重要因素。本实验为了节约时间,在水分符合规定的基础上采用干燥35h作为干燥时间。
冻干过程产生的冰晶会对脂质体结构造成损伤,并导致样品不成形,产生皱缩。为了减小其对脂质体的破坏作用以及一定的美观程度,使其不产生坍塌凹陷的现象,一般需要加入冻干保护剂。本文所考察的冻干保护剂为甘露醇,葡萄糖,蔗糖,海藻糖,通过外观,复溶时间,粒径,包封率为评价指标进行综合评分进行筛选。甘露醇由于自身结晶的支撑能力,容易获得饱满的外观,但是结晶的形成又会对脂质体膜造成机械破坏,导致脂质体的包封率显著性下降和粒径显著性增大。蔗糖外观性较差,但粒径较小,复溶时间较短,分散性较好,erg包封率和afa包封率较高。葡萄糖与海藻糖作为保护剂,复溶后粒径的pdi值偏高,分散性不佳。因此考虑用甘露醇作为支撑剂以使冻干产品获得良好的外观,将其与蔗糖进行进一步的合用筛选。通过综合评分最终确定的冻干粉处方工艺为:糖脂比=3:1,蔗糖:甘露醇=1:1(147mg:147mg)
最终确定的冻干工艺与处方工艺为:采用慢冻法,在设备冷阱处放置4h后,转移到上层进行35h的冻干干燥(冻干程序:-30~-20℃:350min;-20~-10℃:350min;-10~-0℃:350min;0~10℃:350min;10~20℃:350min;20~30℃:350min)。冻干保护剂处方为:每支脂质体冻干粉(5ml)中含有147mg蔗糖和147mg甘露醇(糖脂比为3:1,蔗糖与甘露醇质量比为1:1),对其进行质量评价。结果表明rgd/r8-erg/afa-lip冻干粉外观均匀饱满,完整光洁,复溶后呈均一乳白色,粒径较小,分布集中,稳定在100nm左右,包封率较高,afa的平均包封率为92.45±0.61%,erg的平均包封率为92.87±1.32%。2015版《中国药典》关于脂质体突释效应的要求:开始0.5h的释放量应≤40%,且24h的累积释放百分率超过80%。在释放介质为ph6.5和ph7.4的含40%甲醇的磷酸盐缓冲液下,rgd/r8-erg/afa-lip冻干粉符合该要求。血清稳定性良好。稳定性试验表明rgd/r8-erg/afa-lip冻干粉要低温、避光、干燥条件下保存。
细胞凋亡结果表明,各给药组的细胞凋亡率均显著高于空白对照组。rgd/r8-erg/afa-lip和rgd/r8-erg/afa-lip冻干粉组之间的凋亡率没有显著性差异,表明将rgd/r8-erg/afa-lip制备成冻干粉,对pc-9细胞的凋亡作用并不会减弱。其中,rgd/r8-erg/afa-lip和rgd/r8-erg/afa-lip冻干粉组的细胞凋亡率相对于单靶头修饰脂质体,均有极显著性差异。rgd-erg/afa-lip和r8-erg/afa-lip与erg/afa-lip相比没有显著性差异。说明双靶头修饰较单靶头修饰效果好。
四、小结
本部分实验成功制备了rgd/r8-erg/afa-lip冻干粉。为节约实验成本,减少实验费用,用erg/afa-lip进行冻干工艺的考察和处方的优化实验,筛选出最佳处方工艺后将其应用到rgd/r8-erg/afa-lip中进行验证。得出最佳冻干与处方工艺为:采用慢冻法,在设备冷阱处放置4h后,转移到上层进行35h的冻干干燥(冻干程序:-30~-20℃:350min;-20~-10℃:350min;-10~-0℃:350min;0~10℃:350min;10~20℃:350min;20~30℃:350min)。冻干保护剂处方为:每支脂质体冻干粉(5ml)中含有147mg蔗糖和147mg甘露醇(糖脂比为3:1,蔗糖与甘露醇质量比为1:1)。rgd/r8-erg/afa-lip冻干粉复溶后,粒径、电位、包封率、血清稳定性良好,通过流式凋亡术检测其可以明显促进pc-9细胞的凋亡。保存条件为:低温,干燥,避光条件。
- 还没有人留言评论。精彩留言会获得点赞!